Nuovi Anticoagulanti Orali (NAO)
I nuovi anticoagulanti orali (NAO) promettono di rivoluzionare la terapia cardine dei pazienti con fibrillazione atriale cronica.
Fino ad oggi, la terapia anticoagulante orale orale (TAO) ha rappresentato il cardine del trattamento di pazienti con fibrillazione atriale cronica, avendo un’efficacia ampiamente dimostrata nella prevenzione dell’ictus e del tromboembolismo sistemico.
L’agente antitrombotico ideale dovrebbe, a tal proposito, avere le caratteristiche di efficacia (benefici dimostrati in tuttii sottogruppi di Fibrillazione Atriale e prevedibilità di risposta), sicurezza (ampia finestra terapeutica e bassa incidenza e gravità di effetti locali e sistemici anche negli anziani) e confidenza (ben tollerato dal paziente, grazie ad una dose orale fissa, all’assenza di interazioni con farmaci e alimenti e alla non necessità di monitoraggio continuo dei parametri coagulativi).
Fino a qualche anno fa, i farmaci anticoagulanti maggiormente utilizzati erano gli antagonisti dei fattori coagulativi vitamina K-dipendenti (warfarin), e le eparine (eparine non frazionate – ENF, ed eparine a basso peso molecolare – EBPM).
Poichè, tuttavia, queste classi di farmaci agiscono su molteplici componenti della cascata coagulativa (Figura 1), il loro effetto farmacologico è poco prevedibile, avendo, inoltre, molte e ben note interazioni farmacologiche e con il cibo, così come imprevedibile è il rischio emorragico ad esse correlato. Tali farmaci hanno, inoltre, una finestra terapeutica ristretta (valori target di INR 2-3) e la necessità di un continuo monitoraggio dell’assetto coagulativo, li rende poco maneggevoli, anche dal punto di vista dei costi sanitari.
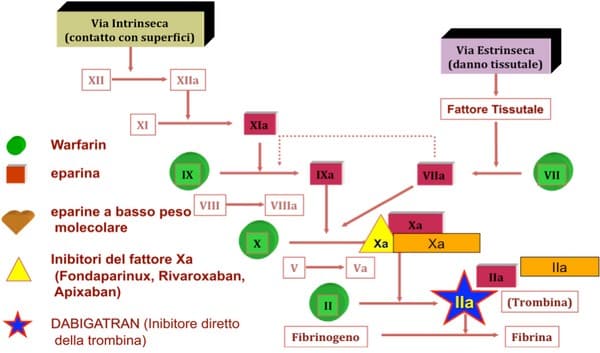
Se si aggiungono casi di resistenza farmacologica (soprattutto nei giovani), si intuisce come tutte queste limitazioni rendono difficile l’utilizzo di tali farmaci, facendo sì che solo il 50% dei pazienti eleggibili ricevano poi effettivamente tale terapia.
I nuovi anticoagulanti orali sono inibitori diretti del fattore Xa (Fondaparinux, Rivaroxaban, Apixaban, Edoxaban, ecc…) e della la trombina o fattore IIa (Dabigatran, Bivalirudina) e costituiscono una nuova classe di anticoagulanti che, agendo su un solo specifico fattore emocoagulativo (Figura 1), ha un’efficacia e una prevedibilità d’azione maggiori.
Dal punto di vista prettamente farmacodinamico, essi mantengono inalterati i livelli di Proteina C e S, proteine vitamina K-dipendenti, che svolgono un importante ruolo di feed-back negativo sulla formazione di trombina; sono in grado di inibire sia i substrati in fase fluida che quelli legati alla fibrina ed hanno anche attività profibrinolitica.
Infine, presentano un grado di interferenza con farmaci e dieta chiaramente inferiore a quanto si riscontra con gli altri anticoagulanti.
D’altro canto, potenziali svantaggi riguardanti l’uso dei nuovi anticoagulanti orali sono rappresentati dalla mancanza di antidoti in caso di sovradosaggio o emorragie, dalla necessità di un aggiustamento empirico del dosaggio, essendo difficile monitorare il loro effetto con gli attuali test laboratoristici, dalla loro breve emivita, con inizio e termine d’azione rapidi e dalla difficoltà di controllare l’aderenza del paziente, che spesso ha poca consapevolezza.
Dabigatran exilato
Tra i nuovi anticoagulanti orali inibitori diretti della trombina, quello che, attualmente, suscita più interesse è il Dabigatran etexilato.
Il Dabigatran viene somministrato come profarmaco e la sua concentrazione plasmatica è proporzionale alla dose ed il massimo effetto sui parametri della coagulazione coincide con la massima concentrazione plasmatica (Tmax 0,5-2 ore); il suo assorbimento è rapido, così come la comparsa degli effetti farmacologici.
Una volta attivo, esso è in grado di inibire direttamente, con elevata affinità e specificità, sia la trombina libera che quella legata al coagulo, consentendo la prevenzione della formazione del trombo e la lisi di quello già formatosi.
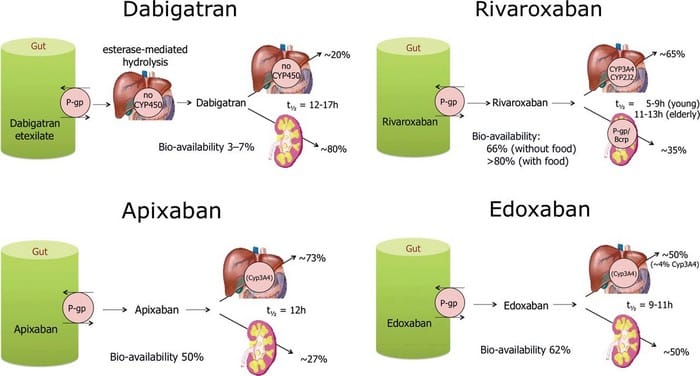
Dal punto di vista farmacocinetico, il Dabigatran ha una biodisponibilità assoluta pari a circa il 65% (la bassa biodisponibilità è la ragione per cui le capsule contengono dosaggi relativamente elevati di profarmaco), un basso potenziale di legame alle proteine plasmatiche, un’emivita di 12-14 ore ed un’escrezione prevalentemente renale (85%).
Il Dabigatran ed i suoi metaboliti non sono metabolizzati dal citocromo P450, cosicchè assai scarso risulta il livello di interazione farmaco-farmaco e quello con gli alimenti (Fig.2).
Il profilo farmacodinamico e farmacocinetico di tale farmaco è, in sostanza, del tutto prevedibile e riproducibile ed è caratterizzato da una bassa variabilità intra-individuale.
Gli studi clinici di fase III hanno dimostrato un profilo di efficacia e sicurezza paragonabile a quello di enoxaparina.
Le uniche interazioni farmacologiche possono avvenire a livello intestinale con gli inibitori e/o induttori della glicoproteina-P, responsabile del riassorbimento del Dabigatran nel lume intestinale.
Potenti induttori di tale trasportatore, come rifampicina, carbamazepina, fenitoina, inibitori delle proteasi ed iperico (“erba di San Giovanni”), possono ridurre l’esposizione sistemica al Dabigatran e sono, perciò, non indicati in associazione.
Forti inibitori di tale proteina, come gli antifungini (itraconazolo e ketoconazolo ad uso sistemico), la ciclosporina, il tacrolimus, e, tra i farmaci antiaritmici, il Dronedarone, ne aumentano il tempo di esposizione e sono, quindi, anch’essi, controindicati in associazione.
In caso di co-somministrazione di inibitori meno potenti della glicoproteina-P, quali l’aspirina, i FANS, gli SSRI o SNRI e gli stessi antiaggreganti Clopridogrel e Ticagrelor (per i quali non ci sono dati circa le possibili interazioni con Dabigatran) è sufficiente un aggiustamento di dosaggio del Dabigatran.
Tra i farmaci utilizzati per il controllo del ritmo e della frequenza nel paziente con F.A., quelli che richiedono una riduzione della posologia del Dabigatran (150-110 mg/die anziché 300 mg/die) sono rappresentati dall’Amiodarone, dalla Chinidina e dal Verapamil, poiché anch’essi inibitori della glicoproteina-P.
Effetti avversi comuni, conseguenti alla terapia con Dabigatran exetilato, sono rappresentati da lieve anemia, nausea, dispepsia e diarrea, sanguinamenti quali ematuria, emorragie gastrointestinali, ematomi post-procedurali e traumatici ed emorragie delle ferite e cutanee, edema, astenia e vertigini; fra gli effetti indesiderati non comuni, si sono riscontrati rialzo delle transaminasi e della bilirubina, riduzione dell’ematocrito, trombocitopenia, sincope ed emorragie quali epistassi, emartrosi, emorragie rettali ed emorroidali ed emorragie vascolari.
Nuovi Anticoagulanti orali: Lo studio RE-LY
Lo studio RE-LY (“Randomized Evaluation of Long-term anticoagulation theraphY”) è uno studio di fase III, prospettico, randomizzato, “open-label”, facente parte del programma di studi clinici “RE-VOLUTION” mirato alla valutazione di efficaciae sicurezza del Dabigatran rispetto alla terapia standard nelle principali malattie tromboemboliche.
Nello specifico, tale studio riguarda la prevenzione dello stroke nei pazienti con F.A. non valvolare con almeno un fattore di rischio aggiunto e pone a confronto l’utilizzo del Dabigatran in due dosaggi differenti (110 mg b.i.d. e 150 mg b.i.d.) con quello del warfarin (con dosaggio adeguato al valore target di INR tra 2 e 3). Gli endpoint primari sono rappresentati dall’efficacia nella prevenzione dello stroke e di altri embolismi sistemici e dalla sicurezza (rischio di sanguinamenti maggiori) dei due farmaci a confronto.
I pazienti reclutati sono in totale 18113, con età media di 71 anni, per circa il 60% uomini; il CHADS2 score medio è di 2,1.
Per quanto riguarda il fattore di rischio tromboembolico aggiuntivo, circa il 20% dei pazienti ha avuto un pregresso stroke/TIA, circa il 17% un pregresso IMA e circa il 32% ha una storia di scompenso cardiaco. Circa il 40% dei pazienti assume terapia con aspirina e circa il 50% non ha mai assunto warfarin.
I risultati dello studio dimostrano che il Dabigatran somministrato alla dose di 110 mg b.i.d. si associa ad un rischio di stroke ed embolismo sistemico comparabile con quello associato alla somministrazione di warfarin, con il vantaggio, però, di una riduzione significativa del rischio di complicanze emorragiche.
La somministrazione di Dabigatran alla dose di 150 mg b.i.d. è associata, invece, ad un rischio minore di stroke ed embolismo sistemico rispetto al warfarin, con una simile incidenza di emorragie maggiori.
I risultati scaturiti dallo studio RE-LY hanno permesso l’approvazione, sia da parte della F.D.A. che dall’E.M.A., dell’utilizzo del Dabigatran nella F.A. non valvolare per la prevenzione dello stroke e del tromboembolismo sistemico in pazienti con uno o più dei seguenti fattori di rischio aggiuntivi: precedente ictus, attacco ischemico transitorio o embolia sistemica; frazione di eiezione ventricolare sinistra <40%; insufficienza cardiaca sintomatica con classe NYHA≥2; età ≥ 75 anni; età ≥65anni associata a ipertensione, diabete mellito e/o coronaropatia.
Il dosaggio di 150 mg b.i.d. deve essere ridotto a 110 mg b.i.d. nei pazienti con più di 80 anni, con elevato rischio di sanguinamento (HAS-BLED ≥ 3), insufficienza renale cronica (filtrato glomerulare 30-49 ml/min) e già in terapia con Verapamil.
In caso di sovradosaggio, non esiste un antidoto in grado di neutralizzarne gli effetti.
L’emodialisi è in grado di rimuovere circa il 62% del farmaco a 2 ore e il 64% a 4 ore (dato il suo scarso legame con le proteine plasmatiche); in alternativa, è possibile utilizzare il carbone attivo per ridurne l’assorbimento essere somministrata subito dopo aver sospeso la UHF.
Rivaroxaban
Il Rivaroxaban presenta elevata biodisponibilità, rapida insorgenza d’azione, non tende ad accumularsi e presenta una bassa variabilità intra-individuale e una moderata variabilità inter-individuale.
Ha un’emivita fino a 9 ore in soggetti giovani sani, fino a 12 ore in soggetti anziani; è eliminato per 1/3 per via renale e per 2/3 per via epatica (Figura 2).
In corso di terapia con Rivaroxaban non è necessario il monitoraggio della coagulazione né si impongono restrizioni dietetiche particolari.
Gli effetti avversi più frequentemente registrati sono stati: nausea, senso di bocca asciutta, vomito, dispepsia, costipazione o diarrea, dolore addominale; in alcuni soggetti si registra un aumento della GGT e delle transaminasi (AST ed ALT) e più raramente dell’amilasi, della lipasi, della bilirubinemia, della LDH, della fosfatasi alcalina.
L’uso di Rivaroxaban è stato associato a un incremento del rischio di emorragie occulte o conclamate in qualsiasi tessuto od organo.
Tali emorragie, se di entità rilevante, possono, a lungo termine, portare ad anemia.
Fra le emorragie si segnalano: ematomi, emorragie del tratto gastrointestinale (gengivali, rettali, ematemesi), ematuria, emorragie del tratto genitale e menorragia, epistassi, emorragia congiuntivale. Non è attualmente nota la frequenza con cui possono verificarsi emorragie in un organo critico (ad esempio nel cervello).
Rivaroxaban è controindicato nei soggetti con ipersensibilità nota al principio attivo oppure ad uno qualunque degli eccipienti.
Esiste controindicazione all’utilizzo in soggetti con emorragie in atto clinicamente significative ed in coloro che sono affetti da epatopatia associata a coagulopatia e rischio emorragico.
Da evitare anche nelle donne in gravidanza o che allattano al seno e nei pazienti con grave insufficienza renale(filtrato glomerulare <15 ml/min).
Deve essere somministrato con cautela nei pazienti con cirrosi e moderata insufficienza epatica (Child-Pugh B), se non associata a coagulopatia, e nei pazienti con una filtrato glomerulare di 15-29 ml/min o con insufficienza renale moderata (filtrato glomerulare 30-49 ml/min), se a rischio di essere esposti ad alte concentrazioni plasmatiche di Rivaroxaban.
Interagisce con i farmaci inibitori del CYP3A4 e della glicoproteina-P quali antimicotici azolici e inibitori delle proteasi (Ritonavir), i quali aumentano l’esposizione sistemica al Rivaroxaban e, quindi, il rischio emorragico ad esso associato (i farmaci che inibiscono solo il CYP3A4, avendo un debole effetto sulla glicoproteina-P, quali la claritromicina, aumentano il rischio emorragico in maniera minore).
Nuovi Anticoagulanti Orali: Lo studio ROCKETAF
Lo studio ROCKETAF (“Rivaroxaban Once-daily oral direct factor Xa inhibition Compared wuth vitamin K antoagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation”) è un trial prospettico randomizzato condotto in doppio cieco, che ha messo a confronto l’efficacia e la sicurezza del Rivaroxaban alla dose di 20 mg/die (15 mg/die in pazienti con filtrato glomerulare pari a 30-49 ml/min), con il warfarin (con dosaggio adeguato al valore target di INR tra 2 e 3).
Sono stati arruolati 14.264 pazienti di età uguale o superiore ai 75 anni, con una storia di stroke/TIA/embolismo sistemico, scompenso cardiaco congestizio, pregresso infarto miocardico, diabete mellito ed ipertensione.
Sono stati esclusi pazienti con grave insufficienza renale e sanguinamenti in atto/alto rischio di sanguinamento.
Da tale studio è emerso come i due farmaci abbiano la stessa efficacia nella prevenzione dello stroke e dell’embolismo sistemico ed un pari rischio di sanguinamento e di effetti avversi; tuttavia, nei pazienti trattati con Rivaroxaban si è rilevato un minor numero di emorragie intracraniche e sanguinamenti fatali.
Tale studio ha, quindi, sottolineato come il Rivaroxaban (approvato dall’E.M.A. nel Dicembre del 2011 e dall’AIFA nel 2013) possa essere considerato una valida alternativa al warfarin nei pazienti con F.A. non valvolare a rischio moderato-alto e con uno o più fattori di rischio quali: insufficienza cardiaca congestizia, ipertensione, età >75 anni, diabete mellito e pregresso ictus/TIA.
Il Rivaroxaban deve essere, quindi, assunto alla dose giornaliera di 20 mg, dosaggio che deve essere regolato in base alla funzionalità renale: per valori di filtrato glomerulare ≥ 50ml/min si mantiene la dose di 20mg/die, per filtrato glomerulare di 50-30ml/min occorre una riduzione del dosaggio a 15mg/, per filtrato glomerulare di 30-15ml/min, si può mantenere la dose di 15 mg/die ma sotto stretto monitoraggio della funzionalità renale, mentre per valori di filtrato glomerulare inferiori a 15ml/min, il farmaco è controindicato.
Sono stati segnalati rari casi di sovradosaggio fino a 600 mg, senza complicanze emorragiche o altre reazioni avverse.
A causa dell’assorbimento limitato, ci si attende un effetto-tetto, senza ulteriori aumenti dell’esposizione plasmatica media per dosi sovraterapeutiche di 50 mg o più.
Non è disponibile alcun antidoto specifico che possa antagonizzare gli effetti farmacodinamici del Rivaroxaban; come unica alternativa, è possibile usare carbone attivo per ridurne l’assorbimento (solfato di protamina o vitamina K non hanno effetto, così come gli agenti emostatici e la dialisi
non è efficace per l’elevata affinità del farmaco per le proteine plasmatiche).
Si è visto, tuttavia, che il Complesso Protrombinico Concentrato (PCC), anche ad una dose molto ridotta rispetto a quella in uso corrente, è in grado di normalizzare completamente il parametro coagulativo PT, allungato in caso di sovradosaggio da Rivaroxaban (il PCC è invece totalmente inefficace nel normalizzare l’aPTT).
In caso di sovradosaggio, può essere preso in considerazione l’uso di carbone vegetale attivo per ridurre l’assorbimento mentre sono in studio sperimentale molecole che possono neutralizzarne l’effetto:
- BAY1110262, che è in grado di neutralizzare l’attività farmacodinamica del Rivaroxaban sul FXa
- PRT064445, che inibisce l’attività anche di altri inibitori del FXa, quali Apixaban e betrixaban, neutralizzandone gli effetti farmacodinamici; tale molecola altro non è che un analogo ricombinante del fattore Xa a cui manca il dominio Gla che si lega alle membrane plasmatiche; esso non permette, quindi, la formazione della protrombina, il cui sito attivo è reso inattivo ma ancora in grado di legare substrati o inibitori.
Apixaban
Apixaban è un potente inibitore diretto reversibile e altamente selettivo del fattore Xa, sia nella sua forma libera che in quella legata al coagulo, prevenendo, così, la generazione del trombina che la lisi del trombo preesistente; l’inibizione della produzione di trombina conferisce, inoltre, a tale farmaco un’azione indiretta di antiaggregazione piastrinica.
L’Apixaban è somministrato in forma attiva, metabolizzato in parte a livello epatico in processi CYP3A4 dipendenti e per il 25% escreto a livello renale; ha una biodisponibità assoluta del 50%, un’emivita di 12 ore e un Tmax di 3 ore (Figura 2).
L’Apixaban non ha interazioni con gli alimenti. Per quanto riguarda, invece, le interazioni farmacologiche, inibitori del CYP3A4, come gli antifungini e gli inibitori delle proteasi, aumentano l’esposizione sistemica dell’Apixaban, aumentando così il rischio emorragico ad esso legato (tali farmaci sono, perciò, controindicati in co-somministrazione); dall’altro lato, induttori del CYP3A4 quali rifampicina, fenitoina, fenobarbital e carbamazepina, ne riducono l’effetto anticoagulante (in tal caso, somministrare Apixaban con cautela).
Essendo, poi, l’Apixaban, riassorbito a livello intestinale grazie alla glicoproteina-P, le interazioni con i farmaci induttori/inibitori di tale trasportatore sono sovrapponibili a quelle del Dabigatran.
Non sono necessari aggiustamenti del dosaggio se somministrato contemporaneamente ai più comuni antiaritmici (Diltiazem, Amiodarone, Atenololo, Verapamil, Digossina e Chinidina).
Fra gli effetti avversi comuni legati alla terapia con Apixaban vi sono: anemia (soprattutto postoperatoria), nausea ed emorragia postprocedurale; effetti indesiderati non comuni sono invece: rialzo di transaminasi, amilasi e lipasi, gamma-GT e bilirubina, trombocitopenia, sanguinamenti quali ematuria, epistassi, emorragie gastrointestinali, emorragie postprocedurali/postoperatorie e dalle ferite ed ipotensione postprocedurale; estremamente rari sono, invece, sono i sanguinamenti, quali emottisi ed emorragie rettali, gengivali, oculari e muscolari e le reazioni da ipersensibilità. Il farmaco è, quindi, controindicato in caso di: grave insufficienza epatica ed epatopatie associate a coagulopatia (somministrare con cautela nei pazienti con cirrosi e Child-Pugh A-B), grave insufficienza renale con filtrato glomerulare <15 ml/min (somministrare con cautela nei pazienti con filtrato glomerulare 15-29 ml/min), emorragie significative in atto e coagulopatie, gravidanza e allattamento ed ipersensibilità al principio attivo e/o agli eccipienti (lattosio).
Nuovi Anticoagulanti Orali: Lo studio Aristotele
Lo studio ARISTOTLE (“Apixaban for Reduction in Stroke and Other ThromboemboLic Events in atrial fibrillation”) è uno studio prospettico randomizzato, condotto in doppio cieco, che pone a confronto l’utilizzo di Apixaban alla dose orale di 5 mg b.i.d. (o 2,5 mg b.i.d. in pazienti con più di 80 anni, di peso corporeo inferiore a 60Kg e con una creatinina >1,5 mg/dl) rispetto a quello del warfarin (con dosaggio adeguato al valore target di INR tra 2 e 3) in pazienti con F.A. ed almeno un altro fattore di rischio aggiuntivo di stroke o embolismo sistemico.
Sono stati arruolati 18201 pazienti di età superiore ai 75 anni, con anamnesi positiva per stroke/TIA, diabetici, ipertesi e con insufficienza cardiaca e F.E <40%; sono stati esclusi dallo studio pazienti con protesi valvolari meccaniche, grave insufficienza reanle e che necessitavano di doppia antiaggregazione (aspirina + tienopiridine).
I risultati di questo studio hanno evidenziato la superiorità dell’Apixaban rispetto al warfarin nel ridurre il rischio di stroke ed embolismo sistemico e nel ridurre la mortalità in questi pazienti, a fronte di una importante riduzione del rischio emorragico.
Switch tra i vari tipi di terapia anticoagulanti
Nel caso in cui si voglia interrompere la terapia con uno dei nuovi anticoagulanti orali (NAO) e passare a quella con warfarin, la somministrazione di quest’ultimo va iniziata 3 giorni (filtrato glomerulare ≥50) o 2 giorni (filtrato glomerulare 30-49 ml/min) prima di sospendere il NAO; per passare, invece, dal nuovi anticoagulanti orali alla terapia con eparine a basso peso molecolare (EBPM), è possibile interrompere subito il nuovi anticoagulanti orali e attendere 24 ore prima di somministrare le EBPM.
Al contrario, l’inizio della terapia con nuovi anticoagulanti orali in pazienti già trattati con warfarin, prevede, dopo l’interruzione di quest’ultimo, il raggiungimento del valore target di INR di 2 prima di iniziare la prima dose di nuovi anticoagulanti orali; in pazienti pretrattati con EBPM, una volta interrotta tale terapia, si possono somministrare i nuovi anticoagulanti orali 0-2 ore prima della dose prevista di EBPM; per pazienti in trattamento con eparina non frazionata (UHF), invece, la prima dose di nuovi anticoagulanti orali può essere somministrata subito dopo aver sospeso la UHF.
Impostazione della terapia nei pazienti con Fibrillazione Atriale
Le nuove raccomandazioni per la prevenzione dei fenomeni tromboembolici sistemici nei pazienti con F.A. non valvolare prevedono che, qual’ora non sia possibile l’utilizzo di antagonisti della vitamina K per un’adeguata terapia antitrombotica, devono essere somministrati i nuovi anticoagulanti orali ora disponibili (inibitori diretti della trombina o inibitori del fattore Xa), laddove non controindicati.
Concludendo, la TAO ha un’efficacia dimostrata nel prevenire fenomeni tromboembolici sistemici nei pazienti con F.A. ed è l’unico trattamento associato ad una significativa riduzione della mortalità per cause cardiovascolari in tali pazienti.
Per tale motivo, essa è raccomandata in tutti i pazienti con F.A., tranne che in quelli con un rischio molto basso (donne con meno di 65 anni e senza comorbidità) o che hanno controindicazioni alla terapia anticoagulante.
La scelta dell’anticoagulante non deve basarsi sul tipo di F.A. (parossistica, persistente o permanente). Di primaria importanza è, invece, la valutazione del rischio emorragico (tramite l’utilizzo di score, quali l’HAS-BLED), per individuare i pazienti ad alto rischio (score superiore a 3), nei quali è necessario correggere i fattori di rischio modificabili ed aggiustare le dosi di anticoagulante.
Dall’altro lato, la valutazione del rischio di stroke (tramite lo score CHA2-DS2-VASc) è utile per individuare i pazienti con un rischio tromboembolico molto basso, che sono quelli che traggono meno beneficio dalla terapia anticoagulante, rispetto, invece, ai pazienti con uno score superiore a 2, che si giovano enormemente di tale terapia.
Il ruolo dell’aspirina (e/o della tienopiridina in associazione) in questo contesto è stato molto ridimensionato, poiché si è rivelata meno efficace e, soprattutto, meno sicura in termini di complicanze emorragiche, soprattutto negli anziani, per cui tale terapia è da riservare ai pazienti che rifiutano la TAO o in cui essa è controindicata per motivi non inerenti alle eventuali complicanze emorragiche.
Negli studi di confronto, i nuovi anticoagulanti orali risultano più efficaci, più sicuri e più convenienti rispetto agli antagonisti della vitamina K, anche se una valutazione completa e attendibile non è probabilmente ancora possibile, soprattutto considerando che si tratta di farmaci destinati a trattamenti la cui durata è di gran lunga maggiore rispetto a quella delle sperimentazioni finora condotte.


