Digitale Lanata
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Digitalis lanata Ehrmardt – Fam. Scrofulariacee/Rinantoidee/Digitalee) (Sin. – Digitalis epiglottidea Bréra – D. nova Wint. – D. orientalis Elmig.)
Digitale Lanata- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Digitalis (come Digitalis purpurea L. – vedi).
lanata, per il lobo mediano della corolla pubescente (lanatus) e per il calice con tomento denso d'aspetto lanoso.
Nome volgare – Digitale d'Ungheria.
Habitat – Ungheria, montagne della Tessaglia e della Romania. Coltivata.
Parti usate – Le foglie.
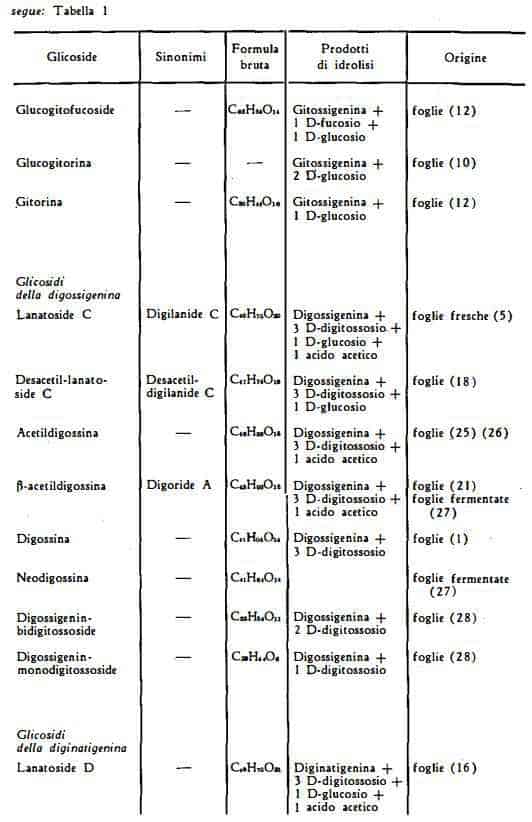
Componenti principali
Glicosidi con struttura sterolica, che, come i glicosidi della Digitalis purpurea, sono riferibili a due gruppi fondamentali:
I – Glicosidi cardioattivi, le cui genine hanno come scheletro il cardenolide con 23 atomi di carbonio.
II – Glicosidi non cardioattivi:
1) glicosidi del gruppo del digitanolo con genine, aventi un nucleo sterolico con 21 atomi di carbonio (digitanolo);
2) glicosidi saponinici con genine, che hanno per scheletro lo spirostano con 27 atomi di carbonio.
Lo studio dei glicosidi cardioattivi della Digitalis lanata fu iniziato nel 1930 da Smith (1), che riuscì ad estratte dalle foglie la digossina, giungendo a determinare la composizione ed i prodotti di idrolisi. Lo stesso A. nel 1931 (2) rilevò nelle foglie la presenza della gitossina, già nota come componente della Digitalis purpurea. In seguito furono separate dalla Digitalis lanata altre sostanze, quali la lanadigina ed i lanataglicosidi II, III e IV per opera di Mannich (3) e la dilanina per opera di Perrot (4). La presenza di questi composti come sostanze uniche non è stata confermata dagli studi successivi. Stotl e Kreis (5) nel 1933, applicando un metodo d'estrazione capace di bloccare l'azione degli enzimi, ottennero dalle foglie fresche la separazione di un preparato cristallino, il “digilanide” da cui poi riuscirono ad isolare i tre glicosidi cristallini lanatosidi A, B e C. Gli stessi AA. (6 – 9) proseguirono in seguito gli studi su queste sostanze e sui prodotti di degradazione di esse, stabilendo la stretta relazione esistente tra la composizione dei lanatosidi A, B e C e dei purpureaglicosidi A e B.
Con l'avvento dei metodi cromatografici e di ripartizione tra solventi non miscibili, molti nuovi componenti sono stati segnalati nella Digitalis lanata. E' comunque da stabilirsi, se tutte le sostanze isolate siano realmente presenti in origine nella droga o non si siano prodotte secondariamente nel corso dei procedimenti di estrazione.
Tra il 1952 ed il 1956, ad opera di Tschesche e coll. e di Sato e coll. furono messi in evidenza nelle foglie della Digitalis lanata alcune nuove sostanze cardioattive, appartenenti per lo più alla serie dei glicosidi della gitossigenina, cioè alla serie B. Furono trovati precisamente la gitorina (12), la glucogitorina (10), il glucogitofucoside (12) ed altri glicosidi, quali il digitalinum verum (11) (12) e lo strospeside (12) (13), componenti già noti della Digitalis purpurea e di altre droghe digitaliche. Kreis (14) nel 1956 segnalò la presenza di 20 nuove sostanze ignote.
Nel 1955 Murphy (15) isolò dalle foglie della Digitalis lanata la diginatina, un nuovo glicoside, avente come aglicone la diginatigenina, con 6 atomi di ossigeno, di cui quattro formanti altrettanti gruppi ossidrilici (tre secondari ed uno terziario), cioè con un ossidrile in più rispetto agli agliconi dei glicosidi già noti della serie A, B e C.
Successivamente, nel 1957, Renz e coll. (16) estrassero dalle foglie della Digitalis lanata un nuovo glicoside primario, producente per idrolisi totale gli stessi zuccheri degli altri lanatosidi insieme ccn l'aglicone diginatigenina ed avente perciò struttura analoga a quella dei lanatosidi A, B e C. Per questo gli AA. denominarono lanatoside D il nuovo composto.
Renz e coll. (17) nel 1958, nel corso di ricerche cromatografiche condotte sul lanatoside A, determinarono la presenza di un nuovo glicoside primario cui diedero il nome di lanatoside E e la cui composizione, secondo l'esito degli studi degli stessi AA. (17), risultò essere quella di un 16-formil-lanatoside B o acetilglucogitalossina, con struttura vicina a quella della glucogitalossina, già noto componente della Digitalis purpurea.
I – Glicosidi cardioattivi
Serie A – Glicosidi della digitossigenina
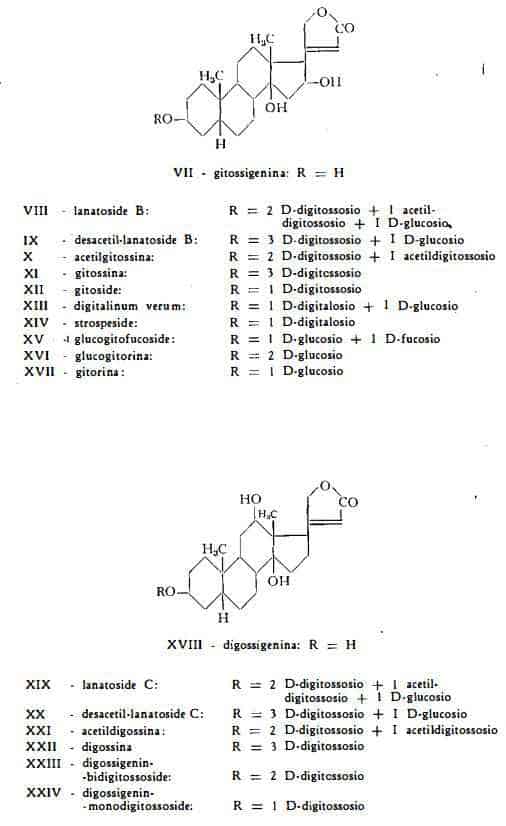
Il lanatoside A (digilanide A), C49H76O19, (formula di struttura Il) è stato isolato da Stoll e Kreis (5) dal complesso glicosidico «digilanide», estratto dalle foglie fresche della Digitalis lanata. Gli stessi AA. ne stabilirono la composizione con lo studio dei diversi prodotti di idrolisi. Esso risultò composto di due molecole di digitossosio, di una molecola di acetildigitossosio, di una molecola di glucosio e dell'aglicone digitossigenina, già noto componente dei glicosidi cardioattivi della serie A della Digitalis purpurea. Il lanatoside A ha quindi struttura vicina a quella del purpureaglicoside A, il glicoside primario della D. purpurea, poiché la differenza tra le due sostanze consiste soltanto nell'avere il lanatoside A un gruppo acetilico nel digitossosio legato al glucosio. Stoll e coll. (7) (8) (9) hanno infatti dimostrato che, per desacetilazione, il lanatoside A produce il purpureaglicoside A o desacetillanatoside A. Per eliminazione di un glucosio per via enzimatica, dal desacetillanatoside A si ottiene digitossina (7).
Il lanatoside A, per l'azione idrolizzante degli enzimi (digilanidasi), che si trovano nelle foglie, perde facilmente una molecola di glucosio (33) e libera acetildigitossina, la quale è stata trovata nelle due forme a e b di diverso potere rotatorio, forma cristallina ecc. (6).
Il desacetil-lanatoside A o purpureaglicoside A, C47H74O18, (formula III) e la b-acetildigitossina, C43H66O14, (formula IV) cioè i derivati del lanatoside C sopra indicati, sono stati trovati, in forma libera, nelle foglie della Digitalis lanata, il primo da Hrdy (18), da Fauconnet e Kreis (19) e da Fauconnet e Kutter (20), il secondo da Rangaswami (21) e da Haack e coll. (22).
Un bi-digitossoside della digitossigenina, C35H54O10, è stato isolato dalle foglie della Digitalis lanata da Haack, Kaiser e Spingler (23).
Un monodigitossoside della digitossigenina, C29H44O7, è stato pure estratto dalle foglie della stessa droga dagli AA. sopracitati (23).
Serie B – Glicosidi della gitossigenina
Il lanatoside B (digilanide B), C49H76O20, (formula di struttura VIII) è stato isolato da Stoll e Kreis (5) dal complesso glicosidico cristallino

«digilanide», estratto dalle foglie fresche della Digitalis lanata. Così denominato dagli stessi AA. (5), che ne hanno studiato la struttura chimica ed i prodotti di idrolisi, il lanatoside B, è composto di due molecole di digitossosio, una di acetildigitossosio, una di glucosio e dell'aglicone gitossigenina, il noto aglucone dei glicosidi della serie B della Digitalis purpurea. Il lanatoside B ha inoltre composizione avvicinabile a quella del purpureaglicoside B, essendo questo identico al desacetillanatoside B. Per scissione idrolitica, ad opera degli enzimi (digilanidasi), che si trovano nelle foglie, il lanatoside B perde facilmente una molecola di glucosio per dare acetilgitossina (33). Questa è stata trovata nelle due forme a- e b-, come la acetildigitossina già nominata sopra (6). Per desacetilazione del lanatoside B si ottiene il desacetillanatoside B o purpureaglicoside B, C47H74O19, (7) (8) (9), che è stato pure trovato in forma libera nell’analisi cromatografica dei lanatosidi commerciali (18).
La gitossina, C41H64O14, (formula di struttura XI), la cui esistenza, in seguito agli studi di Kraft (34), Kiliani (35), Cloetta (36) e Windaus (37), era già stata dimostrata nelle foglie della Digitalis purpurea, è stata poi estratta anche dalle foglie della Digitalis lanata da Smith (2).
Un monodigitossoside della gitossigenina, denominato gitoside, C29H4408, è stato separato da Murphy (24) dalle foglie della Digitalis lanata.
II digitalinum verum, C36H56O14, (formula XIII), isolato sin dal 1892 da Kiliani (38) dai semi della Digitalis purpurea, è stato estratto nel 1949 da Reichstein e coll. (11) anche dai semi e nel 1952 da Tschesche e coll. (12) dalle foglie della D. lanata. Degli studi sulla composizione e sui prodotti della scissione idrolitica del digitalinum verum è stato qui trattato a proposito della Digitalis purpurea.
Lo strospeside (desglucodigitalinum verum), C30H46O9, (formula XIV); già trovato nei semi dello Strophanthus speciosus Ward et Harv. e di S. bovina Baill. (39), è stato poi ottenuto anche dalle foglie della Digitalis purpurea (12) (13) e della Digitalis lanata (12). Esso si può far derivare dal digitalinum verum per perdita di una molecola di glucosio.
Il glucogitofucoside, composto di gitossigenina, di 1 mol. di D-fucosio e di 1 mol. di D-glucosio, è stato isolato in forma di acetato dalle foglie della Digitalis lanata da Tschesche e Grimmer (12). Per scissione idrolitica produce dianidrogitossigenina, 1 mol. di D-glucosio ed 1 mol. di D-fucosio.
La glucogitorina, segnalata da Grimmer (10) come componente della Digitalis lanata, contiene probabilmente due mol. di glucosio uniti all'aglicone gitossigenina.
La gitorina, C29H44O10, (formula XVII) è stata estratta dalle foglie della Digitalis lanata da Tschesche, Grimmer e Neuwald (12). Consta dell’aglicone gitossigenina e di 1 mol. di D-glucosio.
L'aglicone dei glicosidi della serie B, la gitossigenina, C23H34O5, (formula VII), è stato trovato anche in forma libera nelle foglie della Digitalis lanata da Tschesche, Grimmer e Neuwald (12).
Serie C – Glicosidi della digossigenina
Il lanatoside C (digilanide C), C49H76O20, (formula di struttura XIX), è stato separato da Stoll e Kreis (5) dal complesso glicosidico «digilanide», estratto dalle foglie fresche della Digitalis lanata. Gli stessi AA. (5-9) ne stabilirono la composizione centesimale e la formula di struttura studiandone i prodotti di demolizione.
Il lanatoside C consta dell’aglicone digitossigenina con 3 mol. di D-digitossosio, 1 mol. di glucosio finale ed un gruppo acetilico fissato al digitossosio legato al glucosio.
Per idrolisi ad opera degli enzimi che si trovano nelle foglie, dal lanatoside C si distacca 1 mol. di glucosio (33) con formazione di acetildigossina. Questa è stata trovata nelle forme a- e b- (6).
Per desacetilazione del lanatoside C si forma il desacetil-lanatoside C, C47H74O19, (7-9) che è stato trovato anche in forma libera nei lanatosidi commerciali (18),
L'acetildigossina, C43H66O15, (formula XXI), ottenuta, come si è detto, nelle due forme a e b da Stoll e Kreis (6) per idrolisi enzimatica del lanatoside C, è stata trovata anche in forma libera nelle foglie della Digitalis lanata da Gisvold e coll. (25) (26). La presenza della b-acetildigossina è stata segnalata nelle foglie anche da Rangaswami, Subramanian e Rao (21) e nelle foglie fermentate da Haack e coll, (27).
La digossina, C41H64O14, (formula XXII), è stata isolata per la prima volta dalle foglie della D. lanata da Smith (1), che ne ha determinata la formula grezza e che ne ha studiati i prodotti di scissione, costituiti dall'aglicone digossigenina, C23H34O5, e da 3 mol. di digitossosio. La formula di struttura XVIII della digossigenina è stata definita in base ai risultati dei lavori di Smith (1), di Steiger e Reichstein (40), di Mason e Hoehn (41), di Cardwell e Smith (42), di Pataki, Meyer e Reichstein (43).
La neodigossina C41H64O14, è stata trovata nella droga fermentata da Haack e coll. (27). Sembra essere un isomero della digossina che, come questa, per idrolisi produce digossigenina e digitossosio (27).
Un bidigitossoside della digossigenina, C35H54O11, Haack e coll. (28) hanno separato per cromatografia dalle foglie della Digitalis lanata. Gli stessi AA. (28) dalle foglie fermentate hanno ottenuto anche un monodigitossoside della digossigenina, C29H44O8.
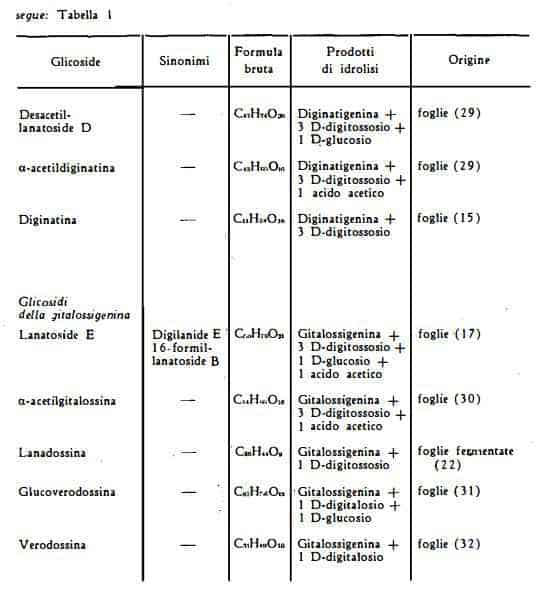
Serie D – Glicosidi della diginatigenina
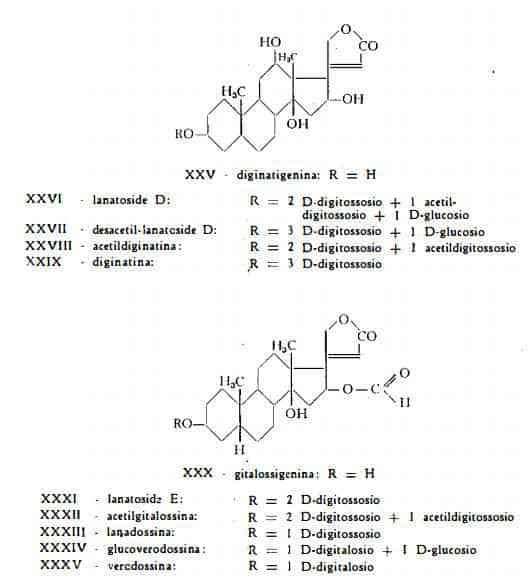
Il lanatoside D, C49H76O21, (formula XXVI) è stato isolato dalle foglie della D. lanata da Renz e coll. (16), i quali l'hanno ottenuto in forma cristallina e ne hanno determinato la costituzione chimica. Questo glicoside ha struttura analoga a quella dei lanatosidi A, B e C. L'idrolisi totale produce l’aglicone diginatigenina, tre molecole di digitossosio, una molecola di glucosio ed una molecola di acido acetico. Mediante parziale idrolisi enzimatica, dal lanatoside D si libera una molecola di glucosio e gli isomeri a- e b-acetildiginatina. Dalla desacetilazione di queste per trattamento con alcali si ottiene la diginatina.
Il desacetil-lanatoside D, C47H74O20, (formula XXVII) che si ottiene per trattamento del lanatoside D con alcali, è stato trovato in forma libera tra i componenti della D. lanata da Renz e coll, (29).
L’a-acetildiginatina, C43H66O16, (formula XXVIII) oltre che come prodotto di degradazione del lanatoside D, è stata riconosciuta anche in forma libera tra i componenti delle foglie della D. lanata per opera di Renz e coll. (29).
La diginatina, C41H64O15, (formula di struttura XXIX) è stata isolata per la prima volta dalle foglie della Digitalis lanata da Murphy (15) ed in un secondo tempo, come prodotto di idrolisi del lanatoside D, da Renz e coll. (29).
La diginatina per idrolisi si scinde, dando l’aglicone diginatigenina, C23H34O6, e tre molecole di digitossosio (15). Sia i prodotti di idrolisi che le formule centesimali e strutturali della diginatina e della diginatigenina sono stati studiati da Murphy (15).
Serie E – Glicosidi della gitalossigenina
Il lanatoside E, C50H76O21, (formula XXXI) è stato ottenuto, nel corso degli studi cromatografici eseguiti sul lanatoside A da Renz e coll. (17). Le ricerche degli stessi AA. hanno permesso di stabilire la composizione chimica di questo nuovo componente, caratteristico della Digitalis lanata ed analogo agli altri lanatosidi. Esso infatti è costituito dall'aglicone gitalossigenina, da tre molecole di digitossosio, da una molecola di glucosio e da un gruppo acetilico, fissato al digitossosio unito al glucosio. L'aglicone gitalossigenina, C24H34O6, (formula XXX) ottenuto dal lanatoside E, è identico all'aglicone della gitalossina, trovato in forma libera solamente nella Digitalis purpurea da Haack, Kaiser e Spingler (44). Pertanto la composizione del lanatoside E è quella di un 16-formil-lanatoside B, cioè di una acetil-glucogitalossina.
L'a-acetilgitalossina, C44H66O16, (formula XXXII) è stata trovata da Haack, Kaiser, Cube e Spingler (30) tra i prodotti dell'estrazione delle foglie di D. lanata, sottoposte o non a fermentazione. Essa può considerarsi derivata dal lanatoside E, privato di una molecola di glucosio.
La lanadossina, C30H44O9, (formula XXXIII) isolata da Haack e coll.
(22) dalle foglie della D. lanata sottoposte a fermentazione, è stata dagli stessi AA. identificata ad un mono-digitossoside della gitalossigenina, sostanza che era già stata estratta in piccole quantità dalla D. purpurea (23).
La glucoverodossina, C37H56O15, (formula XXXIV) resa nota da Haack e coll. (45) in precedenza quale componente delle foglie della D. purpurea, è stata trovata anche nelle foglie della D. lanata dagli stessi AA. (31). Essa consta dell'aglicone gitalossigenina, di una mol. di D-digitalosio e di una mol. di D-glucosio.
La verodossina, C31H46O10, (formula XXXV) isolata per la prima volta dalle foglie (46) e dai semi (45) della D. purpurea, è stata più recentemente trovata anche nelle foglie fermentate della D. lanata (32). La verodossina è stata identificata al 16-formilstrospeside, composto dell’aglicone gitalossigenina e di una mol. di D-digitalosio (46).
Composizione chimica dei glicosidi cardioattivi
I glicosidi cardioattivi della Digitalìs lanata, come quelli della Digitalis purpurea, sono di tipo cardenolide (ved. Digitalis purpurea). Essi hanno cioè come scheletro basilare un nucleo sterano, con un caratteristico anello lattonico insaturo pentatomico in posizione 17, con due gruppi —CH3 nelle posizioni C10 e C18 e con due gruppi —OH, uno in C14 l'altro in C3, al quale ultimo è legato il radicale zuccherino. Il nucleo lattonico è di importanza fondamentale per l'azione cardiotonica.
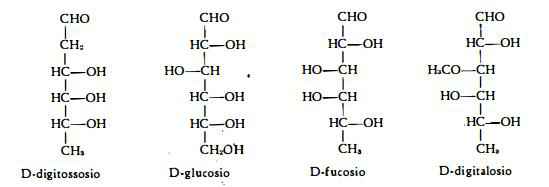
I quattro zuccheri, indicati sotto, sono i soli finora trovati nei glicosidi cardioattivi della Digitale. Due di questi zuccheri, il D-digitalosio ed il D-digitossosio, hanno una composizione caratteristica e sono stati trovati soltanto nei glicosidi cardioattivi. Il D-digitalosio è l'etere 3-metilico del D-fucosio ed il D-digitossosio è un 2-desossimetilpentosio.
La struttura chimica degli agliconi dei glicosidi digitatici è stata chiarita specialmente per merito dei lavori di Windaus e coll. ( 47), i quali riuscirono a mettere in evidenza la relazione, che esiste tra la composizione degli agliconi dei glicosidi cardiotonici e quella di noti steroli.
I glicosidi cardioattivi della Digitalis lanata sono classificabili in cinque gruppi, riferibili ai cinque agliconi digitossigenina, gitossigenina, digossigenina, diginatigenina e gitalossigenina. Poiché la gitalossigenina è la 16- formil-gitossigenina, gli agliconi si possono ridurre a quattro. Questi differiscono l'uno dall'altro soltanto nel numero e nella posizione dei gruppi ossidrilici e cioè:
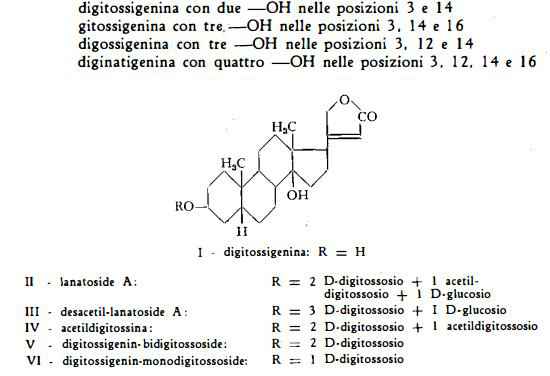
I glicosidi primari, cioè i lanatosidi A, B, C, D ed E contengono tutti nella propria molecola un gruppo acetilico, che li differenzia dai glicosidi iniziali della Digitalis purpurea, cioè dai purpureaglicosidi A e B ( = desacetil-lanatoside A e B).
I lavori di Stoll e coll. (5) ( 7-9) ( 3 3) sui lanatosidi A, B e C hanno dimostrato come avvenga l'idrolisi graduale di queste sostanze in diverse condizioni:
1) idrolisi dovuta agli enzimi della Digitalis lanata (digilanidasi), che distacca una molecola di glucosio, per dare i desglucosidi corrispondenti: acetildigitossina, acetilgitossina, acetildigossina;
2) idrolisi alcalina, che distacca il gruppo acetile sia dai lanatosidi sia dai desglucosidi per dare rispettivamente i purpureaglicosidi A, B e desacetil-lanatoside C nel primo caso e digitossina, gitossina e digossina nel secondo caso;
3) idrolisi enzimatica, ottenibile con gli enzimi delle foglie della Digitalis purpurea (digipurpidasi), che determina il distacco del glucosio dai desacetillanatosidi con formazione dei glicosidi secondari (digitossina, gitossina e digossina).
4) l'idrolisi acida diretta dei lanatosidi non produce tre molecole di digitossosio ed una molecola di glucosio, ma due molecole di digitossosio ed una di digilanidobiosio, C12H22O9, scindibile per idrolisi acida in una molecola di digitossosio ed una di glucosio.
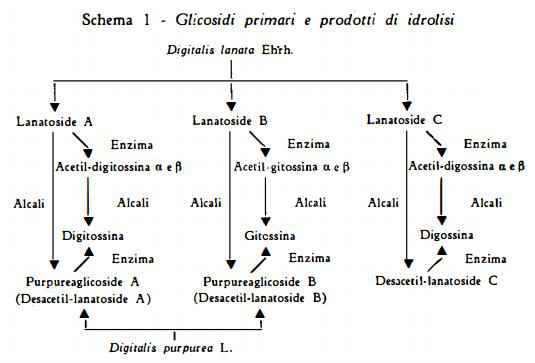
Come risulta dallo schema 1 i processi idrolitici che avvengono per via enzimatica, conducono alla formazione dei desglucosidi mediante eliminazione di una molecola di glucosio.
I glicosidi che contengono un gruppo acetilico sono più facilmente scissi dagli enzimi della Digitalis lanata, mentre quelli privi del gruppo acetilico sono più facilmente attaccati dalle preparazioni enzimatiche della Digitalis purpurea (33).
E' stato dimostrato (48) (49) che la droga fresca, analizzata con procedimenti estrattivi bloccanti l'azione degli enzimi, non contiene i desglucosidi, cioè la digitossina, la gitossina e la digossina, nè gli acetilderivati di queste, mentre, anche solo dopo breve intervento degli enzimi, si producono i desglucosidi A, C e probabilmente B.


0
Contenuto di glicosidi cardioattivi
Il contenuto di glicosidi cardioattivi della Digitalis lanata varia molto a seconda della provenienza della droga ed anche per piante di una stessa coltivazione; per due dei più importanti glicosidi, i lanatosidi A e C, vi possono essere differenze raggiungenti il rapporto di 1 a 10 (50). Variazioni notevoli si hanno anche in una stessa pianta durante il suo sviluppo, nel corso della giornata e secondo le condizioni meteorologiche (20). Differenze nella composizione chimica sono riferibili all’ambiente (terreno, clima, esposizione al sole) ed a fattori ereditari (51). La coltivazione di piante selezionate ha permesso di ottenere piante più omogenee nel contenuto di glicosidi cardioattivi (50) e ricche dei lanatosidi A o C rispettivamente (51). Il titolo di glicosidi cardiotonici nelle foglie, risulta essere massimo verso la line di settembre ed all’inizio di ottobre (20) (50).
Nella tabella 2 sono raccolti i dati quantitativi riportati in letteratura sul contenuto di glicosidi cardioattivi della Digitalis lanata.
II – Glicosidi non cardioattivi
1)Gruppo del digitanolo
Tra gli altri componenti della Digitalis lanata vi sono i seguenti glicosidi non cardioattivi del gruppo del digitanolo, presenti anche nella Digitalis purpurea, i quali hanno come scheletro fondamentale un nucleo sterolico con 21 atomi di carbonio:
1) la diginina, C28H40O7, è stata estratta dalle foglie della Digitalis purpurea da Karrer nel 1936 (58) e più recentemente anche nella Digitalis lanata da Tschesche e Buschauer (59), che ne hanno proposto la formula di struttura XXXVI.

1
2) La digifoleina, C28H40O8, è stata isolata dalle foglie della Digitalis lanata e della D. purpurea da Tschesche e Grimmer (12). Tschesche R. e Buschauer (59) ne hanno determinata la formula di struttura XXXVIl.
L’aglicone digifologenina, C21H28O5, che con una molecola di D-diginosio costituisce la digifoleina, si differenzia dall’aglicone della diginina, la diginigenina, per la presenza di un —OH in C2.
3) La lanafoleina, C28H40O8, (formula di struttura XXXVIII), estratta da Tschesche e Buschauer (59) dalle foglie della Digitalis lanata e della D. purpurea, per idrolisi si scinde dando una molecola di D-oleandrosio ed un aglicone identico a quello della digifoleina, cioè la digifologenina, C21H28O5 (60). Precedentemente l'aglicone della lanafoleina era stato denominato lanafologenina (59).
4) La digipronina, C28H40O9, (61) (62), è stata estratta dalle foglie della Digitalis purpurea e della D. lanata da Sato, Ishii, Oyama e Okumura (61) e da Tschesche, Lipp e Grimmer (63), i quali ultimi ne hanno ottenuto per idrolisi l'aglucone, digiprogenina, di formula grezza C21H28O5, e digitalosio. Sato (62) dall'idrolisi della digipronina ha ricavato tre genine: a-genina C21H28O5, b-genina C21H26O4 e g–genina C21H28O5.
5) La purpnina, trovata nelle foglie della D. purpurea e della D. lanata
(61) (63), darebbe per idrolisi un aglicone di formula grezza C21H32O4 (61).

2
2) Saponine
La Digitalis lanata, come la Digitalis purpurea, contiene saponine steroidiche, aventi come scheletro fondamentale lo spirostano. Le saponine steroidiche isolate dalla Digitalis lanata sono;
1) la digitonina, C56H92O29, (digitogenina + 2 mol. glucosio + 2 mol. galattosio + 1 mol. di xilosio), trovata sin dal 1875 da Schmiedeberg (64) nella digitalina commerciale, preparata dai semi della Digitalis purpurea, è stata identificata anche nei semi della D. lanata da Szahlender (65). Circa la formula di struttura dell'aglicone digitogenina, C27H44O5.
2) La tigonina, C56H92O27, è stata isolata dalle foglie della Digitalis lanata nel 1936 da Tschesche (66). Secondo lo stesso A., la tigonina è costituita dall'aglicone tigogenina e presumibilmente da 2 mol. di galattosio, 2 mol. di glucosio ed 1 mol. di xilosio. L'aglicone tigogenina, C27H44O3, era già noto in precedenza, per essere stato ottenuto, da un estratto delle foglie della Digitalis purpurea, da Jacobs e Fleck (67).
Altri componenti
Oltre ai glicosidi nella Digitalis lanata sono stati trovati:
Vitamina C: 1) (nelle foglie secche del primo anno) mg 105-114 % in maggio, nello stadio di formazione dei germogli; mg 93-73 % in giugno nel periodo della fioritura; mg 63 % in ottobre; 2) (nelle foglie secche del secondo anno) mg 69 % in maggio, mg 53 % in settembre (68).
Acetilcolina 0,001 % e colina 0,1 % nelle foglie secche (69).
Umidità: 11-14% (55).
Enzimi: nelle foglie enzimi (digilanidasi), che, come si è detto sopra, scindono i glicosidi primari nei secondari corrispondenti (33), nei semi enzimi in grado di idrolizzare i glicosidi primari dei semi; nelle foglie enzimi in grado di idrolizzare i glicosidi delle foglie e dei semi (70).
Proprietà farmacologiche ed impiego terapeutico
I primi studi sulla Digitale lanata risalgono al 1917 allorché il Morris (71), forse per il primo, mise in evidenza la rilevante attività terapeutica di campioni di droga coltivata nel Minnesota (U.S.A.) e allorché De Toni e Tognoli (72), un anno più tardi in Italia, constatavano la notevole ricchezza in principi attivi di campioni di Digitale lanata coltivata a Modena.
Ricerche comparative fra l'attività della D. lanata e della D. purpurea, furono in seguito eseguite da diversi AA. (Dafert (73), Dafert e Lasch (74), Dafert e Englisch (75), Himmelbauer e Zwillinger (76) , De Graaf (77), Hecht (78), Dezani (79), Rabbeno e Marini (80) ecc.) i quali tutti trovarono che l'attività della D. lanata è superiore da 2 a 5 volte a quella della D. purpurea, ad eccezione di Rabbeno e Marini i quali la trovarono più attiva soltanto del 25 %.
Questi risultati che deporrebbero a favore di una maggior attività della
D. lanata rispetto alla D. purpurea, sono dovuti molto verosimilmente, oltre che ad un maggior contenuto di principi attivi nella D. lanata, anche alle notevoli variazioni di attiv
Occorre anche tener conto del fatto che i lanatosidi sono meno termolabili e più resistenti alle azioni enzimatiche dei purpureaglicosidi. Tanto Dezani quanto Echt, trovarono infatti che le foglie di D. lanata non perdono di attività dopo un anno di conservazione senza speciali precauzioni e prove da noi eseguite titolando una soluzione di estratto iniettabile di D. lanata, prima e dopo la sterilizzazione a 100° per 20', hanno dimostrato che la soluzione non perde di attività.
Le ricerche farmacologiche e cliniche eseguite con la D. lanata come tale, sono scarsissime, mentre numerose ed esaurienti sono quelle eseguite impiegando i suoi glicosidi, lanatosidi A, B e C, isolatamente considerati o sotto forma di varie associazioni, oppure di prodotti della loro idrolisi, quali specialmente l'acetildigitossina e la digossina.
Ricerche comparative fra l'azione della D. purpurea e la D. lanata furono eseguite dall'Heim (82) il quale trovò che il tempo di latenza sul cuore ipodinamico secondo Straub, è di 3 o 4 volte più lungo per la purpurea che per la lanata. Analogamente, la produzione massimale del lavoro (volume-minuto) del cuore di rana isolato e perfuso, è raggiunto più rapidamente con la lanata che con la purpurea. La fase terapeutica per contro, sarebbe più durevole dopo l'azione della purpurea e l'azione diuretica studiata sul rene isolato di rana, ottenuta con la purpurea, sarebbe più regolare.
Per quanto riguarda l'azione farmacologica dei lanatosidi si può dire che essa è fondamentalmente la stessa di quella descritta per i glicosidi della D. purpurea e se differenze esistono, esse riguardano l’eliminazione che sarebbe più rapida, il periodo di latenza e la durata di azione che sarebbero invece più brevi per i lanatosidi.
I glicosidi digitalici assumono con i componenti proteici del sangue legami più o meno tenaci, formando con essi, complessi la cui stabilità varia col variare della tenacità del legame stesso.
L'azione dei glicosidi che formano complessi più stabili si manifesterebbe, secondo Rothlin e Bircher (83), dopo un periodo di latenza più lungo e la loro azione sarebbe meno reversibile e quindi più durevole. Il lanatoside A per es., assume un legame molto stabile con gli albuminoidi, mentre il legame che assume il lanatoside C è molto più labile.
Esperienze eseguite comparativamente sull'animale e sull'uomo, coi diversi glicosidi digitalici, hanno dato risultati piuttosto contrastanti per quanto riguarda la reversibilità e la durata d'azione. La scala della durata d'azione sulla rana e sul gatto, secondo Rothlin e Bircher sarebbe, in senso crescente, la seguente: Scillaglicosidi, lanatoside A, lanatoside C, acetildigitossina, digitossina, Strofantoglicosidi. Sull'uomo invece, in base a risultati dedotti da ricerche cliniche si avrebbe, sempre in senso crescente, la seguente successione: Strofantoglicosidi, Scillaglicosidi, lanatoside C e digossina, acetildigitossina, digitossina, successione questa che varrebbe anche per l'azione bradicardizzante dei vari glicosidi.
Questa differenza fra i risultati ottenuti sull'animale e sull'uomo dimostrerebbe, secondo gli AA., che il dosaggio deve essere dedotto basandosi non sui dati ottenuti sugli animali ma su quelli derivanti dall'analisi clinico-terapeutica.
Pur tenendo conto delle differenze d'azione esistenti fra i diversi lanatosidi, si può ritenere che essi occupino, per quanto riguarda la velocità di assorbimento, il periodo di latenza, la durata d'azione, la velocità di eliminazione e la reversibilità d'azione, un posto intermedio fra i glicosidi dello Strofanto e quelli della D. purpurea.
Considerando i lanatosidi, troviamo infatti che le caratteristiche di uno di essi e precisamente dell'A., da cui per idrolisi enzimatica ed alcalina derivano, rispettivamente, l'acetildigitossina e la digitossina, sono simili a quelle proprie dei purpureaglicosidi, mentre le caratteristiche del lanatoside C, da cui derivano l'acetildigossina e la digossina, si avvicinano di più a quelle proprie ai glicosidi dello Strofanto, col vantaggio però di un miglior assorbimento enterale ed un'azione più prolungata. L'aliquota di eliminazione del lanatoside C nelle 24 h, sarebbe del 20% e la sua azione si esaurirebbe completamente nello spazio di 5-7 giorni (83).
Si può dire che le stesse differenze d'azione esistano fra l'acetildigitossina derivante dal lanatoside A e la digossina derivante dal lanatoside C. L'acetildigitossina, per la sua completa azione digitalica e per la possibilità di essere quasi completamente assorbita enteralmente, si avvicina notevolmente alla digitossina che da essa deriva per idrolisi alcalina e dalla quale differirebbe per una maggior rapidità d'azione e per una migliore tollerabilità, il che consentirebbe un più ampio margine di dosaggio e quindi un più vasto impiego terapeutico.
L'azione cronotropa negativa dell'acetildigitossina è molto elevata e per la rapidità con cui si manifesta è da ritenersi superiore a quella della strofantina, mentre la sua durata d'azione sarebbe più lunga (10-14 giorni). Per queste caratteristiche essa può essere impiegata per os oltre che per via parenterale, anche nello scompenso grave ed è specialmente indicata nel trattamento iniziale dell'insufficienza cardiaca con tachicardia parossistica. Il potere di accumulo dell'acetildigitossina è piuttosto elevato, ma la sua azione è più facilmente reversibile e quindi meglio controllabile.
I sintomi di iperdosaggio sono simili a quelli degli altri glicosidi digitalici (ved. Digitale purpurea), ma scompaiono più facilmente e, di solito, dopo 1-3 giorni di terapia discontinua [von Lófiler, Essellier e coll. (84), Rothlin, Bircher e Schalch (85)].
La digossina agisce invece più rapidamente ma anche la sua eliminazione è più rapida, tanto che la durata della sua azione non supera i 7 giorni. Essa è meno attiva dell'acetildigitossina e la sua azione è più facilmente reversibile. Per queste caratteristiche l'azione della digossina è più vicina a quella della strofantina che a quella della digitossina. Somministrata per os agisce con la stessa rapidità ed intensità della strofantina somministrata per via parenterale e la sua azione è più prolungata.
II Seibel (86), che ha studiato sul cuore isolato di rana il modo e la velocità d'azione della digossina, la sua attività alle diverse concentrazioni, la tossicità e l'accumulo, ha trovato che le curve meccanografiche ottenute dal cuore intossicato con digossina, sono sovrapponibili a quelle ottenute con gli altri digitalici. A concentrazioni elevate la sua azione si è dimostrata pià rapida di quella della digitossina e della strofantina. La concentrazione optimum per il cuore di rana, sarebbe compresa fra l'1:25000 e l’1:50000 e la sua tossicità sarebbe di 4 volte inferiore a quella della digitossina. Il cuore di rana, secondo Seibel, può fissare il glicoside fino a raggiungere una concentrazione 58 volte superiore a quella del liquido di perfusione e il tempo di fissazione della digossina, alle medie concentrazioni (nel cuore di rana), sarebbe superiore a quello della digitossina; alle basse concentrazioni sarebbe invece inferiore.
Come si è già detto trattando della D. purpurea, oggi si esclude che le droghe digitaliche (Scilla compresa) siano dotate di un'azione diuretica diretta. Alcuni AA. [Hyman, Jaques e Hyman (87)] attribuiscono tuttavia alla digossina una notevole attività diuretica diretta e la proprietà di determinare un aumento dell'escrezione del sodio, oltre che dell'acqua, azione questa alla quale il rene di animali in scompenso congestizio provocato sperimentalmente, si è dimostrato più sensibile di quello di animali normali. Alle stesse conclusioni giunsero precedentemente Davis e coll. (88), i quali trovarono che in cani con insufficienza cardiaca prodotta sperimentalmente, il sodio e l'acqua escreta aumentano dopo trattamento con digossina e così pure la velocità di filtrazione glomerulare e la corrente piasmatica renale.
Per quanto riguarda le modalità di eliminazione della digossina, Shepheard e coll. (89) studiarono, mediante cromatografia su carta, i prodotti di eliminazione nelle urine di ratto, valutandone poi l'attività col metodo dell'embrione di pollo.
Essi trovarono che circa il 10% della dose somministrata viene escreta nelle 24 h sotto forma di metaboliti attivi non identificati, fra i quali non si troverebbe però la digossigenina, ma una sostanza che, come la digossigenina, contiene l'anello lattonico insaturo.
L'escrezione dei lanatosidi attraverso la bile è stata recentemente studiata mediante cromatografia su carta e colorimetria da Cox e Wright (90) i quali trovarono che i lanatosidi A e C vengono escreti integri; la digitossina, la digossina e la digossigenina, in parte integri e in parte come metaboliti, mentre la digitossigenina viene escreta completamente come metabolica.
La quantità di glicoside o di aglicone e i loro metaboliti presenti nella bile 5 ore dopo la somministrazione del glicoside, è di circa il 10% per la digitossina e varia dal 70 all'80 % della dose somministrata, per i lanatosidi A e C. Circa il 10% di ogni aglicone si troverebbe nella bile escreta.
Per quanto riguarda l'impiego terapeutico dei lanatosidi si può dire in generale che, occupando essi per la loro azione un posto intermedio fra quello dei glicosidi della D. purpurea e quelli dello Strofanto, hanno anche le stesse indicazioni, con il vantaggio di un impiego molto più facile di quello della digitossina e della strofantina, alle quali spesso possono essere sostituiti.
I migliori successi terapeutici, secondo Hochrein e Lechleitner (91), che hanno sperimentato col Digilanid (associazione dei tre lanatosidi A, B e C), si otterrebbero nelle cardiopatie con grave scompenso che reagiscono nella stessa misura soltanto alla strofantina e ai diuretici mercuriali associati. L'azione sicura e rapida del preparato, ha permesso agli AA. di usare la via gastrica, in molti casi in cui avrebbero dovuto ricorrere alla terapia strofantinica endovenosa.
II Bisbini (92) afferma che ben raramente si possono osservare nella pratica corrente, effetti sulla diuresi così imponenti ed un rallentamento del polso così intenso, come con l'impiego del suddetto complesso lanatosidico, il cui effetto è considerato dall'A. superiore a quello della D. purpurea stessa.
Condorelli e coll. (93-94), che studiarono esaurientemente l'azione terapeutica di un preparato in cui prevalgono le caratteristiche del lanatoside C, trovarono che gli effetti più brillanti si ottengono nei miocarditici e nei mitralici scompensati con fibrillazione auricolare; nell'insufficienza aortica scompensata con ritmo sinusale, l'impiego del preparato sarebbe meno pericoloso della D. purpurea, data la meno intensa azione cronotropa negativa e può essere ottimamente tollerato anche nei casi in cui esistano fatti coronarici, perchè pare non eserciti azione costrittrice sulle coronarie.
Sembrerebbe dunque, da quanto risulta dalle ricerche farmacologiche e cliniche, che alla D. lanata e ai lanatosidi, possano attribuirsi le azioni della D, purpurea e dei purpureaglicosidi, dei quali però non avrebbero tutte le controindicazioni, sarebbero meglio tollerati, meno tossici avrebbero una zona maneggievole più ampia e potrebbero essere impiegati in alcuni casi, per os in sostituzione della strofantina per via endovenosa. Non a torto quindi Perrot, Bourget e Raymond-Hamet (95), affermarono che la D. lanata potrà essere chiamata a sostituire la purpurea.
Estratti e preparati vari
Estratto secco iniettabile (Titolo biologico).
Dosi: 3 u.e.p. tre volte pro die o secondo prescrizione medica.
Preparazioni usuali e formule galeniche
——
BIBLIOGRAFIA
(1) SMITH S., /. Chem. Soc., 508 e 2478, 1930; 1305* 1935 – (2) SMITH S., /. Chem. Soc., 23» 1931 – (3) MANNICH C.. MOHS P. e MAUSS W., Arch. Pharm., 268, 413, 1930 – (4) PERROT E.. BOURCET P. e RAYMOND-HAMET, Butt. Sci. Pharmaco!., 38, 7» 1931 – (5) STOLE A. e KREIS W., Helv. Chim. Acta. 16. 1049, 1933 – (6) STOLE A. e KREIS W.. Heiv. Chim. Acta, 27. 592. 1934; 35, 1318, 1952; STOLE A., von WARTBURG A. e KREIS W, ibidem.. 35. 1324, 1952 – (7) STOLE A. e KREIS W., Helv. CMm. Acta. 26. 1390, 1933 – (8) STOLE A. e KREIS W„ Hetv. CMm. Acta, 28, 120, 1935 – (9) STOLE A., KREIS W. e von WARTBURG A., Helv. CMm. Acta, 37. 1134, 1954 – (10) GRIMMER G., Pianta Med., 4. 134, 1956 – (11) MOHR K, e REICHSTEIN T.. Pharm. Acta Helv., 24. 246, 1949; Chem. AÒs.. 44. 1652, 1950 – (12) TSCHESCHE R., GRIMMER G. e NEUWALD F., Ber., 85. 1103, 1952; TSCHESCHE R. e GRIMMER G., Ber.. 88, 1569, 1955 – (13) SATO D., YOSHIDA K., ISHll H. e NISHIY., Pharm. Butì., l. 396, 1953; Chem. Abs., 49, 11962 i, 1955 – (14) KREIS K., Tesi di Farmacia, Losanna, 1953; FAUCONNET L. e KREIS K., Pharm. Acta Helv., 32. 253, 1957 – (15) MURPHY J. E., J.A.Ph.A., Sci. ed., 44. 719, 1955 – (16) ANGLIKER E., BARFUSS F., KUSSMAUL W. e RENZ J„ Lleb. Ann., 607. 131» 1957 – (17) ANGLIKER E.» BARFUSS F. e RENZ J., Helv. Chlm. Acta. 42, 479, 1958 – (18) HRDY O. e coU., Cekostov Farm., 4. 395» 1955; /. Pharm. Pharmacot., 8, 616, 1956 – (19) FAUCONNET L. e KREIS W.» Pharm. Acta Helv., 32. 253, 1957 – (20) FAUCONNET L, e KUTTER D.» Pharm. Acta Hetv., 33. 369, 1958 – (21) RANGASWAMI S. e coll., ind. J Pharm.. 27. 253, 1955; Chem. Abi.. 50, 13375 e, 1956 – (22) HAACK S. e col!., Naturwiss.. 45. 388, 1958 – (23) HAACK E.. KAISER F. e SPINGLER H„ Ueb. Ann.. 603» 73. 1957 – (24) MURPHY J. E , J.A.Ph.A.. Sci. ed.. 46. 170, 1957 – (25) HOPONEN R. E. e GISVOLD O.» J.A Ph.A. Sci. ed.. 42. 146, 1952 – (26) KRISHNAMURTY G. G. c GISVOLD O., ibidem., 42. 152, 1952 – (27) HAACK E » KAISER F. e SPINGLER H.. Naturwlss.. 46. 447, 1959 – (28) HAACK E., KAISER F. e SPINGLER H.. Naturwiss.. 44. 633, 1957; Chem. Abs., 52. 12318 c. 1958 – (29) Von WARTBURG A.. ANGLIKER E„ BARFUSS F. e RENZ J„ Exper., 14, 439, 1958 – (30) HAACK E., KAISER F., GUBE M. SPINGLER H.. Naturwiss.. 45. 315, 1958; Chem. Abs.. 53. 650 g, 1959 – (31) HAACK E., KAISER F., GUBE M. c SPINGLER H.. Naturwiss., 45. 338, 1958 – (32) HAACK E, KAISER F. e SPINGLER H.» Naturwiss.. 45. 241, 1958 – (33) STOLL A., HOFMANN W. e KREIS W., Z. physioì. Chem., 235. 249, 1935 – (34) KRAFF F., Arch. Pharm.. 250. 118, 1912 – (35) KILIANI H„ Arch. Pharm., 252. 13, 1914 – (36) CLOElTA M„ Arch. exp. Pmh. u. Pharmakol., 222, 261, 1926 – (37) WINDAUS A. e coll.. Ber., 58, 1515 e 1519, 1925; 61, 1847, 1928 – (38) KILIANI H., Arch. Pharm., 230, 250, 1892 – (39) RIITEL W., HUNCIER A. e REICHSTEIN T„ Helv. Chlm. Mela, 33. 434, 1952; SCHINDLER O., REICHSTEIN T„ Ibidem,, 35, 442, 673, 1952 – (40) STEIGER M. e REICHSTEIN T, Helv. Chlm. Acla, 21, 828, 1938 – (41) MASON K L. e HOEHN W. M„ J. Am. Chem. Soc„ 60, 2824, 1938; 61, 1614, 1939 – (42) CARDWELL H. M. E.!e SMITH S.. Exper., 9, 367, 1953; J. Chem. Sac., 2Ó12, 1954 – (43) PATAKI S„ MEYER K. e REICHSTE1)4 ,
T.. Helv. Chlm. Acla, 36, 1295, 1953 – (44) HAACK E., KAISER F. e SPINGLER H„ Ber., 89, 1353, 1956 – (45) HAACK E., KAISER F„ GUBE M, e SPINGLER H„ Nalurwlss., 43. 301, 1956 – (46) HAACK É., KAISER F. e SPINGLER H„ Nalurwlss., 43, 130, 1956 – (47) WINDAUS A. e WEIL, Z. physiol. Chem„ 121. 62. 1922; WINDAUS A. e STEIN. Ber.. 61. 2436. 1928; WINDAUS e SCHWARTE. Ber.. 58. 1515. 1925; WINDAUS. WESTPHAL e STEIN. Ber.. 61. 1854, 1928; WINDAUS. Arch. exp. Palh. u. Pharmakol.. 135. 256. 1928; WINDAUS e HAACK, Ber.. 62. 475. 1929 – (48) GISVOLD O. e WRIGHT S. E.. J.A.Ph.A.. Sci. ed.. 46. 535. 1957 – (49) STOLL A. e RENZ J.. Verh. Naturi. Gei. Basel. 67. 392, 1956 – (50) FAUCONNET L.. Pharm. Acta Helv.. 35, 121, 1960 – (51) LIGETI G. Pharmatle, 14. 162, 1959 – (52) STOLL A.. Chem. Ind.. 1563. 1959 – (53) LEBEAU P. e JANOT M., Pharmacie Chimique. 1955-1956, p. 3541 – (54) FAUCONNET L. e KUTTER D., Pharm. Acla Helv.. 33, 374. 1958 – (55) TANTIVATANA P. e WRIGHT S. E„ /. Pharm. Pharmacol., 10, 189, 1958 – (56) UCHIBAYASHI M., Chem. Pharm. Bull.. 6. 504, 1958; Chem. Abs.. 53. 11435 1, 1959 • (57) ATARASHI S e coll, rakugaku Kenkyn. 30. 651, 1958; Chem. Abs.. 53. 20699 a. 1959 – (58)KARRER W„ Fesischfift E. Bardi. 1936, p. 238 – (59) TSCHESCHE R. e BUSCHAUER G, Lleb. Ann.. 59. 1957; Chem. Abs., 52, 3847 i, 1958; Dtsch. Ap. ZIg.. 97, 5, 1957 • (60) TSCHESCHE R. e LIPP G.. Ueb. Ann., 615, 210, 1958; Chem. Abs., 53, 20130 a, 1959 – (61) SATO D„ ISHII H.. OYAMA Y. e OKUMURA T„ J. Pharm. Soc. Japan, 75, 1573, 1953; Chem. Abs,, 50. 10750 e, 1956 – (62) SATO D„ Yakugaku ZasshI, 79, 1474, 1959; Chem. Abs., 54. 6809 s, I960 – (63) TSCHESCHE R.. LIPP G. e GRIMMER G., Lleb. Ann., 606, 160, 1957; Chem. Abs., 52, 9176h, 1958 – (64) SCHMIEDEBERG O., Arch. exp. Palh. u. Pharmakol., 3, 16, 1875 – (65) SZAHLENDER K„ Ardi. Pharm,, 446. 1936 – (66) TSCHESCHE R„ Ber., 69. 1665, 1936 – (67) JACOBS W. A, e FLECK E. E, 1. Blol. Chem., 88, 545, 1930 – (68) GUNTHER E., HEEGER E. F. e ROSENTHAL C, Pharmade, 7, 24, 1952- (69) NEUWALD F„ Arch. Pharm., 459, 1952 – (70) WEGNER E., Arinelm.-Forsch., 3, 482, 1953; Chem. Abs., 48, 1633 h, 1954 – (71) MORRIS, Pharm. 1., 44, 375, 1917 – (72) DE TONI e TOGNOLL Atti R. Ist, Veneto di Scien,, Lettere e Arte. 78, Il – (73) DAFERT O, Pharm. Press., 1922 [cit. da PERROT e coll, (95) ) – (74) DAFERT O, e LASCH F., Pharm. Ada Helv., 1, 79, 1926 – (75) DAFERT P. e ENGLISCH K„ Hell. u. Gewlirzpff., 8, 176, 1926 – (76) HIMMELBAUER W, e ZWILLINGER E„ Biololla Gen. [cit. da'HECHT (78)] – (77) DE GRAAF W,, cit. da HECHT ibid. – (78) HECIIT W, Bull. Soc. Pharmacol.. 32, 145, 1930 – (79) DEZANI S., Gazi. Sanll,, 4, 3. 1931 – (80) RABBENO A. e MARINI O, Ardi. Ini. Pharmacodyn. et de Ihér., 48, 3-4, 298-321, 1934 – (81) STOLL A.. Chem. Ind., 1562. 1959 – (82) HEIM F, Arch. t. exp. Palh. u. Pharmakol., 184, 214-228, 1937 – (83) ROTHLIN E e BIRCHER R, Erttebn. d. Inner. Med. u. Klnderheitk. 5 (nuova serie). 457-552, 1954 – (84) Von LÓFFLER W. e ESSELLIER A. F. e eoa, Disch. Med. Woch., 83. 12. 290. 1953 – (85) ROTHLIN E. BIRCHER R. e SCHALCH W. Rr, Schwelz. Med. ìVoch., 83, U, 1953 – (86) SEIBEL E. ,4rcA. /, Krelslaufforsch., 18, 49, 1952 – (87) HYMÀN A. L.. JAQUES W. E. e HYMAN E. S. ,4ni. Heari J., 52, 592, 1956 – (88) DAVIS J. O, HOWEL D. S.. HYATT E. R. e CASPER A.. Circulal. Research, 3, 259-263. 1955 – (89) SHEPHEARD E. E.. TORP R. H. e WRIGHT S. E., J. exp. ther., 112, 133-137, 1954 – (90) COX E. e WRIGHT S. E.. 16/(1., 126. 117-122, 1959 – (91) HOCHREIN e LECHLEITNER. Mlinch. Med. IToch., n. 19. 1933 – (92) BISBINI B.. Min. Med., 25, II. 435, 1934 – (93) CONDORELLI e CORTESI. La Clln. Med. II., n. 3. 205-261, 1935 – (94) FRANCAVILLA. ibid. n. 3 . 293-353, 1940 – (95) PERROT. BOURGET e RAYMOND-HAMET. Bull. Scien. Pharmacol., n. 38, 7, 1931.


