Elaterio (Cocomero asinino)
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
Sedimento del succo del frutto
(Ecballium Elaterium A Rich. – Fam. Cucurbitacee)
(Sin. – Momordica elaterium L. – Momordica aspera Lamk. – Elaterium
cordifolium Rich.)
Elaterio (Cocomero asinino)- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Ecballium, dal greco ekballein = lanciare fuori, allusione al frutto che schizza i semi.
Elaterium, dal greco elathrion, nome greco del purgante estratto dal frutto. Da elathrios = che spinge o caccia e da elathr scagliatore, per
la stessa allusione, ed anche per l’azione purgante.
Momordica (genere che prima comprendeva l’Ecballium) dal latino mordeo, momordi = masticare, mordere, perchè i semi di alcune specie sono un po’ tubercolati, come se fossero rosicchiati.
aspera, per le foglie rugose, ruvide,
cordifolium, per la forma delle foglie.
Nome volgare – Sputaveleno, Schizzetti, Zucchetta marina, ecc.
Habitat – Europa mediterranea, Russia meridionale, Iran, India. In Italia si trova dal mare alla regione submontana, abbondante negli incolti presso il mare.
Pianta erbacea perenne, vivace, prostrata, senza viticci.
Parti usate – Sedimento del succo contenuto nel frutto quasi maturo.
Componenti principali
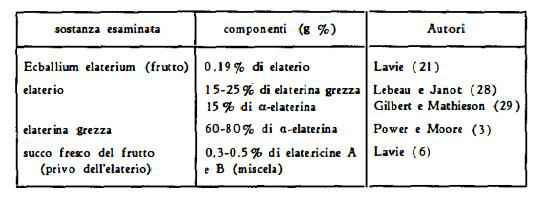
Nell’elaterio: elaterina (1), (2), a-elaterina (levogira) e b-elaterina (destrogira) (3) [= elaterina di Morries (1)], elaterinide (glicoside dell’elaterina) (4) (5), altri tre glicosidi amari (5) e Cucurbitacina E (= a-elaterina di Power e Moore) (5), (8).
Nel succo del frutto privato del sedimento (elaterio) per decantazione: elatericine A e B (6) [= Cucurbitacine D e I (7)].
L’elaterina, isolata sin dal 1831 da Morries (1), è stata indicata successivamente da Power e Moore (3) come miscela di due isomeri l’a- e la b-elaterina. L’a-elaterina è stata recentemente compresa nella serie di sostanze amare, che sono state ottenute da membri della famiglia delle Cucurbitacee ed a cui è stato dato il nome di Cucurbitacine. Secondo l’esito delle ricerche sistematiche condotte da Enslin e Rivett (8), le Cucurbitacine rappresentano una nuova serie di triterpeni, caratterizzati dall'elevato contenuto di ossigeno. Tra esse, dal punto di vista biogenetico, Enslin (9) distingue due serie di sostanze; la serie della Cucurbitacina E (= serie dell'a-elaterina) e la serie della Cucurbitacina B. La serie E comprende le Cucurbitacine E, I, J, K, L, e la serie B le Cucurbitacine A, B, C, D, F, G, H.
L'a-elaterina, isolata dall'elaterio, è stata identificata alla Cucurbitacina E ( 8). Le elatericine D e I, estratte, come si è già detto, dal succo del frutto di Ecballium Elaterium dopo la separazione del sedimento, sono state riconosciute identiche alle Cucurbitacine D e I rispettivamente (7).
L'a-elaterina o Cucurbitacina E si trova normalmente in combinazione glicosidica, come monoglucoside (elaterinide), nel frutto fresco di parecchie Cucurbitacee quali, oltre all’Ecballium Elaterium Rich., il Citrullus Colocynthis, il C. ecirrhosus, il C. vulgaris e la Cucurbita texana (10). L'elaterinide, nel caso dell'Ecballium Elaterium Rich. si scinde facilmente con formazione di a-elaterina, per opera di un attivo enzima, l'elaterasi (4) che Enslin e Rivett (10) (11) hanno identificato con una b-glucosidasi. Questo enzima manca in alcune Cucurbitacee, ad esempio nelle specie del genere Citrullus, nelle quali perciò, come nel Citrullus Colocynthis, l'elaterina si trova in forma glicosidica stabile.
Lo studio della composizione chimica dell'elaterina ha incontrato molte difficoltà ed è stata oggetto delle ricerche di molti AA. Formule centesimali sono state proposte da Zwenger (12), Thoms (13), Hemmelmayr (14), Pollack (15), Berg (16), Power e Moore (3). La formula di Berg (16), C28H38O7 confermata da Power e Moore (3), è stata di recente sostituita dalla C32H44O8, determinata da Rivett ed Herbstein (17).
Il problema della formula di struttura dell'elaterina fu affrontato in un primo tempo da Berg (16) e da Moore (18) e da queste prime ricerche si dedusse che nella molecola doveva essere presente una funzione lattonica. La struttura lattonica è stata però recentemente esclusa da Lavie (19) (20) (21), il quale ha dimostrato che l'a-elaterina contiene, invece di un gruppo lattonico, un gruppo diosfenolico fissato ad un anello esatomico.
Lavie ha messo infatti in evidenza che l'a-elaterina per idrolisi con alcali a caldo produce acido ecballico, C26H38O7 (21) (22), nel quale il gruppo diosfenolico è eliminato, mentre per idrolisi moderata a freddo con alcali produce elateridina, che contiene un gruppo diosfenolico.
E' stato pure dimostrato da Lavie e Willner (6) che anche le elatericine A e B, isolate, come si è detto, dal succo decantato del frutto, contengono il gruppo diosfenolico presente nell'elaterina.
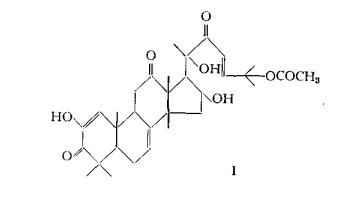
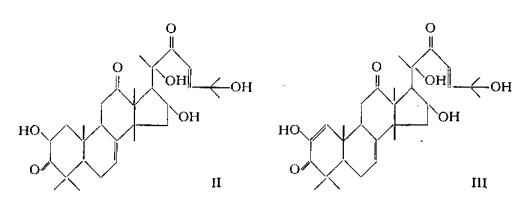
Gli studi di Enslin e coll. (23) (24) e di Lavie e coll. (25) (26) (27) (47) hanno condotto alla proposta dei seguenti schemi I, Il e III per la struttura triterpenoide rispettivamente dell'a-elaterina o Cucurbitacina E, C32H44O8, dell'elatericina A o Cucurbitacina D, C30H44O7 e dell'elatericina B o Cucurbitacina I, C30H42O7.
Nell'elaterio il contenuto di elaterina grezza varia dal 15 al 25 % (28) ed il contenuto di a-elaterina risulta pari al 15 % (29).
L'elaterina grezza, secondo Power e Moore (3) è costituita dal 60-80 % di a-elaterina.
Nel succo fresco del frutto, dopo eliminazione del sedimento per decantazione, è stato trovato lo 0,3-0,5 % di elatericine A e B (6).
Secondo ricerche di Marquart (30) e di Walz (31), i frutti di Ecballium sarebbero in autunno molto più poveri di elaterina rispetto all’estate; secondo il Koehler (32), ne sarebbero privi già in settembre. Secondo Erspamer (33), che ha esaminato nove campioni di frutti della stessa zona nell'autunno 1942 e nell'estate-autunno 1943, la resa di elaterio e di elaterina è soddisfacente anche nei mesi autunnali:
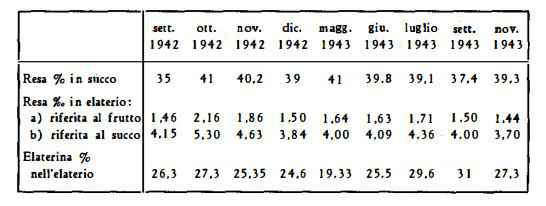
L’Erspamer (33) ha dimostrato che il rendimento di elaterio e di elaterina del succo raccolto dai frutti maturi è pure elevato. Rimane tuttavia valida la raccomandazione riguardante l’uso dei frutti immaturi per la preparazione dell'elaterio, poiché la raccolta dei frutti maturi, che scoppiano al più piccolo urto, è inattuabile ai fini pratici.
Nella preparazione dell'elaterio nero o maltese, che si differenzia dall’elaterio comune o elaterio bianco, poiché é ottenuto non per decantazione, ma per concentrazione del succo e per successiva essiccazione, l’Erspamer
(33) ha ricavato 9,46 %o (rispetto al frutto) di elaterio nero e 0,47%o (rispetto al frutto) di elaterina. Nella contemporanea preparazione dell’elaterio bianco dallo stesso succo, la resa di elaterina é stata di 0,59%o (rispetto al frutto).
Altri componenti trovati nell’elaterio: fitosterina, zucchero, amido, sostanze resinose, lipidi (piccole quantità), acqua 5,3% (3); ceneri 7,6% e 8 % in due diversi campioni di elaterio (30). Dal succo del frutto é stata ottenuta una sostanza cristallizzabile con formula C9H14O3 (34).
Proprietà farmacologiche ed impiego terapeutico
L'Ecballium può essere annoverato, secondo il Leclerc (35), fra le droghe di più antico uso; «Son emploi remonte à l’aurore de la Médecine» egli dice, e da un suo articolo ricco di notizie storiche (36) risulta che l’elaterio era correntemente prescritto da Ippocrate il quale, fra l’altro, raccomandava molta prudenza nella sua somministrazione dimostrando così di conoscere esattamente non solo la sua attività terapeutica ma anche gli inconvenienti che possono derivare da un uso incauto di questa droga.
Dioscoride dà un’esatta descrizione del metodo di preparazione dell’Elaterio dal frutto dell’Ecballium, metodo che fondamentalmente corrisponde a quello impiegato anche attualmente.
Più tardi venne impiegato anche dai medici arabi e in particolare da Avicenna che considerò l’elaterio fra i rimedi più utili e più efficaci.
La droga era allora raccomandata, non solo come energico purgante e come idragogo nell’idrope, ma anche nel trattamento di numerose altre affezioni quali l’angina, gli stati emorroidari, l’ambliopia ed altre affezioni oculari.
Dopo un lungo periodo durante il quale fu quasi completamente abbandonato, l’uso dell’elaterio venne ancora ripreso nel 1700 e nel 1800 per merito soprattutto di alcuni medici inglesi, fra i quali il Sydenham e il Lister ed é in questo periodo che di questa droga si trovano esaurienti trattazioni in tutti i testi di Materia medica e che si trova inscritta nelle farmacopee di quasi tutti i paesi d’Europa e d’America: la Farmacopea degli Stati Uniti ha registrato l’elaterio sino al 1813 e l’elaterina sino al 1916, mentre dell’elaterio e dell’elaterina si trova menzione nella Farmacopea inglese sino al 1914.
Attualmente si può dire che l’uso dell’elaterio e dell’elaterina é di nuovo quasi completamente abbandonato.
Queste sostanze trovano ancora qualche rara applicazione terapeutica nei paesi anglosassoni dove vengono impiegate isolatamente o, più spesso, associate ad altre droghe purgative ad azione più debole, per potenziarne l’azione.
L'Erspamer (37) esaminando le ragioni per cui questa droga, tanto apprezzata sino al secolo scorso, è oggi quasi completamente dimenticata, osserva giustamente che tali ragioni debbono ricercarsi nel fatto che:
«L'elaterio del commercio era frequentemente sofisticato, perchè in dipendenza dei diversi modi di preparazione aveva un contenuto variabile di elaterina, e quindi aveva anche effetti terapeutici variabili ed incostanti, e soprattutto perchè col progredire delle acquisizioni terapeutiche erano un po' alla volta venute meno le fondamentali indicazioni della nostra droga, come in genere quella di altri drastici.
La derivazione intestinale infatti, diretta allo scopo di ottenere perdite di liquidi da parte dell'organismo, è sostituita quasi sempre dalla più simpatica e non debilitante derivazione renale; al salasso bianco, di effetto non controllabile e mal graduabile, si preferiscono decisamente le varie forme di salasso rosso.
E l'elaterio per tutte queste ragioni ha finito per essere relegato fra le droghe obsolete.
Ma è proprio giustificato — si chiede l'Erspamer — questo quasi
totale abbandono per un farmaco che pure aveva meritato lodi da parte di clinici e farmacologi anche insigni? Forse non del tutto. Una buona droga, a contenuto fisso e controllato in elaterina, potrebbe sempre tro-vare utile impiego anche ai nostri giorni:
1) in tutti i casi, non molto numerosi a dir vero, in cui si desideri ottenere un potente e sicuro effetto drastico e idragogo;
2) nei casi assai più numerosi, in cui si ritenga opportuno rinforzare l'azione di purganti più blandi, spesso d'effetto incostante.
L elaterio può sostituire in ogni caso la Coloquintide, ancora inclusa in numerose farmacopee e, probabilmente, può sostituire anche la podofillina sia nel suo impiego come drastico, sia nel suo impiego, forse discutibile, come colagogo».
Le ricerche farmacologiche eseguite sull'elaterio e sull'elaterina sono scarse e tutt’altro che recenti, insufficienti comunque a dare un'esatta idea del loro meccanismo d'azione.
Koehler (38), come altri AA., ritiene che l'azione dell'elaterio e della elaterina, non si manifesti in assenza di bile. Questo A. riferì di non aver ottenuto alcun effetto purgativo dopo legatura del coledoco e che l'elaterio introdotto in un'ansa intestinale limitata da due legature, non ha manifestato alcuna azione locale o generale.
Il Brunton (39), al contrario, nelle stesse condizioni sperimentali, avrebbe osservato un aumento del contenuto liquido nell'ansa intestinale isolata.
Secondo Johannson (40), l'elaterina somministrata per os non verrebbe assorbita dall'intestino, dove la sua permanenza non si protrarrebbe per più di 9 ore.
Altri AA. ritengono invece che essa possa venire assorbita e manifestare un'azione depressiva sul sistema nervoso centrale, azione cui dovrebbe essere attribuito lo stato di depressione e di astenia che consegue alla sua somministrazione [Koehler (38), Schroff (41)].
L'Erspamer non esclude che la presenza della bile, dei succhi pancreatici ed enterici, possa rinforzare l'azione locale aumentando la solubilità della elaterina, fatto questo che potrebbe anche facilitarne l'assorbimento e spiegare quindi l'azione generale manifestantesi con quegli effetti depressivi osservati dagli AA. precedentemente citati.
Estese esperienze farmacologiche sull'elaterio e sui suoi derivati, su estratti ottenuti dal frutto dell’Ecballium, o dall'erba (foglie e fusti) e dalle radici, sono state eseguite dall’Erspamer (37) su ratti, nei quali è stata determinata l'attività e la dose purgativa media e letale per ognuna delle preparazioni sperimentate.
Per l'elaterio con un contenuto di elaterina aggirantesi dal 25,5 al
27,3 % la dose purgativa media è risultata essere pari a mg 0,3-0,4 per 100 g di p.c. e la dose letale media pari a 5 mg per 100 g di p.c. con un rapporto fra dose media purgativa e dose media letale di 1:15 – 1:20.
Per l’elaterina grezza preparata secondo la B.P. 1898, la dose purgativa media è risultata essere pari a 0,1-0,2 mg per 100 g di p.c.
Con l'elaterina purificata, mediante ripetute cristallizzazioni dall'alcool, è possibile ottenere lo stesso effetto solo con dosi 4 volte superiori.
Secondo Power e Moore (42) l'attività dell'elaterina grezza dipenderebbe dal suo contenuto in b-elaterina destrogira, mentre l'a-elaterina levogira contenutavi in quantità molto più elevata sarebbe invece del tutto inattiva o quasi. Nell'elaterina purificata la b-elaterina verrebbe allontanata più o meno completamente durante le ripetute cristallizzazioni dall'alcool, per cui il prodotto grezzo risulterebbe, ovviamente più attivo.
Il succo di pressa dei frutti freschi di Ecballium è attivo alla dose media di 0,075 cc prima della sedimentazione e alla dose di 0,5 cc per 100 g di p. c. dopo completa sedimentazione.
La polvere dei frutti essiccati e privati dei semi è attiva alla dose di mg 5 per 100 g di p.c.
Il succo di pressa dell'erba, gli infusi e la polvere essiccata non sono attivi e così pure il succo di pressa della radice, il suo sedimento e la polvere della radice essiccata.
Secondo Erspamer il miglior prodotto purgativo ottenibile dall' Ecballium, è rappresentato dall'elaterio bianco titolato in elaterina, titolo che per la droga indigena, potrebbe essere fissato al 20 %. Tale prodotto dovrebbe essere preferito tanto all'elaterio grezzo, quanto all'elaterina purificata, in considerazione della sua maggior costanza ed uniformità di azione.
Nè l'elaterio, nè l'elaterina esplicano la loro azione purgativa se somministrati per via parenterale.
Dopo liniezione di mg 1 di elaterina sospesa in soluzione fisiologica, sotto la cute del dorso nei ratti, compare dopo 2-3 giorni, un infiltrato che si risolve molto lentamente.
All'iniezione di 5-20 mg di sostanza, consegue dopo 24 ore un modico infiltrato, molto dolente alla pressione, che in seguito indurisce e si estende sino ad interessare tutta la parte posteriore del dorso e gran parte dell'arto posteriore corrispondente al lato in cui è stata praticata l'iniezione. Dopo 6-8 giorni l'infiltrato tende a cadere in necrosi parziale e ad ulcerarsi. In tutti i casi si è osservato notevole dimagrimento mentre la guarigione procede molto lentamente. Due animali su 6, muoiono fra la 13a e la 17a giornata (Erspamer).
L'elaterio come tale, senza subire cioè alcuna trasformazione, esplica una violenta azione irritante sulle mucose, sulle soluzioni di continuità e sui tessuti coi quali venga posto in contatto ed è certamente a questa azione cui è dovuta l'irritazione della mucosa intestinale con conseguente accumulo di liquido, aumento della peristalsi e scariche diarroiche con emissione di feci insieme con forti quantità di liquido.
Quale sia il meccanismo cui quest'azione irritante è dovuta, non è facile dirlo.
L'Erspamer formula l'ipotesi che la congestione vasale, l'aumento della permeabilità capillare, l'ipersecrezione ghiandolare, possono almeno in parte, essere condizionate dalla presenza di istamina, o di sostanze istaminosimili, messe in libertà dalle cellule lese dal farmaco.
Jitariu e Alexa (34) hanno trovato che il succo naturale di Ecballium agisce sul cuore perfuso di rana con un effetto simile a quello che si ottiene con la stimolazione vagale; non si potrebbe quindi escludere che l'aumento della peristalsi intestinale, sotto l'azione dell'elaterio, sia dovuta anche ad una eccitazione degli accettori colinergici della parete intestinale.
La sostanza C9H14O3 isolata dagli AA. stessi dal succo di Elaterio (vedi parte chimica), perfusa nel cuore di rana, dimostra di possedere un'azione inotropa negativa, laddove il succo naturale e il residuo uniti, provocano un effetto tonotropo e cronotropo con dissociazione atrio-ventricolare.
Sul muscolo dorsale di sanguisuga la suddetta sostanza C9H14O3 è inattiva mentre il succo naturale ne eccita la contrazione.
Tossicologia
L'elaterio è noto come uno dei più potenti drastici, attivo già alla dose di pochi milligrammi.
Le dosi dell'elaterio e dell'elaterina prescritte dalla B.P. 1898 sono, rispettivamente di mg 6-30 e di mg 2-6; l'U.S.P. 1907, prescrive per l'elaterina la dose di 5 mg. Anche queste dosi però, possono riuscire tossiche e, a volte, anche mortali.
La dose di 3-5 mg di elaterina può produrre nell'uomo, vomito e 1 intensa diarrea [Morrus (43), Wolodsko (44)); il Craig (45) descrive il caso mortale di una donna di 70 anni, cui vennero somministrati 10 mg di elaterio. Per contro, esperienze eseguite da Schroff (41) dimostrarono che l'enorme dose di 50 mg di elaterina può non essere letale pur determinando fenomeni tossici manifestantisi con salivazione, nausea, vomito, dolori addominali, cefalgia, flatulenze, prostrazione e copiose scariche diarroiche che possono ripetersi anche durante i due giorni successivi alla somministrazione.
Nel coniglio il Morrus (43) osservò che la dose di 6 mg di elaterina per os, venne tollerata, ma l'animale morì 13 ore dopo la seconda somministrazione di una stessa dose.
L'elaterina iniettata endovena alla dose di 30-120 mg nel gatto e nel coniglio, determinò sempre salivazione, dispnea, convulsioni tetaniche e la morte più o meno rapida degli animali nei quali, all'autopsia si riscontrò iperemia ed edema polmonare [Wolodsko (44), Koehler (38), Lew'm ( 46) ).
Estratti e preparati vari
Sedimento del succo di frutto B.P.C. (Elaterio) (Titolo chimico).
Dosi: g 0,005-0,02 pro dose.
Preparazioni usuali e formule galeniche
Compresse
Elaterio …….. g 0,005
Estratto idroalcoolico belladonna g 0,002
Eccipiente q. b. per 1 compressa
(1-4 compresse pro dose)
Granuli
Elaterio g 0,005
Lattosio e sciroppo di glucosio q. b. per un granulo
(1 granulo ogni due-tre ore. sino a 4-5 granuli)
BIBLIOGRAFIA
(1) MORRIES, J. Royal ln.rtitute, 1, 152, 1831 – (2) HENNEL, Edlnb. Med. Surg. J., 35, 339, 1831 – (3) POWER F. B. e MOORE C. W., J. Chem. Soc., 95, 1985, 1909; 97, 1797, 1910 • (4) BERG M. A., Bull. Soc. Ch/m., 17, 85, 1897 – (5) ENSLIN P. R., J. Sci. food agrlc., 5, 410, 1954 – (6) LAVIE D. e WILLNER D., I. Amer. Chem. Soc.. 80, 710, 1958 – (7) ENSLIN, Comunicazione privala a LAVIE D. (da LAVIE D. e WILLNER D., J. Amer. Chem. Soc., 80, 710, 1958) – (8) ENSLIN P. R. e RIVETT D. E. A., I. Chem. Soc., 3682, 1956; S. A/rie. Znd. Chembt, 11, 15, 1957 – (9) ENSLIN P. R., Symp. Linnean Soc. London, 18 luglio 1957; HEGNAUER E., Pharm. Acta Helv., 32, 334, 1957 – (10) ENSLIN P. R. e coli., J. Sci. jood.r agrrc., 7, 646, 1956 – (11) J:<:NSLIN P. R. e RIVEIT D. E. A., Z. Phy.rlol. Chem., 303, 97, 1956 – (12) ZWENGER, L/eb. Ann., 43, 359, 1842 – (13) THOMS, Apoth. Zelf., 21, 803, 1906 – (14) HEMMELMAYR, Monauh., 27, 1167, 1906 – (15) POLLACK, Ber., 39; 3380, 1906 – (16) BERG, Bu/I. Soc. Chim., 35, 435, 1905 – (17) RIVEIT D. E. A. e HERBST^IN F. H., Chem. Znd., 393, 1957; Chem. Ab.r., 51, II001 a, 1957 – (18) MOORE C. W., J. Chem. Soc., 97, 1797, 1910 – (19) LAVIE D., Bu//. Res. Counc//. Z.rrae/, 5 A, 106, 1955 – (20) LAVIE D., Chem. Znd., 466, 1956 – (21) LAVIE D. e SZINAI S., J. Amer. Cem. Soc., 80, 707, 1958 • (22) BORSCHE W. e DIACONT K., Lleb. Ann., 528, 39, 1937 • (23) RIVETI D. E. A. e ENSLIN P. R., Proc. Chem. Soc., 301, 1958; Chem. Ab.r., 53, 13198 c, 1959 – (24) ENSLIN P. R. e NORTON K. B., Chem. Znd., 162, 1959; Chetn. Ab.r., 54, 1595 a, I960 • (25) LAVIE D., SHVO Y. e WILLNER D., J. Am. Chem. Soc. .81, 3062. 1959; Chem. Ab.r., 53, 22065 i, 1959 – (26) LAVIE D. e SHVO Y., Chem.' Znd., 429, 1959; Chem. Ab.s., 53, 22066 b, 1959 – (27) LAVIE D., WILLNER !)., HUGO J. M. e NORTON K. B., Chem. Znd., 951, 1959; Chem. Ab.r., 54, 2288, I960 – (28) LEBEAU’p. e JANOT M., Pharmacie Chimique, Paris, 1955-1956, voi. V, p. 3756 – (29) GILBERT J. N. T. e MA- THIESON D. W., J. Pharm. Pharmacol., IO, 253 T, 1957 • (30) MARQUART, dt. da ERSPAMER V., !oc. cit (33) – (31) WALZ, cit. da ERSPAMER V., !oc. cit. (33) – (32) KOEHLER H., Neue.r Repert. Pharm., 18, 596, 1869; Vlrchow.r Arch., 49, 406, 1869 – (33) ERSPAMER V., Rlv. It. E.r.r. Prof., 28, n. 8, 11, 1946 – (34) JITARIU P. e ALEXA E., Acad. Rep. popu/are Romdne, Fllla/a lassi, Stud/l cercetari .rt/lnt., 4, 389, 1953; Chem. Ab.r., 50, 15022 h, 1956 – (35) LECLERC H., Precis de Phytothérapie, Masson, Paris 1935, p. 7 – (36) LECLERC H., La Momordique; J. des Pratkiens 1914 – (37) ERSPA:t-fER V., (•) Rlv. 1t. Ess. e Prof., 28, 8, 1946 – (** ) F/toterap/a, 18, 4, 8-9, 1947 – (•••) Ibidem, 19, 1, 4-5, 1948 • (38) KOEHLER H., Neue.r Repert. Pharm., 18, 596, 1869; W/rchow Arch., 49, 406, 1885 cit. da ERSPAMER I. c. (37 •) – (39) LAUDER BRUNTON, The Pracllllontr, 12, 342, 1874; cit. da ERSPAMER, lb/d. – (40) JOHANNSON e., Inaug. Dissert. Dorpat 1884 e Z. Analyt. Chem., 24, 154, 1885; cit. da ERSPAMER, lbld. – (41) SCHROFF C. D. von e C. von SCHROFF, Grundriss der Pharmacologie, W. Braunmuller, Wien 1873; cit. da ERSPAMER ibld. – (42) POWER F. B. e MOORE Ch. W., J. Chem. Soc.'London 95, 946, 1909 e 95, 1985, 1909; Pharm. J., 29, 501, 1909; cit. da ERSPAMER, lbld. – (43) MORRUS M., J. Pharm., I, 27, 1822;Edimburgh’j a. Surg. J., aprile 1931, cit. da ERSPAMER, lbld. – (44) WOLODSKO H. Diss. Jnaug. Dorpat, Livonum 1857; cit. da ERSPAMER, ibid. – (45) CRAIG, cil. da ERSPAMER I. c. – (46) LEWIN L., Trailé de Toxicologie; O. Doin, Paris 1903; cit. da ERSPAMER, /bld. • (47) LAVIE D. e SHVO Y., Chem. Tnd., 403, 1960; Chem. Abs., 54, 18581, 1960.


