Oppio
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
——
Oppio- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – dal greco opos = succo, da cui opion e opium.
Si distingue in oppio grezzo – oppio preparato e oppio officinale.
Oppio grezzo e oppio bruto, è il succo spontaneamente coagulato ottenuto per leggera incisione delle cassule non ancora mature (quando cominciano ad ingiallire) dal Papaver somniferum L., nelle sue varietà:
Papaver somniferum var. setigerum DC.
Papaver somniferum var. glabrum Boiss.
sin. P.s. var. nigrum DC. (semi neri)
Papaver somniferum var. album Mill. (semi bianchi)
Il succo ha subito la sola manipolazione della confezione in pani, qualunque sia il suo contenuto in morfina.
I pani, del peso di 200-300 g e più, sono orbicolari, rettangolari, rotondi, conici o sformati, involti con foglie della pianta stessa e cosparsi di frutticini di Rumex (tranne l’oppio d'Egitto o d'Alessandria) o ricoperti con fogli di carta colorata.
Questi pani hanno esternamente colore grigio/brunastro, sono, nell’interno, un po' umidi, grossolanamente granulosi, color bruno o bruno-rossastro, contengono frammenti di cassule e frutti di Rumex. L’odore è viroso, forte, il sapore amaro, acre, sgradevole.
Le incisioni sono effettuate a mezzo di speciali raschietti muniti di piccole lamette plurime disposte come i denti d'un pettine e di un dispositivo che impedisce di passar oltre lo spessore della parete della cassula, cioè che le lamette entrino nell’interno ed il succo gema nella cassula.
In Turchia viene anche usato un coltellino con una sola lama corta, col quale viene praticata un’incisione circolare od a spirale. Le lame vengono umettate di volta in volta, per evitare che il succo vi aderisca.
II succo viene anche ottenuto per frantumazione, contusione e spremitura delle cassule.
Ciascuna cassula può dare sino a g 0,060 di succo.
Parecchie sono le varietà di oppio. Le principali sono:
Oppio dell’Asia Minore, di Smirne o del levante, di Geiwa o Guepé.
Oppio di Turchia e di Costantinopoli.
Oppio di Alessandria d’Egitto o Tebaico.
Oppio della Persia o dell'Iran.
Oppio dell’India.
Oppio della Cina.
Oppio di Macedonia.
Altre varietà sono: Oppio di Romania, d’Algeria, del Giappone, d'Australia o del Queensland, d'America o del Minnesota e del Vermont.
Oppio indigeno, ottenuto da piante coltivate in Europa (Inghilterra, Francia, Germania, Ungheria, Boemia e in qualche campo sperimentale).
L’Oppio dell'Asia Minore (detto anche d'Anatolia) è considerato il migliore. E’ in masse irregolari di vario volume che appaiono costituite da tante lacrime, ravvolte in brani di foglie, cosparse di frutticini di Rumex, parecchi dei quali penetrati nell’impasto. Se è secco, ha una certa durezza e molta tenacità. Il colore, internamente, è rosso-scuro. L'odore è acuto, viroso, nauseoso. Il sapore amaro, persistente, acre.
E’ ricavato dalla var. glabrum Boiss.
Il principale centro di raccolta è Afium Karahissar (che significa Montagna nera dell'oppio) (Turchia asiatica centrale) e i centri di produzione le località di Ghiveh, Amasia, Balukissar.
L'Oppio del Monopolio governativo turco (detto di Costantinopoli). Proviene dall’Asia Minore e dalla Turchia europea, ricavato dalla var. glabrum Boiss. (Turchia asiatica) e dalla var. setigerum DC. (Turchia europea).
E’ in grossi pani irregolari, appiattiti, simili a forme di formaggio, oppure in pani piccoli, regolari, schiacciati. Gli uni e gli altri hanno la superficie ricoperta con foglie di papavero, sotto le quali sono dei frutticini di Rumex. Sono avvolti in carta nera con la scritta IMU e accanto una stella con la semiluna.
Questo oppio è più duro, più fragile, di colore più intenso (rosso-mattone) della droga di Smirne, della quale ha simile il sapore e l’odore: questo è però meno sensibile, specialmente nei pani piccoli. E’ più mucillagginoso del Smirne e si crede che, nella preparazione al succo, sia aggiunto il liquido ottenuto dalla spremitura delle piante.
L'Oppio d’Egitto o Tebaico (detto di Alessandria). E’ la varietà più anticamente conosciuta: l’Egitto era, in passato, il maggior produttore. Oggi non è frequente in commercio. E’ in piccoli pani orbicolari, schiacciati (senza foglie, nè frutticini di Rumex). E’ duro, omogeneo nella massa: odore debole che sa leggermente di muffa. E’ una varietà scadente, sovente sofisticata.
L'Oppio della Persia o dell'Iran. E' di varia forma e qualità, o in piccoli pani ovoidi, molli, non vischiosi, avvolti in foglie di platano o con altre foglie, in masserelle coniche o in mattonelle involte in carta lucida, rossa, o in bastoncini cilindrici, grossi come un dito (lunghi circa 13 cm) pure incartati e legati a metà con un nastrino. Questi bastoncini sono di color nero brillante. Il colore della massa omogenea, densa, è bruno, un po’ lucido. L’odore è pronunciato. E’ droga manipolata, oleosa, perchè la raccolta viene effettuata raschiando le cassule con arnesi unti con olio di lino, e fermentata, per azione di una muffa che le fa acquistare un particolare aroma. E' considerata qualità corrente, destinata al consumo locale a scopo voluttuario. In Persia viene anche usata per preparare un liquore il coronar. Rara nel commercio europeo. Utilizzata nelle industrie per l’estrazione degli alcaloidi.
L’Oppio delle Indie (or.) proviene dalle regioni di Behar, Benares, Bolkar, Lahore, Ghazipur e, commercialmente, da Calcutta. E’ in pani squadrati, grossi (1 kg) avviluppati in carta cerata bianca. E’ molto oleoso, molle e difficilmente si essicca e si polverizza. Viene quasi tutto esportato in diverse contrade asiatiche, specialmente in Cina.
Le qualità sono; del Bengala, in pani rotondi ricoperti di petali di papavero agglutinati con un liquido speciale, più o meno vischiosi, cosparsi anche di tritume di petali e di cassule. – di Malwa o del Punjab, in masse arrotondate, ricoperte di tritume di petali e cassule. – di Patna (Bengala) in pani grossi (1 kg) non viscosi, involti in carta giallognola e legati con filo.
L'Oppio della Cina. Prodotto su larga scala in Cina e non esportato. Povero di p.a. Centro commerciale Shanghai.
L'Oppio di Macedonia (detto anche di Bulgaria, jugoslavo o serbo) proviene dalla Tracia, Macedonia, Bulgaria, Grecia. E’ in pani di peso e forma variabile: in passato talora piatti, talora conici o ovali (del volume di un uovo o di un ananasso), ora in forme appiattite. Il tasso di alcaloidi è alto.
Oppio preparato. S’intende il prodotto grezzo ottenuto in seguito a speciali procedimenti (dissoluzione, ebollizione, concentrazione a secco, fermentazione) aventi lo scopo di trasformare il grezzo in estratto atto al consumo. Nell’oppio preparato sono comprese anche le scorie ed i vari residui.
Oppio officinale. S’intende l’oppio che ha subito le preparazioni necessarie per l’uso terapeutico, sia in polvere che granulare, sia in mescolanza con altre sostanze, secondo le Farmacopee.
Sofisticazioni – Sono frequenti e numerose, effettuate nei luoghi d’origine, con ogni sorta di mezzi, ed anche nei luoghi di smercio. Può contenere amido, sabbia, argilla, polvere di foglie, polpa di barbabietole e carote, lattice di lattuga, glucosio, gomma arabica, caucciù, tannino. Inoltre può contenere una percentuale di polvere ottenuta dalla minutissima frantumazione delle cassule.
E’ droga che va sempre controllata con l’esame al microscopio, il dosaggio della morfina, delle ceneri, ecc.
Componenti principali
Lo studio della composizione chimica dell’Oppio risale al XVII secolo, durante il quale si cercò di ottenere l’isolamento delle sostanze attive. Derosne (1) nel 1803 notò la separazione di un composto cristallino, diluendo con acqua un estratto acquoso di Oppio concentrato a consistenza sciropposa. Séguin (2) nel 1804 inviò all’Institute de France una comunicazione, che doveva essere pubblicata solo più tardi, nel 1814, ed in cui era descritto un processo di isolamento della morfina. Nel 1804 Serturner (3-5) separò dall’Oppio la morfina e l’acido meconico. Successivamente lo stesso A. (6-9) riconobbe la capacità della morfina di neutralizzare gli acidi e mise in evidenza che questa sostanza apparteneva ad una nuova serie di composti, gli «alcali vegetali».
Dopo alcuni decenni furono isolati gli altri alcaloidi dell’Oppio, tra cui la codeina nel 1832 dallo stesso Robiquet (10), la narceina nel 1832 da Pelletier (11), la tebaina nel 1835 da Pelletier e Thibouméry (12) e la papaverina nel 1848 da Merck (13).
Nella seguente tabella sono indicati i nomi e le formule grezze degli alcaloidi dell’Oppio, divisi nei cinque gruppi, in cui si possono classificare in base alla struttura chimica basilare:

1) Derivati dell'isochinolina
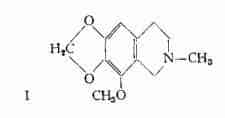
Idrocotarnina, C12H15O3N, (I) – Questo prodotto d’idrolisi della narcotina è stato trovato da Hesse (14) nell’Oppio sia come base libera, che in forma di sale.
2) Derivati della benzilisochinolina
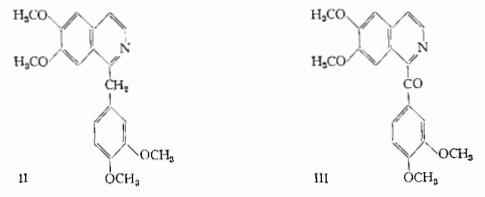
Papaverina, C20H21O4N – E' stata isolata da Merck (13) nel 1848 dalle acque madri provenienti dall’estrazione della morfina. Si trova nell’Oppio, nelle proporzioni dello 0,5-1 %, ed in tutte le parti del Papaver somniferum var. album, specialmente nelle capsule immature (15). E' stato il primo alcaloide dell’Oppio, cui sia stata assegnata un’esatta struttura. I più importanti lavori che hanno condotto alla designazione della formula strutturale II nel 1888, sono stati eseguiti da Goldschmiedt e coll. (16). La papaverina è la 1-(3,4-dimetossibenzil)-6,7-dimetossi-isochinolina.
Xantalina (papaveraldina), C20H19O5N – Isolata dalle acque madri dell’Oppio da Smith T. e H. Co. (17), è stata identificata alla papaveraldina, (formula III) (18) (19).
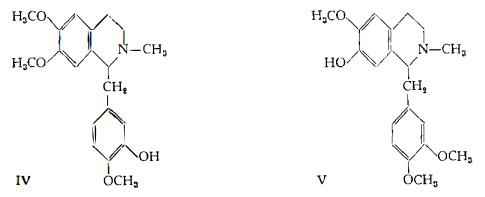
Laudanina, C20H25O4N – E' stata separata da Hesse (20) dalle acque madri dell’estrazione della morfina, in quantità pari allo 0,005 % dell’Oppio esaminato. Ha la formula di struttura IV (21), confermata per sintesi da Spath e Lang (22). Il prodotto naturale è racemico.
Laudanidina, (l-laudanina, tritopina), C20H25O4N – E’ stata ottenuta dalle acque madri d’estrazione della laudanina da Hesse (23). La formula centesimale è stata stabilita da Spath e Seka (24), che hanno determinato l’identità dell’alcaloide con la tritopina di Kander (25). E’ la forma levogira della laudanina (IV).
Codamina, C20H25O4N – Isolata da Hesse (26) dalle acque madri dell’estrazione della morfina, secondo lo stesso A. si trova nell’Oppio di Turchia nella quantità dello 0,0033 %. La formula di struttura (V) della codamina è stata assegnata da Spàth ed Epstein (27) (28).
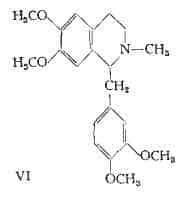
Laudanosina, C21H27O4N – E’ stata separata da Hesse (14) (29) dall’Oppio; vi è stata trovata in proporzioni inferiori allo 0,1% (30). La composizione della laudanosina è stata determinata da Pictet e Athanasescu (31). La formula di struttura si rappresenta secondo lo schema VI.
3) Derivati della ftalideisochinolina
Narcotolina, C21H21O7N – Isolata dalle capsule del Papaver somniferum L. da Wrede (32), è stata trovata in quantità pari allo 0,05% in qualche varietà di Oppio (33) (34). E’ il derivato della ftalideisochinolina con formula VII (34a).
Narcotina, (l-a-narcotina), C22H23O7N – E' stata probabilmente estratta per la prima volta nel 1804 da Derosne (35), ma l’isolamento di essa è stato attribuito a Robiquet (36), che le ha assegnato la formula C23H25O7N, successivamente corretta nella formula attuale C22H23O7N da Matthiessen e Foster (37). La narcotina ha la struttura VIlI, confermata per sintesi (38).
a-Gnoscopina, (dl-a-narcotina), C22H23O7N – E’ la forma racemica della narcotina trovata nell’Oppio da Smith e Smith (39). E’ dubbio però se sia un componente originale dell’Oppio o si formi durante le operazioni di estrazione degli alcaloidi.
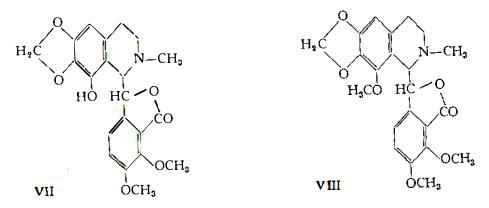
Narceina, C23H27O8N – E’ stata estratta dall’Oppio da Pelletier (11) nel 1832. Le formule centesimale e strutturale (IX) sono state stabilite in seguito agli studi di Freund e Frankforter (40) e di Freund e di Oppenheim (41).
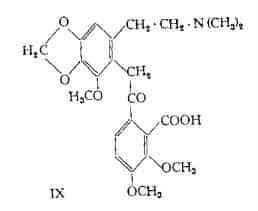
Nornarceina, C22H25O8N, (X) – E’ stata separata dalla narceina grezza da Mayer (42) e da Beckett e Wright (43) con il nome di ossinarcotina. L’identità della nornarceina con la ossinarcotina è stata stabilita da Rabe e McMillian (44).
La readina, alcaloide del Papavero rosso, è dubbio che si trovi nell’Oppio (44a).
4) Gruppo della criptopina
Protopina, C20H19O5N – Trovata in piccole quantità nell’Oppio (45), è stata isolata da numerose altre Papaveracee, compresa la Corydalis.
Criptopina (criptocavina), C21H23O5N – Estratta per la prima volta dalla frazione della tebaina degli alcaloidi dell’Oppio da Smiles (46) nel 1867, è stata successivamente isolata da diverse specie di Corydalis e di Dicentra.
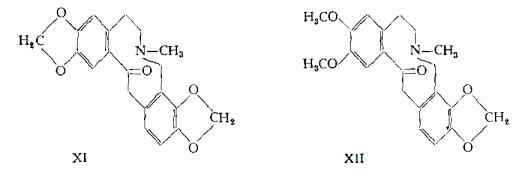
In seguito ai lavori di Perkin (47) (48), alla protopina ed alla criptopina sono state assegnate le formule di struttura XI e XII rispettivamente.
5) Gruppo della morfina
Morfina, C17H19O3N – Isolata dall’Oppio, in seguito ai primi lavori di separazione degli alcaloidi per opera di Derosne nel 1803 (1) e di Séguin nel 1804 (2), la morfina fu infine esattamente caratterizzata quale base vegetale da Sertùrner (3-9) nel 1804.
I lavori eseguiti sulla struttura chimica della morfina e degli altri alcaloidi del gruppo di questa (codeina, tebaina, neopina) sono troppo numerosi perchè si possa qui fare ad essi anche breve riferimento. Rimandando alla consultazione di altri testi, che hanno approfondito questo argomento (49-52a), citiamo gli studi di Knorr e coll. (53), di Pschorr (54), Wieland (55), Von Braun (56), Gulland e Robinson (57), Schópf (58), di Small e coll. (59) ecc., in base ai quali è risultata la stretta vicinanza esistente tra la struttura dei tre alcaloidi morfina, codeina e tebaina. Dopo la proposta delle formule strutturali di Pschorr (54) nel 1902, è rimasta a lungo indefinita unicamente la posizione in cui è collocata la catena contenente l’atomo di azoto (etanamina—CH2—CH2—N—CH3). Altre formule sono state proposte nel 1907 da Knorr (53), nel 1911-1923 da Wieland (55), fino alla formula Xllla), attualmente accettata, di Gulland e Robinson (1923) (57), discussa da Schòpf (58) e confermata dalla sintesi totale della morfina operata da Gates e Tschudi (60) (61) e con diverso procedimento da Elad e Ginsburg
(62)(63).
Codeina, C18H21O3N – Estratta da Robiquet (10) nel 1832, si trova nell’Oppio in proporzioni oscillanti tra lo 0,1 ed il 3 % (64). E’ l’etere metilico della morfina XIII b).
Tebaina, C19H21O3N – Si trova nell’Oppio in quantità pari allo 0,1-1 % (65). E’ stata isolata per la prima volta da Pelletier e Thibouméry (12), che la considerò come un isomero della morfina e la denominò «paramorfina».
E’ l’etere metilico del codeinone nella forma enolica (XIV) (66).
Neopina, C18H21O3N – Ottenuta da Smith (67) dalle acque madri derivanti dall’estrazione degli alcaloidi dell’Oppio, è stata oggetto di studio, per quanto riguarda la composizione chimica, ad opera di Dobbie e Lauder (68) e poi di Duin, Robinson e Smith (69), i quali hanno identificato questa base con un isomero della codeina (isomero D8,14) (XV).
y-Morfina (ossidimorfina, deidromorfina, ossimorfina), C34H36O6N2•3H2O. Questo alcaloide è stato isolato dall’Oppio da Pelletier (70) e quindi da Hesse (71). La pseudo-morfina è una dimorfina, in cui i primi ricercatori (72) hanno localizzato l’unione delle due molecole di morfina nella posizione C2—C’2—, mentre Small e Turnbull (73) hanno poi assegnato allo stesso legame la posizione C1—C’1 (XVI).

0
6) Alcaloidi di composizione non definita
Porfiroxina – Questo nome fu dato nel 1837 da Merck (74a) ad una sostanza, isolata dall’Oppio, sostanza che in seguito fu indicata da Hesse (74b) come miscela di alcaloidi, includenti readina e meconidina. Rakshit (74c-75a) nel 1919 estrasse la porfiroxina dall’Oppio indiano e le assegnò la formula grezza C19H23O4N ed una formula strutturale vicina a quella della codeina.
Successivamente Machiguchi (75b) ricavò dall’Oppio giapponese un prodotto con caratteristiche corrispondenti a quelle della porfiroxina di Rakshit; esso però, secondo l’A., risultò essere una miscela di codamina, laudanina e di meconidina. Rajagopalan (75 c) non ha trovato porfiroxina nell’Oppio indiano. Bamford (75 d) ha poi segnalato che il saggio della porfiroxina non è specifico per l’Oppio indiano, mentre l’Oppio turco risponde a questo test.
Più recentemente Klayman (75e) ha denominato porfiroxina una base estratta in forma cristallina dall’Oppio, con formula grezza C21H23O6N. Secondo questo A., la porfiroxina contiene due gruppi metossilici, un gruppo ossidrilico, è priva di gruppi N—CH3 ed è probabilmente da classificarsi tra gli alcaloidi del gruppo della benzilisochinolina. Pfeifer e Teige (75 f) hanno successivamente indicato per la porfiroxina la formula grezza C20H21O6N.
Meconidina, (C21H23O4N) è stata trovata nell’Oppio da Hesse (76).
Papaveramina, (C21H25O6N) – E’ stata separata da Hesse (77) come prodotto secondario nel corso della purificazione della papaverina.
Lantopina, (C23H25O4N) – Ottenuta da Hesse (76) nel corso dell’isolamento degli alcaloidi minori dell’Oppio, è stata isolata anche da Machiguchi (78) dall’Oppio giapponese.
Somniferina (C20H22.23O4N), non precedentemente descritta tra gli alcaloidi del’Oppio, è stata isolata in quantità pari a 0,05-0,1% da Pfeifer e Teige (75 f) da Oppio indiano e riconosciuta dagli stessi AA. (75 f) come base riferibile agli alcaloidi benzilisochinolinici.
Contenuto di morfina nell’Oppio in rapporto alla zona d’origine della droga
La quantità percentuale di morfina, titolo che esprime il valore commerciale dell’Oppio, può variare dal 3 al 25% (79). Oppio con alto titolo di morfina è stato ottenuto in diverse zone mondiali, anche ad elevata altitudine. Buono rendimento di morfina si è avuto da Oppio prodotto in India (20%) (80), nell’Italia meridionale (sino al 17%) (81), negli Stati Uniti d’America (15,28%), in Africa Orientale (14,3%), in Algeria (14-17,8%), in Francia (12,1-22,9%), in Persia (8-16%), in Turchia (12,18 %), in Svezia (12%), in Australia (11,5 %), in Cina (11,2%), in Giappone (10,2%) (80).
In parecchie zone dell’Asia si coltiva il papavero da Oppio a scopo commerciale; Turchia, Persia, India, Indocina, Cina, Giappone. In Europa si coltiva in Jugoslavia. Bulgaria, Grecia. Coltivazioni sperimentali, che hanno dato ottimi risultati, ma che non hanno avuto seguito, sono state fatte nell’Europa centrale e occidentale, specialmente in Germania, Austria, Francia ed anche in Italia. Si distinguono i seguenti tipi di Oppio secondo la zona d’origine:
Oppio dell’Asia minore o di Anatolia o di Smirne o di Turchia o di Costantinopoli – Nell’Oppio (pani) commerciale è stato trovato titolo minimo pari a 9,9%, titoli medi di 12-14%, sino a 18% (82) e anche 21% di morfina (79). E’ povero di codeina (83).
Oppio di Serbia o di Jugoslavia o di Macedonia o di Salonicco – Il titolo di morfina è in generale superiore al 12%, ma raggiunge anche il
14-15%, persino il 17% (Macedonia) ed il 20% ca. (zona di Salonicco). Nell’oppio di Macedonia si trova l’1,6% sino al 2% di codeina, in quello della zona di Salonicco solo lo 0,578% di codeina e lo 0,075% di narceina (84).
Oppio di Persia – L’Oppio di Persia di buona qualità contiene 10-12% di morfina (85). E’ ricco di narcotina (83).
Oppio dell’India – L’Oppio indiano preparato dai fumatori contiene 4-6%, quello esportato per l’estrazione degli alcaloidi anche il 12% di morfina. Vi si trovano elevate quantità di narcotina e di codeina (83).
Oppio di Cina – La più alta produzione ed il più forte consumo di Oppio sono quelli di Cina. Il titolo di morfina dell’Oppio che vi si produce è 3-5% (86), ma può raggiungere l’11 % (85).
Oppio di Bulgaria o di Grecia – Presenta caratteristiche simili a quelle dell’Oppio di Turchia. Ha generalmente contenuto elevato di morfina, pari cioè al 12-18% (87).
Oppio di Romenia – E’ più povero di morfina: 10% ca. (87).
Oppio di Boemia – E’ risultato molto ricco di morfina (17%) e di codeina (1,5%), non contiene narcotina, ma vi si trovano anche molti grassi e resine, che rendono difficoltosa l’estrazione degli alcaloidi (88).
Oppio di Egitto o tebaico – Prodotto di qualità inferiore con basso titolo di morfina: 3-7% (87).
Oppio italiano – La cultura del papavero da Oppio in Italia è stata sinora limitata a campi sperimentali specialmente nelle zone centro-meridionali (89-99). Si sono avuti titoli raggiungenti anche il 17% di morfina (81) nell’oppio. In esperienze fatte nella zona di Palermo si è ottenuto Oppio con il 13,7% di morfina (90). In 12 campioni di Oppio di Papaver somniferum var. album, coltivato in Napoli, si è trovato un titolo minimo di 7,95 % ed un massimo di 12,04% di morfina. In 5 campioni di P. somniferum var. nigrum si è avuto un minimo di 12,10% ed un massimo di 14,2% di morfina (94).
Da Papaver somniferum var. Opium e var. Pirakis, coltivato in Italia, Rovesti (100) ha avuto un’alta resa di morfina per ettaro (ved. Papavero).

1
Contenuto dei singoli alcaloidi nell'Oppio in rapporto alla zona d’origine
Il contenuto percentuale dei principali alcaloidi nell’Oppio è riferibile in generale ai dati della tabella 2, pur tenendo conto dell’elevata variabilità della composizione chimica dei prodotti di diversa origine.

2
E' noto quanto sia importante, per la lotta contro il traffico illecito degli stupefacenti, la determinazione dell'origine dell’Oppio al fine di scoprire le vie clandestine del commercio della droga. E' stata pertanto studiata la possibilità di determinare la provenienza dell’Oppio in base ai dati analitici caratteristici per i singoli tipi di droga.
La composizione chimica dell’Oppio varia notevolmente in relazione alla zona di provenienza per l’influenza di diversi fattori — condizioni climatiche, del terreno, di altitudine, metodi di coltivazione, di raccolta, di preparazione del prodotto grezzo, eventuali falsificazioni ecc. — oltre che per i caratteri particolari delle differenti varietà di Papaver somniferum L., da cui l’Oppio può derivare (ved. parte botanica qui sopra trattata).
Per quanto riguarda l’origine botanica è stata segnalata l’esistenza di diverse popolazioni («razze chimiche») di Papaver somniferum L., che si distinguono per un caratteristico contenuto di alcaloidi a seconda dell'origine geografica (101) (102) (103). Differenze costanti nel contenuto di certi alcaloidi sono state notate in campioni di diversa provenienza. La narcotina è risultata presente in quantità particolarmente abbondante nell’Oppio dell'India, della Persia (83) e del Giappone (80) ed assente da quello prodotto in Francia (80) ed in Boemia (88). Essa si trova nella maggiore parte dell'Oppio derivante dal Papaver somniferum var. album, e sembra invece sia assente dal lattice del P. somniferum var. nigrum. Nel caso della narcotina quindi le differenze trovate nei campioni di Oppio di diversa provenienza potrebbero essere riferibili a differenti varietà di Papavero. La papaverina invece è stata determinata in campioni di Oppio tutti derivanti dal Papaver somniferum var. album; essa è stata trovata nei campioni originari dell’Asia minore, Persia, Cina, Egitto, America, Francia, ma non in quelli provenienti dal Bengala, Patna e Benares ( 104).
In rapporto al basso od elevato titolo di papaverina e di tebaina Grlic (105) ha classificato due tipi di Oppio il «tipo a papaverina» dell’emisfero occidentale e della Macedonia ed il «tipo a tebaina» dell’Asia sudorientale e indiano «Benares».

3
Le ricerche analitiche, condotte su vasto raggio dai periti incaricati dal Segretariato delle Nazioni Unite (106-112), hanno dato notevole contributo alla conoscenza della composizione chimica dell’Oppio in rapporto all’origine dei vari prodotti mondiali. Da questi studi è stata messa in luce la relazione esistente tra la quantità di porfiroxina-meconidina e l’origine dell'Oppio (107) (107 a). L’Oppio indiano ha un titolo elevato, mentre quello dell’Iran ha un basso titolo; i campioni di Turchia hanno valori intermedi (109). L’Oppio turco e l'Oppio indiano presentano caratteri simili, ma per quanto riguarda il contenuto di porfiroxina-meconidina si distinguono nettamente (110).
Un altro dato analitico indicativo per stabilire l'origine dell’Oppio è il titolo di codeina (111), che in generale tende ad essere inversamente proporzionale a quello della morfina (112):

4
La determinazione dell’origine dell’Oppio si vale anche della titolazione delle ceneri e dell’acqua e della ricerca dei componenti delle ceneri stesse.
Degradazione del contenuto di morfina nell’Oppio – Il contenuto di morfina subisce sensibili variazioni durante la maturazione delle capsule, durante la raccolta del lattice, nel corso della preparazione del prodotto essiccato commerciale e nel periodo di magazzinaggio. Si occuparono di questo problema Bourquelot (113) e poi Bougault (114), il quale ultimo riconobbe, nel prodotto derivante dall’alterazione della morfina, la pseudomorfina. Annett e Singh (115) e Abraham e Rae (116) attribuirono la perdita di morfina nell’Oppio alla presenza di un'ossidasi e di una perossidasi. Secondo Nilow, Nilowa e Trotschenko (117), l’azione alterante sarebbe esplicata da una perossidasi e da una invertasi e condurrebbe alla perdita di una quantità di morfina oscillante tra il 7 ed il 35 % nel lattice fresco del Papavero. Schenck, Fròmming, Wiechula e Schwalb (118) hanno invece identificato nel lattice del Papavero, quale unico enzima ossidante, una fenolossidasi producente l’ossidazione della morfina in presenza degli acidi fenolici, acido caffeico e cumarico, contenuti nelle capsule del Papavero. Gli stessi AA. (118) hanno notato che questo processo enzimatico può condurre alla degradazione di una quantità di alcaloide raggiungente anche il 15 % nell’Oppio nel corso del procedimento di preparazione e durante il magazzinaggio.
Circa l’azione della temperatura di essiccazione del lattice di Oppio, è stato riferito che una temperatura tra i 60° ed i 120° produce alterazioni minime del contenuto di morfina (119).
Altri componenti – Oltre agli alcaloidi, nell'Oppio si trovano i seguenti componenti caratteristici:
— acido meconico, C7H4O7 (120-124), trovato da Sertiirner (120) nel 1805 e da questi denominato prima acido oppianico e poi acido meconico. E’ stato isolato in forma pura da Robiquet (121) nel 1833. L’acido meconico si trova nell’Oppio in combinazione con la morfina e con gli altri alcaloidi, in quantità pari sino al 6,5% (125).
— meconina (opianil), C10H10O4 (126-131), estratta da Dublanc (126) e da Cuèrbe (127) dall’Oppio, è stata così denominata da quest’ultimo. Fu poi trovata anche nei rizomi dell’Hydrastis canadensis L. (128) e nella pianta del Papaver somniferum L. (129).
— ciclolaudenolo, C31H52O, che è stato isolato dall'Oppio ed identificato al derivato triterpenico con formula XVII (132) (133).

5
Nell’Oppio sono state inoltre trovate le seguenti sostanze: ginnolo (nonacosanolo-10) (132), acido dl-lattico (134) 1-2% (135) ed altri acidi organici (malico, tartarico, citrico, acetico e succinico come sali) ed inorganici (solforico e fosforico combinati con gli alcaloidi, con magnesio, calcio e ammonio) (136), cera 6-13,6% (137) con acido cerotico esterificato con l’alcool cerilico (= cerina) (138), pirrolidina (139), enzimi (proteasi, ossidasi) (140), pectine 2,7-3,3%, zuccheri, resina, gomma (136), acqua 9-14% (136). Ceneri 3-9%: (141) (142).
Sulla ricerca dei componenti delle ceneri, così come per quella degli alcaloidi, cui si è già accennato sopra, è stata basata la determinazione dell’origine dell’Oppio. Particolare importanza da questo punto di vista avrebbe l’analisi quantitativa del K, Ca, Na, PO4, Sn, Fe, Si, Al, Mg, Ti, Mn, Mo, Pb e del Cu (143-145 a).
Nella fig.1 sono indicati i valori corrispondenti al rapporto tra contenuto percentuale di potassio e di calcio per campioni di diversa provenienza (145).

6
Altri dati, ritenuti utili per la determinazione dell’origine dell’Oppio, sono quelli del contenuto percentuale di ceneri e di acqua (141) (144):

7
Proprietà farmacologiche ed impiego terapeutico
L’uso e le proprietà del Papaver somniferum sono conosciute fin dai tempi più remoti. Secondo Galeno fu lo stesso Dio Thot a preparare per primo il «meconio» che si otteneva per decozione delle capsule di Papaver somniferum frantumate. Ma il merito di aver insegnato ad estrarre il lattice per incisione delle capsule immature sembra spettare a Diagora, contemporaneo di Democrito (146),
Il Papavero era noto anche agli antichi Egizi i quali già ne estraevano l’Oppio, da essi considerato come il «farmaco dell’oblio e della insensibilità» (146).
L'azione farmacologica e terapeutica dell’Oppio è dovuta principalmente alla morfina che fra i numerosi alcaloidi contenuti nella droga, è quello più attivo e che, rispetto agli altri, vi è contenuto in proporzioni maggiori. Ciò nonostante non si può dire che l’azione dell’Oppio si identifichi con quella della morfina poiché gli altri alcaloidi, per le loro caratteristiche farmacologiche e per lo stato chimico-fisico in cui si trovano nella droga, possono sinergizzare, attenuare, antagonizzare o comunque modificare, l’azione della morfina.
Si deve quindi ritenere che l’azione dell'Oppio, più che alla morfina, sia dovuta al suo fitocomplesso, il quale conferisce alla droga una fisionomia farmacologica caratteristica e la rende atta a particolari usi terapeutici.
Gli alcaloidi dell'Oppio che per la loro azione più influiscono nel modificare l’azione della morfina, sono la narcotina, la codeina, la papaverina e la tebaina.
La narcotina attenua l’azione depressiva della morfina sui centri bulbari e in particolare sul centro respiratorio, ma non sul centro della tosse, la cui eccitabilità viene elettivamente inibita dalla codeina. La tebaina eccita invece i centri spinali con un meccanismo di azione simile a quello della stricnina, mentre la papaverina che, come la tebaina, è quasi completamente priva di azioni analgesico-narcotiche, esplica una notevole azione spasmolitica sulle fibre muscolari liscie, azione che è specialmente evidente allorché esista uno stato di ipertono.
E’ appunto a queste interreazioni di potenziamento, di attenuazione e di antagonismo fra i diversi alcaloidi contenuti nell’Oppio, che si deve il frequente impiego pratico di preparati risultanti dall’associazione della morfina con la narcotina o con tutti gli alcaloidi contenuti nella droga, in opportune proporzioni, invece della sola morfina, allorché si voglia attenuare l’azione deprimente della morfina sul centro respiratorio.
Le proprietà analgesiche e stittiche o costipanti dell’Oppio, vengono ampiamente utilizzate nella terapia sintomatica delle coliche gastro-intestinali, epatiche, renali, vescicali ecc. L’ipercinesi intestinale viene inibita sia per azione miolitica, sia per ottundimento della mucosa intestinale agli stimoli che la provocano. Utile per determinare uno stato di riposo del tubo gastro-enterico ove esista minaccia di emorragie o di perforazione (appendicite, ulcera), ma controindicato in fase diagnostica perchè la soppressione del sintomo dolore, può rendere più difficile il rilevamento dei dati semeiologici e quindi l’accertamento e la localizzazione di eventuali lesioni.
Usato come stittico per combattere alcune forme di diarrea, casi nei quali si usa associare a disinfettanti intestinali di cui prolunga l’azione, protraendo la loro permanenza nell’intestino.
In tutti questi casi l'uso dell’Oppio è preferito a quello della morfina, non solo perchè l’azione del fitocomplesso può essere giudicata terapeuticamente più utile, ma anche perchè gli alcaloidi, essendo contenuti nella droga sotto forma di sali e di complessi poco solubili, sono soggetti ad un più lento assorbimento, permettendo un’azione locale più prolungata e più intensa ed un’azione generale più blanda.
L’uso dell’Oppio e dei suoi preparati è controindicato nei bambini, nelle nutrici, negli stati congestivi dei centri nervosi, in alcune lesioni valvolari cardiache, nelle insufficienze epatiche e renali, nell’edema polmonare, nelle stasi fecali e deve essere usato con cautela negli arteriosclerotici, nei vecchi e nelle donne.
L’Oppio è largamente impiegato a scopo voluttuario specialmente presso alcuni popoli orientali. Sembra che i primi ad impiegare la droga a questo scopo siano stati gli arabi i quali la fecero conoscere in Persia da dove si diffuse poi in India, in Cina e in tutto l’oriente asiatico.
unicode ms”>Presso i popoli occidentali l’oppiomania non costituisce un problema sociale come la morfinomania o altre tossicomanie, essendo l’uso della droga limitato a particolari ambienti cosmopoliti di grandi metropoli o di grandi porti, residenze di comunità orientali e medio-orientali, stabili o di transito.
La droga usata dai mangiatori di Oppio (oppiofagi) o dai fumatori, non è costituita dal comune Oppio in pani, ma da una pasta ottenuta con speciali e piuttosto complicate manipolazioni.
Secondo il Logre (147), una pipa contiene da 0,25 a 0,50 g di pasta ed a seconda del numero delle pipe fumate, si distinguono i piccoli fumatori che consumano da 10 a 20 pipe al giorno, dai grandi fumatori che ne consumano da 50 a 100.
Inizialmente il fumatore, come avviene a chi fuma per la prima volta il tabacco, prova soltanto malessere e disgusto, ma continuando si giunge al momento in cui l’Oppio provoca il caratteristico quadro dell’azione stupefacente ampiamente descritta da medici e da letterati.
Dopo la prima inalazione, dice il Logre, il soggetto prova un’impressione di forza intellettuale e fisica. Egli dimentica i suoi affanni e subentra in lui una serenità ideale.
E’ una gioia passiva, una beatitudine contemplativa, un vero nirvana. Le idee fluiscono più facilmente, l’immaginazione si esalta, raggiungendo, secondo il Depouy (148) un vero delirio. In queste condizioni il fumatore assiste, ma senza grande emozione e in maniera passiva a scene in cui dominano, secondo le tendenze personali, l’amore, la ricchezza, la gloria.
L’abuso dell’Oppio determina dopo qualche anno le più deleterie conseguenze le quali non tardano a manifestarsi con un più o meno rapido decadimento fisico, psichico e morale.
In queste condizioni l’intossicato è esposto a contrarre gravi malattie verso le quali non è più in grado, per la diminuita resistenza organica, di opporre una valida difesa e la sua triste esistenza molto frequentemente si conclude con un grave stato maniacale e non rari sono i casi di morte subitanea per sincope cardiaca.
I fenomeni di assuefazione e di astinenza che conseguono all’uso dell’Oppio, sono fondamentalmente simili a quelli noti per la morfina. Abbiamo premesso nella nostra presentazione e più volte ripetuto, che scopo di questa nostra opera non è quello di sostituire i trattati di farmacologia italiani e stranieri attualmente esistenti ma di completarli con la trattazione di quelle droghe che in essi non sono di solito descritte o lo sono molto succintamente. Non ci intratteremo quindi nell’esporre le azioni farmacologica, terapeutica e tossicologica della morfina e degli altri alcaloidi dell’Oppio, essendo esse ampiamente svolte in tutti i migliori trattati di Farmacologia. Crediamo però utile completare il capitolo riguardante la farmacologia della papaverina riferendo i risultati di recentissime ricerche con le quali Santi e i suoi Collaboratori, hanno apportato un concontributo veramente originale a questo interessante argomento.
Santi (149) osservò che la papaverina fatta agire a determinate concentrazioni su segmenti di intestino di cavia, altera la risposta all’azione di farmaci stimolanti (acetilcolina, istamina, BaCl2) fatti agire successivamente, determinando il manifestarsi di una contrazione rapida e la totale scomparsa della fase tonica prolungata che normalmente segue la contrazione iniziale (Fig. 2).

8
Tale comportamento della papaverina, caratteristico di tutte le condizioni sperimentali che comportano una inibizione del metabolismo energetico, ha condotto il Santi a supporre che la sua attività interessasse la fosforilazione ossidativa.
Partendo da questa ipotesi, il Santi coi suoi Collaboratori (150,151), ha potuto dimostrare che la papaverina sopprime la funzione dei mitocondri ponendo il metabolismo energetico nelle stesse condizioni che si realizzano con l'anossia o con farmaci inibitori elettivi dei mitocondri, quali il KCN, il 2,4-dinitrofenolo e l’attrattiloside.
Con una serie di ben condotte ricerche volte a precisare l’esatta sede e il meccanismo d’azione, gli AA. hanno potuto dimostrare che la papaverina esplica un’attività inibitrice sui mitocondri di fegato di ratto e che il blocco prodotto da questo alcaolide, si verifica con straordinaria elettività nello stesso punto della catena respiratoria su cui agiscono l’amital, l’allilossibenzamide, il rotenone e con un’intensità d’azione che è superata soltanto da quest’ultimo attivissimo inibitore elettivo della respirazione mitocondriale (ad una concentrazione cioè di 10-7 M la papaverina e di 10-9 M il rotenone).
L’inibizione che la papaverina esercita sulla fosforilazione ossidativa, è così intensa che può spiegare, secondo Santi, la sua attività spasmolitica e la maggior parte dei suoi molteplici e interessanti effetti farmacologici, quali la vasodilatazione per azione diretta sul circolo coronario, polmonare, cerebrale e sul circolo generale; l’azione risolvente degli spasmi arteriosi; l’azione antifibrillante; l’azione miolitica diretta sulla muscolatura liscia dell’intestino, dell’uretere, delle vie biliari, dell’utero e dei bronchi, nonché l’attività antipruriginosa.
La papaverina è dotata inoltre di azione anestetica locale, di azione stimolante sui chemiocettori senocarotidei e sui pressocettori, con potenziamento dell’azione adrenalinica e dei ganglioplegici.
Il Santi ritiene che la papaverina, per la sua azione elettiva sulla respirazione mitocondriale, possa essere considerata come un buon reattivo farmacologico, biochimico e fisiologico per lo studio del meccanismo dell’azione spasmolitica: negli studi sulla fosfoirilazione ossidativa, in sostituzione dell’amital inibitore molto meno specifico e, inoltre, la sua proprietà di bloccare specificamente la fase aerobica mitocondriale del metabolismo energetico e non la fase anaerobica svolgentesi sul citoplasma, può offrire nuove possibilità per lo studio, sia dei molti problemi non ancora completamente chiariti riguardanti la fisiologia della fibrocellula muscolare liscia, sia per le ricerche sui riflessi originatisi nelle zone reflessogene senocarotidee, per l’azione stimolante che essa induce a livello di queste particolari cellule vasosensibili.
Dal complesso dei risultati ottenuti dagli AA., risulta dunque una interpretazione veramente nuova ed originale del meccanismo d’azione della papaverina, la quale interpretazione non soltanto offre una spiegazione unitaria del meccanismo con cui si manifesta la maggior parte delle sue azioni farmacologiche, ma può essere estesa anche allo studio del meccanismo d’azione di altri farmaci antispastici ad azione papaverinosimile.
Estratti e preparati vari
a) Estratto fluido F.U. titolato al 10% di morfina (g 1 = XXXII gtt).
Dosi: II-V gtt (corrispondenti a circa g 0,05-0,15) pro dose, fino a XV gtt pro die.
b) Estratto molle acquoso titolato al 13% di morfina.
Dosi: g 0,03-0,09 pro dose, sino a g 0,3 pro die.
c) Estratto secco acquoso F.U. titolato al 20% di morfina.
Dosi: g 0,02-0,05 pro dose, sino a g 0,2 pro die.
d) Tintura F.U. titolata all'1 % di morfina (g 1 = XXXVII gtt).
Dosi: V-XX gtt pro dose: dosi massime g 1,5 pro dose, g 5 pro die.
e) Laudano liquido del Sydenham F.U. titolato all’1 % di morfina (g 1 = XXXIX gtt).
Dosi: V-XX gtt pro dose: dosi massime g 1,5 pro dose, g 5 pro die.
f) Laudano pozione analgesica titolato allo 0,05% di morfina.
Dosi: g 2,5-10 prò dose: dosi massime g 30 pro dose, g 100 pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido oppio F.U…………………………………………….. g 10
Alcool di 20°………………………………………………………………. g 90
(gtt V-XX pro dose, sino a g 1,5 pro dose e a g 5 pro die).
Sciroppo F.U.
Tintura oppio F.U……………………………………………………. g 5
Sciroppo semplice F.U………………………………………………….. g 95
(g 2,5-10 pro dose, dosi massime g 30 pro dose, g 100 pro die).
Sciroppo tebaico
Estratto fluido oppio F.U…………………………………………….. g 2
Sciroppo semplice F.U………………………………………………. g 98
(fino a g 20 pro die).
Pillole contro la tosse spasmodica
Estratto secco oppio F.U.
Estratto secco idroalcoolico giusquiamo
Estratto secco idroalcoolico belladonna……………… ana g 0,01
Canfora……………………………………………………………………… g 0,05
Sciroppo gomma q. b. per 1 pillola.
(2-3 pillole pro die).
BIBLIOGRAFIA
(1) DEROSNE, Ami. chim., 45. 257, 1803 – (2) SEGUIN M. A., Ann. chim., 92, 225, 1804 • (3) SERTUR- NER F. W-. (Trommsdcorffs) J. pharm., IS. 234, 1805 – (4) ibid.. 14. 47, 1806 – (5) ibid., 20. 99, 1811 – (6) SÉRTURNER F. W„ Ann. chim. et phys., 5. 275, 1817 . (7) SERTURNER F. W„ (Gilbert's) Ann. Physik., SS. 56, 1817 – (8) idem, 57, 192, 1817 – (9) idem, 59, 50, 1818 – (10) ROBIQUET, J. pharm., 19. 89, 1832; Lieb. Ann., 5. 106, 1833 . (11) PELLETIER, J. pharm.. 150 e 597, 1832; Ann. chim., SO, 252, 1832 – (12) PELLETIER e THIBOUMERY, Lieb. Ann., 16, 38, 1835 – (13) MERCK G., Lieb. Ann., 66. 125, 1848; 73, 50. 1850 – (14) HESSE O., Lieb. Ann.. (SuppL). 8. 261, 1872 – (14a) PYMAN c REMFREY, Chem. Soc., JOJ. 1595, 1912 – (15) MANSKE R. H. F. e HOLMES H. L., The AlValoids, voi. IV, 1954. p. 30 – (16) GOLDSCHMIEDT G-, Monutsh., 4, 704, 1833; 6. 372, 667, 954, 1885; 7, 485, 504, 1886; 8. 510, 1887; 9, 42, 327, 762, 778, 1888; 10. 673, 1889; 19. 321, 1898; GOLDSCHMIEDT G. c STRACHE H., ibid., 10. 156, 692, 1889; GOLDSCHMIEDT G c SCHRANZHOFER F., ibid., 13, 697, 1892; GOLDSCHMIEDT G c KIRPAL A., ibid., 17, 491, 1896; GOLDSCHMIEDT G. e HOENIGSCHMIDT O., ibid., 24, 681, 1903; Ber., 36, 1850, 1903; HIRSCH A., Monatsh., 12. 486, 1891; STUCHLIK L., ibid., 21. 813. 1900; SCHRANZHOFER F., ihid., 14, 521, 597, 1893; WEGSCHEIDER H.. ibid., 18. 418, 1897; 23. 387. 1902 – (17) SMITH T. c H. Co., Pharm. J. und Trans.. 23. 793, 1893 – (18) DOBSON B. e PERKIN W. H. Jr-, J. Chem. Soc.. 99, 133, 1911 – (19) KABACHNICK M. I. e ZITSER A. !.. J. Gen. Chem. U.S.S.R., 7, 162, 1937 – (20) HESSE O., Lieb. Ann.. 153. 47, 1870; Ber., 4. 693, 1871 – (21) SPAETH E.. Monatsh., 41, 297, 1920 – (22) SPAETH E. c LANG N.. Monatsh.. 42, 273, 1921 – (23) HESSE O.. Lieb. Ann.. 282, 208, 1894 – (24) SPAETH E. c SEKA R., Ber., 58, 1272, 1925 – (25) KANDER E.. Arch. Pharm., 288, 419, 1890 – (26) HESSE O., Lieb. Ann., 153. 47. 1870; ibid., supp!., 8, 261, 1872 – (27) SPAETH E. c EPSTEIN H., Ber., 59, 2791, 1926 – (28) SPAETH E. e EPSTEIN H., Ber., 61, 334. 1928 – (29) HESSE
O., Ber., 4. 693, 1871 – (30) MANSKE R. H. F. c HOLMES H. L., The Alkaloids, voi. IV. 1954. p. 48 – (31) PICTTET A. e ATHANASESCU B., Ber.. 33. 2346, 1900 – (32) WREDE F., Arch. exp. Path. u. Pharmakoi, 184. 331, 1937 – (33) WREDE F., Forsch. u. Fortschr.. 14, 173, 1938 – (34) BAUMGARTEN G. e CHRIST W., Pharmuzie, 5. 80, 1950 – (34a) MANSKE R. H. F. e HOLMES H. L., The Alkaloids, voi. IV, 1954, p. 168-169 – (35) DEROSNE C., Ann. chim., 45. 274, 1804 – (36) ROBIQUET M.. Ann. chim. et Phys., 5. 275, 1817 – (37) MATfHIESSEN A. e FOSTER G. C.. J. Chem. Soc., 16, 343. 1863; Ann. (Suppl.), 1. 330, 1861 – (38) PERKIN W. H. Jt. e ROBINSON R., J. Chem. Soc., 99. 775, 1911 – (39) SMITH T. e SMITH H., Pharm. }.. 9. 82, 1878; 23. 794, 1893 – (40) FREUND M. e FRANKFORTER G. B., Lieb. Ann., 277, 20, 1893 – (41) FREUND M. e OPPENHEIM P„ Ber., 42. 1084, 1909 – (42) MAYER, Proc. Phjl Soc., Glasgow, 1871; HENRY T. A., Plani Alkaloids, IV ed., p. 209 – (43) BECKETT e WRIGHT, 3. Chem. Soc., 29. 461, 1876 – (44) RABE P. e McMlLLTAN A.. Lteb. Ann., 377, 223,
1910 – (44 a) HESSE O., Lieb. Ann., J40. 145, 1866; 149. 35, 1869; Arch. Phurm., 28. 79. 1890 – (45)
HESSE O., Lieb. Ann., Sappi.. 8, 261, 1872; Ber., 4. 693, 1871 – (46) SMILES J. (Lab- T. e H. Smith), Phurm. J., 8, 595, 1867 – (47) PERKIN W. H. Jr.. /. Chem. Soc., 109. 815, 1916 – (48) PERKIN W. H. Jr,, 3. Chem. Soc.. 115, 713, 1919 – (49) SMALL L. F. e LUTZ R. E., Chemistry of thè Opium Alkaloids, U.S. Treasury Dept., Public Health Service, n. 103. 1932 – (50) HENRY T. A., The Plani Alkaloids, IV ed„ 1949 – (51) MANSKE R. A. F. e HOLMES H. L.. The Alkaloids, voi. li, 1952. pp. 1-159 e 161-217; voi. IV, 1954, pp. 2971, 149, 157; voi. VI, 1960. pp. 219-245 – (52) BENTLEY K. W., The Chemistry of thè morphine Alkaloids, Oxford, Clarendon press. 1954 – (52 a) BOIT H., Ergebnisse der Alkaloid-Chemie bis 1960, Berlin, 1961, pp. 212, 219, 290, 356, 949, 1017 – (53) KNORR, Ber., 27. 1144, 1894; 38. 3172, 1905; KNORR e HOERLEIN, Ber.. 40, 3341, 1907; KNORR, Lieb. Ann., 368, 305,
1909 – (54) PSCHORR e coll.. Ber.. 33, 1810, 1900; iJ, 4377, 1902; Lieb. Ann., 391, 40, 1912 – (55)
WIELAND, Lieb. Ann., 382. 306, 1911; 433. 267, 1924 – (56) VON BRAUN, Ber.. 47. 2312, 1914; VON BRAUN e CAHN, Lieb. Ann.. 451, 55, 1927 – (57) GULLAND e ROBINSON, 3 Chem. Soc., 123, 980 e 998, 1923 – (58) SCHOEPF e WINTHERHALDER, Lieb. Ann., 452, 211 e 232, 1927; SCHOEPF e BOR* KOWSKI, Lieb. Ann.. 452. 249, 1927; SCHOEPF C, PERREY H. e JACKH I., Lieb. Ann., 497. 47, 1932; SCHOEPF C., GOETTBERG K. e PETRI W., Lieb. Ann., 536, 216, 1938 – (59) SMALL L. F. e FRY E. N., 3. Org. Chem., 3, 509, 1939; SMALL L. F., SARGENT e BRALLEY, 3. Org. Chem., 12. 839. 1947 – (60) GATES M. e TSCHUDl G., 3. Am. Chem. Soc., 74. 1109, 1952 – (61) GATES M. e TSCHUDI G., 3 Am. Chem. Soc.. 78. 1380, 1956 – (62) ELAD D. e GINSBURG D., /. Am. Chem. Soc.. 76, 312, 1954 – (63) ELAD D. e GINSBURG D., 3 Chem. Soc., 3052, 1954 – (64) HENRY T. A., The Plani Alkaloids, IV ed., p. 216 – (65) HENRY T. A., The Plani Alkaloids, IV ed., p. 219 – (66) GULLAND J. M. e ROBINSON R., Mem. Munchr. Lil. Phit. Soc., 69. 79, 1924 – (67) SMITH T. e H.. cit. da DOBBIE e LAUDER, 3 Chem. Soc.. 99. 34, 1911 – (68) DOBBIE e LAUDER, 3. Chem. Soc., 99. 34, 1911 – (69)
VAN DUIN C. F.. ROBINSON R. e SMITH J. C, 3 Chem. Soc.. 903, 1926 – (70) PELLETIER e
THIBOUMERY, 3. pharm., 21, 569, 1835; Lieb. Ann.. 16. 27, 1835 – (71) HESSE 0„ Lieb. Ann.. 141, 87, 1867; 222. 234. 1884; 234. 253. 1886 – (72) GOTO K. e KITASATO Z., Lieb. Ann.. 48t. 81. 1930 – (73) SMALL L. F. e TURNBULL S. G., 3 Am. Chem. Soc.. 59. 1541. 1937 – (74a) MERCK. Lieb. Ann.
21. 201. 1837 – (74b) HESSE O.. Lieh. Ann.. 153, 47, 1870 – (74c) RAKSHIT, 3. Chem. Soc., 115. 455
1919 – (75a) RAKSHIT, Ber.. 59, 2473, 1926 – (75b) MACHIGUCHI, 3 Pharm. Soc. 3apan. n. 529, 19 1926 – (75c) RAJAGOPALAN, 3. Org. Chem.. 10. 175, 1945 – (75d) BAMFORD, Analyst, 55. 445, 1930 (75 e) KLAYMAN D. L., Dissertution Abstr., n. 18474, pp. 1802-1803, 1956, t/niverjify Microfims Ann. Arbor, Michigan, 1956 – (75 f) PFEIFER S. e TEIGE J., Phurmazie. 17, 692. 1962 (76) HESSE O.. Lieb. Ann., 153, 53, 1870 – (77) HESSE O., 3ahresber., 1721, 1886 – (78) MACHIGUCHI, 3. Pharm. Soc. 3apun, n. 529, 185, 1926 – (79) HENRY T. A.. The Plani Alkaloids, IV ed., p. 178 – (80) ANNETr H. E., Mem. Dept. Agr. India, Chem. Sper., 6, 60. 1921 – (81) LONGO B., La coltivazione del Papavero da Oppio in Italia, Relaz. alla Giunta Esecutiva della
Commissione consultiva per le Piante Officinali, giugno 1932; Boll. dell’Orto Botanico dell’Università di
Napoli, voi. 11 â– (82) DUQUÉNOIS P., Prod. Pharm., 2, 12, 1947 – (83) HENRY T. A., The Plani Alkaloids, IV ed., p. 179 – (84) PERROT E., Matières Usuelles du Ràgne végétal, Paris, 1944, p. 886 – (85) PAECH K. e TRACEY M. V., Moderne Methoden der Pffanzenanalyse, Berlin, 1955, voi. IV, p. 448 – (86) PERROT E., Matières usuelles du Règne végétal, Paris, 19444, p. 888 – (87) ibid., p. 885 –
(88) SVAGR, Chem. Lisly, 19, 73, 1925 – (89) SERONO C., Arch. Farm., Roma, 6, 235, 1917 – (90)
BOREI A., Boll, di Studi ed inform. del R. Giard. Colon, di Palermo, 5, 80, 1920 – (91) LAZZARO C„ Boll, di Studi ed inform. del R. Giard. Coion. di Palermo, 4, 219, 1918 – (92) CAVARA F. e CHISTONl
F. , Atti III Congr. Naz. Ind. Sanit. Napoli, 1922 . (93) CAVARA F. e CHISTONl F., Atti R. Ist. Incoragg. Napoli, scr. VI, 76, 1924 – (94) CAVARA F. c CHISTONl A., Rend. R. Acc. Naz. Lincei, 3, ser. VI, 113, 1926 – (95) CAVARA F. e CHISTONl A., Rend. R. Accad. Sci. Fis. e Nat. di Napoli, 3}, ser. IV, 1929 – (96) GIGLI T., Boll. chim. larm., 62, 609, 1923 – (97) RAVENNA G., La Slaz. Sperim. Agr. Ital., 57, 5, 1924 . (98) RAVENNA G., Boll. Ist. Sup. Agr. Pisa, 2, 1, 1926 – (99) LONGO B., Boll. Orto Boi. R. Univ. di Napoli, 10, li, pp. 1 e 9; 11, li, p. 1 – (100) ROVESTl P., Rie. ital. ess. prol., 36, 211, 1954 – (101) ANNETr H. E., Biochem. J., 14, 618-636, 1920- (102) BASILEWSKAJA N. A., Teoret. Osnoary Selek. Rast. (Moskvuh 1, 1935 – (103) HEEGER E. F. e POETHKE W„ Pharmuzie Beihelt. 4, 1947 – (104) MANSKE R. H, F. e HOLMES H. L, The Alkaloids, voi. I, 1950, p. 80 – (105) GRLIC L., Acla Pharm. lagosi., 7, 199, 1957; Chem. Abs., 52. 16693 c, 1958 – (106) Sécrétariat dcs Nations Unies, Docum., ST/SOA/SER.K/17, 1953 – (107) Bull. StupL, IV, n. 1, 11, 1952 – (107a) PRUNER G„ Rend. Ist. Sup. Sanità. 22, 717. 1959: Nations Unies Sécrétariat, Docum. ST/SOA/SER.K/98, 1960; ST/SOA/ SER.K/108, 1961 – (108) Bull. Stupì. V, n. 1, 8, 1935 – (109) Sécrétariat des Nations Unies, Docum. E/CN.7/117, 1948 e E/CN.7/195, 1950 – (110) Sécrétariat des Nations Unies, Docum. ST/SOA/SER.K/4, 1954 – (111) Sécrétariat des Nations Unies, Docum. ST/SOA/SER.K/32, 1954 – (112) Bull. StupL, V, n. 3, 9, 1953 – (113) BOURQUELOT E., 1. phurm. chim., 6, 382, 1896 . (114) BOUGAULT 1., 1. phurm. chim., 15, 49, 1902 – (115) ANNETT H. E. e SINGH H. D., Pharm. 1. Pharmacist.. 109, 304, 1922 – (116) ABRAHAM A. C. e RAE J., Pharm. 1. Pharmacist., 117, 32, 1926 – (117) NILOW W. 1., NILOWA
W. P. e TROTSCHENKO A. T„ Biokhimiya. 1, 165, 1936 – (118) SCHENCK G„ FROEMMING K. H., WIECHULA W. e SCHWALB E., Arch. Pharm., 293, 312, 1960 – (119) KOZO KINOSHITA, Eisei Shikenjo H5koku, n. 74, 69, 1956; Chem. Abs., 51, 7648e, 1957 – (120) SERTURNER F. W., 1. pharm., 13, 349, 1805; (Gilberfs) Ann. chim. et phys., 56, 1817 – (121) ROBIQUET M., Lieb. Ann.. 5, 82 e 90, 1833 – (122) LIEBIG J., Lieb. Ann., 5, 287, 1833; 26, 113, 1838 – (123) PERATONER A. e LEONARDI G. , Chem. Zbt., II, 384, 1900 – (124) BORSCHE W., Ber., 49, 2538, 1916 – (125) KARRER W„ Konstitu- tion und Vorkommen der Organischen Pflanzenstoffe, p. 567, 1958 – (126) DUBLANC, Lieb. Ann., 3, 121 e 127, 1832 – (127) CUERBE J. P., Lieb. Ann., i, 180, 1833 – (128) FREUND M., Ber., 22, 456 e 459, 1889 – (129) SCHMID H. e KARRER P., Helv. Chim. Acta, 28, 722, 1945 – (130) WEGSCHEIDER R., Monatsh., 3, 351, 1882 – (131) FRITSCH P., Lieb. Ann., 301, 352, 1898 – (132) BENTLEY H. R., HENRY J. A., IRVINE D. S„ MUKERJI D. e SPRING F. S., 1. Chem. Soc., 596, 1955 – (133) HENRY J. A., IRVINE D. S. e SPRING F. S., J. Chem. Soc., 1607, 1955 – (134) BUCHANAN J. Y„ Ber., 3, 182, 1870 – (135) ANNETT e BOSE, Analyst, 47. 387, 1922 – (136) WEHMER C., Die Pflanzenstoffe, II ed., p. 30 – (137) RAKSHIT, Analyst. 51, 491, 1926 – (138) HESSE 0„ Ber., 3, 637, 1870 – (139) REUITER DE ROSEMONT L.. Chem. Zbì., IL 736, 1918 – (140) ANNETF, Biochem. !.. 16, 765, 1922 – (141) Sécrétariat des Nations Unies, Docum. ST/SOA/SER.K/23, 1954 – (142) MUSONS Y„ GINESTA J. Medicamento, Ed. Farm., 8, 216, 1956 – (143) Sécrétariat des Nations Unies, Docum. ST/SOA/SER.K/30,
1954 – (144) MUSONS Y., GINESTA J., Medicamentu, Ed. Farm., 8, 220, 1956 – (145) BARTLET J. C. e FARMILO C. G., Notare, 174, 407, 1954: Can. J. Technol.. 33, 134, 1955; Chem. Abs., 49, 566i e 11955h,
1955 – (145a) Confr. con MASI A., Fitoterapia, 32, n. 4. 14, 1961 – (146) BENEDICENTI A., Malati, medici e farmacisti. 1, 55, 116, 117, U. Hoepli, Milano 1925 – (147) LOGRE, Toxicomanie, Deiamain ed. Parigi, cit. da DE BLOCK L., Toxicomanies, Vigot Frères ed, Paris e Thone, G. Liegi 1927, p. 56 e seg. – (148) DEPOUY, Les Opiomanes, cit. da DE BLOCK L. Le. (147) – (149) SANTI R„ La Clin. Terapeut., 25, 397, 1963 – (150) SANTI R,, CONTESSA A. R. e FERRARI M., Biochem. Biophys. Research Commun., 11. 156, 1963 – (151) SANTI R.. CONTESSA A. R. e FERRARI M., Arch. II. Sci. Farmacol., 12, 231, 1962.


