Tabernanthe
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Tabernanthe iboga Baill. H. Bn. – Fam. Apocinacee/Plumieroidee/ Tabernaemontaninee)
Tabernanthe- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Il genere Tabernanthe fu istituito da H. Baillon (Sur l'obouété du Gabon-Bull. d. la Soc. linnéenne, Paris 1889) senza precisare se dovesse essere ascritto ad una sezione del genere Tabernaemontana. L'A., nella determinazione dice: «fleurs presque du genre Tabernaemontana». E' probabile quindi che col nome Tabernanthe, abbia voluto indicare Tabernae-anthos (da anqos = fiore) cioè con fiori simili a quelli delle Tabernaemontana [genere dedicato a Jacob Théodor = Tabernaemontanus, di Bergzabern, medico del vescovo di Speyer (+ 1520)].
Iboga – Uno dei nomi indigeni della pianta (dialetto Nipongivé).
Nello stesso anno J. Braun e K. Schaumann (Bot. Bericht. uber die Flora v. Kamerun, 1889) la nominarono Iboga Wateriana, dedicandola al botanico tedesco W. Water.
Nomi volgari – Secondo le varie tribù e regioni, la pianta ha nomi diversi.
Nel Gabon – obouété, obuété, loboka, libonka, aboua, aboga (dial. Pahouin) – iboga (dial. Nipongivé) – deboga (dial. Bekelé) – iboka (dial. Majumba).
Nel Congo – boga (dial. Apindij) – inkoni, élabu pandu, ikuke (dial. Mongo) – bougensengo (dial. Bengeula) – inaolo a ikakuna (dial. Turumbu) – inaolo aebangabanga (dial. Tahiluluba).
Nell'Angola – bocca.
Habitat – Localizzato fra il 10° lat./nord e il 10° lat./sud, nei territori della Guinea, del Cameroun, del Gabon, del Congo e del nord dell'Angola. Vegeta nei terreni umidi (ed anche nei terreni sabbiosi e secchi), soprattutto nella foresta del Mayumbé (o Majumbe). Abbondante nel delta dell'Ogowé e lungo il corso di questo fiume, specie nelle vicinanze del forte di Lambaréné, a metà strada fra Capo Lopez [dove la trovò per primo Griffon du Bellay (1864)] e Njolé e nella zona compresa fra i territori di Urungu (o Oronga) e Okanda. Si trova dal mare, in Guinea e al Gabon, sino a 500 m. sm. nel Congo. E' spesso coltivata presso le abitazioni.
Arbusto o albero (da 0,50 a 5 m.).
Parti usate – Le radici.
Nota – Gli indigeni del Gabon, quando devono sostenere dei grandi sforzi masticano un frammento della radice e, con questa pratica, possono accudire senza fatica ai loro pesanti lavori. Arrivano a raddoppiare la lunghezza normale di una marcia, il peso del loro carico, senza accorgersi della fatica. I piroghieri risalgono facilmente la corrente ed anche le rapide dell’Ogowé, remando per più di 70 km senza riposare e trasportando forti carichi nelle piroghe. E’ anche usata come afrodisiaco.
Componenti principali
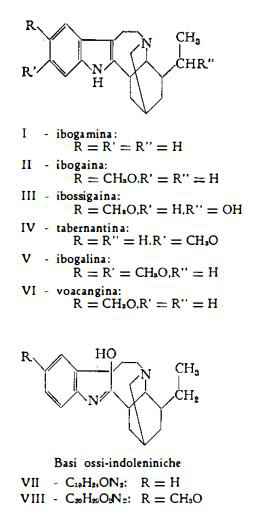
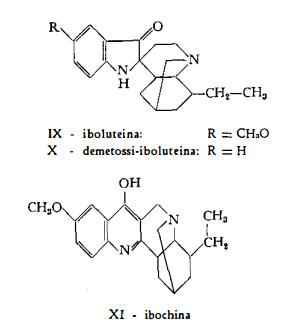
Alcaloidi con struttura indolica: ibogaina (1) (2), ibogamina (3), ibossigaina (4), tabernantina (5), ibogalina (6), voacangina (7), chisantina e gabonina (7). Ad essi si accompagnano altre basi, base C19H24ON2 e base C20H26O2N2 (7), che invece del nucleo indolico contengono uno scheletro ossi-indoleninico; inoltre iboluteina (8) e demetossi-iboluteina (7) con struttura pseudoindossilica ed ibochina
(8), che ha uno schema 4-ossichinolinico.
Ibogaina, C20H26ON2, è stata estratta per la prima volta dalla Tabernanthe iboga da Dybowski e Landrin (1) e da Haller ed Heckel (2). La presenza, nell'ibogaina, di un nucleo indolico fu determinata da Janot, Goutarel e Sneeden (9). In seguito agli studi di Schlittler, Burckhardt e Gellért (10), di Goutarel, Janot, Mathys e Prelog (11), di Taylor e coll. (12) (13) e di Biemann e Friedmann-Spiteller (14) alla ibogaina è stata assegnata la formula di struttura Il.
lbogamina, C19H24N2, isolata in un primo tempo dalla Tabernanthe iboga da Burckhardt, Goutarel, Janot e Schlittler (3), è stata in seguito trovata anche nella Tabernaemontana oppositifolia (15 ) e nella Stemmadenia galeottiana (16). E' una base monoacida con nucleo indolico (3) e con un gruppo C-etilico (12), la cui struttura, determinata specialmente per opera di Goutarel, Janot e coll. (3) (17) (18), di Bartlett, Dickel e Taylor (3) e di Biemann e Friedmann-Spiteller (14), è stata formulata secondo lo schema I.
Ibossigaina, C20H26O2N2, fu ottenuta dalla Tabernanthe iboga da Goutarel, Percheron e Janot (4). Dalla stessa droga è stata ricavata da Taylor e coll. (7), che l'hanno denominata chimvulina. Essa è stata identificata con la base III, in relazione all’esito degli studi, eseguiti sui prodotti di scissione e di riduzione del tosilato della stessa base [C20H25ON2] OSO2C6H4CH3 (4) (14) (19-21). Tabernantina, C20H26ON2, trovata nella Tabernanthe iboga da Delourme-Houdé (5), nella Stemmadenia donnell-smithii da Watts e coll. (16) e nella Conopharyngia durissima da Renner e Prins (22), corrisponde alla base di formula IV, che differisce da quella della ibogaina soltanto per la posizione del metossile. Alla definizione della sua struttura hanno contribuito sia le ricerche di Raymond-Hamet (23), il quale ne ha messo in evidenza la natura di base metossi-indolica, sia le indagini di Taylor (12), che ha dimostrato la presenza di un gruppo C-etilico e che con Bartlett e Dickel (13) ne ha studiato i prodotti di ossidazione, di riduzione e di trasformazione per riscaldamento con soda, sia gli studi di Goutarel, Janot e coll. (18), che ne hanno esaminato i derivati ottenibili dalla fusione con potassa.
Ibogalina, C21H28O2N2, è stata isolata dalla Tabernanthe iboga Baill. da Neuss (6), che ne ha proposto la struttura V, confermata poi da Biemann e Friedmann-Spiteller mediante studio dello spettro di massa dell’alcaloide (14).
Voacangina, C22H28O3N2, isolata per la prima volta dalla Voacanga africana (24) (25), fu poi ricavata anche dalla Tabernanthe iboga da Taylor e coll. (7). In seguito ai lavori di Janot, Goutarel e coll. (24) (26) (27) e di Taylor e coll. (13) ne è stata determinata la formula di struttura VI.
Basi ossi-indoleniniche C19H24ON2 e C20H26O2N2 (VII e VIII) rispettivamente, sono state identificate da Taylor e coll. (7) nella Tabernanthe iboga, ma si tratta probabilmente di prodotti di trasformazione degli alcaloidi del gruppo dell’ibogaina.
Iboluteina, C20H26O2N2, è il derivato pseudoindossilico con formula strutturale IX (17) (28), trovato tra gli alcaloidi della Tabernanthe iboga da Goutarel e Janot (8).
Demetossi-iboluteina, C19H24ON2, con formula strutturale X, è stata pure riconosciuta tra gli alcaloidi della Tabernanthe iboga da Taylor e coll. (7).
Ibochina, C20H24O2N2, è il derivato 4-ossichinolinico, messo in evidenza da Goutarel e Janot (8) mediante separazione cromatografica degli alcaloidi della Tabernanthe iboga.
Alcaloidi indolici di struttura chimica sinora non definita, chisantina C21H28O3N2 e gabonina, C21H28O4N2, sono stati trovati inoltre nelle radici della Tabernanthe iboga da Taylor e coll. (7).
Nelle radici il contenuto di alcaloidi varia dallo 0,5 all’1,67 % (29). Ghielmetti e Mela hanno segnalato titoli pari sino a circa l’1,5% di alcaloidi totali (30). Goutarel (31) ha ottenuto un rendimento oscillante tra l’1,5 ed il 2 % di alcaloidi grezzi. Dybowski e Landrin (1) hanno isolato 0,6-1 % di ibogaina dalle radici.
Proprietà farmacologiche ed impiego terapeutico
Sembra che l’iboga sia conosciuta da molto tempo presso alcune popolazioni dell’Africa equatoriale (Congo, Gabon, Camerun) per le sue proprietà antifatica, stimolanti nervose, ipnofughe e afrodisiache, proprietà per le quali questa droga è estesamente usata dagli indigeni per meglio resistere alla fame, alla sete ed agli sforzi violenti e prolungati.
Secondo notizie pervenute in Europa fin dal secolo scorso, attraverso relazioni e informazioni di viaggiatori e di medici che hanno esplorato o risieduto in quelle regioni, i guerrieri, i cacciatori, i pagaiatori indigeni che con le loro piroghe risalgono il corso del fiume Ogawè riescono, sotto l’azione della droga, a raddoppiare la loro resistenza alla fatica e al sonno, pur nutrendosi con esigue e rare razioni di manioca.
L’iboga inoltre ha un ruolo molto importante in certe pratiche di stregoneria e nei riti feticisti di iniziazione, per indurre negli iniziandi un particolare stato d’eccitazione che, secondo Landrin (32) così è descritto dal Guien.
«I loro nervi sono tesi in modo straodinario, si verifica uno stato maniaco epilettiforme durante il quale essi diventano incoscienti e pronuciano parole che sono interpretate dai vecchi della Tribù; esse hanno un significato profetico e provano che il feticcio è entrato in loro».
Questi effetti sono prodotti facendo masticare le radici della droga, ma da altri resoconti risulta che stati d’eccitazione, d’ebrezza e, forse, d’allucinazione, sono ottenuti anche con la somministrazione di estratti grezzi della droga, se presi a dosi sufficientemente elevate [Le Roy (33)].
Presso altre tribù gli iniziandi vengono lasciati soli nella foresta per alcuni giorni durante i quali essi si nutrono soltanto di iboga.
Anche altre popolazioni pigmee dell’Africa equatoriale, usano masticare i rametti e le foglie della pianta, prima e nel corso di certe loro cerimonie rituali, durante le quali i partecipanti rimangono svegli per parecchi giorni e in continuo stato di eccitazione.
Piccole dosi di questa droga sono usate inoltre dagli indigeni del Congo prima di intraprendere spedizioni di caccia particolarmente faticose e pericolose (34, 35, 36), analogamente dunque agli indigeni della Bolivia, i quali usano masticare le foglie di Coca per acquistare una maggior resistenza alla fame, alla sete, al sonno, alla stanchezza, alla fatica e, in generale, agli sforzi fisici.
Ricerche farmacologiche sistematiche sulla Tabemanthe iboga furono iniziate da autori francesi nei primi anni del nostro secolo, dopo che Dybowski e Landrin (1) isolarono l’ibogaina, alcaloide indolico, contenuto nella droga insieme con molti altri farmacologicamente meno studiati (vedi parte chimica).
Le prime ricerche farmacologiche furono eseguite nel 1901 da Mailer e Heckel (37) e da Phisalix (38) il quale sperimentando su animali a sangue caldo e a sangue freddo, concluse che l’azione prima dell’ibogaina è quella che essa esercita sul sistema nervoso centrale e che è facilmente osservabile nel cane il quale reagisce con uno stato di ebbrezza che ricorda quella alcoolica.
Crisi di agitazione si osservano anche nel coniglio e nella cavia, ma esse sono rapidamente seguite da incoordinazione dei movimenti, da paresi e da paralisi. L’esito letale prodotto da dosi elevate, segue alla paralisi respiratoria, mentre la sensibilità si mantiene per tutta la durata dell’esperienza.
Nella rana, dosi tossiche di ibogaina determinano paralisi progressiva e graduale diminuzione dell’attività riflessa, ma l’eccitabilità dei nervi e dei muscoli è conservata,
L’ibogaina produce aumento della temperatura nel conglio e nel cane. Nella cavia le stesse dosi inducono ipotermia, ma un aumento della temperatura può seguire alla somministrazione di dosi molto piccole.
La pressione arteriosa nel cane, è aumentata dalla ibogaina, dalla quale vengono contemporaneamente aumentate anche la frequenza respiratoria, la frequenza e la validità del polso.
L’incremento della diuresi compare non solo come conseguenza dell’accresciuta attività circolatoria e della pressione ematica ma forse anche, secondo gli AA., per un effetto diretto sugli elementi secernenti renali. A queste ricerche di Phisalix seguirono nello stesso anno, quelle di Lambert e Heckel (39) e quelle di Lambert (40, 41), il quale riprendendo l’argomento, concludeva dopo più estese indagini, che l’azione dell’ibogaina si esercita prevalentemente sul sistema nervoso centrale e sul cuore. L’eccitabilità riflessa e la sensibilità negli animali a sangue caldo, sono prima diminuite, poi abolite: la paralisi centrale è preceduta da un certo periodo di eccitazione che si manifesta con la comparsa di convulsioni. La persistenza della coscienza e dei riflessi encefalici, nel momento in cui la paralisi del tronco è completa, sembra indicare secondo l’A., che l’ibogaina agisce sui centri intermedi, mentre la morte per arresto respiratorio dimostra che la sua azione si estende ai centri bulbari. La bradicardia e l'effetto ipotensivo sarebbero dovuti ad un'azione diretta sul cuore, l'azione tonica dei pneumogastrici è soppressa senza che essi perdano la loro eccitabilità. Anche i muscoli e i nervi motori conservano le loro proprietà, tranne quando l'intossicazione, per dosi mortali, nella rana, è in fase avanzata e la paralisi persiste da molto tempo.
Il quadro dell'intossicazione ibogainica presenta, tanto negli animali a sangue freddo, quanto in quelli a sangue caldo, molte analogie con quello dovuto alla cocaina. L'azione anestetizzante, i fenomeni convulsivi, l'atteggiamento degli animali paralizzati, le dosi mortali, il meccanismo della morte sono infatti così simili, secondo l’A. che spesso riesce difficile distinguere a prima vista, se gli animali sono intossicati dall'uno o dall'altro alcaloide. Esistono tuttavia alcune differenze e fra le principali va considerata la brevità del periodo d'eccitazione, che si manifesta con fenomeni convulsivi, ma ciò avviene soltanto allorché l'ibogaina è somministrata a dosi molto elevate.
L'azione eccitante psichica, caratteristica della cocaina, non si ottiene mai con dosi deboli d'ibogaina la quale, pur determinando sugli animali un certo stato di ebbrezza, non provoca in essi l'eccitazione motoria disordinata quale si osserva nella fase iniziale dell'intossicazione cocainica. L'ibogaina inoltre non è dotata d'azione vasocostrittrice nè di azione paralizzante dei nervi frenatori del cuore.
In considerazione di tutto ciò, Lambert trova difficile spiegare l'azione antifatica dell'iboga e l'uso che ne fanno gli indigeni dell'Africa equatoriale per ottenere gli stessi effetti che gli indigeni di altri paesi ottengono con la Coca e con la Kola. L'azione di queste due ultime sostanze è spiegata in base alla loro attività sul sistema nervoso, sui muscoli e sul cuore, ma l'ibogaina non sembra agire sul lavoro muscolare. Nella rana i muscoli esauriti da frequenti eccitazioni dei nervi motori, non sembrano ristabilirsi più rapidamente sotto l'influenza dell'ibogaina.
D'altra parte, autoesperienze eseguite da Lambert stesso, hanno dimostrato che nei tracciati ergografici, presi prima e dopo la masticazione di 5 g di foglie di Tabernanthe iboga, non è possibile svelare differenze apprezzabili.
L'A. non esclude però che a dosi più elevate, l'ibogaina agisca come eccitante del sistema nervoso, ma la sua azione sembra essere inferiore a quella prodotta dalla cocaina, pur essendo la sua attività anestetizzante piuttosto marcata.
Sembra comunque interessante a Lambert il fatto che popolazioni diverse impieghino le due sostanze per scopi analoghi.
Queste ricerche vennero continuate quattro anni dopo da Pouchet e Chevalier (42) i quali studiarono la tossicità dell'ibogaina, la sua azione sul sistema nervoso, sull'apparato cardiovascolare e respiratorio, sulla diuresi e sul ricambio.
Essi trovarono che la dose mortale dell'ibogaina nella cavia, per via intraperitoneale, è di 90-100 mg/kg e di 40-50 mg/kg nel cane per via endovenosa. L'intossicazione ibogainica nel cane si manifesta «soprattutto, con un’eccitazione violenta, con sintomi di ebbrezza, con allucinazioni, incoordinazione motoria, tremori e quindi paraplegia, paralisi motrice e, simultaneamente, un'anestesia più o meno completa. Si notano nello stesso tempo convulsioni tetaniformi che iniziano alla fine del primo periodo dell'intossicazione e persistono fino alla morte dell'animale». La morte avviene per paralisi respiratoria seguita dall'arresto del cuore in diastole.
Dopo una fase di iperestesia l'ibogaina determina anestesia, ma molto meno marcata di quella ottenibile con cocaina.
Nel cane il ritmo cardiaco è accelerato inizialmente dall'ibogaina in maniera transitoria e il successivo rallentamento è contemporaneo ad un aumento dell'energia della contrazione cardiaca.
Un effetto ipotensivo si manifesta durante la fase di accelerazione. A dosi medie si osserva a volte un leggero aumento della pressione e un forte aumento dell'energia della contrazione sistolica.
A forti dosi la pressione subisce una diminuzione e si determina una aritmia cardiaca.
L'eccitabilità del vago cardiaco è diminuita o soppressa per dosi medie d'ibogaina.
L'ampiezza e la frequenza respiratoria sono leggermente aumentate dalle piccole dosi mentre le dosi più elevate determinano prima una diminuzione poi un aumento della frequenza. Le dosi mortali inducono uno spasmo respiratorio cui segue l'arresto.
La necroscopia degli animali morti per intossicazione ibogainica rivela congestione del fegato, della milza e dei reni che gli AA. attribuiscono alla paralisi vascolare che si osserva durante la fase finale dell'intossicazione.
Nei cani trattati con somministrazione quotidiana d'ibogaina, non si osserva aumento della diuresi, è invece nettamente evidente un aumento dei fenomeni ossidativi che si manifestano con un aumento dell'urea dell'azoto totale, dei fosfati urinari e del coefficiente d'utilizzazione dell'azoto.
Questi AA. concludono che l'ibogaina deve essere considerata come un farmaco neurastenico, tonicardico e eccitante della nutrizione.
Queste ricerche vennero poi continuate ed approfondite sotto la direzione dello stesso Chevalier, da Landrin (43) il quale ha descritto più dettagliatamente il quadro dell'intossicazione ibogainica: «si osserva la brusca comparsa di una serie di sintomi che svelano un'ipereccitabilità midollare intensa. Si osserva incoordinazione motoria, tremori che denotano l'azione cerebellare della sostanza, fenomeni di ebbrezza e di allucinazioni, turbe visive dovute ad un'azione cerebrale; infine convulsioni toniche che sono nettamente di origine midollare».
A proposito dell'azione cardiaca, Landrin ritiene che essa sia dovuta ad un meccanismo complesso nel quale intervengono effetti sul sistema nervoso centrale, sul sistema nervoso periferico, sui gangli intracardiaci e, forse, un'azione elettiva sul muscolo cardiaco stesso.
I risultati di esperienze condotte dall'A. con l'ibogaina amorfa dimostrarono che essa, pur non essendo un prodotto definito, agisce in maniera molto simile all'ibogaina cristallizzata.
Dopo queste prime ricerche farmacologiche, l'ibogaina venne sperimentata clinicamente da Kuborn (44) dal quale venne raccomandata come rimedio sintomatico nella malattia del sonno.
Successivamente Huchard (45) impiegò il cloridrato d’ibogaina alla dose di 10-30 mg al giorno nel trattamento della grippe, nella convalescenza di malattie infettive e nella nevrastenia. In questi casi egli afferma d’aver ottenuto buoni risultati, con diminuzione dell’astenia nervosa, aumento dell’appetito, delle forze e miglioramento della nutrizione generale.
Anche nei cardiopatici astenici o con dilatazione atonica del cuore, egli constatò un miglioramento delle turbe funzionali.
Poi non si sa bene per quale ragione, l’ibogaina venne dimenticata sino a che il suo studio venne ripreso dopo più di trent’anni da Rothlin e Raymond-Hamet (46-47-48) i quali, con lo scopo di completare lo studio di questo alcaloide, il cui meccanismo d’azione non era stato sufficientemente precisato dalle ricerche degli autori precedenti, eseguirono una serie d’indagini sull’azione che esso esplica sugli organi isolati.
Sulle vescicole seminali isolate di cavia (46) essi trovarono che l’ibogaina a dosi sufficienti, inibisce quasi totalmente gli effetti motori prodotti dall’adrenalina e dall’acetilcolina, benché tale loro azione resista male al lavaggio.
Dopo ibogainizzazione e lavaggio tuttavia, gli effetti motori dell’acetilcolina si manifestano meno rapidamente di quelli prodotti dall’adrenalina.
L’inibizione ibogainica degli effetti motori prodotti dall’acetilcolina e dall’adrenalina differiscono quindi essenzialmente, secondo gli AA. dall’inibizione prodotta dall’atropina e dall’ergotamina.
Anche sull’utero isolato di coniglio, su cui a forte concentrazione determina una marcata reazione motoria, l’ibogaina è priva d’azione adrenolitica e tutti i risultati ottenuti dagli AA. dimostrano che essa non appartiene allo stesso gruppo farmacologico della yohimbina (47).
I risultati di successive ricerche degli stessi AA. (48) hanno confermato quelli suddetti ed hanno precisato che sull’intestino tenue isolato di coniglio e sull’intestino crasso di cavia, l’ibogaina esercita un’azione inibitrice. Essa diminuisce il potere inibitore dell’adrenalina, ma in maniera non altrettanto marcata, gli effetti inibitori dell’acetilcolina.
L’azione inibitrice dell’ibogaina sull’intestino è invertita dall’ergotamina.
L’ibogaina che sulle vescicole seminali di cavia, ha un’azione diretta estremamente debole, inibisce quasi totalmente gli effetti motori tanto dell’adrenalina quanto dell’acetilcolina.
Sull’utero isolato di cavia l’azione inibitrice dell’adrenalina non viene invece modificata dall’ibogaina, la quale manifesta su questo organo una azione eccitante.
In base a questi risultati gli AA. concludono che l’ibogaina si allontana dai quattro veleni tipici del sistema nervoso vegetativo: adrenalina, acetilcolina, yohimbina e atropina.
Ulteriori indagini sull’azione dell’ibogaina eseguite da Raymond-Hamet sull’intestino in situ di cane in anestesia cloralosica (49) hanno dimostrato che essa, analogamente alla cocaina, prolunga notevolmente l’azione intestino-inibitrice dell’adrenalina. Il cloridrato d’ibogaina, alla dose di 4 mg/kg ha prolungato di tre volte l’arresto totale della peristalsi intestinale prodotto dall’iniezione di 0,007 mg di adrenalina, elevando nello stesso tempo da 62 a 82 mmHg, l’effetto ipertensivo.
L’A. ritiene pertanto, di poter concludere che l’ibogaina ha sugli effetti inibitori dell’adrenalina, la stessa influenza che essa esplica sugli effetti motori
Per quanto riguarda l’azione diretta dell’ibogaina sull’intestino in situ, l’A. ha trovato che essa ha la stessa attività inibitrice già osservata sull’intestino isolato (48). Nelle prove eseguite sul cane questa inibizione si è manifestata con un abbassamento più o meno accentuato del tono e con una diminuzione dell’ampiezza delle contrazioni.
Sulla pressione carotidea il cloridrato d’ibogaina, alla dose di 4 mg/kg, nel cane, ha determinato soltanto un leggero e molto transitorio aumento, seguito da un'altrettanta leggera diminuzione.
In considerazione delle analogie esistenti fra l’azione farmacologica della cocaina e quella dell’ibogaina, già osservate dal Lambert (41), Raymond-Hamet (50) ha voluto vedere se l’ibogaina, analogamente alla cocaina, possiede anche la proprietà di rinforzare l’azione dell’adrenalina e di abolire il riflesso senocarotideo. Egli ha potuto dimostrare infatti che anche queste due proprietà sono comuni ad entrambe le sostanze e poiché l’A. classifica l'ibogaina fra i farmaci da lui definiti simpaticostenici, l’azione antifatica che gli indigeni dell’Africa equatoriale attribuiscono all’iboga, troverebbe in queste ricerche, secondo l’A., una giustificazione sperimentale.
Vincent e Séro (51) hanno dimostrato che l’iboga ha sulla colinesterasi del siero, un’attività inibente tanto più marcata quanto più le preparazioni usate si avvicinano alla droga; la tintura si dimostra infatti più attiva dell’estratto alcoolico grezzo e questo più attivo dell’ibogaina amorfa la quale é, a sua volta, molto più attiva dell’ibogaina cristallizzata. Gli AA. non hanno però potuto stabilire se tale attività anticolinesterasica, più elevata nella droga che nell’alcaloide purificato, deve essere attribuita ad un principio attivo diverso dall’ibogaina cristallizzata, a una sua eventuale alterazione durante il processo d’estrazione o al fatto che essa é contenuta nella droga in una forma più attiva.
L’attività anticolinesterasica della tintura d'iboga é apparsa superiore sulla colinesterasi serica che su quella contenuta nei muscoli, nel fegato e specialmente di quella contenuta nel cervello.
Gli AA. ritengono che tale attività delle preparazioni d’iboga, induca un’alterazione della funzione neuromuscolare la quale verrebbe eccitata dalle piccole dosi, mentre le dosi più elevate determinano fenomeni tossici che si manifestano con contrazioni e con convulsioni.
Essi hanno notato inoltre che l’iboga manifesta un’azione tossica sui muscoli, per la quale la loro sensibilità all’acetilcolina viene diminuita.
Questi risultati furono successivamente confermati dalla Séro (52) la quale ha confermato anche l’azione ipotensiva dell'iboga (più attiva di quella dell’ibogaina) e la sua azione sensibilizzante dell’effetto ipertensore dell’adrenalina.
Essa ha inoltre constatato: la scomparsa della bradicardia adrenalinica riflessa e il prolungamento dell’ipertensione acetilcolinica sotto l’azione dell’iboga; l’effetto tossico prodotto dall’ibogaina sul muscolo dorsale anteriore di sanguisuga, effetto che si manifesta con la comparsa di contrazioni ritmiche di modesta ampiezza e senza che il preparato venga sensibilizzato all’azione dell'acetilcolina e, infine, l'effetto depressivo, nell'insieme, dell’iboga sull’intestino isolato di cane.
Più recentemente Raymond-Hamet e Vincent (53), hanno trovato che, anche altri alcaloidi contenuti nella Tabernanthe iboga, quali l’ibogamina l'iboluteina e la tabernantina, dotati di un’attività simpaticostenica più o meno marcata, possiedono anche un'attività anticolinesterasica dello stesso ordine di quella dell'ibogaina; fra l’azione simpaticostenica degli alcaloidi studiati dagli AA. e i loro effetti anticolinesterasici non esiste però alcun parallelismo: l'iboluteina infatti, la cui attività simpaticostenica è molto più debole di quella dell’ibogaina, ha sulla colinesterasi del cervello di montone un potere inibente molto più elevato.
L’effetto anticolinesterasico degli alcaloidi studiati si manifesta in maniera quantitativamente diversa sulla pseudocolinesterasi del siero e sulla colinesterasi vera del cervello, agendo essi su quest'ultima, con una intensità che è stata calcolata, molto approssimativamente, dagli AA., di 50 volte superiore.
In una monografia comparsa nello stesso anno (1944) in cui comparve quella già citata della Séro, Delourme-Houdé (54) trattò molto estesamente l’iboga sia dal punto di vista botanico che chimico e farmacologico.
Per quanto riguarda la parte farmacologica l'A., dopo aver ricordato le ricerche precedenti, ha studiato l’attività delle diverse parti della pianta, delle preparazioni totali, del complesso alcaloidico, dell’ibogaina amorfa e cristallizzata, sia isolatamente considerate che comparativamente con la tabernantina.
Egli trovò che tutte le diverse parti della pianta, ad eccezione dei semi che sembrano avere un’azione particolare, agiscono nello stesso senso.
Le preparazioni totali, gli alcaloidi totali e gli alcaloidi cristallizzati, hanno un'attività qualitativamente identica.
La tabernantina ha la stessa azione dell’ibogaina. I due alcaloidi cristallizzati sembrano realizzare un sinergismo e contribuire insieme all’attività della droga
L'A. ha determinato nella cavia la DL50 del cloridrato d’ibogaina cristallizzato, del cloridrato degli alcaolidi totali e di un estratto alcoolico delle radici al 15 % di alcaloidi totali (titolati col metodo al silico-tungstato).
Per il cloridrato di ibogaina è stata trovata una DL50 pari a 82 mg/kg, per gli alcaloidi totali a 75 mg/kg e, per l’estratto, pari a 55 cg/kg corrispondente a 0,85 mg di alcaloidi totali.
Secondo l’A. la proprietà ipotensiva relativa alle forti dosi d’ibogaina, sembra dovuta alla loro azione vasodilatatrice e le indagini eseguite comparando l'azione della tabernantina con quella dell’ibogaina, hanno permesso all’A. di concludere che, come quest’ultima, la tabernantina diminuisce l'ampiezza e la frequenza delle escursioni respiratorie, che ha azione ipotensiva e diminuisce l’ipertensione riflessa prodotta dall’occlusione delle carotidi, che aumenta l’ipertensione adrenalinica e, infine, che sembra prolungare l’azione ipotensiva dell’acetilcolina.
Questo alcaloide secondario sembra dunque a
L'estratto acquoso del pericarpo non ha invece dimostrato un’azione netta, mentre l’estratto acquoso dei semi che, come l’ibogaina, rinforza notevolmente l’azione ipertensiva dell’adrenalina, aumenta invece anche l'ipertensione prodotta dall’occlusione delle carotidi.
Lo studio degli effetti tonici della droga sull'animale, ha rivelato fenomeni molto complessi che, secondo l'A., non possono essere completamente spiegati nè dai risultati delle sue ricerche, nè da quelle eseguite dagli Autori precedentemente citati. Paris e Vairel (55) hanno studiato le modificazioni prodotte dall’iboga e dall’ibogaina sull'eccitabilità muscolare determinando la cronassia del preparato neuro-muscolare (sciatico-gastrocnemio) di rana.
I risultati di queste indagini dimostrano che nè l'infuso di radice di iboga all’1 %, nè la tintura 1:20 (dopo evaporazione dell’alcool), nè l’ibogaina in soluzione all’1:500, modificano la cronassia del nervo mentre abbassano quella del muscolo. Date le relazioni esistenti fra la cronassia e lo stato di imbibizione del muscolo, gli AA, hanno studiato le modificazioni dell'imbibizione ed hanno trovato che l’ibogaina non aumenta l’imbibizione quando il muscolo si trova immerso in una soluzione isotonica, mentre l’aumenta quando la soluzione è ipotonica.
L’iboga e l'ibogaina, almeno in certe condizioni (piccole dosi e breve durata di contatto) si avvicinano, secondo gli AA. ai veleni, quali l’eserina, la pilocarpina ecc., che diminuiscono la cronassia muscolare e agiscono sui gliodi facilitando la penetrazione dell'acqua. Essi hanno un’azione diretta sul muscolo al quale permettono di contrarsi anche con eccitazioni molto deboli e ciò potrebbe spiegare secondo gli AA., l’azione tonica dell’iboga e del suo alcaloide principale.
Gli AA. hanno quindi osservato che l’ibogaina provoca la paralisi della rana ed hanno determinato la dose che abolisce il riflesso di ritorno, la quale è risultata essere molto elevata, e pari cioè a 35 mg/kg. Nel coniglio si ottenne una risoluzione muscolare con paralisi del treno posteriore e caduta della testa con una dose di 4-5 mg/kg endovena.
La DL50 per via sottocutanea nel topo, è stata trovata dagli AA. uguale a 275 mg/kg e a 82 mg/kg nella cavia, la quale si è dimostrata più sensibile del topo all’azione tossica dell’ibogaina.
Le indagini sull’azione cardiovascolare dell’ibogaina vennero più tardi riprese da Schneider e Rinehart (56) i quali sperimentando su gatti e su cani in anestesia, hanno trovato che l’effetto ipotensivo prodotto dall’ibogaina è indipendente dal sistema nervoso centrale, potendosi esso osservare anche negli animali spinali (gatti) con ipertensione sperimentalmente indotta.
Nel determinismo di tale azione sono da escludere secondo gli AA., effetti bloccanti gangliari o adrenergici.
Sui vasi di arti isolati e perfusi di gatto, l’ibogaina non determina vasodilatazione alla concentrazione di 10-5 ma il flusso ematico viene aumentato alla concentrazione di 10-4.
Sul cuore isolato di gatto l’ibogaina alla concentrazione di 3×10-6 nel liquido di perfusione, determina bradicardia e diminuisce l’ampiezza delle contrazioni e del flusso coronarico, e ciò concorda coi risultati di esperienze eseguite sul preparato cuore-polmone di cane, in cui si è notato un rallentamento del ritmo cardiaco seguire all'iniezione di una singola dose di 1 mg.
Questi risultati sono stati ulteriormente confermati studiando, nel cane, le modificazioni del volume/minuto, il quale è diminuito dall'ibogaina, ma senza che compaiano variazioni significative della resistenza periferica totale.
Gli AA. ritengono che l'ipotensione provocata dall’ibogaina nel cane, in anestesia, sia principalmente dovuta ad un'azione cardiaca diretta.
Nel cane non anestetizzato, essi hanno osservato invece un aumento della pressione, seguire all’azione dell'ibogaina, fatto questo di cui gli stessi AA. hanno successivamente indagato l'origine eseguendo un'analisi farmacologica della sua azione cardiovascolare. I risultati di queste ricerche dimostrano che l'ibogaina ha azioni cronotropa e inotropa negative sul cuore isolato di gatto e che la caduta della pressione che segue alla somministrazione endovenosa dell’alcaloide nei cani anestetizzati, è in gran parte dovuta alla riduzione del flusso coronarico.
L'aumento della pressione arteriosa notato nei cani non anestetizzati è considerato dagli AA. come un effetto differenziale fra l'azione inibitrice diretta sul cuore e la componente stimolante centrale. Schneider e Mc Arthur (57) hanno constatato che l'ibogaina aumenta la tossicità della morfina nel topo e ne potenzia l’azione analgesica.
L'azione analgesica dell'aminopirina non viene invece influenzata dalla ibogaina neppure impiegando dosi molto elevate. Lo stesso effetto potenziante dell'azione analgesica della morfina da parte dell'ibogaina era già stato constatato da Stephen (58) nell’uomo e venne in seguito confermato da Salmoiraghi e Page (59) i quali trovarono che essa aumenta anche il sinergismo esistente fra serotonina e barbiturici.
Poichè l'ibogaina, alla stessa dose, non produce analgesia, una semplice azione addittiva è esclusa dagli AA. i quali pertanto, suppongono che essa interferisca con un processo metabolico coinvolto nel meccanismo della azione analgesica della morfina e ritengono che esista un punto di attacco comune alle due sostanze.
Salmoiraghi e Page ricordano che secondo diversi autori, la morfina inibisce marcatamente l'attività della colinesterasi e che Slaughter e Nùnsell (60) trovarono in più, che l’azione analgesica della morfina può essere aumentata dalla neostigmina. Analogamente, secondo Vincent e Sèro (51, 52), l'ibogaina inibisce la colinesterasi ed è stato dimostrato che essa determina fenomeni di eccitazione cerebrale.
Ammesso che l'inibizione colinesterasica prodotta dalla morfina sia legata al suo effetto analgesico, l’azione di entrambe le sostanze sullo stesso enzima, può offrire, secondo gli AA. una spiegazione dell'azione potenziante dell'ibogaina sull'attività analgesica della morfina da essi descritta.
Schneider e Sigg (61), in conisderazione del fatto che l'ibogaina è un alcaloide indolico dotato di nette proprietà stimolanti centrali, ritennero necessario indagare le sue attività neurofisiologica e neurofarmacologica, in relazione specialmente alla sua possibile attività frenotropica.
Essi hanno osservato che con dosi elevate l'effetto eccitante dell'ibogaina, è accompagnato negli animali da esperimento, da reazioni di apprensione e di paura; essi desiderano sfuggire dalla situazione che li spaventa ma non essendo in grado di evitarla, la loro reazione dominante consiste nell’aggredire un nemico reale o immaginario. Con dosi più elevate si nota regolarmente atassia.
I risultati di ricerche ECgrafiche dimostrano che un punto di attacco dell'ibogaina si trova nel sistema reticolare ascendente, la cui stimolazione produce una sindrome eccitante [(Magoun (62)].
I risultati di studi sui riflessi eseguiti dagli AA., escludono una componente stricnosimile nel meccanismo d'azione dell'ibogaina. Essa può essere anzi compresa in un gruppo di stimolanti centrali che possiedono deboli ma precise proprietà anticonvulsivanti e, analogamente ad alcuni stimolanti ed eccitanti centrali studiati da Everett e coll. (63) e da Toman e coll. (64), aumenta anch'essa, nonostante la sua azione stimolante centrale, la soglia dell'elettroshock e ne prolunga il periodo di latenza nel topo.
Per la sua azione sulle funzioni psichiche, l'ibogaina rientra nel gruppo delle sostanze psicodislettiche derivate dall'indolo, insieme con la dietilamide dell’acido lisergico (LSD), la mescalina, la psilocibina, la bufotenina, l'armalina, le sostanze derivate dall'acido lisergico contenute nell’Ouliqui, la serotonina e l'adrenocromo.
I psicodislettici derivati dall'indolo, in considerazione della loro parentela chimica con le amine biogene (serotonina, adrenalina e loro metaboliti), risultano particolarmente interessanti, non solo sotto l'aspetto farmacologico e terapeutico, ma anche per lo studio della patogenesi di alcune psicosi e psiconeurosi (e della schizofrenia in particolare).
Fra queste sostanze derivate dall'indolo, la più nota e importante sotto ogni aspetto, è indubbiamente la LSD (vedi Segale cornuta), la quale è anche la più studiata e quella più estesamente impiegata sia sperimentalmente che in terapia.
Tutte le altre sostanze appartenenti a questo gruppo, compresa l'ibogaina, sono dotate di un'azione qualitativamente simile a quella della LSD ma quantitativamente molto inferiore.
Le dosi della LSD capaci di produrre effetti psicodislettici sono infatti, come già detto, dell'ordine di quelle delle amine biogene e cioè di 0,5-1 g/kg nell'uomo, mentre per ottenere effetti comparabili con le altre sostanze occorrono dosi molto superiori.
L'azione psicodislettica dell’ibogaina è infatti molto debole e non risulta che nè questo alcaloide, nè la droga che lo contiene abbiano trovato applicazioni terapeutiche sotto questo aspetto.
Le nostre conoscenze sull'azione psicodislettica dell’iboga derivano dalle prime descrizioni dei suoi effetti osservati negli indigeni del Congo e del Gabon, ottenuti con l'uso della droga nelle condizioni descritte e dalle esperienze eseguite sugli animali da Phisalix (38), da Lambert (40) e da altri che osservarono la sua azione eccitante nei cani e da quelle più recenti di Schneider e Sigg (61) i quali osservarono nei gatti, uno stato ansioso e di falsa rabbia e, sembra, allucinazioni visive accompagnate dalle corrispondenti alterazioni ECgrafiche e dai caratteristici effetti neurovegetativi.
Più recentemente Quevauviller e Blaupin (65) hanno studiato comparativamente l’azione farmacologica dell’ibogaina e degli alcaloidi totali della Tabernanthe. Dal complesso delle indagini da essi eseguite, risulta che gli alcaloidi totali sono dotati di proprietà farmacologiche simili ma non identiche a quelle dell’ibogaina.
Lo studio della tossicità dell'ibogaina e degli alcaloidi totali eseguito sui topi per somministrazione endovenosa e sulle cavie per perfusione endovenosa lenta, ha dimostrato che non esistono differenze notevoli fra la tossicità dell’ibogaina e quella relativa agli alcaloidi totali. Gli AA. non escludono tuttavia la presenza, accanto all’ibogaina, di un alcaloide più tossico e ciò in considerazione del fatto che le dosi tossiche trovate per gli alcaloidi totali sono leggermente inferiori a quelle trovate per l’ibogaina, la quale entra nelle proporzioni del 15 % nella composizione del complesso alcaloidico.
L’attività sul sistema nervoso centrale pur essendo globalmente la stessa, sembra essere dovuta ad un’azione che si esercita su punti di attacco diversi.
Infatti, mentre l’ibogaina è nello stesso tempo inibitrice degli effetti depressori centrali e eccitante dei centri inferiori, gli alcaloidi totali eccitano essenzialmente la corteccia e la formazione reticolare.
Come antagonisti degli effetti beta dell’adrenalina, l’ibogaina e gli alcaloidi totali, rinforzano l’azione ipertensiva di questo mediatore, mentre per la loro proprietà di deprimere il miocardio e per i loro effetti anestetici locali su certe fibre nervose, essi appaiono come leggeri ipotensori.
Per quanto riguarda l'azione anestetica, l’ibogaina, come gli alcaloidi totali, possiede un’attività anestetica locale di superfìcie, sulla cornea di coniglio, dello stesso ordine di grandezza di quello del cloridrato di cocaina, impiegato alla stessa concentrazione.
L’azione anestetica locale d’infiltrazione è stata studiata comparativamente con la procaina e i risultati ottenuti dimostrano che tanto l’ibogaina, quanto gli alcaloidi totali, sono capaci di produrre un’anestesia d’infiltrazione la cui intensità è leggermente inferiore a quella dovuta alla procaina, l’azione della quale si avvicina di più a quella degli alcaloidi totali.
L’ibogaina, per quanto riguarda l'azione anestetica locale, porta rapidamente all’assuefazione mentre ciò non sembra avvenire con gli alcaloidi totali, per i quali si può osservare, al massimo, una leggera attenuazione di attività.
L’effetto che si osserva al 10° giorno appare comunque, identico a quello prodotto dalla prima istillazione.
Chen e Bohner (66) trovarono che l’ibogaina, analogamente ad altre sostanze che agiscono sul sistema nervoso centrale, si è dimostrata capace di inibire, nei topi, il movimento tonico estensivo di presa determinato elettricamente o mediante pentilentetrazolo, ma non allorché esso venga determinato da stricnina o da caffeina.
Zetler e Unna (67), i quali hanno studiato l’azione dell’ibogaina comparativamente con quella degli alcaloidi della Voacanga, hanno concluso che mentre esiste fra essi una quasi perfetta analogia chimica, differiscono invece notevolmente dal punto di vista della loro attività farmacologica.
Più recentemente Long e Lessin (68) notarono che l’ibogaina, analogamente a numerose altre basi organiche, è capace di inibire, in vitro, la captazione della serotonina da parte delle piastrine del sangue.
Estratti e preparati vari
Estratto secco idroalcoolico titolato all'8% di alcaloidi.
Dosi: g 0,1-0,3 pro die.
Preparazioni usuali e formule galeniche
——
BIBLIOGRAFIA
(1) DYBOWSKl e LANDRIN, Compt, rend., 133, 748. 1901; Chem. Zbi, II, 1352, 1901 – (2) HALLER e HECKEL, Compì, rend., 133, 850, 1901; Chem. Zbl, II, 126, 1902 – <3) BURCKHARDT C. A., GOUTAREL R„ JANOT M. M. e SCHLIITLER E., Helv. Chim. Aera, 35 , 642, 1952 – (4) GOUTAREL R., PERCHERON F. e JANOT M. M„ Compì, rend., 246, 279, 1958 – (5) DELOURME-HOUDE, Ann. pharm. franf., 4 , 30, 19 46- (6) NEUSS N., 1. Org. Chem., 24, 2047, 1959 – (7) DICKEL D. F„ HOLDEN, MAXFIELD R. C„ PASZEK L. E. e TAYLOR W. I., J. Am. Chem. Soc., SO, 123, 1958 – (8) GOUTAREL R. e JANOT M. M, Ann. pharm. franf., 11, 272, 1953 – (9) JANOT M. M., GOUTAREL R. e SNEEDEN R. P. A., Helv. Chim. Acla, 34, 1205, 1951 – (10) SCHLITTLER E., BURCKHARDT C. A. e GELLERT E., ìbìd., 36, 1337, 1953 – (11) GOUTAREL R„ JANOT M. M., MATHYS F. e PRELOG V,, Compì, rend., 237, 1718, 1953; Chem. Zbl, 7215, 1955 – (12) TAYLOR W. L, 1. Am. Chem. Soc., 79. 3298. 1957 – (13) BARTLETT M. F„ DICKEL D. F. e TAYLOR W. I., Ibid., SO, 126, 1958 – (14) BIEMANN K. e FRIEDMANN-SPITELLER M., ibid., S3, 4805, 1961 – (15) GORMAN M., NEUSS N„ CONE N. J. e DEYRUP J. A., ibid., S2, 1142, 1960 – (16) WAITS F„ COLLERA O. e SANDOVAL A., Teirahedron, 2, 173, 1958; Chem. Abs., 52, 18479, 1958 – (17) GOUTAREL R„ JANOT M. M., MATHYS F. e PRELOG V., Helv. Chim. Acla, 39, 742, 1956 – (18) GOUTAREL R„ PERCHERON F„ WOHLFAHRT J. e JANOT M. M., Ann. pharm. franf., 15, 353, 1957 – (19) STAUFFACHER D. e SEEBECK E., Helv. Chim. Acla, 41, 169, 1958 – (20) RENNER U. e PRINS D. A, Experienlia, 15. 456, 1959 – (21) BIEMANN K. e FRIEDMANN-SPITELLER M„ Teirahedron Lellers, 68, 1961 – (22) RENNER U. e PRINS D. A., Brevetto Germ. 1,109.699 (Cl. 12 p), 7 agosto 1959; Chem. Abs., 56, 4878, 1962 – (23) RAYMOND- HAMET, Compì, rend., 229, 1359, 1949; Chem. Abs., 44, 3794, 1950 – (24) JANOT M, M. e GOUTAREL R., Compì, rend.. 240, 1800, 1955; Chem. Zbl, 7274, 1956 – (25) LA BARRE e GILLO, Bull Acad. roy. Méd. Belgigue, 20, 194, 1955; Chem. Zbl., 12909, 1956 – (26) JANOT M. M. e GOUTAREL R., Compì rend., 241, 986, 1955; Chem. Zbl, 4705, 1957 – (27) PERCHERON F., LE HIR A., GOUTAREL R. e JANOT M. M., Compì, rend., 245, 1141, 1957; Chem. Abs., 52. 5434, 1958 – (28) BARTLEIT M. F„ DICKEL D. F., MAXFIELD R. C., PASZEK L. E. e SMITH A. F„ J. Am. Chem. Soc., SI, 1932, 1959 – (29) MELA C., risultati inediti. Laboratori Inverni 4 Della Beffa, Milano – (30) GHIELMETTI G. e MELA C., Il farmaco, ed. prat., 14, 36, 1959 – (31) GOUTAREL R., Thése Doct, des Sciences, Paris, 1954 – (32) LANDRIN A., Bull Sci Pharmacol, 11, 319, 1905 – (33) LE ROY A., Disserl. Università di Basilea 1953 – (34) Anonimo, Nature 17S, 1153, 1956 – (35) AUBRY-LECOMTE, Arch. Med. Navale, 2, 264, 1864 – (36) BAILLON H., Bull Mens. Soc. Lìnnienne Paris, 1, 782, 1896 – (37) HALLER A. e HECKEL E., Compì rend., 133, 850, 1901 – (38) PHISALIX M. C., C. R. Soc. Biol, 53, 1077, 1901 –
(39) LAMBERT M. e HECKEL E., Compì rend., 133, 1236, 1901 – (40) LAMBERT M., C. R. Soc. Biol, 53, 1096, 1901 – (41) LAMBERT M., Afeli. Ini Pharmacodyn el Thér., 10, 101, 1902 – (42) POUCHET G. e CHEVALIER J., Bull Cen. de Thér., 149, 211, 1905 e Les Nouveaui remèdes, 21, 97, 1905 – (43) LANDRIN A., Thàse Doct. méd. Paris 1905 – (44) KUBORN, Cenir. Baklerlol. Parasinienk., 31, 562, 1902 – (45) HUCHARD H., cit. da POUCHETE e CHEVALIER in (42) – (46) ROTHLIN E. e RAYMOND-HAMET, C.R. Soc. Biol, 116, 1340, 1934 – (47) ROTHLIN E. e RAYMOND-HAMET, ibid., 127, 592, 1938 – (48) RAYMOND-HAMET e ROTHLIN E., Ardi, ini Pharmacodyn el Thér., 63, 27, 1939 – (49) RAYMOND-HAMET, C. R. Soc. Biol, 135, 176, 1941 – (50) RAYMOND-HAMET, ibid., 133, 426, 1940 – (51) VINCENT D. e SERO I., Bull Soc. Biol, 24, 1325, 1942 – (52) SERO I., Thèse Doct. Pharm., Tolouse 1944 – (53) RAYMOND-HAMET e VINCENT D., C. R. Soc. Biol, 154, 2223, 1960 – (54) DELOURME-HOUDE J., Elude de Iboga, Tabernanthe iboga H. Thése Fac. de Pharm. Paris, anc.ne Imprim. de la cour d'appel, Paris 1944 – (55) PARIS R. e VAIREL C,, Compì rend., 22S, 436, 1949 – (56) SCHNEIDER J. A. e RINEHART R. K., Ardi. Ini Pharmacodyn. el Thér., 110, 92, 1957 – (57) SCHNEIDER J. A. e MC ARTHUR M., Experienlia, 12, 323, 1956 – (58) STEPHEN R., cit. da SCHNEIDER e MC ARTHUR, ibid. – (59) SALMOIRAGHI G. C. e PAGE J. H., J. Pharm. Exp. Ther.. 120, 20, 1957 – (60) SLAUGHTER D. e NUNSELL D. W., J. Pharmacol Exp. Ther., 6S, 104, 1940 – (61) SCHNEIDER J. A. e SIGG E. B., Ann. N.Y. Acad. Sci., 66, 765, 1957 – (62) MAGOUN H. W., Physiol Revs., 30, 459, 1950 – (63) EVERETJ G. M., TOMAN J. E. P. e SMIT A. H. Jr., Federai. Proc., 14, 337, 1955 – (64) TOMAN J. E. P., EVERETT G. M. e SMITH A. H, Jr., Ibid., 14, 391, 1955 –
(65) QUEVAUVILLER A. e BLAUPIN O,, Semaine Hàp. Paris {Semaine Thérapeulique), 36, 23, 1960 –
(66) CHEN G. e BOHNER R., J. Pharm. expll Ther., 123, 212, 1958 – (67) ZETLER G. e UNNA K. R., Ardi. exp. Palli u. Pharmakol, 236, 122, 1961 – (68) LONG R. F. e LESSIN A. W., Bioch. }., 82, 46, 1962.


