Osteonecrosi dei mascellari da Bifosfonati
L’attenzione sugli effetti collaterali delle terapie croniche a base di bifosfonati da parte dei clinici e della comunità scientifica è cresciuta molto negli ultimi anni ed ha portato in primo piano una complicanza rara ma importante: l’osteonecrosi dei mascellari.
Da ricerche recenti è emerso che i bifosfonati sono tra i 20 farmaci più prescritti al mondo.
Questi infatti ricoprono il ruolo di terapia d’elezione nel trattamento e/o nella prevenzione di diverse patologie, quali il mieloma multiplo, l’ipercalcemia maligna (tumor-induced), di alcuni tumori solidi, delle metastasi ossee, nonché dell’osteoporosi e di alcuni disordini ossei, quali il morbo di Paget e l’osteogenesi imperfetta.
l’ osteonecrosi dei mascellari provocata dall’uso dei bifosfonati è un’importante complicanza a medio e lungo termine, riscontrata originariamente solo nei pazienti oncologici che assumevano i bifosfonati per via parenterale, ma ritrovata recentemente anche in quelli trattati con il farmaco per via orale.
Tuttavia, a causa della recente introduzione di questi farmaci nella farmacopea mondiale, i dati epidemiologici sull’ osteonecrosi dei mascellari da bifosfonati sono ancora pochi.
Ad oggi, oltre alla somministrazione parenterale, anche la dose di farmaco cumulata nel tempo si configura come un fattore importante di rischio per lo sviluppo di danni orali.
A questi vanno sommati diversi fattori predisponenti, tra cui hanno maggiore frequenza per lo sviluppo di lesioni osteonecrotiche dei mascellari un’anamnesi positiva per procedure di chirurgia orale, traumi dentali, oppure traumatismi cronici indotti da manufatti protesici.
Benché l’incidenza di questa patologia sia attualmente relativamente bassa, se confrontata col grandissimo numero di pazienti curati con successo con i bifosfonati, essa non deve essere trascurata soprattutto perché il controllo dell’ osteonecrosi è spesso difficile e non codificabile a causa delle lesioni estese ed inveterate.
Al riguardo, molti protocolli sono stati proposti, concentrati maggiormente sulla prevenzione della comparsa delle lesioni orali e sul trattamento dei pazienti colpiti dall’ osteonecrosi, spesso già seriamente provati e sofferenti a causa della loro condizione sistemica di base.
I Bifosfonati
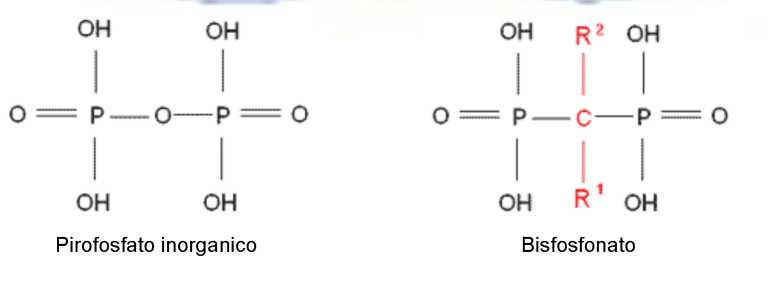
I bifosfonati sono analoghi strutturali del pirofosfato inorganico.
Avendo sostituito l’atomo di ossigeno nell’asse principale della molecola con un atomo di carbonio (formazione del legame P-C-P), i bifosfonati sono resistenti alla scissione idrolitica da parte delle pirofosfatasi dell’organismo.
Caratteristica di queste molecole è la presenza di due catene laterali, R1 e R2, che ne condizionano l’affinità, la potenza relativa e il profilo di tossicità.
La catena R1, tendenzialmente corta, partecipa al legame con la matrice ossea mineralizzata, mentre la catena R2 è alla base delle proprietà biologiche dei bifosfonati e varia considerevolmente da composto a composto (Figura 1).
I bifosfonati furono sintetizzati per la prima volta negli anni ’60 e grazie all’aggiunta di catene laterali al nucleo centrale sono stati successivamente realizzati composti farmacologicamente più attivi, tutti con forte affinità per il tessuto osseo.
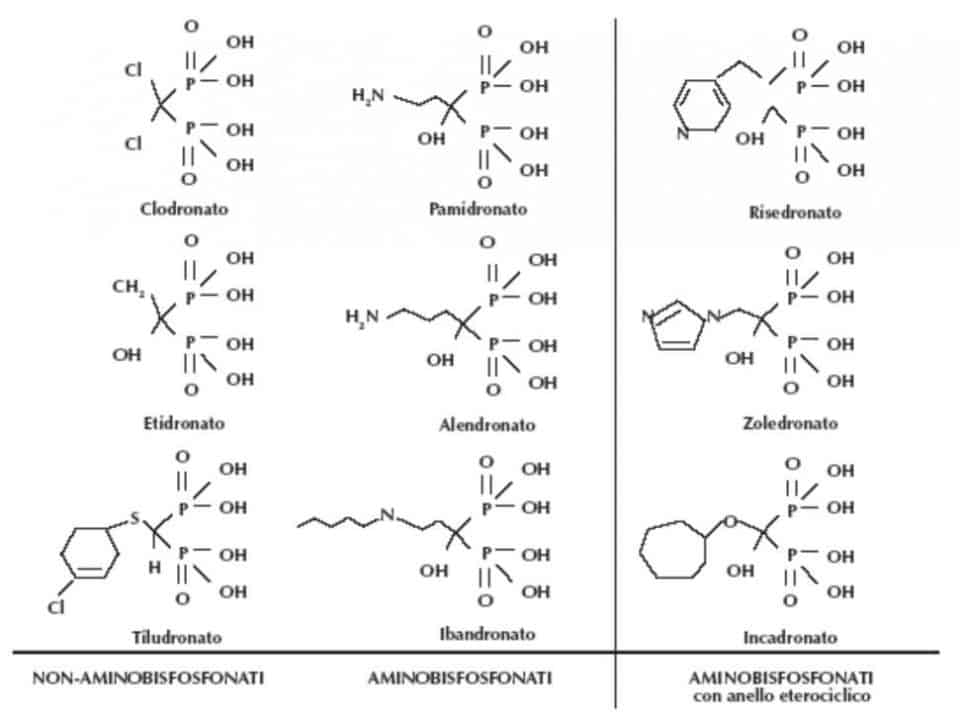
Dal punto di vista chimico, i bifosfonati si dividono in non-amino bifosfonati (bifosfonati di prima generazione) ed amino-bifosfonati (bifosfonati di seconda generazione) a seconda della presenza o meno di un atomo di azoto nella formula di struttura (Tabella 1).
La sostituzione della catena laterale azotata sull’atomo di carbonio centrale della catena incrementa la potenza e probabilmente la tossicità.
I bifosfonati di I generazione, come l’Etidronato ed il Clodronato, con struttura molecolare molto somigliante a quella del pirofosfato, sono metabolizzati all’interno degli osteoclasti e di tutte le cellule che provengono dalla stessa linea cellulare (monociti, macrofagi) e trasformati in un analogo non idrolizzabile dell’ATP, che, dopo essere stato incorporato, provoca un deficit energetico che porta alla morte immediata delle suddette cellule.
Invece gli amino-bifosfonati agiscono sulla via del mevalonato, inibendone l’enzima chiave, la farnesil-pirofosfato sintetasi che catalizza la biosintesi del colesterolo a partire dal mevalonato stesso, andando a produrre dei derivati isoprenilici che causano la mancata prenilazione post-traduzionale di varie classi di proteine GTP-asi dipendenti (Ras, Rac, Rho ecc.), le quali hanno un ruolo fondamentale nel mantenimento del ciclo cellulare.
Esse infatti svolgono il loro compito sulla trasduzione dei segnali intercellulari, sulla morfologia e sulla proliferazione cellulare, indispensabili per il corretto funzionamento e la sopravvivenza della cellula osteoclastica.
L’inibizione di questo meccanismo provoca un’alterazione del citoscheletro dell’osteoclasta che gli impedisce di formare il “ruffled border” (orletto a spazzola), ed ha come effetto finale una sua più rapida apoptosi.
Gli amino-bifosfonati sono più potenti e maggiormente selettivi dei bifosfonati di prima generazione e sono in grado d’inibire l’angiogenesi e la proliferazione delle cellule tumorali sia in vivo che in vitro.
Tra gli amino-bifosfonati, l’acido pamidronico e l’acido zoledronico si sono dimostrati i più efficaci, sia da studi in vitro che dal punto di vista terapeutico, per la cura delle metastasi ossee e dell’ ipercalcemia neoplastica; tuttavia, siccome si registra la maggiore percentuale d’incidenza e la più rapida insorgenza delle lesioni osteonecrotiche dopo l’assunzione di Zoledronato, oggi si preferisce indicare il Pamidronato come bifosfonato di prima scelta al posto dello Zoledronato, anche se quest’ultimo è ancora il più prescritto.
Dalle caratteristiche molecolari dipendono le caratteristiche cliniche, come il loro accumulo nel tessuto osseo e la lunga emivita, alla base tra l’altro degli effetti collaterali di tali sostanze.
Tabella 1: principali molecole di bifosfonati classificati per struttura chimica ed indicazione del principale metodo di somministrazione
- I Generazione
- Clodronato (somministrazione per via endovensa/intramuscolare)
- Etidronato (somministrazione per via orale)
- II Generazione
- Alendronato (somministrazione per via orale)
- Neridronato (somministrazione per via endovensa/intramuscolare)
- Pamidronato (somministrazione per via endovensa/intramuscolare)
- Ibandronato (somministrazione per via orale)
- Risedronato (somministrazione per via endovensa/intramuscolare)
- Zoledronato (somministrazione per via endovensa/intramuscolare)
Figura 2: molecole di sintesi derivate dal bifosfonato
Farmacocinetica dei bifosfonati
In generale, i bifosfonati non vengono assorbiti molto nell’uomo per via della loro scarsa lipofilia.
L’assorbimento ha luogo nel tratto gastrointestinale, soprattutto nel duodeno, ed è dose-dipendente.
Una volta assorbiti, si legano alle proteine plasmatiche, soprattutto all’albumina, essendo completamente ionizzati a pH=7. Il legame tra la molecola e le proteine plasmatiche subisce una forte influenza dal pH e dalla presenza di calcio.
Infatti, il calcio, contenuto nel latte e nei suoi derivati, forma chelati insolubili con i bifosfonati, ed altri alimenti, quali succhi di frutta, cibi ricchi di ferro, caffè, etc, ostacolano l’assorbimento della molecola nel tratto gastro-intestinale: per tali ragioni si consiglia di assumere questi farmaci a stomaco vuoto.
La somministrazione endovenosa e quella intramuscolare garantiscono una biodisponibilità del 100%, per cui si raggiunge rapidamente una dose elevata.
Per questo motivo tali vie si sono dimostrate più efficaci nella terapia delle ipercalcemie secondarie a metastasi scheletriche di neoplasie solide e neoplasie dell’apparato emopoietico.
L’assunzione orale dei bifosfonati rende una bassa biodisponibilità che varia anche da individuo a individuo.
I bifosfonati somministrati per via orale sono assorbiti in minima parte, ossia solo per circa lo 0,5-2%; questa bassissima quota ha inoltre una breve emivita.
Dopo 12-24 ore infatti, solo il 20-50% di essa è captata dall’osso, il resto viene rapidamente eliminato con le urine.
Per questi motivi la via orale è la più usata nella terapia dell’osteoporosi postmenopausale, laddove dosi più basse del farmaco sono sufficienti a controllarne il turn over osseo e ad evitare le complicanze scheletriche.
Dopo la somministrazione, i bifosfonati si allontanano velocemente dal plasma; la molecola si lega fortemente all’idrossiapatite ossea e viene rilasciata di nuovo quando il tessuto osseo è riassorbito.
I bifosfonati rilasciati durante il rimodellamento osseo possono essere farmacologicamente attivi.
La quantità di farmaco rilasciata ogni giorno in questa maniera dopo 10 anni di terapia è stimata di circa il 25% di quella assorbita.
Nel tessuto osseo la distribuzione dei bifosfonati non è omogenea e si pensa sia da correlare alla maggiore o minore esposizione dell’idrossiapatite nei siti in cui si ha riassorbimento osseo.
Ciò spiegherebbe la maggiore concentrazione dei bifosfonati a livelli delle ossa spugnose, delle estremità articolari e delle ossa mascellari.
La parte di farmaco assunto che non si lega al tessuto osseo è invece eliminata senza subire modifiche per via renale.
L’escrezione si svolge attraverso le vie comuni di eliminazione renale e non tramite traportatori renali cationici-anionici.
Gli effetti dei bifosfonati sul riassorbimento osseo possono essere considerati a tre livelli: tissutale, cellulare e molecolare.
A livello tissutale l’azione di tutti i bifosfonati attivi sembra essere simile e consiste in una riduzione del turn over osseo.
Ciò è dimostrato da un abbassamento sia del riassorbimento che della formazione dell’osso, come osservato grazie a marcatori biochimici.
A livello cellulare, c’è un accordo generale nel considerare l’osteoclasta come il bersaglio finale dell’azione dei bifosfonati.
I bifosfonati potrebbero ridurre il riassorbimento attraverso l’inibizione del reclutamento osteoclastico, l’inibizione dell’attività osteoclastica, riduzione della vita media dell’osteoclasta, alterazione dell’idrossiapatite ossea tale da causarne, attraverso un processo puramente fisiochimico e non cellulare, il tasso di dissoluzione.
A livello molecolare, l’azione dei bifosfonati, atti a determinare un’inattivazione o una diminuita formazione degli osteoclasti, non è stata completamente chiarita, sebbene sia probabile che la molecola leghi un recettore della superficie cellullare o interagisca con un enzima il cui effetto si manifesta sul metabolismo cellulare.
Bifosfonati e loro applicazioni cliniche
I bifosfonati costituiscono la terapia d’elezione nel trattamento e/o nella prevenzione di diverse malattie, quali il mieloma multiplo, l’ipercalcemia maligna (tumor-induced), di alcuni tumori solidi (carcinoma prostatico, carcinoma mammario), delle metastasi ossee, nonché dell’osteoporosi e di alcuni disordini ossei, quali il morbo di Paget e l’osteogenesi imperfetta.
L’uso di questi farmaci porta dei risultati positivi ben evidenti, come la prevenzione di ulteriori danni ossei, la diminuzione del dolore e, quindi, del bisogno di antidolorifici, e la riduzione di fratture patologiche, nonché la riduzione della necessità di effettuare trattamenti radioterapici su segmenti scheletrici ed il trattamento delle ipercalcemie maligne.
Nella cura delle malattie scheletriche di tipo benigno, come l’osteoporosi e il morbo di Paget, i bifosfonati sono usati soprattutto per via orale con dosaggi bassi e prolungati; in ambito oncologico, invece, per la cura delle metastasi ossee, siccome servono dosi di farmaco molto più elevate, si ricorre quasi esclusivamente alla somministrazione per via endovenosa piuttosto ravvicinata nel tempo, al fine di raggiungere in poco tempo alte concentrazioni scheletriche.
Inoltre, l’aderenza alla terapia è più elevata nel paziente oncologico rispetto a quella del paziente con osteoporosi.
L’Alendronato, il risendronato e l’Ibandronato sono comunemente somministrati per via enterale nelle donne in post-menopausa per la cura dell’osteoporosi e dell’osteopenia, mentre il Pamidronato e lo Zoledronato sono specificamente indicati nella prevenzione delle complicanze ossee e nella cura dell’ipercalcemia maligna associata a mieloma multiplo o a metastasi ossee.
I bifosfonati orali, come l’Etidronato ed il tiludronato sono di elezione per la terapia del morbo di Paget, in fase attiva.
L’Ibandronato è usato, invece, per la cura dell’osteoporosi e dell’osteopenia.
Il Pamidronato non è ancora stato approvato per la cura infantile di osteogenesi imperfecta grave, displasia fibrosa, osteoporosi, malattia di Gaucher, osteoporosi da corticosteroidi, per la prevenzione di metastasi ematiche negli adulti e per ridurre la progressione della perdita di supporto osseo nelle donne in gravidanza.
Per quanto riguarda le metastasi ossee, infatti, questi farmaci inibiscono l’attività osteoclastica e fermano l’aumento delle dimensioni tumorali ed accrescono la sopravvivenza e la qualità di vita dei malati.
Per quanto riguarda l’ipercalcemia, l’acido zoledronico è capace di abbassare i valori calcemici entro i livelli fisiologici di 8,5-11,5 mg/dL in 24 ore.
Anche nel morbo di Paget si vede l’azione antiriassorbimento e ipocalcemizzante, e aumenti della densità ossea sono stati ritrovati nel trattamento dell’osteoporosi con Alendronato.
Osteonecrosi dei mascellari indotte dai bifosfonati
La prima descrizione di una problematica odontoiatrica in una paziente in terapia con bifosfonati è stata riportata nel 1995.
Tra le possibili complicanze dell’assunzione cronica dei bifosfonati, la comparsa di osteonecrosi dei mascellari è stata ampiamente riferita in letteratura, particolarmente dopo somministrazione per via sistemica, per il trattamento dell’ipercalcemia maligna e per la prevenzione delle fratture patologiche in soggetti a rischio, con metastasi ossee o mieloma multiplo.
L’ osteonecrosi dei mascellari è descritta come una patologia infettiva e necrotizzante a carattere progressivo con poca tendenza alla guarigione, associata solo recentemente alla terapia con bifosfonati.
Studi riferiscono come l’incidenza dell’ osteonecrosi dei mascellari da bifosfonati somministrati per via endovenosa vari dallo 0,8% all’1,2%, in assenza di fattori di rischio locali, fino a raggiungere il 9% qualora si siano eseguite estrazioni dentarie in corso o alla fine della terapia con il farmaco.
È stato provato che un dosaggio di 4 mg al mese di Zoledronato, può provocare osteonecrosi ed esposizione ossea entro 6-12 mesi, mentre un dosaggio di 90 mg al mese di Pamidronato, a somministrazione regolare, può portare a esposizione ossea in 10-16 mesi.
Più recentemente, sono stati registrati casi di osteonecrosi dei mascellari anche in soggetti in trattamento con bifosfonati che prendevano il farmaco per via orale (per esempio con Alendronato o risendronato) per la cura e/o la prevenzione dell’osteoporosi.
In uno studio di Mavrokokki et al., l’incidenza dell’ osteonecrosi dei mascellari da bifosfonati orali varia dallo 0,01% allo 0,34%, anche dopo estrazioni dentarie; una dose di 70 mg/settimana di Alendronato somministrato per via endorale potrebbe portare ad esposizione ossea in almeno 3 anni.
Nonostante il rischio relativo sia minore, sia per la tipologia di farmaco che per la modalità di assunzione, il grande aumento di pazienti in terapia con bifosfonati orali per il trattamento dell’osteoporosi, motiva l’allarme sociale per le lesioni da osteonecrosi dei mascellari da bifosfonati.
I meccanismi patogenetici dell’ osteonecrosi dei mascellari non sono stati ancora completamente chiariti ed il management dei pazienti affetti è stato finora basato su linee guida cliniche scritte da opinionisti esperti e da analisi di case series.
Il processo attraverso il quale i bifosfonati causano la comparsa dell’ osteonecrosi dei mascellari sembrerebbe collegato alla netta riduzione del flusso ematico che avviene nel tessuto osseo.
Inoltre, il coinvolgimento preferenziale delle ossa mascellari nello sviluppo delle lesioni è dovuto all’elevato turn-over delle ossa mascellari e mandibolari, nonché alla peculiarità dell’ambiente orale, in quanto tali strutture risultano sempre esposte a traumatismi ed a possibili infezioni.
Nel 2005 Marx, in uno studio condotto su 119 pazienti, definiva come presunte cause di osteonecrosi le estrazioni dentarie (37,8%), la chirurgia parodontale ed endodontica (12%), gli interventi di implantologia (3,4%), e individuava un rapporto con le parodontopatie nel 28,6% dei casi.
Nonostante il conclamato rapporto patogenetico tra interventi di chirurgia orale e osteonecrosi da bifosfonati, sono stati evidenziati molti casi a insorgenza spontanea o idiopatica; studi più recenti registrano una percentuale più elevata di queste forme di osteonecrosi, dal 25-30% a oltre il 40%.
In tali forme non legate a terapia odontoiatrica non è chiaro il ruolo che svolgono gli altri fattori, locali o sistemici, nello scatenare, promuovere o far progredire la patologia ossea.
In alcuni casi si riscontrano differenti patologie odontostomatologiche quali lesioni parodontali, carie, ascessi odontogeni, trattamenti endodontici incompleti, ed è inoltre da far notare la presenza di tori palatini e mandibolari; l’ipotesi è che vi sarebbe un danno all’epitelio da bifosfonati che compromettendo la capacità di guarigione della mucosa orale ai traumi porterebbe ad un’infezione secondaria dell’osso spontanea che potrebbe essere dovuta a infezioni dento-parodontali reiterate.
Le lesioni osteonecrotiche dei mascellari possono perdurare in maniera asintomatica anche per settimane, mesi o anni, comparendo solo in seguito alla loro esposizione nella cavità orale, o avere inizio con imponente sintomatologia dolorosa.
Il passaggio da una condizione asintomatica alla comparsa della sintomatologia spesso è causata da sovrainfezione batterica o nel caso di un trauma subito dai tessuti molli.
l’ osteonecrosi può anche presentarsi con disturbi blandi, che il paziente frequentemente riconduce a dolenzie a carico della gengiva e della mucosa orale.
Segni e sintomi tipici, oltre all’esposizione di osso alveolare necrotico (giallo-grigio) a livello mandibolare e/o mascellare che non tende a guarire, includono la presenza di sequestri ossei e di deiscenze mucose che non cicatrizzano, ma tendono anzi a peggiorare, tumefazione dei tessuti molli e del volto, mobilità dentale con successiva perdita degli stessi elementi dentari, alterazioni della sensibilità, sotto forma di parestesie o disestesie, dolore alle ossa mascellari o dentale, spesso resistente ai comuni farmaci anti-infiammatori, sovrainfezioni batteriche ricorrenti o persistenti dei tessuti molli perilesionali, presenza di fistole intra- o extraorali drenanti pus, alitosi, difficoltà nella comune igiene orale, nell’alimentazione e nell’eloquio, calo ponderale, trisma reattivo dei muscoli masticatori, fratture patologiche.
Prevenzione e trattamento dell’osteonecrosi
A causa delle frequenti segnalazioni, è nata una grande sensibilizzazione verso l’osteonecrosi collegata alla terapia con bifosfonati, tuttavia restano non pochi dubbi al riguardo.
È stata pubblicata una serie di raccomandazioni, per lo specialista odontoiatra e maxillo-facciale, per gestire il paziente in cura con bifosfonati, che però presentano alcuni limiti.
Il primo di questi sta nel fatto che tutti i pazienti che per diverse indicazioni sono in terapia con bifosfonati vengono accomunati, in quanto non sempre sono gli stessi fattori di rischio che incidono sul paziente mielomatoso, oncologico o osteoporotico.
Il secondo limite consiste nella scarsità di evidenze scientifiche sull’argomento; alla base di tali argomentazioni sono pochi infatti gli studi longitudinali ed i trials randomizzati, mentre abbondano le opinioni dei singoli clinici e di gruppi di esperti.
Poiché ad oggi non esiste una terapia efficace contro l’ osteonecrosi dei mascellari da bifosfonati, che rimane quindi una malattia ad andamento peggiorativo e invalidante, è necessario attivare protocolli di prevenzione primaria, o effettuare uno screening sui pazienti sottoposti a terapia cronica con bifosfonati per poter intraprende una diagnosi precoce della patologia e prevenire le possibili complicazioni.
Prima di iniziare il trattamento con bifosfonati, i pazienti dovranno essere adeguatamente informati sui benefici della terapia e sulle potenziali complicanze collegate, inclusa la reale entità del rischio di osteonecrosi da bifosfonati; inoltre, essi dovrebbero essere sottoposti ad una visita odontoiatrica per valutare la salute orale, per pianificare un adeguato programma di prevenzione e l’eventuale trattamento di patologie locali.
I pazienti con patologia orale e/o coloro che per la patologia e/o la terapia in atto mostrano compromissione del sistema immunitario e/o maggior rischio infettivo, come chi è affetto da diabete mellito non controllato, sindrome da immunodeficienza acquisita o malattie ematologiche, chi è sottoposto a terapia immuno-soppressiva o corticosteroidea cronica, o chi fa abuso cronico do alcool o fumo, vanno considerati come a maggiore rischio di sviluppare osteonecrosi da bifosfonati.
In questi casi, il medico specialista e/o il medico di medicina generale, dovrebbero raccomandare una visita odontoiatrica ai propri assistiti che devono cominciare la terapia farmacologica.
L’odontoiatra prende in carico il paziente ed, in accordo con il medico specialista, identifica il trattamento terapeutico di cui necessita.
Nello specifico, nei pazienti trattati dal punto di vista odontostomatologico prima dell’inizio della terapia con bifosfonati, la prevenzione dell’ osteonecrosi dei mascellari si effettua eseguendo la terapia odontoiatrica (chirurgica e non) prima della somministrazione di questi farmaci.
Bisogna posticipare la terapia endovenosa di 2-3 mesi, consentendo all’odontoiatra di rimuovere i potenziali fattori di rischio per l’ osteonecrosi.
Nei pazienti con un buon controllo di placca, la terapia endovenosa può essere eseguita prima di questo tempo.
Per quanto riguarda i pazienti con scarsa igiene orale, è necessario dare priorità ai trattamenti di terapia parodontale non chirurgica ed a quelli di tipo conservativo-endodontici, per evitare l’esecuzione futura di estrazioni.
Bisogna, inoltre, fissare subito le estrazioni dei denti in inclusione parziale (inclusione mucosa) o di quelli con scarsa prognosi (denti con malattia parodontale severe o non recuperabili dal punto di vista conservativo-protesico).
La riabilitazione protesica non deve essere a supporto implantare per il rischio di rimodellamento osseo, che può avvenire per colpa della malattia, ma deve prevedere solo riabilitazioni con protesi fissa o mobile, anche rimuovendo i tori di grandi dimensioni.
Le protesi rimovibili, qualora già presenti, andrebbero modificate, sostituite o ribasate per prevenire e ridurre fenomeni di decubito o compressione meccanica dei tessuti orali.
In linea generale, la terapia con bifosfonati andrebbe posticipata fino a quando il paziente non raggiunge un adeguato stato di salute dento-parodontale.
Tuttavia, per i pazienti che necessitano di una terapia odontoiatrica non chirurgica, la somministrazione di bifosfonati può non essere differita.
Quest’ultima deve avere la priorità su qualsiasi cura odontoiatrica, informando il paziente del rischio che le lesioni ossee possano presentarsi nell’arco di sei mesi.
Nel caso di interventi chirurgici orali indispensabili per la cura dell’infezione e del dolore, l’odontoiatra valuta, in accordo con il medico specialista, il potenziale rischio di osteonecrosi, utilizza protocolli di trattamento specifici, utilizza tecniche che riducano al minimo il trauma locale dei tessuti, ed effettua un controllo postoperatorio frequente.
In tali pazienti è conveniente che la terapia con bifosfonati venga posticipata di almeno un mese e, comunque, fino al completo ristabilimento dell’integrità della mucosa gengivale sovrastante la breccia chirurgica; sono comunque sconsigliati interventi di implantologia orale; è necessario, inoltre, rendere meno traumatici i manufatti protesici rimovibili.
La scelta dell’iter preventivo e terapeutico di un paziente già in terapia con bifosfonati che non presenta lesioni osteonecrotiche dei mascellari comincia innanzitutto dalla sequenza classica: anamnesi, esame obiettivo e piano di trattamento.
Nell’anamnesi medica generale, ed in quella dentale specifica, è utile inserire domande chiave che permettano di riconoscere i pazienti a rischio per tale patologia, ed eventualmente le caratteristiche della sintomatologia che hanno spinto il paziente ad incontrare uno specialista.
Soprattutto per quanto riguarda il trattamento dei pazienti a cui i bifosfonati sono somministrati per via endovenosa è importante rilevare il nome del farmaco, l’indicazione, la via e la frequenza di somministrazione.
L’esame obiettivo, extra- ed intraorale, deve essere accurato e correlato di test ed esami radiografici appropriati, per evidenziare le situazioni che posso chiaramente suggerire la presenza di un’osteonecrosi o di un’osteomielite, come esposizione di osso, fistole di dubbia origine, alitosi, presenza di tumefazioni localizzate, dolore, disestesie o parestesie.
È di estrema importanza l’uso dei test di vitalità, che valutano lo stato infiammatorio dei tessuti periapicali (palpazione e percussione) e l’osservazione con mezzi d’ingrandimento di una valida radiografia endorale.
Utili sono pure le ortopantomografie (OPT), le tomografie assiali computerizzate (TC) o la RMN.
La visita di un paziente che assume bifosfonati per via endovenosa include la ricerca di aree di esposizione ossea con attenzione della corticale linguale posteriore del mascellare inferiore e non deve prescindere da un esame radiografico con OPT.
Questo esame mostra la presenza di masse osteolitiche, con attenzione al legamento parodontale, in cui si possono rilevare fenomeni di slargamento, sclerosi o perdita della lamina dura.
Alcune lesioni, poi, possono colpire le forcazioni dei molari inferiori.
Per organizzare un corretto piano di trattamento, bisogna innanzitutto cercare di avere un rapporto diretto con gli altri specialisti coinvolti nella gestione del paziente nell’ambito delle patologie che hanno portato alla necessità di iniziare una terapia con i bifosfonati.
Di fronte ad un paziente oncologico, il contatto con l’oncologo e l’ematologo che ha prescritto la terapia è utile, soprattutto se questo ha suggerito al paziente di sottoporsi ad una visita odontoiatrica prima di dare inizio alla terapia.
Se il paziente assume i bifosfonati per la cura dell’osteoporosi, il confronto con il medico di base si dimostra molto importante.
Infine, il rapporto con il chirurgo maxillo-facciale è inevitabile per il trattamento delle complicanze delle lesioni osteonecrotiche, quando già presenti.
Altro aspetto importante da considerare è la durata del trattamento con bifosfonati, dato che tali farmaci manifestano il fenomeno dell’accumulo nel tessuto osseo per via della lunga emivita.
Se la durata del trattamento mediante bifosfonati per via orale è inferiore ai 3 anni, ed in assenza di fattori di rischio locali e/o sistemici, bisogna raggiungere e mantenere un adeguato stato di salute dento-parodontale e di igiene orale.
In mancanza di lesioni clinicamente obiettivabili, il trattamento odontoiatrico deve essere assolutamente conservativo, evitando il più possibile qualunque forma di chirurgia.
Va quindi preferita la terapia parodontale non chirurgica, i trattamenti endodontici, lo splintaggio dei denti con elevata mobilità, l’eliminazione dei fattori di rischio locali (manufatti protesici o otturazioni incongrue, margini dentali appuntiti o taglienti), ed evitare l’uso di vasocostrittore associato all’anestetico locale.
La terapia parodontale va effettuata con scaling del tartaro sopragengivale, con la prescrizione di sciacqui a base di clorexidina 0,20%.
La terapia protesica prevede l’uso di protesi mobili da ribasare frequentemente per evitare decubiti.
Se è presente un elemento dentario con mobilità superiore al III grado con ascesso, e la sola terapia possibile è l’estrazione, essa va effettuata sotto adeguata copertura antibiotica.
Prima di ogni procedura invasiva che preveda manipolazione delle ossa mascellari, è consigliabile effettuare una consulenza specialistica con il medico che ha prescritto il farmaco, per valutare l’eventuale sospensione della terapia (3 mesi secondo Marx, sebbene non vi siano ad oggi prove scientifiche), o la prescrizione di una terapia sostitutiva.
È inoltre possibile effettuare la valutazione del CTX sierico come marker di valutazione del turn-over osseo.
Nel caso di peri-implantiti, la terapia non chirurgica deve essere preferita a quella chirurgica.
Se fosse necessario l’approccio chirurgico, si può eseguire una revisione chirurgica dei tessuti molli peri-implantari sotto copertura antibiotica (svolgendo, se necessario, un minimo rimodellamento dei contorni ossei).
Per evitare il rischio di sovrainfezioni batteriche, che spesso si presentano nei pazienti oncologici, bisogna prescrivere una terapia profilattica.
La profilassi si effettua con somministrazione di una dose di amoxicillina/acido clavulanico 1000 mg, eventualmente insieme a metronidazolo, da assumere a partire da 1-2 giorni prima della procedura odontoiatrica e da continuare per altri 7-10 giorni dopo la procedura.
Nei pazienti allergici alle penicilline si può prescrivere levofloxacina, da somministrare in dosi di 500 mg 1-2 ore prima dell’intervento, ed una volta al giorno per i 5 giorni seguenti, o altrimenti azitromicina, in dosi di 500 mg 1-2 ore prima dell’intervento ed una volta al giorno per i 5 giorni seguenti.
La clindamicina da sola non basta, perché non è attiva contro le Eikenella e Moraxella ed ha bassa attività contro gli Actinomyces, coinvolti nelle lesioni da osteonecrosi dei mascellari.
La sospensione del bifosfonato per alcune settimane prima e dopo l’intervento odontoiatrico invasivo può essere consigliato come forma di cautela, sebbene non vi siano prove che tale approccio abbassi il rischio di osteonecrosi da bifosfonati.
I pazienti con lesioni osteonecrotiche conclamate devono essere indirizzati ad un chirurgo maxillo-facciale.
L’esame clinico odontostomatologico consiste nella rilevazione della lesione, che si manifesta come osso necrotico, spiegandone al paziente la natura e le potenziali complicanze (carattere irreversibile di essa, sintomatologia, fratture).
La lesione, a causa della necrosi, appare generalmente non dolente, tranne quando si espone maggiormente e si infetta.
Risulta, quindi, molto importante la terapia antisettica.
L’approccio chirurgico andrebbe valutato solo in casi limitati sintomatici, quando la gestione antimicrobica non riesce a controllare la malattia.
Terapie palliative come la somministrazione di clindamicina e l’ossigenoterapia non si mostrano particolarmente efficaci.
È ugualmente inutile sospendere la terapia con i farmaci, considerata la loro lunga emivita.
La terapia non chirurgica (conservativa, endodontica, protesica e parodontale) deve essere sempre finalizzata a raggiungere e mantenere un adeguato stato di salute dento-parodontale e di un adeguato stato di igiene orale.
La terapia farmacologica cambia secondo il quadro clinico e sintomatologico.
In caso di limitata esposizione ossea ed algia moderata, è raccomandata una antibiotico-terapia ciclica (ad esempio una settimana al mese) ad ampio spettro, mediante amoxicillina/acido clavulanico 1000 mg ogni 12 ore per 15 giorni, da accompagnare eventualmente a metronidazolo 250 mg ogni 12 ore per 15 giorni, da assumere anche in caso di miglioramento clinico o completa remissione della sintomatologia algica.
A tale protocollo farmacologico va aggiunta la prescrizione di sciacqui con clorexidina più applicazioni in gel ed eventuale associazione di antimicobatterici ed antimicotici.
Vanno inoltre considerati i pro e i contro della sospensione della terapia e svolti controlli periodici anche in caso di miglioramenti clinici.
In caso di grave esposizione ossea e algia severa, il protocollo farmacologico sopra descritto può essere sostituito con somministrazione di piperacillina/tazobactam i.m.(1 fl ogni 12 hh per 15 gg) oppure ampicillina/sulbactam i.m.(1 fl ogni 12 hh per 15 gg).
Può essere suggerito un courettage osseo delicato della zona necrotica esposta e/o causa d traumi ai tessuti, cercando di ridurre l’ulteriore esposizione di tessuto osseo sano, sotto copertura antibiotica ad ampio spettro, oltre alla prescrizione di farmaci analgesici per far cessare la sintomatologia dolorosa.
In caso di esposizione ossea più severa, è indicato un debridement o la sequestrectomia per mezzo di un terminale piezoelettrico e, nei casi più gravi, resezione parziale, marginale o segmentale dei mascellari accompagnata o meno da una fase ricostruttiva.
In ogni caso, bisogna evitare l’utilizzo di un vasocostrittore insieme all’anestetico locale.
Alla luce di queste considerazioni, è importante evidenziare che molti di questi pazienti mostrano una condizione di compromissione sistemica, talvolta non compatibile con trattamenti radicali, così come una minore aspettativa di vita, perciò già il solo raggiungimento di una migliore qualità di vita attraverso procedure poco invasive può considerarsi un traguardo sufficiente e favorevole.
BIBLIOGRAFIA
Abu-Id MH, Warnke PH, Gottschalk J, Springer I, Wiltfang J, Acil Y, Russo PA, Kreusch T. “Bis-phossy jaws” – high and low risk factors for bisphosphonate-induced osteonecrosis of the jaw. J Craniomaxillofac Surg. 2008 Mar;36(2):95-103.
Bamias A, Kastritis E, Bamia C, Moulopoulos LA, Melakopoulos I, Bozas G,Koutsoukou V, Gika D, Anagnostopoulos A, Papadimitriou C, Terpos E, Dimopoulos MA. Osteonecrosis of the jaw in cancer after treatment with bisphosphonates: incidence and risk factors. J Clin Oncol. 2005 Dec 1;23(34):8580-7.
Bilezikian JP. Osteonecrosis of the jaw–do bisphosphonates pose a risk? N Engl J Med. 2006 Nov 30;355(22):2278-81.
Borromeo GL, Tsao CE, Darby IB, Ebeling PR. A review of the clinical implications of bisphosphonates in dentistry. Aust Dent J. 2011 Mar;56(1):2-9.
Campisi G, Fedele S, Colella G, Casto AL, Fusco V. Canadian consensus practice guidelines for bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009 Feb;36(2):451-3.
Cheng A, Daly CG, Logan RM, Stein B, Goss AN. Alveolar bone and the bisphosphonates. Aust Dent J. 2009 Sep;54 Suppl 1:S51 -61.
Cheng A, Mavrokokki A, Carter G, Stein B, Fazzalari NL, Wilson DF, Goss AN. The dentai implications of bisphosphonates and bone disease. Aust Dent J. 2005 Dec;50(4 Suppi 2):S4-13.
Daley-Yates PT, Dodwell DJ, Pongchaidecha M, Coleman RE, Howell A. The clearance and bioavailability of pamidronate in patients with breast cancer and bone metastases. Calcif Tissue Int. 1991 Dec;49(6):433-5.
Dimopoulos MA, Kastritis E, Bamia C, Melakopoulos I, Gika D, Roussou M, Migkou M, Eleftherakis-Papaiakovou E, Christoulas D, Terpos E, Bamias A. Reduction of osteonecrosis of the jaw (ONJ) after implementation of preventive measures in patients with multiple myeloma treated with zoledronic acid. Ann Oncol. 2009 Jan;20(1):117-20.
Drozdzowska B. Osteonecrosis of the jaw. Endokrynol Pol. 2011 Jan-Feb;62(1):88-92.
Fedele S, Porter SR, D’Aiuto F, Aljohani S, Vescovi P, Manfredi M, Arduino PG, Broccoletti R, Musciotto A, Di Fede O, Lazarovici TS, Campisi G, Yarom N. Nonexposed variant of bisphosphonate-associated osteonecrosis of the jaw: a case series. Am J Med. 2010 Nov;123(11):1060-4.
Fehm T, Felsenberg D, Krimmel M, Solomayer E, Wallwiener D, Hadjii P. Bisphosphonate-associated osteonecrosis of the jaw in breast cancer patients: recommendations for prevention and treatment. Breast. 2009 Aug;18(4):213-7.
Fusco V, Baraldi A, Loidoris A, Ciuffreda L, Galassi C, Goia F, Scoletta M, Berrone S, Benech A, Ortega C, Berruti A; Rete Oncologia di Piemonte e Valle d’Aosta ONJ Study Group. Jaw osteonecrosis associated with intravenous bisphosphonate: is incidence reduced after adoption of dental preventive measures? J Oral Maxillofac Surg. 2009 Aug;67(8):1775.
Gebara SN, Moubayed H. Risk of osteonecrosis of the jaw in cancer patients taking bisphosphonates. Am J Health Syst Pharm. 2009 Sep 1;66(17):1541-7.
Gertz BJ, Holland SD. Kline WF, Matuszewski BK, Porras AG. Clinical pharmacology of alendronate sodium. Osteopor Int. 1993; 3(suppl. 3):513-516.
Khan AA, Rios LP, Sandor GK, Khan N, Peters E, Rahman MO, Clokie CM, Dore E, Dubois S. Bisphosphonate-associated osteonecrosis of the jaw in Ontario: a survey of oral and maxillofacial surgeons. J Rheumatol. 2011 Jul;38(7):1396-402.
Lin JH, Chen IW, deLuna FA, Hichens M. Role of calcium in plasma protein binding and renal handling of alendronate in hypo- and hypercalcemic rats. J Pharmacol Exp Ther. 1993 Nov;267(2):670-5.
Lin JH, Chen IW, deLuna FA. On the absorption of alendronate in rats. J Pharm Sci 1994; 83:1741-1746.
Lin JH, Chen IW, deLuna FA, Hichens M. The role of calcium in plasma protein binding and renal handling of alendronate in hyper- and hypocalcemic rats. J Pharmacol Exp Ther 1993; 267:670-675.
López-Jornet P, Camacho-Alonso F, Molina-Minano F, Gomez-Garcia F. Bisphosphonate-associated osteonecrosis of the jaw. Knowledge and attitudes of dentists and dental students: a preliminary study. J Eval Clin Pract. 2010 Oct;16(5):878-82.
Mavrokokki T, Cheng A, Stein B, Goss A. Nature and frequency of bisphosphonate-associated osteonecrosis of the jaws in Australia. J Oral Maxillofac Surg. 2007 Mar;65(3):415-23.
McLeod NM, Brennan PA, Ruggiero SL. Bisphosphonate osteonecrosis of the jaw: a historical and contemporary review. Surgeon. 2012 Feb;10(1):36-42.
Migliorati CA, Hujoel P. Osteonecrosis of the jaw may not be a common acute side-effect of oral bisphosphonates. J Evid Based Dent Pract. 2007 Jun;7(2):77-8.
Miksad RA, Lai KC, Dodson TB, Woo SB, Treister NS, Akinyemi O, Bihrle M, Maytal G, August M, Gazelle GS, Swan JS. Quality of life implications of bisphosphonate-associated osteonecrosis of the jaw. Oncologist. 2011;16(1):121-32.
Nase JB, Suzuki JB, Osteonecrosis of the jaw and oral bisphosphonate treatment. J Am Dent Assoc, 2006. 137(8): 1115-9.
Oral and intravenous bisphosphonate-induced osteonecrosis of the jaws: etiology, prevention, and treatment, Marx RE Quintessence Publishing (New Malden), 2007.
Otomo-Corgel J. Implants and oral bisphosphonates: risky business? J Periodontol. 2007 Mar;78(3):373-6.
Palaska PK, Cartsos V, Zavras AI. Bisphosphonates and time to osteonecrosis development. Oncologist. 2009 Nov;14(11):1154-66.
Papapetrou PD. Bisphosphonate-associated adverse events. Hormones (Athens). 2009 Apr-Jun;8(2):96-110.
Passeri LA, Bértolo MB, Abuabara A. Bisphosphonate-related osteonecrosis of the jaws. Rev Bras Reumatol. 2011 Aug;51(4):401-3, 407.
Pazianas M, Cooper C, Ebetino FH, Russell RG. Long-term treatment with bisphosphonates and their safety in postmenopausal osteoporosis. Ther Clin Risk Manag. 2010 Jul 21;6:325-43.
Reid IR. Bisphosphonates in the treatment of osteoporosis: a review of their contribution and controversies. Skeletal Radiol. 2011 Sep;40(9):1191-6.
Reid IR. Bisphosphonates. Skeletal Radiol, 2007. 36(8): p. 711-4.
Ripamonti CI, Maniezzo M, Campa T, Fagnoni E, Brunelli C, Saibene G, Bareggi C, Ascani L, Cislaghi E. Decreased occurrence of osteonecrosis of the jaw after implementation of dental preventive measures in solid tumour patients with bone metastases treated with bisphosphonates. The experience of the National Cancer Institute of Milan. Ann Oncol. 2009 Jan;20(1):137-45.
Russel RG, Crouucher Pi, Rogers MJ. Biphophonate: pharmacology, mechanism of action and clinical uses. Osteoporosis Int 1999;9: S66 – S80.
Sacco R, Sacco G, Acocella A, Sale S, Sacco N, Baldoni E. A systematic review of microsurgical reconstruction of the jaws using vascularized fibula flap technique in patients with bisphosphonate-related osteonecrosis. J Appl Oral Sci. 2011 Aug;19(4):293-300.
Thumbigere-Math V, Sabino MC, Gopalakrishnan R, Huckabay S, Dudek AZ, Basu S, Hughes PJ, Michalowicz BS, Leach JW, Swenson KK, Swift JQ, Adkinson C, Basi DL. Bisphosphonate-related osteonecrosis of the jaw: clinical features, risk factors, management, and treatment outcomes of 26 patients. J Oral Maxillofac Surg. 2009 Sep;67(9):1904-13.
Vandone AM, Donadio M, Mozzati M, Ardine M, Polimeni MA, Beatrice S, Ciuffreda L, Scoletta M. Impact of dental care in the prevention of bisphosphonate-associated osteonecrosis of the jaw: a single-center clinical experience. Ann Oncol. 2012 Jan;23(1):193-200.
Vescovi P, Merigo E, Meleti M, Manfredi M, Guidotti R, Nammour S. Bisphosphonates-related osteonecrosis of the jaws: a concise review of the literature and a report of a single-centre experience with 151 patients. J Oral Pathol Med. 2011 Sep 30.
Walter C, Grotz KA, Kunkel M, Al-Nawas B. Prevalence of bisphosphonate associated osteonecrosis of the jaw within the field of osteonecrosis. Support Care Cancer. 2007 Feb;15(2):197-202.
Weitzman R, Sauter N, Eriksen EF, Tarassoff PG, Lacerna LV, Dias R, Altmeyer A, Csermak-Renner K, McGrath L, Lantwicki L, Hohneker JA. Critical review:updated recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw in cancer patients–May 2006. Crit Rev Oncol Hematol. 2007 May; 62(2):148-52.
Zavras AI, Zhu S. Bisphosphonates are associated with increased risk for jaw surgery in medical claims data: is it osteonecrosis? J Oral Maxillofac Surg. 2006 Jun;64(6):917-23.
Zavras AI. The impact of bisphosphonates on orai health: lessons from the past and opportunities for the future. Ann N Y Acad Sci. 2011 Feb; 1218:55-61.