Coridale Cava
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Corydalis cava (Mill.) Schweigger et Koerte – Fam. Fumariacee) (Sin. – Corydalis bulbosa Pers. (non DC.) – C. tuberosa DC.)
Coridale Cava- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Corydalis, dal greco korudallis = allodola, perchè i fiori hanno uno sperone, come l’allodola.
cava – perchè il tubero è cavo. (Durante la vegetazione, la parte inferiore muore e si distrugge ed il tubero risulta vuoto internamente) – bulbosa e tuberosa per il tipo di radice.
Nome volgare – Coridali, Giacinto selvatico.
Habitat – Europa centrale e meridionale. In Italia si trova nei luoghi ombrosi, boschi siepi macchie, nel settentrione in collina e nella regione montana. Pianta erbacea.
Parti usate – I tuberi
Componenti principali
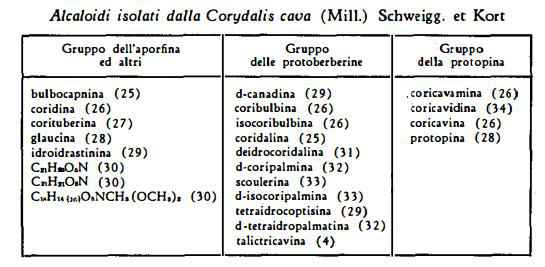
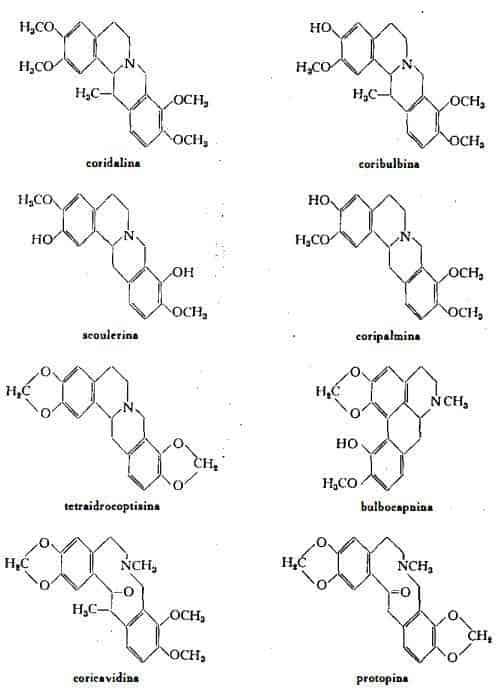
Alcaloidi 5 % circa: coridalina C22H27O4N, coribulbina C21H26O4N, isocoribulbina C21H25O4N, d-coripalmina C20H23O4N, d-tetraidrocoptisina C19H17O4N, d-tetraidropalmatina C21H25O4N, d-canadina C20H21O4N, idroidrastinina C11H13O2N, protopina C20H19O5N, coricavina C21H21O5N, coricavidina C22H25O5N, bulbocapnina C10H19O4N, corituberina C10H21O4N:5H2O, coridina C20H23O4N. Lo studio di questi alcaloidi è stato condotto principalmente da Freund e Josephy (1), da Gadamer e coll. (2) e da Spath e coll. (3). Manske e coll. (4) hanno isolato da diverse specie di Corydalis parecchi altri alcaloidi tra cui dalla C. tuberosa DC., la talictricavina, identificata con la 2,3-metilendiossi-9,10-dimetossi-6-metiltetraidroprotoberberina.
Gli alcaloidi della Coridale cava si distinguono per la composizione chimica in tre gruppi come è indicato nella tabella seguente.
Proprietà farmacologiche ed impiego terapeutico
La Coridale deve la sua attività, soprattutto ad uno dei suoi principi attivi, la bulbocapnina, alcaloide fenantrenico la cui azione può ricordare, sotto certi aspetti, quella dell'apomorfina, allorché questa venga impiegata a dosi subemetiche.
Le applicazioni della bulbocapnina alla terapia, sono limitatissime, notevole è invece la sua importanza farmacologica, soprattutto come mezzo di ricerca e di studio nel campo della neurologia.
Sull’attività di questa sostanza ci limiteremo quindi a riferire le notizie fondamentali, indicando allo studioso che desiderasse approfondire l'argomento, la completa monografia del De Jong (5), in cui la storia e la farmacologia della bulbocapnina, sono ampiamente trattate.
Fra le prime ricerche farmacologiche eseguite sulla bulbocapnina sono da annoverare quelle del Peter (6) che risalgono al 1904. Questo A. trovò che dosi di 25-100 mg/Kg nei cani e nei gatti e dosi di 20 mg nelle rane, pongono questi animali in una particolare condizione narcotica e catalettica. Gli stessi fenomeni si manifestano nella scimmia [De Jong (7)] nei topi e negli uccelli [Henry e De Jong (8)]. In realtà non sembra esatto definire come catalettico quel particolare stato che si manifesta nei mammiferi dopo somministrazione di dosi sufficienti di bulbocapnina. Trattasi più precisamente di uno stato di catatonia sperimentale, caratterizzato da stupore, letargia e da rigidità plastica, per la quale gli animali assumono l'attitudine a permanere nelle posizioni più strane e anormali nelle quali vengono posti. Lo stato narcotico predomina nel coniglio e nella cavia. Nella scimmia (Macacus Rhesus) piccole dosi inducono sonno o un'attitudine astratta che il Sollmann, con un'immagine che in questo caso può ben dirsi scultorea, la definisce simile al “Pensatore di Rodin”.
Per dosi medie lo stato catatonico dura parecchie ore; a dosi più elevate consegue ipercinesi, agitazione e gli animali assumono attitudini strane. Le alte dosi causano sempre fatti epilettoidi. Questi fenomeni, secondo De Jong (9), sarebbero quasi identici a quelli che si osservano nella catatonia clinica, nella sindrome motoria e psicologica della demenza precoce e non alla immobilità parkinsoniana. Nell'uomo i riflessi posturali sono prima indeboliti poi esagerati.
Buscaino (10) sperimentando sull'uomo e sugli animali, trovò che la bulbocapnina determina un effetto motorio simile alla schizofrenia catatonica.
Un sinergismo favorevole alla schizofrenia, fra serotonina e bulbocapnina ed anche fra serotonina ed altre sostanze, quali la mescalina e la dietilamide dell'acido lisergico, sarebbe stato dimostrato sperimentalmente da Poloni (11).
Feldberg e Sherwood (12) trovarono che iniezioni intramuscolari di 1 mg di bulbocapnina nei gatti, producono uno stato di stupore catatonico, mentre per ottenere lo stesso effetto per iniezione sottocutanea, sarebbero necessarie dosi 40 volte più elevate.
Dosi di 100-200 g intraventricolari, determinano soltanto variazioni di comportamento.
Secondo Passouant e coll. (13) la bulbocapnina eleverebbe la soglia di eccitabilità di varie parti del cervello.
Il Boriani (14) trovò che la bulbocapnina inibisce nettamente la colinesterasi del siero di sangue, alla diluizione di 2×10-4 e Pappalardo e Lipani (15), che studiarono l'attività colinesterasica del tessuto nervoso nell'intossicazione acuta e cronica da bulbocapnina, trovarono che essa, nei ratti, alla dose di 3 mg/Kg e per iniezione intramuscolare, diminuisce l'attività colinesterasica nel cervelletto, nei nuclei della base del cervello, nel tronco encefalico e nel midollo spinale. Ciò sarebbe specialmente evidente se la somministrazione viene ripetuta quotidianamente mentre nella corteccia cerebrale e nel bulbo, tale attività sarebbe aumentata, specialmente allorché le somministrazioni vengano ripetute nello stesso giorno.
L'azione della bulbocapnina sull'attività elettrica spontanea del cervello e la reattività agli stimoli afferenti sono state studiate da Szekely e Spiegel
(16) i quali trovarono che essa, a dosi capaci di produrre uno stato catalettico, determina un leggero effetto depressivo sull'attività elettrica del cervello, attività che può essere messa in evidenza nel proencefalo, nel diencefalo e nel mesencefalo. Onde lente e stati transitori di eccitamento, con le dosi impiegate, si osserverebbero solo occasionalmente.
Durante lo stato cosiddetto, catalettico, la reattività della corteccia e quella delle varie aree subcorticali (ipotalamo, sostanza reticolata del cervello medio, corteccia cerebellare) sarebbe preservata dagli influssi afferenti e persino aumentata. Registrazioni simultanee dalla corteccia e da diverse aree subcorticali, rivelerebbero differenze variabili per quanto riguarda il grado di sensibilità di queste regioni, il che dimostrerebbe, secondo gli AA., l’esistenza dello stesso grado di indipendenza dello stato funzionale delle suddette regioni.
Le sede dell'azione catatonica sembra possa essere localizzata nei gangli basali del mesencefalo. Dosi di novocaina capaci di abolire la rigidità posturale, non antagonizzano lo stato spastico il quale viene invece risolto dalla cocaina alla dose di 2-5 mg/Kg, tramite forse, una stimolazione centrale. Tale azione è specialmente evidente nelle scimmie, le quali vengono recuperate completamente e immediatamente.
La catatonia da bulbocapnina viene prolungata dalla scopolamina e temporaneamente esagerata da inalazioni di CO2 (18) le quali sovrapporebbero alla catatonia, uno stato ipercinetico (19).
La bulbocapnina abbassa la pressione arteriosa e quella venosa, per azione diretta sui vasi, azione questa che si manifesta anche dopo atropinizzazione.
Secondo Leese ed altri (20), la vasodilatazione si manifesta in tutti gli organi, ma più evidentemente nei vasi dell'orecchio, delle estremità e del rene, mentre con minor intensità si manifesterebbe sui vasi dell'intestino. La bulbocapnina abolisce i riflessi vasocostrittori, antagonizza l'azione ipertensiva dell'adrenalina e quella depressiva del Mecholyl (cloridrato di acetil-b-metilcolina), ma non diminuisce la risposta alla pitressina o all'istamina (21).
La motilità intestinale viene parzialmente inibita dalla bulbocapnina.
Impiego terapeutico
Come fu già detto, le applicazioni terapeutiche della Coridalis e della bulbocapnina, sono limitatissime. Schaltenbrand (22) osservò che alla somministrazione di 1 mg/Kg di bulbocapnina, nell'uomo, consegue uno stato di narcosi e di marcato affaticamento. Nella paralisi agitante, dosi di g 0,10 somministrate per via sottocutanea, possono determinare un rapido ma transitorio miglioramento [Lewy (23)]. Venne impiegata anche nel trattamento del morbo di Parkinson, nel quale agisce soprattutto abolendo transitoriamente il caratteristico tremore.
Sperimentalmente venne impiegata anche come preanestetico, in luogo della morfina o dell'associazione morfina-scopolamina, per la sua azione sedativa motoria che si manifesta senza influenzare le funzioni circolatoria e respiratoria [Molitor (24)].
Estratti e preparati vari
Estratto fluido (g 1 = LX gtt).
Dosi; g 0,5-2 pro die
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido coridale………………… g 20
Alcool di 60°………………………………………. g 80
(g 2,5-10 pro die).
Sciroppo
Estratto fluido coridale…………………………………………. g 2,5
Sciroppo semplice F. U…………………………. ………….. g 97 5
(a cucchiaini).
Elixir composto
Estratto fluido coridale…………………………………. g 10
Estratto fluido camomilla per tintura……………………….. g 100
Sciroppo semplice F. U………………………………………. ' g 390
(a bicchierini; 2-4 pro die).
Vino
Estratto fluido coridale ………………………….. g 10
Glicerina……………………………………………. g 30
Vino Marsala………………………………. g 500
(a bicchierini; 2-4 pro die).
BIBLIOGRAFIA
(1) FREUND e JOSEPHY, LIeb Ann.. 277, 1, 1893 – (2) GADAMER J. e coll., ArcK fharm., 240, 19 e 81, 1902; 248, 204 e 681, 1910; 249, 30, SOO, 641 e 680, 1911; 254, 296, 1916; 259, 24S, 1921; 260, 97, 1922; 264, 401, 1926 – (3) SPATH E., Ber.. 54, 3074, 1921; 56, 87S, 1923; LIeb. Ann., 433, 138, 1923; Ber., SS, 1274, 192S; 59, 2800, 1926; 60, 704, 1927; 61, 1334 e 1692, 1928 – (4) MANSKE R. H. F., Annua! KeV. a! Bioehem., 13, S33, 1944; The Alkalolds. 4, 119, 19S4; 7. Am. Chem. Soe„ 75, 4928, 19S3; Chem. Ab4„ 48, 127S3 c, 19S4 – (S) DE JONG H. H., Experlmental Catatonia – Williams e Wllklns Co. Baltimora 194S – (6) PETER F., citato da SOLLMANN T. In A Manual of Pharmacoloa)' and Its appllcallons to TherapeuUcs and Toxlcolosy, p. 212, W. B. Saunders Co. Phlladelphla-London 19S0 – (7) DE JONG H. H., citato da SOLLMANN, ibld. – (8) HENRY e DE JONG, citali da SOLLMANN, Ibld. . (9) DE JONG e BARUK, citali da SOLLMANN, Ibld. – (10) BUSCAINO V. M., Oae. Sani!., 20, 417-20, 1949; Excerpta Med. Sect.. Vili, 3, 635, 1950 – (11) POLONI A., Cervella, 31. 271-94, 1954 e 31, 355-81, 1956 . (12) FELDBERG W. e SHERWOOD S.. L., Brilh. 1. Pharmacol., 10. 371-4, 1955 – (13) PASSOUANT P.. PASSOUANT-FONTAINE Th. e CADILHAC J., C. R. Soc. Blol.. 149, 2185-7, 1955 – (14) BORIANI A., Boll. Soc. It. Blol. Sper., 27, 4, 570, 1951 -'(15) PAPPALARDO P. e LIPANI O., Acta Neurol. 7, 208-12, 1952 . (16) SZEKELY E. G. e SPIEGEL E. A., Eleciroencephalotr. a. Clin. Neurophyilal., 6. 213-19, 1954 – (17) BUCHMANN e RICHTER, citati da SOLLMANN 1. c. – (18) PETER e RICHTER, Idem – (19) DE JONG. Idem – (20) LEESE ed altri, Ideni – (21) MOLITOR H., LEESE C. E. e FOGELBERG. idem – (22) SCHALTENBRAND, idem – (23) LEWY, Idem – (24) MOLITOR H., Idem • (25) FREUND M. e JOSEPHl W., Ber.. 25, 2411, 1892 – (26) GADAMER J, ZIEGENBEIN H. e WAGNER H., Arch. Pharm., 240, -19, 81, 1902 – (27) DOBBIE J. J. e LAUDER A., I. Chem. Soc., 63, 485, 1893 – (28) GADAMER J„ Arch. Pharm., 249, 224, 1911 – (29) SPATH E. e JULIAN P. L, Ber., 64. 1131, 1931 – (30) HAARS O., Arch. Pharm., 243, 154, 1905 – (31) SCHMIDT E.. Arch. Pharm.. 246, 575, 1908 – (32) SPATH E.. MOSBITIG E. e TROETHANDL O.. Ber., 56, 875, 1923 – (33) GADAMER J„ SPATH E. e MOSETTIG E,, Arch. Pharm., 265, 675, 1927 – (34) GADAMER J„ Arch. Pharm. 249, 30, 1911.


