Camomilla Volgare
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Matricaria Chamomilla L. – Fam. Composite/Anthemidee/Crysanteminee)
(Sin. – Chamomilla vulgaris K. Koch. – Chamaemelum vulgare Dod. – Chamaemelum sylvestre Matt. – Matricaria suaveolens Pali. – Leucanthemum
Camaemelum Lamk.)
Camomilla Volgare- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Matricaria, dal latino matrix/matricis = utero, per le proprietà uterine. [Trad. latina di parqenos (M. Silvatico XIV sec.) = donna vergine].
Chamomilla, dal greco camaimhlon = nome della Camomilla; da camai = piccolo, umile, a terra e da mhelon = mela, per l'odore di alcune specie che assomiglia a quello della mela ranetta (Plinio).
Chamaemelum (vedi Camomilla romana).
sylvestre – dal latino silva che devesi intendere anche come selvaggio, oltre che silvestre, cioè abitante delle foreste.
Nome volgare – Amareggiola. Erba Maria, Matricaria, ecc.
Habitat – Tutta l'Europa centrale e meridionale, lAsia Minore. Coltivata in Svizzera, Ungheria, Sassonia, Olanda (Noorwyk), Australia e America del Nord (importata). In Italia comune nei luoghi soleggiati, incolti, lungo le strade, ecc.
Pianta erbacea annua. Fiorisce, secondo le regioni, dal maggio all'agosto, sino all'ottobre.
Parti usate – I capolini ed i fiori staccati (Chamomillae communis flores F.U.).
Componenti principali
Olio essenziale, trovato in varie proporzioni da fori di differente provenienza, secondo le referenze di diversi ricercatori: in fiori di Germania 0,6-0,67 % (1), 0,72-0,78 % (2), 0,70-1,05 % (3), 0,75-1,05 % (4), 0,5-1,5 % (5), 0,25-0,45 % (6), 0,45-0,75 %
(7), in fiori della Germania del Nord in media 0,73 %, della Germania del Sud in media 0,88 % (8), in fiori d'Ungheria 0,3-0,35 % (1), 0,38-0,63 % (2), 0,35-0,84 % (9). 0,43-0,54 % (3). 0,2-0,38 %
(10), 0,2-0,5 % in media 0,3 % (1 0), 0,47-0,57 % (7), in media 0,47 % (8), in fiori di Jugoslavia 0,33 % (7), 0,39-0,56 %(3), in fiori di Russia 0,41-0,45 % (12), in fiori di Francia in media 0,54 % (8), in fiori di Grecia 0,44-0,56 % (con odore anormale) (5), in fiori di Spagna 0,31 % (con odore anormale ed incoloro) (5), in fiori di dieci diverse regioni (84 campioni) 0.25-1,35 %, in media 0,48 % (13).
Tra le numerose ricerche condotte per valutare il contenuto percentuale di olio essenziale di Camomilla sono da segnalarsi quelle di Will (5) su singoli campioni di fiori provenienti da diverse regioni europee (vedere . la tabella seguente).
Dai risultati delle proprie analisi Will ha dedotto che l’elevato titolo di olio essenziale è un elemento decisivo per riconoscere la buona qualità dell’olio.
I più importanti componenti dell'olio essenziale sono i composti azulenici, tra cui il camazulene, che si trova nell'olio in quantità oscillanti, secondo Guenther (14), dall' 1 al 15 % e più con una media del 6 %. Il rendimento di camazulene varia secondo l’origine ed il tempo di conservazione della droga; diminuisce notevolmente durante il magazzinaggio (14) e, secondo Koch (15), si riduce, rispetto ai valori iniziali, a circa il 30 % dopo un anno e mezzo e, secondo Grahle (8), persino al 6 % dopo circa 2 anni. La quantità di azulene, ottenuta da Koch (15) da diversi campioni di droga, è stata in media di mg 64,5 %; Grahle (8), in fiori di diversa provenienza, di diverse annate e dopo un anno e più di magazzinaggio, trovò: in fiori della Germania del Nord in media 0,135 % di azulene nella droga e 18,5 % nell’olio, in fiori della Germania del Sud in media 0,135 % di azulene nella droga e 15,3 % nell’olio, in fiori di Francia in media 0,067 % di azulene nella droga e 12,3% nell’olio, in fiori d’Ungheria in media 0,027 % nella .droga e 5,7 % nell’olio. Kaiser e Frey (16) trovarono nell’olio 1-1,5 % ed anche 4,8 % (c. ungherese) e 15,2% (c. tedesca) di azulene.
Ruhemann e Lewy (17) e Koch (18) hanno messo in evidenza che il camazulene non esiste nella droga come tale, ma si forma da prodotti sesquiterpenici per azione enzimatica.
La struttura del camazulene, proposta da Pfau e Plattner (19) e corrispondente all’ 1,4-dimetil-8-isopropil-azulene, è stata recentemente modificata da Stahl (20) in quella di 1,4-dimetil-7-etilazulene. Secondo Stahl
(20), vi sono in natura parecchi procamazulenogeni, che per degradazione producono un acido camazulencarbonico, acido a-[1,4-dimetil-azuIil – (7) ]-propionico, da cui per distillazione in corrente di vapore si separa anidride carbonica con formazione di camazulene.

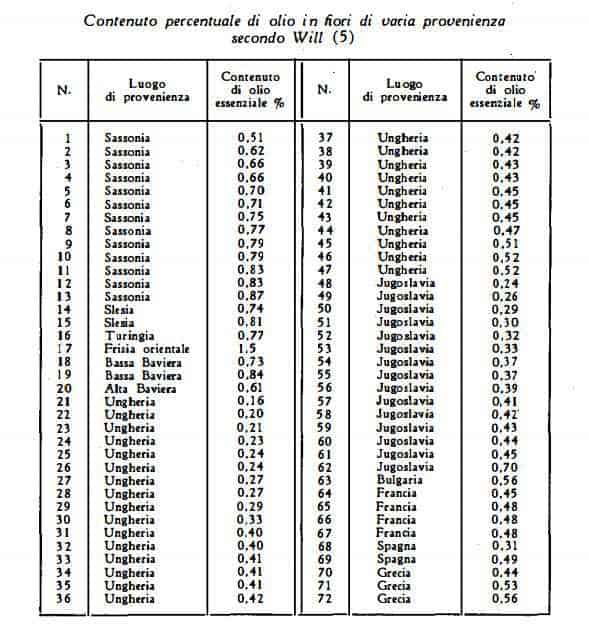
Sorm e Coll. (21) hanno isolato dalla M. Chamomilla una sostanza cristallina C17H22O5 (0,05 1 % della droga) produttrice di azulene, che è stata identificata con I’1-ossi-6-acetossiguaia-2,4(10)-dien-8,12-olide è che è stata denominata matricina.
Herout, Sorm e coll. (95) hanno estratto successivamente dalle acque madri della cristallizzazione della matricina un nuovo composto azulenico, C17H20O5 denominato matricarina
Oltre a composti azulenici nell’olio etereo è stata segnalata la presenza dei seguenti composti: acido caprico C10H20O2, specialmente in forma di estere (22), 10 % di sesquiterpeni principalmente monociclici (23), tra cui, secondo Ruhemann (22), vi sono un sesquiterpene monociclico C15H30,. denominato B, ed un sesquiterpene denominato C, che è probabilmente una miscela di un sesquiterpene monociclico e di un sesquiterpene biciclico; inoltre alcooli sesquiterpenici (22) 20 % (23), tra cui un derivato di un sesquiterpene denominato sesquiterpene A (22) e bisabololo levogiro 85% come composto, isopropilidenico, 15% come derivato isopropenilico (21): una paraffina C29H60 (24), triacontano C30H62 (25).
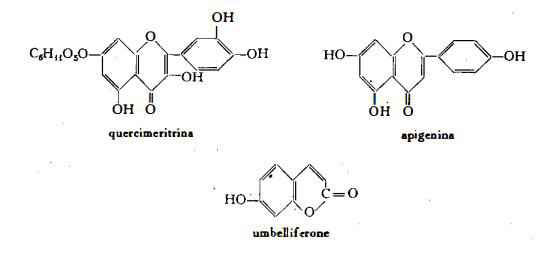
Altri componenti dei fiori oltre all’olio essenziale: apigenina C15H10O5 (5,7,4‘-triossiflavone) libera ed in forma glicosidica, umbelliferone (7- ossi-cumarina), etere metilico dell’umbelliferone (7-metossi-cumarina), acido salicilico, acido ottilico, resina, fitosterina C27H46O, gli acidi grassi oleico, linolico, cerotico, palmitico e stearico (25), un glicoside non identificato (sino al 3 %), che sarebbe dotato di proprietà spasmolitiche (26) (27), quercimeritrina (quercetin-7-glucoside) (28), acido clorogenico (29), vitamina B1 1,154% nei fiori essiccati (96), vitamina C (in fiori freschi mg 33 % equivalenti a mg 159 % nei fiori secchi) (30), ceneri 10 % in c. ungherese, 9 % in c. germanica, 11 % in c. russa (31) :
. nei fiori secchi mg 3,8% di manganese (32). Una frazione contenente
7-ossi-cumarina e 7-metossi-cumarina è stata denominata da Neuwald camillina (33) (34).
Proprietà farmacologiche ed impiego terapeutico
La Camomilla va certamente annoverata fra le piante medicinali più note fin dall’antichità e fra quelle più largamente usate anche nella medicina popolare. Nonostante però le numerose ricerche eseguite specialmente negli ultimi 25 anni, il problema farmacologico riguardante l’attività della droga e la ricerca dei principi attivi cui attribuirla non è stato definitivamente risolto e, pertanto, resta ancora aperto all’indagine.
Con lo scopo di inquadrare l’argomento in maniera che ne risulti una esposizione più ordinata e più chiara, tratteremo separatamente in questo capitolo, dei principi attivi cui la droga deve le sue proprietà, della loro azione farmacologica e quindi dell’impiego terapeutico della droga e dei suoi derivati.
a)Principi attivi
La maggior parte degli AA. ritengono che il principio attivo della camomilla sia rappresentato dall'azulene o camazulene e fu forse l'Heubner in collaborazione col Grabe (35) che per il primo ne riconobbe l'azione antiflogistica, azione che fu in seguito confermata dall'Heubner stesso in collaborazione con l’Albath (36) e da numerosi altri AA. fra i quali Bruehl (37) Blaszo (38), Roeckrath (39), Burhans (40), Tuczek (41), Luetzenkirchen (42), Vida (43), Porzer (44), Caujolle e Coll. (45), Herz (46), Koch (47) ed altri.
Una conferma indiretta all'attività del camazulene deriverebbe dai risultati delle ricerche di Jaretzky e Neuwald (48) di Kagelmacker (49), di Janistyn (50), di Bosch (51), di Kriiger-Nilsen (52) e di Kolestaedt (53) secondo i quali i preparati di Camomilla privi di camazulene non avrebbero che uno scarso valore farmacologico e terapeutico, tanto che essi propongono che la standardizzazione dei preparati di Camomilla venga fatta in base al loro contenuto in camazulene.
Altri AA. ritengono però che il camazulene non sia l'unico principio attivo della Camomilla. L’Albath (54) isolò dall'olio di Camomilla, oltre il camazulene, anche una frazione di olio verde che vi sarebbe contenuto nelle proporzioni dello 0,05 % circa e che sarebbe dotato delle stesse proprietà antiflogistiche del camazulene. Successive ricerche di Pommer (55) non avrebbero però confermato l'esistenza di tali proprietà in questa frazione dell’olio di Camomilla. Egli conferma invece l'attività antiflogistica del camazulene che egli stesso ha ottenuto da una Camomilla ungherese.
Lo Janku (56) ha studiato un pigmento giallo dei fiori di Camomilla, l'apigenina, trovandolo poco tossico e capace di esplicare un'azione antagonista a quella contratturante del cloruro di bario e dell'istamina sull’intestino isolato. Iniettata endovena nei cani, l'apigenina aumenterebbe il tono e la motilità dell'intestino e, nello stesso tempo, antagonizzerebbe l'azione stimolante della carboilcolina. Tale comportamento apparentemente contradittorio, potrebbe essere spiegato formulando l'ipotesi che questa sostanza, analogamente ad altre, agisca in maniera qualitativamente diversa a seconda dello stato di tonalità dell'organo su cui viene fatta agire.
L'apigenina somministrata per via orale, intramuscolare o endoperitoneale, in soluzione tamponata a pH 8, esplicherebbe un'azione benefica negli animali previamente sottoposti all'irradiazione con raggi U.V. o all’azione del calore, pur non riuscendo a impedirne la morte. Anche questa sostanza quindi, analogamente all'azulene. sarebbe dotata di una azione antiflogistica.
Secondo Rock (57) l’azulene non si troverebbe come tale nella droga ma sotto forma di proazulene,
Wegner (58) trovò che il contenuto di azulene nei preparati acquosi di Camomilla diminuisce, tanto più la temperatura cui sono sottoposti è elevata e quanto più se ne prolunga il riscaldamento. Egli ha esaminato il contenuto in azulene e in proazulene di estratti acquosi di Camomilla al 5 %, ottenuti con metodi diversi e notò che usando una droga avente un contenuto medio di proazulene, i relativi estratti contenevano soltanto tracce di azulene e, inoltre, che la maggior parte di questo veniva trattenuto
dal residuo nel filtro. Così stando le cose, non è possibile secondo l'A. attribuire all'azulene l’azione antiflogistica di tali estratti e, pertanto, egli ritiene che nell'olio di Camomilla deve essere contenuta anche un'altra sostanza ad azione antiflogistica.
Analogamente Bogs e Meinhard (59) affermano che l'azione antiflogistica dei preparati di Camomilla non è dovuta all'azulene ma ai suoi prodotti di demolizione e che l'azulene deriva, a sua volta, per riscaldamento, dal proazulene. Per cui secondo Meinhard (60), la Camomilla e i suoi derivati acquisterebbero l’attività antiflogistica soltanto dopo essere stati sottoposti all’azione del calore. Egli ritiene che gli estratti alcoolici preparati a freddo siano completamente inattivi sotto questo aspetto, mentre il thè di Camomilla sarebbe dotato di ottime qualità antiflogistiche. Tuttavia, tanto il thè quanto i comuni estratti alcoolici, sarebbero privi di azulene. Nella preparazione del thè si ottiene l'estrazione di azulene ma, come osservò anche il Wegner, viene trattenuto dalla droga durante la filtrazione. L’azione antiflogistica delle preparazioni di Camomilla non dovrebbe quindi essere attribuita, secondo l’A., soltanto all'azulene. Riscaldando l’estratto alcoolico di Camomilla ottenuto a freddo, si ha la formazione di azulene che viene distrutto insistendo nel riscaldamento.
L'azulene rappresenterebbe probabilmente secondo l'A.. un labile punto di passaggio di una catena di reazioni, che può condurre alla formazione del principio attivo. Bollendo un estratto alcoolico, come preparando una infusione acquosa, si ottiene la formazione di questo principio. Per infusione lo si ottiene nel liquido di spremitura, mentre l'azulene verrebbe trattenuto dalla droga.
b)Attività farmacologica
Jancso (61) attribuisce l'attività antiflogistica dell'azulene ad una stimolazione dell'apparato reticolo-endoteliale da parte dell’istamina che verrebbe liberata nei tessuti sotto l'azione dell'azulene. Essa favorirebbe la trasformazione delle cellule endoteliali in riposo, in fagociti e perciò, all’istamina verrebbe attribuito un ruolo importante nelle reazioni riparatrici difensive dell'organismo, reazioni che secondo l'A. potrebbero spiegare anche l’azione antiallergica che viene attribuita all'azulene.
Anche secondo Ditroi (62) l'effetto farmacologico principale dell'olio di Camomilla, allorché viene applicato topicamente o somministrato per via intramuscolare, consisterebbe nella liberazione di istamina nei tessuti. Essa stimolerebbe e intensificherebbe le reazioni difensive e riparatrici dei tessuti soprattutto per l’attivazione dei fagociti che ne risulterebbe.
Il Thomas (63) avendo studiato i due azuleni più importanti, il camazulene e il gaiazulene (dall’olio di Gurjun) ha trovato che ambedue sono dotati di proprietà antiflogistiche, antiallergiche e favorenti la riparazione dei tessuti. Analogamente ai precitati AA. egli ritiene che gli azuleni stimolino il sistema reticolo-endoteliale, provocando la liberazione di istamina.
A conclusioni interessanti giungono Schimert e Schwarz (64) i quali distinguono tra l’azione che abbrevia la durata del processo infiammatorio e quella che lo arresta. Essi, valendosi del cloruro di calcio e di soluzioni di formaldeide, provocarono delle necrosi sul dorso delle cavie. Divisi quindi gli animali in tre lotti, trattarono il primo con dosi di mg 2,5 di ACTH pro die per via endoperitoneale, il secondo con cc 0,5 di una soluzione al 5 % di azulene sintetico e lasciarono il terzo lotto per controllo. Dopo 24 giorni di trattamento, le lesioni necrotiche delle cavie trattate con azulene erano quasi tutte guarite, mentre le cavie trattate con ACTH, non solo non mostravano alcuna tendenza alla guarigione, ma tale tendenza si mostrava in misura anche minore di quella che si poteva notare nei controlli. Secondo gli AA. l’azulene, anziché determinare l’arresto dei processi infiammatori, sembrerebbe affrettarne il decorso e sarebbe quindi più logico parlare di « azione riparatrice » piuttosto che di azione antiflogistica.
Con prove eseguite sull’uomo, gli stessi AA. notarono che dopo somministrazione intramuscolare di cc 0,5-1 di azulene, nei 2/3 dei soggetti così trattati, era possibile osservare una rapida diminuzione degli eosinofili. In nessun caso si osservò invece, un aumento dell’eliminazione urinaria dei 17-chetosteroidi. In base a questi risultati gli A A. escludono che l’attività dell’azulene si manifesti secondo un meccanismo preipofisosurrenalico e ritengono che la sua azione sia prevalentemente periferica.
Jung e coll. (89) hanno sperimentato sull’occhio di cavia una numerosa serie di azuleni naturali e sintetici trovando che, fra le sostanze studiate, soltanto 2 hanno dimostrato di possedere un’azione simile al camazulene.
Complessi ad azione antiflogistica si troverebbero sia fra gli azuleni acidi carbonici che fra gli alcooli azulenici. Fra questi ultimi, 1’ 1 -isopropil- 5-metilazulene, sarebbe dotato di un’attività eccitante la peristalsi intestinale, il che fa ritenere agli AA. che all’azulene sia dovuta, oltre l’azione antiflogistica, anche quella carminativa. Stern e Milin (90) hanno studiato l’azione antiflogistica e antiallergica dell’azulene sotto forma di un suo composto idrosolubile. Impiegando il metodo del granuloma di Selye, gli AA. hanno potuto dimostrare che l’azulene possiede una netta azione antiflogistica.
L’attività antiallergica è stata studiata sulle variazioni di pressione arteriosa provocate da un « istamino liberator » (prodotto di condensazione della p-metossifeniletilamina con la formaldeide) e sugli edemi del muso e delle estremità dei ratti, provocati sia con un « istamino liberator » che con proteine eterologhe. L’azione dell’azulene si manifestò nell’un caso e nell’altro, normalizzando la pressione e determinando la scomparsa degli edemi. Gli AA. traggono la conclusione che l’azulene impedisce la scarica istaminica tessutale, il che spiegherebbe le sue azioni antiallergica e antiflogistica le quali si esplicherebbero mediante un’attivazione del sistema ipofiso-surrenalico con liberazione di ACTH.
Successive ricerche di Stern (91), contrariamente all’opinione di Jancso
(61), di Ditroi (62) e di Thomas (63), hanno confermato l’azione di ostacolo dell’azulene sulla scarica istaminica cutanea provocata da un «istamino liberator». La pelle che per opera di una di queste sostanze, abbia perduto il suo normale contenuto di istamina, reagisce come la pelle di un animale trattato con azulene, dal quale l’effetto dell’istamina viene ostacolato. In base a questi risultati e a quelli precedentemente ottenuti l’A. conclude che l'azulene, immobilizzando l’istamina nei tessuti, esplica un’azione antiallergica e antiflogistica.
A proposito di eventuali applicazioni terapeutiche di sostanze liberatrici di istamina, l’A. si chiede se l’allontanamento dalla pelle di un fattore tanto importante quale è l’istamina, non incida anche su altre funzioni della pelle stessa (92), tanto più che la rigenerazione dell’istamina avviene molto lentamente (93). L’azulene agirebbe invece, secondo l’A., in senso più fisiologico, in quanto il contenuto cutaneo di istamina rimarrebbe inalterato, mentre verrebbe ostacolata soltanto la sua fuoruscita delle cellule. Giertz e Hahn (94) hanno studiato l’azione degli azuleni sullo shock da istamina, da serotonina e sullo shock anafilattico nelle cavie in cui le sostanze anafilattizzanti venivano somministrate sotto forma di aerosol. Gli AA. notarono che l’azulene somministrato preventivamente alle cavie, alla dose di mg 100/Kg, riusciva a prevenire lo shock anafilattico e da serotonina, ma non quello da istamina.
Oltre le surricordate attività antiflogistica, antiallergica e riparatrice dei tessuti, negli azuleni ed in altre sostanze contenute nella Camomilla sono state sperimentalmente accertate anche altri tipi di attività che potremmo definire secondarie, in quanto non hanno trovato, almeno sino ad ora, applicazioni alla terapia.
Popesco (65) trovò che estratti di fiori di Camomilla iniettati endovena nel cane e nel gatto, provocano vasodilatazione e conseguente ipotensione. Dopo atropinizzazione la vasodilatazione manca o si manifesta in maniera molto attenuata.
Sul cuore di rana l’azione degli estratti di Camomilla si manifesta con un effetto inotropo negativo. Dai risultati delle sue ricerche l’A. trae la conclusione che tali estratti sono dotati di un’attività simpatico-mimetica.
Il Mayer (66) che ha studiato un’altra sostanza contenuta nella Camomilla, la camillina, costituita da un miscuglio di 7-ossi e 7-metossi cumarina, è riuscito a dimostrare che questa sostanza è dotata di una leggera azione spasmolitica e Caujolle e Stanislas (67) trovarono che il gaiazulene, in soluzione twinata, è un modificatore della motilità delle fibre muscolari liscie, esalta la peristalsi intestinale e rende più energiche le contrazioni dell’utero isolato di cavia, di ratto e di topo. Sul polmone isolato manifesta un’attività broncodilatatrice e, somministrato ai pesci (Pomatis gibbosus) dà luogo ad accidenti precoci di tipo anossemico, seguiti da turbe dell’equilibrio. La morte sopravviene in essi in meno di 5 ore, per dosi superiori a g 4×10-6.
Un altro azulene, l’S-gaiazulene, somministrato ai topi, vi determina astenia, sonnolenza ed anche turbe dell’equilibrio. La dose di 1-5 g/kg provoca la morte in tempi compresi fra 50 e 10 ore. La dose di g 0,0125 può provocare l’aborto nella femmina gestante. Somministrato nel cane cloralosato, l’S-gaiazulene determina ipotensione, rilasciamento cardiaco, apnea transitoria seguita da tachipnea persistente, attenuazione della reflessività neurovegetativa ed esagerazione del peristaltismo intestinale. Nel cane, per dosi letali, la morte avviene per paralisi respiratoria.
La dose di g 0,70/kg somministrata per perfusione lenta e continua, uccide l’animale in 60’ circa; all’autopsia, dopo intossicazione acuta, l’S-gaiazulene si ritrova soprattutto nei polmoni, ma in tutto l’organismo se ne trovano tracce. I polmoni e i reni presentano lesioni infiammatorie.
Abbiamo creduto di riferire queste ricerche sebbene riguardino il gaiazulene poiché l’attività di questo non differisce da quella del camazulene. Precedenti ricerche comparative di Herz (68) sull'attività antiflogistica del camazulene e del gaiazulene, avevano infatti dimostrato che non esistono sensibili differenze di attività fra le due sostanze.
Secondo Kreitmair (69), l'azione spasmolitica della Camomilla, sarebbe dovuta ad una sostanza glicosidica o glicosidosimile, che si presenta come una polvere bruno-chiara, facilmente solubile in acqua, che in dosi elevate ha azione paralizzante sui muscoli lisci.
Ricorderemo inflne che l’effetto cancerogeno del 9-10-dimetil-1-2-benzenantracene, verrebbe diminuito da alcuni derivati del camazulene e da alcune frazioni dell’estratto acquoso di Camomilla (70).
Accanto a questi AA. che in base ai risultati delle loro ricerche, hanno creduto di poter attribuire alla Camomilla ed ai suoi derivati le attività farmacologiche e terapeutiche che abbiamo sin qui enumerate, altri ve ne sono che hanno ottenuto risultati del tutto negativi, specialmente per quanto riguarda l’attività antiflogistica. Così Hesse e coll. (71) negano alla Camomilla e all’azulene ogni attività antiflogistica. Pommer (72), pur confermando l’attività antiflogistica dell’azulene, contrariamente all’Albath non riconosce che di tale proprietà sia dotata anche la frazione di olio verde isolata e studiata da questo ultimo A. e il Mitolo (73) trova che il camazulene non ha alcuna influenza sulle reazioni allergiche provocate nella cavia.
Alle stesse conclusioni giungono Stein e Friebel (74) in base ai risultati da essi ottenuti con ricerche eseguite nelle cavie ed estese a parecchie centinaia di soggetti.
Brock e Coll. (75) hanno sperimentato l’azione antiflogistica del camazulene e dell’olio di Camomilla sulle chemosi provocate nel coniglio con l’olio di Senape e con raggi U.V. ottenendo risultati del tutto negativi, ciò che induce gli AA. ad escludere che il camazulene rappresenti il principio antiflogistico della Camomilla.
Il problema dell’attività antiflogistica degli azuleni e dei preparati di Camomilla (infuso), fu più recentemente affrontato dal punto di vista critico da Oettel e Kollmannsperger (76) i quali controllarono anzitutto la validità dei metodi più comunemente usati, per valutare l’attività antiflogistica degli azuleni (chemosi da olio di Senape nelle cavie e nel coniglio) e riscontrarono che tale metodo provoca facilmente la diffusione delle lesioni a tutti e due gli occhi dello stesso animale. Gli AA. sperimentarono quindi con questo metodo (sul coniglio), l’attività del camazulene, del gaiazulene, dell’infuso di Camomilla e di quattro azuleni sintetici, estendendo le prove ad un notevole numero di animali. In nessun caso essi ottennero un arresto del processo infiammatorio statisticamente significativo e ritengono per ciò che i risultati positivi fino ad ora ottenuti impiegando il metodo della chemosi da olio di Senape, non possano essere considerati sufficientemente attendibili e tali da fornire la prova che l’azulene rappresenti il principio antiflogistico della Camomilla. Gli AA, ritengono inoltre che siano da considerare prive di valore le considerazioni sulle analogie esistenti fra costituzione chimica e attività antiflogistica degli azuleni naturali e sintetici, formulate in base ai risultati ottenuti con il suddetto metodo.
c) Attività terapeutica
La Camomilla volgare, analogamente a quella romana, è largamente impiegata, sotto forma di infusi e di tisane preparate direttamente dai fiori o valendosi dei vari estratti (fluidi, molli, secchi). L’uso di queste preparazioni, in quanto prive di ogni tossicità, è particolarmente indicato negli stati di lieve ipereccitabilità nervosa delle donne e dei bambini.
Somministrati a piccole dosi, i preparati di Camomilla manifestano un’attività amaro-aromatica, stomachica ed antispasmodica, utile nei casi di infiammazione gastrica, negli stati dispeptici, nel meteorismo di origine spastica (Boas 77).
Alla Camomilla è stata riconosciuta anche un’azione antinevralgica (78) che si manifesta specialmente nei soggetti anemici ed un’azione emmenagoga utile nelle amenorree dovute a turbe nervose.
Secondo Reichert (79.) la Camomilla agirebbe sull’intestino come una mucillaggine, ritardando l’assorbimento e prolungando l’azione sulla mucosa intestinale dei farmaci contemporaneamente ingeriti. Occorre dire però, che dato lo scarso contenuto nella droga di sostanze atte ad esercitare l’azione protettiva cui l'A. sembra riferirsi, appare piuttosto improbabile che i preparati di Camomilla possano manifestare un’attività di questo tipo.
Hatzky (80) ha impiegato con successo un dializzato di Camomilla nella terapia di molte forme infiammatorie, interessanti l’ultimo tratto intestinale, nella colica mucosa e nella dissenteria amebica. Lo stesso preparato fu impiegato anche come profilattico, sotto forma di perle gelatinose, contro l’influenza, le forme anginose, il raffreddore e, localmente, nell'intertrigo e nelle irritazioni cutanee dei bambini.
Estratti di Camomilla somministrati per via endovenosa in pazienti affetti da cistite purulenta, hanno manifestato un’azione analgesica, antiflogistica ed antisettica [Wasiky (81)].
Risultati analoghi furono ottenuti da Arnold (82) il quale studiò estesamente l’attività di impacchi preparati con infuso di Camomilla e applicati sulla cute umana dopo avervi provocato delle reazioni infiammatorie valendosi di diversi agenti (chimici, fisici, allergici, tossici). In tutti i casi l’A. osservò un'evidente attività analgesica ed antiflogistica, mentre le prove di controllo eseguite con impacchi d’acqua calda, portata alla stessa temperatura, risultarono negative.
Il Rehdern (83) richiamò l’attenzione sul valore della Camomilla nei suoi vari impieghi in cosmetologia. Egli afferma che con preparazioni opportunamente ottenute, è possibile migliorare l’efficacia dei prodotti da applicarsi sulla cute, sul cuoio capelluto e anche di quelli che vengono aggiunti nell’acqua per bagno. Esperienze cliniche eseguite dal Brilli (84) con un prodotto a base di azulene, hanno dimostrato che questo esplica un sicuro effetto sulla mucosa gastrica infiammata. L’A. somministrava, il mattino a digiuno, 20 gocce del suddetto prodotto (soluzione di azulene allo 0,2 %) in bicchiere d’acqua tiepida, consigliando il paziente di porsi per 5' disteso sul dorso, poi sul fianco destro e sul sinistro. Egli trovò che l’azulene è dotato di un’attività nettamente antiflogistica sulla mucosa gastrica infiammata, provocando un regresso delle alterazioni morfologiche e la normalizzazione della secrezione dell’HCl con la conseguente scomparsa o l’attenuazione dei relativi disturbi.
Poiché secondo l'A., la gastrite cronica, sarebbe più comunemente dovu
Con l'azulene l'A. ha potuto osservare risultati favorevoli nell' 80 % dei casi. In questi, i controlli gastroscopici mostrarono un marcato miglioramento delle alterazioni morfologiche della mucosa e gli esami frazionati del succo gastrico misero in evidenza una normalizzazione dei disturbi funzionali. Il Brull raccomanda pertanto l'azulene come utile trattamento terapeutico delle gastriti, trattamento particolarmente efficace negli episodi acuti.
I dermatologi Zierz e Kiessling (85) hanno sperimentato clinicamente soluzioni e pomate a base di azuleni. Essi riferiscono di aver osservato un buon effetto analgesico, un'azione stimolante dei processi riparativi dei tessuti lesi (granulazione ed epitelizzazione) e un'azione protettrice contro i raggi. Essi notarono però che l'azione antiflogistica non corrispondeva ai reperti sperimentali. Nella prova anafilattica sulla cavia sensibilizzata con siero di coniglio, lo shock non comparve negli animali pretrattati con azulene. In base a questi risultati gli AA. conclusero che gli azuleni impediscono la liberazione dell’istamina dalla cellula. Ma poiché lo spasmo bronchiale provocato da istamina non é stato influenzato dall'azulene, sembrerebbe che l’istamina, una volta liberata non subisca più l'azione dell'azulene.
Riassumendo dunque, da tutto ciò che abbiamo sin qui esposto, emerge prima di tutto che gli AA. non sono ancora concordi nello stabilire a quale o a quali, fra i principi attivi contenuti nella Camomilla, debbano essere attribuite le proprietà terapeutiche che generalmente vengono riconosciute a questa droga e ai suoi derivati.
Appare inoltre che, mentre i risultati delle ricerche farmacologiche sono piuttosto discordi e tali da porre seriamente in dubbio l'attività antiflogistica della Camomilla e dei suoi derivati, quelli delle prove cliniche, depongono invece concordemente o quasi, a favore dell'esistenza di tale proprietà.
Così stando le cose ci si potrebbe, chiedere se l'evidente disaccordo esistente fra i risultati delle ricerche sperimentali e di quelle cliniche, non possa essere dovuto alla relativa attendibilità del metodo più comunemente impiegato per provocare uno stato infiammatorio sperimentale, del metodo cioè che consiste nello studiare l'azione antiflogistica sulle chemosi da olio di Senape, provocate negli animali da esperimento.
Non è improbabile infatti che l’isosolfocianato di allile contenuto nell'olio di Senape, analogamente ad altre sostanze vescicatorie e lacrimogene (come pure ai metalli pesanti, agli ossidanti, ad alcune sostanzi alogenate e arsenicali) agisca provocando una inibizione enzimatica, dovuta alla proprietà comune alle sostanze di questo tipo, di reagire elettivamente coi gruppi —SH degli enzimi e delle proteine tessutali, sostanze che Bacq (86) ha proposta di chiamare “tioloprive”. L'isosolfocianato di allile è infatti annoverato fra queste sostanze le quali sono caratterizzate dalla loro attitudine a provocare la contrazione del muscolo di rana e la sua ineccitabilità dopo lavoro, effetto questo che fu constatato da Lundsgaard nel corso di sue ricerche sull'acido monojodoacetico e che alcuni AA. (87) hanno proposto di chiamare appunto, « effetto Lundsgaard ».
Se il processo infiammatorio generato dall'olio di Senape trae origine da un tale meccanismo d'azione, è chiaro che i preparati di Camomilla e l'azulene non potrebbero esplicare, in questo caso particolare, quell'azione antiflogistica clinicamente dimostrabile allorché queste sostanze vengono fatte agire su processi infiammatori etiologicamente diversi. Occorrerebbe in questo caso, agire o con sostanze fortemente riduttrici (cianuri per es.), capaci di sbloccare i solfidrili proteici ed enzimatici che hanno reagito con la sostanza tossica, o portando a contatto del tessuto leso altre sostanze (quali per es. la dimercaptoglicerina o BAL). capaci di deviare l'azione della sostanza tossica, reagendo con essa più elettivamente degli enzimi e delle proteine tessutali.
Del resto, il metodo che si basa sulla chemosi da olio di senape, é stato ritenuto inesatto anche da altri AA., quali per es. Oettel e Kollmannsperger (76), Brock e coll, i quali ultimi hanno preferito impiegare i raggi ultravioletti (75) e Deininger (88) il quale ha descritto un nuovo metodo che permette di seguire lo sviluppo di lesioni provocate sulla coda di topo (cancrena, asportazione della coda, ottenute immergendola per 10’ in un bagno portato alla temperatura di 55°C.).
Ulteriori e più accurate indagini potranno chiarire le incertezze che ancora sussistono sui principi attivi responsabili dell'azione antiflogistica della Camomilla e sulla esistenza o meno di tale azione.
Occorre però riconoscere che, anche se questa non ha ancora ricevuto una piena conferma sperimentale, i risultati clinici sino ad ora noti, possono essere ritenuti sufficienti a giustificare l'impiego terapeutico della Camomilla e dell'azulene, per ottenere un'azione antiflogistica, antiallergica, riparatrice dei tessuti, oltre quelle leggermente sedativa, antinevralgica e antispasmodica.
Estratti e preparati vari
a)Estratto fluido alcool-idrosolubile (g 1 = LII gtt)
Dosi: g 1-5 pr dose.
b) Estratto fluido per tintura (g 1 = Lll gtt).
Dosi: come sopra.
c) Estratto fluido F. U. (g 1 = XLIl gtt).
Dosi: come sopra.
d) Estratto fluido detannizzato (g 1 = XXXVI gtt).
Dosi : come sopra.
e) Estratto fluido etereo per olio.
Uso esterno.
f) Estratto molle acquoso (una parte = 4 p. circa di droga).
Dosi: g 0,25-1.25 pro dose.
g) Estratto secco acquoso (una parte = 6 p. circa di droga).
Dosi: g 0,15-0.80 pro dose.
b) Tintura al 20 % di droga.
Dosi: a cucchiaini.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido camomilla volgare per tintura …………… g 20
Alcool di 70°……………………………………………………………. g 80
(a cucchiaini)
Sciroppo
Estratto fluido camomilla volgare F. U. o alcool-idrosolubile . .g 10
Sciroppo semplice F, U……………………………………….. g 90
(a cucchiai)
Soluzione da sostituirsi all’infuso
Estratto fluido camomilla volgare F.U…………………….. g 5
Acqua…………………………………………………………………… g 95
(a bicchierini)
Elisir
Estratto fluido camomilla volgare F. U………………… g 200
Tintura di vaniglia alcool-idrosolubile………………. g 100
Sciroppo semplice F. U……………………………………. g 500
Acqua q. b. a……………………………………………………. g 1000
Lasciare in riposo e filtrare.
(a bicchierini)
Elisir
Estratto fluido camomilla volgare F.U…………………. g 200
Vanillina……………………………………………………………… g 0,5
Sciroppo F. U…………………………………………………….. g 500
Acqua q. b. ………………………………………………………. g 1000
(a bicchierini)
Elisir di camomilla composto
Estratto fluido camomilla volgare F.U…………………. g 60
Estratto fluido camomilla romana………………………… g 80
Estratto fluido angelica………………………………………….. – g 6
Estratto fluido rabarbaro…………………………………….. g 0,5
Estratto fluido iride fiorentina………………………………… g 5
Estratto fluido genziana………………………………………… g 5
Estratto fluido arancio dolce alcool-idrosolubile………….. g 40
Alcool di 95°……………………………………………………. g 1400
Zucchero
Acqua………………………………………………………………….. ana g 1200
(a bicchierini come digestivo)
Gocce eupeptiche
Estratto fluido camomilla volgare………………………….. g 2
Tintura genziana
Tintura noce vomica…………………………………………….. ana g 40
(VIII-X gtt prima dei pasti)
Olio di camomilla
Estratto fluido etereo…………………………………………… g 20
Olio di olive g 80
(per uso esterno)
BIBLIOGRAFIA
(1) KAISER, EGGENSPERGER e BAERMANN, Siiidd. Apoth. Ztt., 68, 284. l»2g – (2) BERGMANN, Fharm. ZentratK, 71. 785, 1930 – (3) LIEBISCH, Chm. Ind.. 57, 7«2, 1934 – (4) ZIMMERMANN, Pharm. Ztt., 81, 1091, I93« – (5) WILL, Disch. Ap. Ztt., 53. 1479, 1938- («) SCHIMMEL, Ber. ScUmmel, 1939, 39 – (7) SCHMITZ B., Disch. Ap. Ztt., 93, 5«4, 1953 – (8) GRAHLE A., Dtsch. Ap. Ztt-, 96, 538, 1956
(») ROM, Pharm. Posi., 66, 109, 1933 – (10) GILDEMEISTER e HOFFMANN, Aelherlsche Ocle, 1914, p. 670 – (11) BIITERA, citalo da GUENTHER, The Essential OHs, 1932, voi. V, p. 441 • (12) AUGOSTIN B., Hrll il. Gew. Pfiam., IO, 86, 1927 – (13) HEEGER e ROSENTHAL, Pharl mode, 4, 383, 1949 – (14) GUENTHER^E., The Essential Olla, 1932, voi. V, p. 443 • (13) KOCH K., Arch. Pharm., 19, 424, 1942 – (16) KAISER e FREY, Disch. Ap. Ztg., 54, 882, 1939; 57, 155, 163, 1942 – (17) RUHEMANN e LEWY, Ber., 60. 2459, 1927 – (18) KOCH, Anh. Pharm., 280, 424, 1942 – (19) PFAU A. S. e PLATTNER P., Helv. Chim. Aera, 19, 858, 1936; 20, 224, 1937; 22, 202, 1939; 23. 768, 1940 – (20) STAHL E„ Naiiirwiss., 41, 257, 1954; Chem Ber., 87, 202, 505, 1626, 1954; Chem. Ab.f., 49, II614a, 147261, 1955 – (21) HEROUT V., CEKAN Z. e SORM F„ Chem. Usir, 48, 1071, 1948; Chem. Imi., 1234, 1956; Chem. Usty, 51, 756, I95T; Chem. Abs., 47, 8699 e 8702, 1953; 49, 96041, 1933; 51, 4970h, II313b, 1957 – (22) RUHEMANN e LEWY, Ber., 60, 2463, 1927 – (23) RUZI- CKA e RUDOLPH, Helv. Chim. Acro, 9, II8, 1926; II, 253, 1928 – (24) KLOBB, GARNIER e EHRWEIN, Bull. Soc. Chim., 7, 940, 1910 – (25) POWER e BROWNING, J. Chem. Soc., lOS, 2280, 1914 –
(26) JUNKMANN K, e WlECKOWSKl, Arch. exp. Paih. Pharm., 144, 1929 – (27) BEGUIN C„ Pharm.
Acla Helv., 7, 332, 1932; 8, 140, 1933 – (28) LANG W. e SCHWANDT K, Dtsch. Ap. Zig., 97, 8, 149, 1957 – (29) POLITIS J„ Proc. Inler. Botati., Stockholm Congr. 1950, 7, 367, 1953; Chem. Abs., 48, 12251e, 1954 – (30) GUENTHER E., HEEGER E. F. e ROSENTHAL C., Die Pharmatle, 7, 24, 1952 – (31) ROM, Ungar. Drogen-Versuchst. Budapest, 6, 296, 1930; WEHMER C., Die Pflanzensloffc^ 1930, p. 1243 – (32) KUHN K. C., Dtsch. Ap. Ztg., 92, 800, 1932 – (33) NEUWALD, Ztschr. Nalurforsch., 76, 60; 1952 – (34) MEYER F. Z., Ztschr. Nalur/orsch., 76, 61, 1952 – (33) HEUBNER W. e GRABÉ, Arch. /. exp. Paih. u. Pharmakol., ITI, 329, 1933 – (36) HEUBNER W, e ALBATH W., Ibld., 192, 383, 1939 –
(37) BRUEHL, Deul. Med. Woch., 77, 11, 1942 • (38) BLASZO, Schwelt. Med. IVoch., 222, 1940 –
(39) ROECKRATH, Sirahlenlerap., 82, 253, 1950 – (40) BURHANS, Ami. Prax., 3, 9,1951 – (41) TUCZEK, Med. Kilt!., 48, 1744, 1953 – (42) LUETZENKIRCHEN, Ibld., 48, 318, 1953 – (43) VIDA, Ibld., 48, 1288,
1953 – (44) PORZER, Aerzil. Prax., 5, 3, 1953 – (43) CAUJOLLE M. F, MEYNIER D. e HUYNH
N. A., Comunicaz. al «IX Congr, des Soc. de Pharm. du Sud de la Loire» – Clermonl-Ferrand 7-9. giugno 1957 – (46) HERZ A., Arznelm. Forsch., 3, 233, 1933 – (47) KOCH K„ Ardi. Pharm., 280, 424, 1942 – (48) JARETZKY R. e NEUWALD F., Ibld., 277, 50, 1939 – (49) KAGELMACKER E„ Duseri. MOnch., – (50) JANISTYN E., Par/, u. Kosm, 32, 3-4, 1931 – (51) BOSCH G., DIss. MOnchen, 1948 –
(52) KRUGER – NILSEN B., Arch. /. exp. Path. u. Pharmakol., 147, 197, 1934 – (53) KOLESTAEDT
E., STAAB E. e KESSLER W., Die Pharmazie, I, 218, 1946 – (54) ALBATH W„ Arch. /. exp. Path. u. Pharmakol., 193, 619, 1939 – (55) POMMER Ch., Ibld., 199, 74, 1942 – (56) JANKU J.. C. R. Soc. Blol., 151, 241, 1957 – (57) KOCK K., Areh. Pharm., 280, 424, 1942 – (58) WEGNER G„ Ibld., 283, 127, 1950 – (59) BOGS U. e MEINHARD J., Die Pharmatle, n. II, 633, 1953 – (60) MEINHARD J., Deul. Apoth. Ztg., 97, 2, 29, 1957 – (61) 3ANCSO, Nature, 160, 227, 1947 – (62) DITROI G„ Ophtalmologica, 120, 168-74, 1950; Am. 1. Ophtalmol., 34, 6478, 1951 – (63) THOMAS H. K., Pharm. Ind. Auleador/ I n'urti., 18, 3, 89-93, 1956 – (64) SCHIMERT G. e SCHWARZ K., Aerati. Forsch., 85, 1954 – (65) TOPESCO M., Bull. Acad. Roum., 12, 22, 1942 – (66) MEYER F., Ztschr. Natur/osch., 7 b, 61, 1952 – (67) CAUJOLLE F. e STANISLAS E., Ann. Pharm. Frane., 10, 6, 412-24, 1952 – (68) HERZ A., Arznelm. Forsch., 3, 233, I9S3 – (69) KREITMAIR, Citato da WOLFGRAMM io Die Pharmatle, 7, 9, 604, 1952 – (70) KRAULE M. A. e SCHMIDT F., Arch. Pharm., 190, 66-75, 1957 – (71) HESSE E., ALTNER W. e ZEPPMEISEL L., KHn. Woch., 1485, 1936 – (72) POMMER Ch., I.c. – (73) MITOLO G. R., Min. Ped., 6, 22, 918, 1934 – (74) STEIN A. e FRIEBEL H., Arznelm. Forsch., 7, 9, 343, 1957 – (75) BROCK N., KOITMEIER I., LORENZ D. e WEIGEL H., Arch. /. exp. Path. u. Pharmakol., 223, 450-64, 1954 – (76) OETTEL H. e KOLLMANNSPERGER G. W, Ibld., 222, 228, 1954 e 226, 473, 1955 –
(77) BOAS, Dlagnostic u. Ther. der Magenkrankheiten. Leipzig, 1925, Ther. d. Gegenwart., n. 1, 4, 1926 –
(78) LECLERC H., PrMUnch. Med. IVoch., p. 261, 1925 – (80) HATZKY H., Hed. Klln., n. 22, 1930 – (81) WASICKY R., Lehrbuch der Physlopharmakognosle, C. Fromme, Edll., 1929, 1932 – (82) ARNOLD W., ,4rcA. /. exp. Path. u. Pharmakol., p. 129, 1943; MOnch. Med. IVoch., 73, 19, 1926 – (83) REHDERN, Lein/ensider Ztg., 62, 439, 1935 – (84) BRDLL W„ Deul. Med. IVoch., 77, 1, 4, 1952 – (83) ZIERZ P. e KIESSLING W., Ibld., 11, 430, 1933 – (86) BACQ Z. M„ Experlenila, 2, 349 e 385, 1946 – (87) BACQ Z. M., GOFFART M. e AUGENOT P„ Bull. Acad. Roy. Mid. Belg., 255, 1940 – BACQ Z. M. Ibld. da p. 108 a 134 – BACQ Z..M. e DESREUX V., Exposé Annuels de Bloch. Méd., Vili ser., p. 67, 1948 – (88) DEININGER R., Arznelm. Forsch., 6, 394, 1956 – (89) JUNG F., SCHOETTENSACK W., MAHLER E. e BURCK- HARD L, Arch. / Path. u. exp. Pharmacol., 213, 255, 1931 – (90) STERN P. e MILIN R., Arznelm, Forsch., 6, 445, 1951 – (91) STERN P., Md., 9, 551, 1959 – (92) STERN P., Traveaux de l'Acad. de Sclen., 292, 57, 1957 (cit. da STERN P, I. c.) – (93) FELDBERG A. e TALESNl.K I., J. Physiol., 120, 530, 1953 (eli. da STERN P., I. c.) – (94) GIERTZ H. e HAHN F., Arznelm. Forsch., 9, 553, 1959 – (95) CEKAN Z. V. PROCHAZKA, V. HEROUT e F. SORM, Collection Czechoslov. Chem. Commun., 24, 1554-7, 1959; Chem. Abs.. 53, 201211, 1959 – (96) CHAIKELIS A. S., l.A.Ph.A., 35, 343, I9J9.


