Ipecacuana
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Fam. Rubiacee/Psychotriee)
Col nome di Ipecacuana sono in commercio radici di varie Rubiacee.
a) (Uragoga Ipecacuanha Baill.).
(Sin. – Cephaelis Ipecacuanha Willd. Roemer. Schult. Tissac. Rich. – Cephaelis emetica Pers. – Calicocca Ipecacuanha Brot. DC. Gom. Psychotria emetica Velloso (*) – Psychotria Ipecacuanha Mull. Arg. Calicocca Evea Brot.).
(*) non deve essere confusa con la Psychotria emetica Mutis.
b) (Uragoga granatensis Baili.).
(Sin. – Cephaelis acuminata Karsten. ).
Ipecacuana- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – 1) Uragoga – Il nome linneano è Ouragoga (Hort. Cliff., 486, 1737): dovrebbe derivare dal greco ouron = orina e agw = promuovo, eccito, cioè con azione diuretica. Questo vocabolo fu infatti usato da Jacquin per una Celastracea/Rhamnoidea, la Myginda uragoga, dell'America centrale e del sud, le cui radici e foglie si prescrivono come diuretiche. Non è ben chiaro il perchè Linneo abbia dato questo nome a questo genere, a meno di pensare che il vocabolo ouros l’abbia usato nel senso di protettore, oppure oura non l’abbia fatto derivare da ouros vento favorevole o prosperità, nel senso di benessere, di salute, cioè pianta che dà la salute, che guarisce, protegge,
2) Ipecacuanha o Ipecacoanha o Ipepoacanha indios che derivano dalla parola della lingua Tupì “pecaogoene” = pianta vomitiva, che indicava anche altre varie piante della famiglia delle Menispermacee.
La parola preceduta da una I, che significa piccolo, = I-pecaogoene vuol dire piccola pianta vomitiva.
Secondo i vari Autori la parola ha diversi significati, secondo l’unione di diversi vocaboli Tupì.
/ = piccolo, pe = strada (che nasce ai margini delle strade), caa (o cao) = pianta, goene o guene = vomitare: cioè = piccola pianta che nasce ai margini delle strade e fa vomitare (Martius).
Secondo Saint Hilaire, da Ipe = corteccia (della radice), caa = pianta cua = odorosa, nha = striata, cioè: corteccia radicale di pianta odorosa, striata (per le strie longitudinali e trasversali). Ed anche Ipe = corteccia, caa = pianta, cua = che ha odore e nha = raggiata, stellata (per il capolino).
Altre interpretazioni sono: da Ipecacòaya derivante da Ypeg – aquai = penis do pato, per la forma che ha la radice della pianta (Gaetano), Ipeka = pato (anatra) e konha = membro, allusione, come la precedente, alla radice che ha l’aspetto dell'organo mascolino del palmipede (Barbosa Rodriguez). Secondo gli Indios delI’Anahuac, la Conca lacustre del Messico, i Maia, da cipo-kaa-kuéne = pianta volubile (liana) a radice vomitiva (Lofgrèn).
3) Cephaelis, dal greco kejalh = testa e eidos = forma, aspetto somiglianza, per le infiorescenze che assomigliano a capolini.
granatensis – della Nuova Granada (capitanìa spagnola) (Colombia).
Nomi volgari – a) Ipecacuana anellata minore, Ipeca di Rio o del Brasile –
b) Ipecacuana anellata maggiore, Ipeca di Cartagena.
Il nome Poaya (Cephaelis Ipecacuanha Baill.) deriva da Ycipò = piccola liana e ayacà = cesto, cioè liana per fare i cesti; che indicava una specie rampicante, non precisamente nota, con radice vomitiva. Da Y-cipòayaca, i Portoghesi, per elisione di due sillabe, (Yci e ca), fecero Poaya. Il raccoglitore delle radici = poayero. Secondo Martius, da capò – ayba = radice contro i mali.
Non va confusa con la Poaya – mineira (hab. Minas Geraes) il cui caule ascendente viene usato, per far cesti, la falsa Ipecacuana che corrisponde alla Heteropteris praguà (Vell.) Costa e Pekolt (fam. – Malpighiacee).
Habitat – a) Brasile (Matto Grosso, vallata del Parana, Maranhao, Pernambuco, Bahia, Espirito Santo, Rio de Janeiro, vallata del Rio Paraguay, Minas Geraes, Parà), Bolivia.
Coltivata in India or. (Darjiling (Bengala), Bombay, Nilgherries, Tinnevelly (Madras), Nella Malesia (Straits Settelments, Johore, Sélagor, Singapore). Burma.
b) Venezuela, Colombia, vallata umida del rio Sinù, Saint Onofre, bacino dell'Atrato (fiume) (golfo di Darien). E’ abbondante soprattutto in Colombia, da dove viene esportata specialmente dai porti di Baranquilla e di Cartagena (da ciò il nome).
Piccole piante perenni.
Parti usate – Le radici (Ipecacuanhae radix F.U.).
Usata dalla epoche anteriori alla scoperta dell’America dalle popolazioni indigene del Brasile.
Il primo storiografo che la indicò fu Grabriel Suares de Souza (Tratado descriptivo do Brasil, 1587, pag. 187) col nome di pecacuen.
Ne riferì poi frate Fernào Cardim, confermando le proprietà antidissenteriche col nome di igpecacoaya (Tratados da terra e gente do Brasil, 1601).
Fu il monaco portoghese Manuel Tristan (non Michele e non Trystram o Tristam) infermiere del Collegio di Bahia, che aveva soggiornato per trent’anni in Brasile, dal 1570 al 1600, a far conoscere in Europa la droga, sotto il nome di Pigaya o Ipecaya, precisando che gli Indios la usavano come espettorante ed anche come vasocostrittore antiemorroidario. Nel 1672 un medico francese mr. Le Gras (o Le Gros) ne portò in Francia, dall America del sud, una certa quantità che cedette al farmacista Craquenel (o Craquenelle) sotto il nome di béconquille o racine d’or. Il medicamento usato senza criterio, perdette la reputazione che era stata indicata da Pison e Maregrav (o Marcgraff, non Maregraf) nel 1648 (Historia naturalis brasiliae). Circa quattordici anni dopo un negoziante di Parigi, mr. Garnier (non Grenier) in possesso di 150 libbre della droga, sperimentandola su se stesso ne elogiò il valore come antidissenterico al suo medico Afforty ed al suo discepolo Jaen Claude Adrien Helvetius, olandese. Il dr. Afforty non diede importanza alla cosa, ciò che non fece il discepolo Helvetius. Questi che esercitava a Reims, avendo ottenuto degli ottimi risultati, chiese a Luigi XIV il permesso di continuare i suoi saggi all'Hótel-Dieu di Parigi, dove potè dimostrare la sua efficacia. Il re concesse all’Helvetius il diritto esclusivo di vendita, sotto il nome di radix brasiliensis. Più tardi, avendo diversi nobili ed il Delfino di Francia avuto occasione di curarsi con questo medicinale, il re fu consigliato dal suo medico Antoine d’Aquin e dal suo confessore, il gesuita padre Francesco la Chalse, a comperare il rimedio tenuto segreto. Il re pagò 1000 luigi d’oro, ordinando all’Helvetius di renderlo pubblico. Helvetius si tenne la somma ed il segreto e s’accese una lite fra il medico e il Garnier, che chiese una compartecipazione. Il tribunale del Chàtelet decise a favore del medico ed il Garnier, indignato, svelò allora il segreto e l’uso del rimedio si divulgò rapidamente in tutta Europa.
Da allora incominciarono le sofisticazioni.
Secondo quanto riferisce il Lemery, un medico di Montpellier mr. Deliveau, che aveva soggiornato in America nei luoghi dove nasce la pianta, affermò in una lettera inserita nel Journal de Trévoux (Ain) (aprile 1708, pag. 651) che avendo fatto più volte esperienza sulle proprietà anche delle foglie, aveva in esse riconosciuto qualità eccellenti per tutte le malattie di colliquazione (eccessiva diarrea), per le affezioni di petto, per le ostruzioni, per provocare i mestrui delle femmine, per i mali di stomaco pericolosi per coloro che sono arrivati di fresco nelle Indie occidentali. Soggiunse che non può recarsi a quelle malattie rimedio alcuno che eguagli o che s’accosti alla eccellenza delle foglie dell’ipecacuanha.
Hooper confermò che le foglie ed anche la corteccia sono di poco meno ricche di principi attivi della radice.
Sofisticazioni – Sono numerose. Col nome di Ipecacuanha, vengono offerte, se si considera come officinale la sola Uragoga Ipecacuanha Baill. – Cephaelis Ipecacuanha Willd. – Psychotcia emetica Velloso (non Mutis), le radici della Uragoga granatensis Baill. – Cephaelis acuminata Karsten. Si devono ritenere una sostituzione perchè contengono gli stessi p.a. della prima.
Sono sofisticazioni le radici della Richardsonia brasiliensis Gom. (Ipecacuana ondulata) e quelle di Psycotria emetica Mutis (non Velloso) (Ipecacuana striata) (da non confondere con la Cephaelis emetica Pers.) che non contengono emetina. E quelle di:
Richardsonia scabra Rich. (sin. Spermococe exandra Rich.) – Poaya do campo (specie affine alla R. brasiliensis Gom.) (Ipecacuanha bianca o amilacea) – Brasile.
Cryptocorine spiralis Fisch. – Ipecacuana delle Isole Indio-Malesi (fam.
Aracee).
Manettia ignita K. Schum. – Ipecacuana di S. Paulo (fam. Rubiacee) – Brasile.
Banksia asplenifolia Kngt. et Sal. – Ipecacuana antipode (fam. Proteacee)
– Nuova Olanda.
Ruellia polyrrhiza Juss. – Ipecacuana bastarda antillana (fam. Acantacee)
– Antille.
Pedilanthus tithymaloides Poit. – Ipecacuana messicana o Candelilla (fam. Euforbiacee) – Messico (Tamaulipas).
Psoralea glandulosa L. – Ipecacuana d’America o del Cile (fam. Leguminose) – Cile.
Ionidium Ipecacuanha Vent. – Ionidium Ipecacuanha Vent. – Ipecacuana di Cajenna (fam. Violacee).
Ionidium polygalaefolium H. B. K. – Ipecacuanha del Pais (fam. Violacee) – Messico (Santa Fe, Valle de Mexico).
Hybanthus Ipecacuanha (L.) Taub. – Ipecacuana falsa del Brasile – (fam. Violacee) e la specie affine H. poaya St. Hil.
Asclepias curassavica L. (sin. A. bicolor Moench.) – Ipecacuana bastarda delle Antille, Ipecacuana di Madame Boivin (fam. Asclepiadacee) – America tropicale, Antille (Curaçao, Trinidad).
Euphorbia Ipecacuanha L. (sin. Anisophyllum Ipecacuanha Haw.) – Ipecacuana della Virginia e del Canada (fam. Euforbiacee).
Podophyllum peltatum L. – Ipecacuana della Carolina (U.S.A.) (fam. Berberidee).
Periploca mauritiana Poiret – Ipecacuana dell’Isola Bourbon (Réunion) – Isole Mascarene (fam. Asclepiadacee) (sin. Cynancum mauritianum Lamk.).
Triosteum majus Mich. (sin. T. perfoliatum L.) – Ipecacuana della Virginia (U.S.A.) (fam. Viburnee).
Cynancum vincetoxicum (Rich.) Pers. (sin. Asclepias vicetoxicum L.) – Vincetoxicum officinale Moench.) – Ipecacuana dei Tedeschi (fam. Asclepiadacee).
Naregamia alata W. et A. – Ipecacuana di Goa o dei Portoghesi (fam. Meliacee.
Tylophora asthmatica Wight. et Arn. – Indian Ipecacuanha (é sinonimo di Cynancum Ipecacuanha Rich. – C. vomitorium Lamk. – Asclepias asthmatica L. – e di Ipecacuana dell’Ile de france – Cynancum ipecacuanha Lamk.) (fam. Asclepiadacee).
Heteropterys praguà (Vell.) Costa e Peckolt. – Ipecacuanha mineira, Falsa Poaya (fam. Malpighiacee) – Brasile (S. Paulo, Rio, Minas Geraes), Argentina (Misiones, Posadas, La Granja) Colombia (Santa Marta). Alcune specie di Polygalacee – angulata DC., paniculata L., timoutou Aubl., lancifolia St. Hil., virgata Vell.
E varie altre piante quali la Machaonia brasiliensis Cham. et Schlecht. la Diodia polymorpha Cham. et Schlecht. la Lipostoma capitatum D. Don varie specie di Spermacoce (Borreria, secondo I. K. – B. capitata DC. (poaya botao) – B. verticillata Meyer. (poaya rosario) – B. poaya DC. (poaya do corrado).
Tutte queste piante sono note col nome volgare di poaya (da praia) (di spiaggia) (do campo) (del campo) ecc.
La poaya mineira corrisponde alla Heteropterys praguà (Vell.) – Costa et Peckolt.
Componenti principali
Alcaloidi: emetina, isolata nel 1817 da Pelletier e Magendie (1), poi da Glénard nel 1875 (2) ed infine, in forma pura, nel 1894 da Paul e Cownley (3); cefelina, e psicotrina, estratte nel 1894 da Paul e Cownley (3); O-metil-psicotrina ed emetamina, isolate nel 1917 da Pyman (4); protoemetina ed «ipeca-alcaloide A», separati dagli altri alcaloidi dell’Ipecacuana da Battersby e Harper nel 1959 ( 5).
Hesse (6) nel 1914, con i nomi di ipecamina e di idroipecamina, ha descritto due sostanze amorfe, di composizione chimica non definita. Un’altra base [criptopina (7) = emetoidina (8)] fu estratta in forma amorfa da Lloyd (7) nel 1916 e da Browne (8) nel 1917.

La composizione chimica degli alcaloidi dell’Ipecacuana è stata a lungo oggetto di studio (8a) ad opera specialmente di Paul e Cownley (1894-1901) (3), di Pyman e coll. (1914-1927) (4) (9-11), Windaus e coll. (1914) (12), Karrer e coll. (1917, 1948-1950) (13-15), Keller e coll. (1911-1925) (16), Spath e coll. (1927, 1948) (17) (18), Staub (1927) (19), Ahl e Reichstein (1944) (20), Robinson (1948) (21), Pailer e Porschinski (1949) (22), Battersby, Openshaw e coll. (1949-1959) (5) (23-26), Evstigneeva e coll. (1950-1953) (27) e di Santavy e coll. (1961) (28) . Anche la formula grezza dell’emetina è rimasta per un certo tempo in dubbio sino alla dimostrazione della formula attualmente accettata, C29H40O4N2, che è stata proposta da Carr e Pyman (9) e da Karrer (13). Come è stato chiarito dai lavori di Carr e Pyman (9), di Hesse (6) e di Karrer (13) l’emetina contiene quattro metossili. Keller e coll. (16) hanno inoltre messo in evidenza che nell’emetina un atomo di azoto è secondario e l’altro terziario. Per quanto concerne la completa definizione della formula di struttura, dopo i primi schemi proposti nel 1927 da Brindley e Pyman (11) e da Staub (19), finalmente nel 1949 Pailer e Porschinski (22) e, indipendentemente da questi, Battersby e Openshaw (25), hanno fissato per l’emetina la formula (I), che è stata successivamente (1952-1953) confermata per sintesi da Evstigneeva e coll. (27).
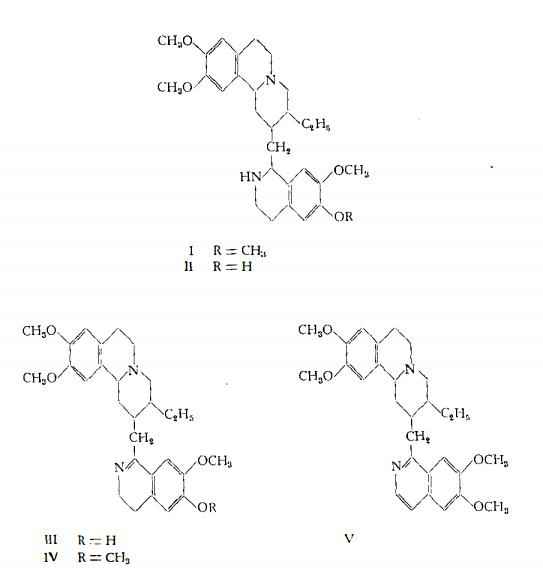
La cefelina, il principale tra gli alcaloidi secondari dell’Ipecacuana, contiene tre metossili ed un ossidrile fenolico, per metilazione del quale si ottiene emetina. La psicotrina, sottoposta a processo di riduzione, produce una miscela di cefelina e di isocefelina ed è convertita, mediante metilazione, in O-metilpsicotrina. L'emetamina è ottenibile per deidrogenazione catalitica dell’emetina (20). Vi è quindi una stretta relazione strutturale tra queste sostanze e perciò, stabilita la formula dell’emetina, il problema della costituzione degli altri alcaloidi si è ridotto alla determinazione del gruppo ossidrilico libero nella cefelina (22), individuato nello stesso punto in cui si trova nella psicotrina, ed alla definizione della posizione dei doppi legami nella psicotrina, nell'O-metilpsicotrina e nell’emetamina. Per l’O-metilpsicotrina e per la psicotrina, Brindley e Pyman nel 1927 (11) e Karrer e coll. nel 1948 (14) avevano supposto che il doppio legame fosse tra gli atomi di carbonio 1 e 9. Al contrario, in base all’esito di esami spettroscopici U.V. e I.R., Openshaw e Wood nel 1952 (26) e Battersby e coll. nel 1959 (5) hanno espresso l'opinione che il doppio legame si trovi tra le posizioni 1 e 2. In analogia con prove precedenti, eseguite sulla papaverina e su alcuni derivati di questa, Santavy e coll. nel 1961 (28) hanno saggiato per via polarografica emetina, emetamina e O-metiIpsicotrina, giungendo a definire la formula strutturale dell’emetamina ed a confermare le asserzioni di Openshaw e Wood (26) e di Battersby e coll. (5) per quanto riguarda la posizione del doppio legame tra gli atomi di carbonio 1 e 2 nell’O-metilpsicotrina e quindi anche nella psicotrina. Pertanto le formule assegnate alla cefelina, psicotrina, O-metilpsicotrina ed alla emetamina sono attualmente la Il, III, IV e V rispettivamente.
La struttura (VI) della protoemetina, proposta nel 1959 da Bettersby e coll. (5) , fa supporre che questa sostanza possa essere un precursore biogenetico deII’emetamina.
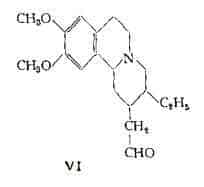
In linea generale quindi nella composizione degli alcaloidi dell’Ipecacuana entra un nucleo 7-etiI-1,2-benzochinoIizinico, in cui l’atomo di carbonio in posizione 8 è collegato, per mezzo di un gruppo metilenico con la posizione 1 di un nucleo isochinolinico oppure con un radicale formilico.
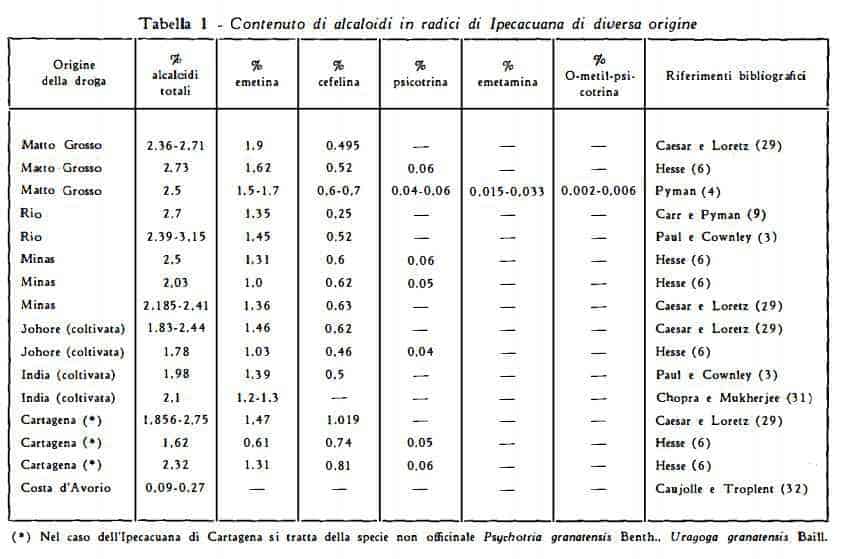
Contenuto di alcaloidi – Le radici di Ipecacuana di Rio (Brasile) contengono in generale più del 2 % di alcaloidi. Nella tabella seguente sono raccolti i risultati di analisi di droghe di diversa provenienza: brasiliane (Rio, Minas, Matto Grosso), indiane (Johore), della Colombia, del Venezuela (Cartagena) e della Costa d’Avorio.
Per la droga brasiliana in letteratura sono normalmente riportati titoli non inferiori al 2 % (3-6) (9) (29), ma in base a risultati analitici inediti si è dedotta la presenza di quantità anche notevolmente inferiori di alcaloidi [0,73 % per radici di provenienza Minas (33)].
Gli alcaloidi della droga brasiliana (Matto Grosso) contengono circa il 60-70% di emetina (4) (6) (29) (30). Nelle radici indiane si trova in media il 2 % di alcaloidi, di cui circa il 60 % è costituito da emetina (30) (31), ma le radici delle piante di età inferiore ai quattro anni ne contengono quantità minori. Gli alcaloidi delle radici di Cartagena consistono, in media, del 40 % di emetina, del 56 % di cefelina e del 2 % di psicotrina (3).
Altri componenti
Nelle radici di Ipecacuana sono stati inoltre trovati i seguenti composti glucosidici di struttura chimica non definita:
1) acido ipecacuanico di Willigk (34), con formula C14H18O7, modificata nella C17H26O10 da Kimura (35), secondo il quale l’acido ipecacuanico sarebbe un acido glucosidico;
2) ipecacuanina, descritta nel 1912 da Finnemore e Braithwaite (36) come un glucoside cristallizzabile e scindibile dagli acidi diluiti o dalla emulsina in glucosio ed in un aglucone fenolico;
3) ipecoside, isolato nel 1954 da Bellet (37), in forma cristallina, nella quantità dell’1 % dalle radici della Cephaelis Ipecacuanha. Secondo l'A., si tratta di un glucoside azotato o-difenolico di formula bruta C27H85O12N.
Sono stati trovati inoltre acido ascorbico mg 13,5 % nella droga fresca, mg 13,9% nella droga con 3,5 % di umidità (38), gli acidi malico e citrico, una saponina acida e resina (39); elevate quantità di amido (40). Ceneri: 1,8-2,72% ricche di potassio, calcio, magnesio e silicio (41); 3,34% nell’Ipecacuana di Rio, 3,21% nell'Ipecacuana di Bahia, 6,02% nell'Ipecacuana di Cartagena (29).
Dalla polvere di Ipecacuana (provenienza Rio) Berrens e Young (42) hanno estratto un allergene e l’hanno identificato con un complesso glucoproteico, contenente 10,4% di azoto proteico e 8,5 % di zuccheri riduttori (espressi come galattosio). Nella sostanza sottoposta ad idrolisi ed a cromatografia su carta, sono stati trovati gli amminoacidi cistina, lisina, arginina, asparagina, glutammina, treonina, glicina, serina, istidina, alanina, prolina, valina, leucina, isoleucina, tirosina, fenilalanina e triptofano. Negli idrolizzati ottenuti con acido debole sono stati identificati galattosio, glucosio, arabinosio e xilosio.
Proprietà farmacologiche ed impiego terapeutico
L’Ipecacuana è oggi usata quasi esclusivamente come espettorante, più raramente come emetico. Il suo effetto espettorante è dovuto alla lieve e durevole nausea determinata dalle piccole dosi, cui consegue una fluidificazione della secrezione bronchiale, una più facile espettorazione ed anche un'azione moderatamente diaforetica. L'azione emetica è determinata dalle dosi più elevate.
Tali proprietà sarebbero dovute, secondo Waters e Koch (43), alla emetina ed alla cefelina le cui azioni sono qualitativamente identiche, sotto questo aspetto, ma quantitativamente diverse, per la più elevata attività irritante e tossica di cui è dotata la cefelina.
Ambedue le sostanze, secondo Eggleston e Hatcher (44) agiscono eccitando direttamente il centro del vomito, ma l’effetto emetico che si manifesta dopo la somministrazione orale dei preparati della droga sembra essere dovuto, almeno in grande parte, all'azione irritante locale e quindi all'eccitazione delle terminazioni emetico-sensitive della mucosa gastrica. Tale irritazione però, allorché consegue alla somministrazione dei preparati della droga, non sarebbe dovuta, secondo Rosenthaler e Gordonoff (45), ai due suddetti alcaloidi ma soprattutto all’azione della saponina.
Azione antiamebica – Nei paesi di origine e nel Brasile in particolare, l’Ipecacuana, come già detto (vedi parte botanica), era usata da secoli come antidissenterico ed è appunto con questa indicazione che venne impiegata inizialmente in Europa. I risultati furono però incostanti: brillanti in certi casi e assolutamente negativi in altri, ciò che contribuì ad alimentare molte discussioni sulla reale attività della droga e sulla serietà di coloro che la consideravano come rimedio sovrano ed insostituibile.
Questa incostanza di risultati è oggi spiegabile semplicemente riferendosi alla diversa eziologia delle forme dissenteriche diffuse nei paesi di origine della droga (Brasile in particolare) e di quelle più comuni in Europa. E’ infatti nota oggi, la specificità con cui l'Ipecacuana e l’emetina agiscono sulla Entamoeba histolytica e sulle forme dissenteriche delle quali questa rappresenta l’agente patogeno. Ma, come vedremo in seguito, è oggi noto che l’emetina è dotata, oltre che di un potere amebicida sui trofozoiti della suddetta ameba, anche di un non trascurabile effetto batteriostatico su diversi gruppi di germi.
E' quindi presumibile che la droga agisca terapeuticamente verso alcune forme diarroiche e dissenteriche sostenute da germi sensibili all’azione dell’emetina e che resti invece inattiva in altri casi.
Il primo ad impiegare l’emetina nelle diverse forme dissenteriche, fu forse Bardsley nel 1829 (46). Wedder (47) nel 1911, osservò che l'Ipecacuana sotto forma di infuso all’1:10000 e l’emetina all’1:100000, inibiscono l’Entamoeba histolytica e affermò che sia l’una che l’altra sono prive di azione battericida. Vedremo in seguito come questa affermazione sia inesatta ma, per quanto riguarda l’azione antiamebica, Wedder stesso riferì di aver ottenuto, con l'emetina, buoni risultati nella terapia della dissenteria e delle epatiti amebiche.
Sulle forme mobili dell’Entamoeba, l’emetina agisce a concentrazioni poco elevate e tali da poter essere raggiunte nell'organismo con la somministrazione di dosi terapeutiche. Le forme cistiche sono invece molto più resistenti, tanto che non è possibile raggiungere una concentrazione attiva con l’impiego dell'emetina in dosi tollerabili.
Non ci dilungheremo sull’azione antiamebica dell'emetina, azione ampiamente trattata in tutti i testi di farmacologia e di terapia, ma completeremo questo capitolo ricordando brevemente le altre attività farmacologiche e terapeutiche che in base a più recenti ricerche sono state attribuite a questo alcaloide.
Melchior (48) nel 1946, segnalò limpiego dell’emetina nella terapia di alcune infezioni chirurgiche. Egli osservò che le infezioni peritonitiche conseguenti ad appendicectomia, come pure le infezioni postoperatorie delle vie biliari, venivano spesso e rapidamente dominate con la somministrazione di emetina alla dose quotidiana di g 0,04-0,06. Successive comunicazioni dello stesso A. (49-53), confermarono la particolare efficacia dell'emetina nelle infezioni da germi penicillinoresistenti, specie da coli ed in numerosi casi di infezioni postoperatorie (infezioni gravi delle vie biliari e del pancreas; nelle peritoniti purulenta, traumatica ed appendicolare; nella meningite purulenta traumatica, nell’edema gassoso, nelle tromboflebiti meseraica, appendicolare e mesenteriale; nei foruncoli maligni delle labbra, nelle infezioni gassose traumatiche ecc.).
Altri AA. [Messina (54)] estesero la terapia emetinica al trattamento della piorrea alveolare, con buoni risultati soprattutto nei casi di paradontiti in cui dominavano fatti infiammatori. Nei casi di paradontosi con fenomeni degenerativi, in assenza o quasi di flogosi locale, i pazienti trattati dall’A. non trassero invece alcun giovamento dalla terapia emetinica.
Che l’Ipecacuana e l'emetina siano dotate di un'attività inibente, oltre che sulle amebe, anche su altri gruppi di germi, è provato anche dai risultati di ricerche in vitro condotte successivamente.
La Mela (55), continuando alcune nostre indagini sull’azione antibiotica delle piante superiori, trovò che estratti fluidi di Ipecacuana a diversa gradazione alcoolica (30-70°) sono dotati di potere inibente verso i coli, gli Staf. aureo, albo e di Oxford; verso il Dipl. vitelli e il B. anthracis. Analogamente, la Lambin e la Bernard (56) trovarono che l'emetina, alla concentrazione minima di g 0,35/l, inibisce lo sviluppo del Mycobact. tuberculosis coltivato in terreno di Sauton-siero e che, alla concentrazione di 5-50 mg/l, ritarda la moltiplicazione del Micrococcus piogenes aures, pur non avendo su di esso, un effetto significativo a crescita avvenuta (57).
Le osservazioni inoltre di Griveaud e coll. (58), di Thuong Dinh Wy (59), di Martin (60), di Reynon (61), sull’azione dell'emetina nella terapia dell'herpes zoster, indicherebbero che lo spettro di attività di questa sostanza si estende anche verso i virus.
Da altri AA. infine, venne posta in evidenza l’attività antielmintica dell’emetina contro le infestazioni da tricocefalo, da anchilostoma, da ascaridi e da echinococco, nell’uomo e negli animali [Burrows e coll. (62), Durbin (63), Reese e coll. (64)].
y:arial unicode ms”>Risulta dunque da tutto ciò, che l’attività dell'emetina, come sostanza antibiotica e veleno protoplasmatico, non è limitata alle sole amebe ma che si manifesta con uno spettro d’azione piuttosto ampio, comprendente oltre le amebe, qualche virus, molti germi patogeni e alcuni elminti.
La tossicità protoplasmatica, dell’emetina si manifesterebbe anche negli animali superiori e nell’uomo in particolare, con uno speciale tropismo cardiaco, capace di determinare fra l’altro, alterazioni elettrocardiografiche consistenti in segni di danno miocardico generico, disturbi del ritmo e della conduzione. Secondo Marino e Robertaccio (65), l'emetina dovrebbe essere dunque considerata come una sostanza dannosa alla funzione cardiaca e pertanto essi consigliano di esaminare attentamente le condizioni cardiocircolatorie del paziente, prima di iniziare il trattamento emetinico.
Anche Sodeman (66) che ha condotto un attento studio sugli effetti tossici dell’emetina, pur ritenendo che le modificazioni elettrocardiografiche che si rilevano abitualmente nel corso della terapia emetinica, non sono tali di solito, da consigliare la sospensione del trattamento, avverte che il medicamento dovrebbe essere per quanto possibile evitato nei cardiopazienti.
De Cossio (67), su 45 pazienti trattati con emetina e sottoposti a controllo elettrocardiografico prima, durante e dopo il trattamento, osservò che le alterazioni elettrocardiografiche continuano anche dopo interrotta la somministrazione e che i tracciati tornavano alla norma soltanto dopo 6 settimane. In un caso di intossicazione mortale, l’esame istologico del miocardio rivelò fatti di degenerazione miocardica acuta.
Alterazioni dell'attività del cuore isolato di rana vennero osservate anche da Porro (68), sia sul tracciato miocardiografico che sull’ECG, per aggiunta di emetina al liquido di perfusione, alla conc. di 20-30 g/cc, alterazioni queste che verrebbero antagonizzate dall’ATP aggiunto al liquido di perfusione contenente emetina, alla conc. di 100 g/cc. Gli effetti cardiotossici dell’emetina, vennero inoltre studiati da Deitrich e Heim (69) su alcuni processi respiratori di omogenati di cuore di ratto. I risultati delle loro ricerche dimostrerebbero che l’emetina esercita un effetto inibitore sulla respirazione endogena dei suddetti omogenati. L'effetto inibitore dell’emetina si osserverebbe anche in presenza di glucosio, di piruvato, di fumarato e di inalato, mentre un effetto stimolante sarebbe da essa determinato in presenza di succinato e così pure accresciuta, risulterebbe anche l'attività di una ossidasi ottenuta dal cuore di ratto.
Secondo gli AA., gli effetti cardiotossici determinati dall’emetina sarebbero, almeno in parte, dovuti all’aumentata ossidazione del succinato.
Lasslo e Kimura (70) hanno studiato alcuni derivati quaternari della emetina da essi sintetizzati, dimostrando che la trasformazione di uno o di ambedue gli N terziari contenuti nella molecola dell'emetina, in quaternari, conduce a composti dotati, rispettivamente, di una minor o maggior attività curarosimile. Essi hanno potuto constatare che l’N-N'-dietiletilsolfato di N-metilemetina, è dotato di un’attività curarosimile molto elevata e tale da raggiungere di quella del cloridrato di tubocurarina.
La polvere di Ipecacuana può dar luogo a reazioni allergiche o anafilattiche in alcuni soggetti. Widal e coll. (71) ritengono che tali reazioni, prodotte da inalazione di polvere di Ipecacuana (riniti, asma) siano di tipo anafilattico o allergico, delle quali però l’emetina non sarebbe la sostanza responsabile. Lo stesso Widal e coll. dimostrarono infatti che pazienti sensibili alla polvere di Ipecacuana, danno reazioni negative alla emetina, ciò che venne successivamente confermato da Storm van Leeuwen (72). Molto verosimilmente l’allergene è dato dalla sostanza estratta dall’Ipecacuana da Berrens e Young (42), la quale sostanza iniettata per via intracutanea a pazienti allergici alla polvere della droga, ha prodotto reazioni positive, che sono invece mancate in soggetti non allergici.
Terapia – Abbiamo già detto dell’attività specifica dell’emetina verso l’Entamoeba histolytica e del suo impiego nella terapia della dissenteria amebica e di altre forme diarroiche sostenute da germi sensibili alla sua azione. Occorre tuttavia tener conto del fatto che non sempre e non in tutti i casi si ottengono, mediante la terapia emetinica i risultati attesi. Manson-Bahr e Sayers (73) ritengono che l’azione dell’emetina è tanto più sicura quanto più i sintomi sono acuti e che non è quindi indifferente impiegarla in uno stadio della malattia piuttosto che in un altro. Lo joduro di emetina e bismuto che essi hanno usato, avrebbe l’inconveniente di determinare facilmente la nausea e il vomito. In base alla loro esperienza, il miglior metodo di cura sarebbe quello di combinare il trattamento a base di joduro di emetina e bismuto con lo yatren.
Nei casi di dissenteria amebica cronica che non reagivano più alla semplice terapia emetinica, Siguier (74) avrebbe ottenuto buoni risultati con un altro tipo di terapia combinata (d’attacco) e cioè quella consigliata da Hargreaves e Blanc (75) che prevede l’impiego simultaneo di emetina, penicillina e solfoguanidina. Tale terapia non sarebbe rivolta tanto verso le amebe, contro le quali la penicillina è priva di azione, quanto contro le infezioni intestinali associate cui gli AA. attribuiscono un ruolo aggravante di primo piano. Il cloridrato di emetina veniva somministrato per iniezione alla dose di g 0,06 al giorno in una volta, durante i primi 7 giorni e associando all’emetina piccole dosi di stricnina. La cura veniva continuata, a partire dall’ottavo giorno, con g 0,04 di cloridrato di emetina sino a raggiungere la dose totale di tanti cgr quanti sono i kg di peso corporeo del malato. Durante la prima settimana, insieme con la dose quotidiana di g 0,06 di emetina, venivano somministrate 200000 U. di penicillina ripartite in 8 iniezioni distanziate di 3 ore, per una dose totale di 1400000 U. nei 7 giorni. Veniva somministrata inoltre la solfoguanidina, per os, alla dose di 4 g, 4 volte al giorno, per un totale di 112 g nei 7 giorni.
I risultati, secondo Siguier, sarebbero ottimi e anche se la guarigione definitiva non si ottiene che nel 50 % dei casi trattati, in tutti gli altri si otterrebbero considerevoli vantaggi.
Nella dissenteria amebica dei lattanti Teitel (76) consiglia un altro trattamento combinato, consistente nella somministrazione parenterale di dosi opportune di cloridrato di emetina, e nel praticare simultaneamente irrigazioni e clisteri con una soluzione di rivanolo e di yatren. Il trattamento è quindi completato alla fine, con la somministrazione di piccole dosi di spirocid o di stovarsolo.
L’A. afferma che allorché il dosaggio è appropriato e il preparato di emetina è puro, non si osservano quasi mai fenomeni tossici.
Oltre nei casi in cui l’amebiasi interessa il tratto intestinale, il trattamento emetinico risulta efficace anche in quelli, più rari, di complicazioni dovute a localizzazione in altri organi.
Lo stesso Siguier (77) descrive l’emetina come efficacissimo rimedio nella amebiasi epatica. Collard e Kendal (78) hanno comunicato la guarigione di un paziente affetto da amebiasi dell’encefalo sviluppatasi nel corso di una grave forma di dissenteria cronica e Langeron e coll. (79) hanno riferito il caso di un malato colpito da pleuropolmonite dopo un soggiorno in Algeria, i cui sintomi clinici e ematologici fecero ritenere agli Autori, trattarsi di una localizzazione amebica pleuro-polmonare. In questo caso la terapia emetinica condusse, nello spazio di 15 giorni, alla completa scomparsa dei sintomi clinici e radiologici.
Come espettoranti, i preparati di Ipecacuana (estratti, infuso, sciroppo, polvere del Dover) vengono impiegati isolatamente o, più spesso, associati ad altre droghe o sostanze ad azione bechica e balsamica.
Sotto forma di sciroppo, l’Ipecacuana si sarebbe rivelata di grande utilità nella terapia dell’asma bronchiale dei bambini, nei quali non provoca mai disturbi collaterali. In questi casi, l’adrenalina, somministrata a piccole dosi per via sottocutanea o per inalazione e lo sciroppo di Ipecacuana, rappresenterebbero, secondo Ratner (80), i farmaci elettivi. Ad essi può essere associata, in particolari circostanze e con tutta la prudenza che il caso impone, la terapia cortisonica, ma tutti gli altri medicamenti dovrebbero essere, secondo l’A., evitati.
Tossicità, eliminazione ed azione cumulativa
La tossicità dell'emetina è notevolmente elevata, negli animali da esperimento, allorché venga somministrata per via endovenosa. In questo caso, dosi minime sono già sufficienti per determinare la morte per arresto cardiaco.
Per via ipodermica nel cane, particolarmente sensibile all’emetina, dosi di 5-7 mg/kg provocano rapidamente la morte. Negli altri animali sono necessarie invece, dosi più elevate (da 1 a 3 cgr/kg),
Dall’uomo l’emetina può essere tollerata in maniera diversa in rapporto con la sensibilità individuale.
Secondo Campourcy e Moretti (81), da soggetti particolarmente resistenti, possono essere tollerate senza disturbi, dosi di 7-8 mg/kg. Esistono però casi di intolleranza nei quali dosi molto più deboli possono determinare fenomeni di intossicazione anche gravi. Blanc e Siguier (82) hanno riferito l’osservazione di uno shok emetinico in cui uno stato di collasso, seguì immediatamente alla prima iniezione di una dose terapeutica di emetina.
L’eliminazione dell’emetina avviene molto lentamente attraverso l’emuntorio renale. Una dose submortale iniettata per 4 giorni consecutivi nel coniglio, viene completamente eliminata soltanto dopo 60 giorni.
Anche nell’uomo l’emetina viene eliminata in maniera prolungata e discontinua. Mattei e Ribon (83) descrissero il caso di un malato al quale fu somministrata una dose complessiva di g 0,48 di emetina in 8 giorni, (g 0,06 al giorno), in cui l’eliminazione continuò sino a 60 giorni dopo la sospensione.
La lentezza con cui l’emetina viene eliminata dall’organismo, può condurre ad uno stato di accumulo e quindi alla comparsa di fenomeni tossici, ove la somministrazione venga troppo prolungata, oppure se i singoli trattamenti non vengano oppurtunamente interrotti con periodi di sospensione sufficientemente protratti.
Campourcy e Moretti ricordano che gli accidenti tossici dovuti ad emetina consistono essenzialmente, dopo i segni premonitori di nausea, di vomito, di tachicardia e di ipotensione, in polinevriti degli arti inferiori, in paralisi del plesso brachiale o estensive del tipo di Landry od altre, di miocardite, di disturbi del ritmo e della conduzione.
Controindicazioni – Abbiamo già accennato alla controindicazione del trattamento emetinico nei cardiopazienti e aggiungeremo ora che secondo Lecoq (84), esisterebbe una incompatibilità fra emetina e alcool, sotto forma di bevande alcooliche e quindi la controindicazione negli alcoolisti cronici, nei quali per ciò, il trattamento emetinico dovrebbe essere condotto con prudenza.
L’associazione alcool-emetina determina nel coniglio fenomeni tossici che sembrerebbero dovuti all’inibizione dei processi enzimatici che condizionano il metabolismo dell’alcool etilico, con conseguente aumento del tasso di acetaldeide e di acido piruvico nel sangue.
Estratti e preparati vari
a) Estratto fluido titolato all’ 1,5% di alcaloidi (emetina e cefelina) (g 1 = XLV gtt).
Dosi: I-V gtt pro dose come espettorante; L-C gtt come emetico, in due o tre volte nello spazio di ½ ora.
b) Estratto molle idroalcoolico F.U. titolato al 5% di alcaloidi (emetina e cefelina).
Dosi: g 0,003-0,02 pro dose come espettorante: g 0,2-0,7 come emetico.
c) Tintura F.U. titolata allo 0,2% di alcaloidi (emetina e cefelina).
Dosi: g 0,2-1 come espettorante; g 5-15 come emetico.
Preparazioni usuali e formule galeniche
Tintura F.U.
Estratto fluido ipecacuana……………………………………….. g 13,3
Alcool di 70°……………………………………………………………. g 86,7
(g 0,2-1 come espettorante; g 5-15 come emetico).
Sciroppo F.U.
Tintura F.U………………………………………………………………. g 10
Sciroppo semplice F.U……………………………………………. g 90
(a cucchiaini come espettorante; a cucchiai come emetico).
Sciroppi composti (espettoranti)
a) Sciroppo ipecacuana……………………………………… g 15
Sciroppo papavero rosso………………………………………… g 25
Sciroppo sena…………………………………………………………. g 50
Sciroppo arancio…………………………………………………….. g 10
Magnesio solfato…………………………………………………….. g 1,5
(a cucchiai).
b) Estratto fluido ipecacuana………………………………. g 20
Estratto fluido sena………………………………………………….. g 100
Estratto fluido timo composto…………………………………… g 30
Estratto fluido papavero rosso…………………………………. g 125
Estratto fluido di arancio dolce alcoolidrosolubile……. g 10
Sciroppo semplice F.U……………………………………………. g 2600
(a cucchiai).
BIBLIOGRAFIA
(1) PELLETIER J. e MAGENDIE F., Ann. chim. el phys., 4, 172, 1817 – (2) GLENARD A.. Compt. rend., 81. 100, 1875 – (3) PAUL B. H. e COWNLEY A. Fharm. 25, 111 e 373, 1894; Ibtd., 690,
1895; Amer. J. Ph.vstol.. 73, 57, 1901 – (4) PYMAN F. L, J. Chem. Soc., Ili, 419, 1917 – (5) BAT- TERSBY A. R, e coll., Chem. tnd., 982 e 983, 1957; J. Chem. Soc., 1744, 1748, 2704, 3512, 1959 –
(6) HESSE O.. Lieb. Ann., 405, 1, 1914 – (7) LLOYD, J.A.Ph.A., 5. 1053, 1916 – (8) BROWNE, ibid., 6, 1041,1917 – (8a) Confr. con lANOT M. M. in MANSKE R. H. F. e HOLMES H. L., The Alkaloids, voi. Ili, 1953, p. 364 – MANSKE R. H.F., ibid., voi. VII, 1960, p, 419 – BOIT H. G„ Ersebnisse der Alkaloid- Chemie, bis 1960, p. 370 – CAPRA C, Filolerapia, 33, 66, 1962 – (9) CARR e PYMAN, J. Chem. Soc., 105, 1591, 1914 – (10) PYMAN F. L.. ibid., 113, 222, 1918 – (11) BRINDLEY W. H. e PYMAN F. L., ibid., 130 e 1067, 1927 – (12) WINDAUS A, e HERMANNS L„ Ber., 47, 1470, 1914 . (13) KARRER P„ ibid., 49. 2057, 1916 e 50, 582, 1917 – (14) KARRER P., EUGSTER C.H., e RUETFNER O., Heh. Chim. Acla, 31, 1219, 1948 – (15) KARRER P. e RUETTNER O., ibid., 33, 291, 1950 – (16) KELLER O. e coll., Arch. Pharm., 249, 512, 1911; 251, 701, 1913; 265, 401, 1925 – (17) SPAETH E. e LEITHE W., Ber., 60, 688, 1927 – (18) SPAETH E. e PAILER M.. Monaish., 78, 348, 1948 – (19) STAUB H., Dissert. Zurich., 1927; He/v, Chim. Acla, 10, 826, 1927 – (20) AHL A. e REICHSTEIN T., ibid., 27, 366, 1944 – (21) ROBINSON R., Nature, 162, 524, 1948 – (22) PAILER M. e PORSCHINSKI K„ Monatsh., 80, 94 e 101, 1949 – (23) BATTERSBBY A. R. e OPENSHAW H. J., ]. Chem. Soc., 59 e 67, 1949 – (24) NORCROSS G. e OPEN- SHAW H. J., ibid., 1174, 1949 – (25) BATrERSBY A. R. e OPENSHAW H. I., ibid.. 5207, 1949; Experien- Ha, 5. 398, 1949; ibid.. 6. 378, 1950 – (26) OPENSHAW H. J. e WOOD H. C. S., 1. Chem. Soc., 391, 1952 – (27) EVSTIGNEEVA R. P., LIVSHITS R.S., BAINOVA M. S„ ZAKHARKIN L. I. e PREOBRAZHEN- SKII N. A., Dokiady Akad. Nauk. S.S.S.R., 75, 539, 1950; Zhur. Obshchei Khim., 22, 1467, 1952; Chem. Abs., 45, 7577, 1951; 47, 5949, 1953 – (28) MATUROVA M., HRBEK J. e SANTAVY F., Arch. Pharm., 294, 25, 1961 – (29) CAESAR e LORETZ, Cesch. Ber., 1903, sept., 1912, 77 – (30) BUECHI I., Arch. Pharm., 285, 40, 1952 – (31) CHOPRA R, N. e MUKHERIEE, Indian Med. Gaz., 67, 88, 1932 – (32) CAUJOLLE F. e TROPLENT L„ Ann. pharm. Iranf., 14, 501, 1956 – (33) Risultati analitici inediti – Laboratori Inverni & Della Beffa – Milano – (34) WILLIGK E.. ]. prakt Chem., SI, l, 424, ISSO – (35) KIMURA T., Arch. Intern. pharmacod. et de thét., U, 405. 1902-1903 – (36) FINNEMORE H. e BRAITHWAITE D., Pharm. J., 35, 4, 136, 1912 – (37) BELLET M. P„ ,4nn. pharm. franp., 12, 466, 1954; Brevetto Ger. 1.060.089, 25 giugno, 1959; Chem. Abs-, SS, 12781 b, 1961 – (38) GIRAL F. e AGUILAR M. D„ Céencla (Mex.), 12, 283, 1953; Chem. Abs., 4S, 4177 a, 1954 – (39) KELLER O. e BORGGREFE, Festschrift f. A. Tschirch, 1926, 85 – (40) BLANQUET L„ Thesis, Bordeaux, 1928 – (41) HOLMES E. M. e BLAKE G. S., Pharm. !.. 28, 764, 1909 – (42) BERRENS L. e YOUNG E., Biochim. et Biophys. Acta, 63, 561, 1962 – (43) WATERS e KOCH, J. Pharmacol. exp. Therap., 10, 73, 1917 • (44) EGGLESfON e HATCHER, Ibld., 21, 1, 1933 – (45) ROSENTHALER e GORDONOFF, Schweli. med. Woch., n. 20, 650, 1937 – (46) BARDSLEY, cit. da GOODMAN L. S. e GILMAN A. in 4The Pharmacological basis of Thera- peulics», McMillan Comp. New York 1955, p. 1210 – (47) WEDDER, J.A.M.A., 62, 501. 1914 – (48) MELCHIOR E„ Presse Méd., n. 53. 729, 1946 . (49) MELCHIOR E., Schweiz. med. IVoch., n. 29, 673, 1949 – (50) MELCHIOR E., Wlen. Klin. Woch., n. 35-36, 581, 1949 – (51) MELCHIOR E., Istanbul Contrib. CUn. Sci., 2, 77, 1952: Chem. Abs., 48, 5375, 1954 – (52) MELCHIOR E, Emeline, seine Wirk- samkeit auf schwere chirurgische Infekte, F. Enke ed. Stuttgart 1954 – (53) MELCHIOR E., Medizlnlsche, 3, 1241, 1954 – (54) MESSINA A., Ross. Clln. Sci., 30, 21. 1954 – (55) MELA C., Fitoterapia, n. 2, 1950 – (56)LAMBIN S. e BERNARD I., Compt. rend. soc. blol., 147, 138, 1953 – (57) LAMBIN S. e BERNARD I, ibld., 149, 492, 1955 – (58) GRIVEAUD e coll., Zbl. Haut. Geschl. Krank., SS, 5-6, 286, 1954; Semaine des H6p., n. 11, 1959 – (59) THUONG DINH WY, Presse Méd., n. 45, 955, 1954 – (60) MARTIN C.. lourn. de Méd. de Bordeaux, gennaio 1955 – (61) REYNON M., Zbl. tes. Opht., 64, 1-2 12, 1955 – (62) BURROWS e coll., Kongr. Zbl. Inn. Med., 118, 7-9, 417, 1948 – (63) DURBIN CH., Vtsch. TieràrZtl. Woch., n. 37, 439, 1953 – (64) REESE e coll. Klin. Woch., n. 41-42, 1131, 1956 – (65) MARINO A. e ROBERTACCIO A., Folla cardiologica, 16, 91, 1957 – (66) SODEMAN W. A., Am. Heart. 1., 43, 582,
1952 – (67) DE COSSIO A. G., ibid., 43, 456, 1952 – (68) PORRO A., Boll. soc. Ir. blol. sper., 29, 2, 239,
1953 -(69) DEITRICH R. A. e HEIM H. C., J.AJ’h.A. ed. sci., 45, 562,1956-(70) LASSLO A. e KIMURA
K. K., ibld., 39, 43. 1950 – (71) WIDAL F., ÀBRAMI P. e JOLTRAIN E., Presse Méd., 30, 341, 1922 – (72) STORM VAN LEEUWEN W., Therap. Gegenw., 65, 97, 1924 – (73) MANSON-BAHR PH. e SAYERS E. G., Brit. Med. ]., II, p. 490, 1927 – (74) SIGUIER F., Presse Méd., SS, 53, 604, 1947 –
(75) HARGREAVES e BLANC, Arch. des maSadies de l’App. digest., 36, 33, 1947; cit. da SIGUIER, Le. –
(76) TEITEL D., Wien. Klin. Woch., n. 8, 1929 – (77) SIGUIER F., Presse Méd., 64. 60. 1401, 1956 – (78) COLLARD P. e KENDALL D.. Lnncer. n. 6462, 17, 1947 – (79) LANGERON L., D’HOURT H. e ZOGHBl E., Soc, Fran$ de Path. respìrat. 12 ott. 1958; ree. in Presse Méd., 66, 85, 1918, 1958 • (80) RATNER B., Giorn. Med. Prat., 34, 7-8, 263, 1959 – (81) CAMPOURCY A. e MORETTI G., Presse Méd., 63, 44, 922, 1955 – (82) BLANC e SIGUIER, cit. da CAMPOURCY e MORETTI ibid. – (83) MAITEI C, e RIBON, cit. da CAMPOURCY e MORETTI ibid. – (84) LECOQ R., Thérapie, 8. 70, 1953.


