Lichene Islandico
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Cetraria islandica (L.) Acharius – Fam. Parmeliacee/Cetrariee) (Sin. – Lichen islandicus L.)
Lichene Islandico- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Cetraria, diminutivo del latino cetra, piccolo e leggero scudo di cuoio del fantaccino romano. Allusione alle fossette rossastre o castano scuro, circolari o quasi, a superficie piana, irregolare, bollosa, con margine rialzato e crenulato che, qua e là, si vedono alle estremità dei lobi del tallo isolati o binati (gli apoteci). «Similitudinem apotheciorum cum ejusmodi perta coriacea» Pelta, come cetra, dal greco pelth = piccolo scudo, da cui peltasta, soldato di fanteria leggera greco,
islandica – questa specie non è propria dell'Islanda (Terra del ghiaccio, Atlantico settentrionale). Il nome deriva dal fatto che gli Islandesi la consumano come alimento. La raccolgono quando piove o di notte, la macerano nell’acqua per 24 ore, per eliminare le sostanze amare, la disseccano e la macinano (farina).
Lichen – il nome proviene dal fatto che si attribuiva a questi vegetali la virtù di guarire la impetigine, il lichene pilare ed altre malattie della pelle dette licheni.
Nome volgare – Lichene catartico, musco di terra, musco islandico, musco catartico (da non confondersi con i muschi delle Muscinee), erba rissa, Crep (piem.) ecc.
Iceland Moss [da non confondere con l’Irish Moss o Mousse d’Irlande cioè col Chondrus crispus Lyngb. alga delle Fioridee)]. (Carrageen).
Habitat – Vegeta nelle regioni fredde del globo (Groenlandia, Spitzberg, Svezia e Norvegia, Islanda, Russia, in America del nord, Asia (Himalaja). In Italia specialmente sulle Alpi centrali, sulle piante del sottobosco e dei boschi, sulla terra scoperta e sulle rupi. Anche nella zona subalpina e montana.
Sulle Alpi francesi, svizzere, austriache, in Spagna, Slesia, Turingia, Harz, nelle regioni meridionali danubiane.
Parti usate – Il tallo (la parte vegetativa) (Lichen islandicus F.U.), raccolto in primavera o in autunno.
Componenti principali
Glucidi: lichenina ed isolichenina.
Acidi lichenici: acidi lichesterico, protolichesterico, allo-protolichesterico, fumarprotocetrarico, usnico.
Lichenina ed isolichenina
1) Lichenina, (C6H10O5)n, in un primo tempo indicata come «amido di Lichene» (1), fu in seguito riconosciuta come miscuglio di polisaccaridi (2-4). Attualmente si distinguono due frazioni, lichenina ed isolichenina, entrambi polimeri del D-glucosio, ma con caratteri diversi, essendo la prima di tipo cellulosico ed avendo invece la seconda natura di amido.
La similarità della struttura della lichenina rispetto a quella della cellulosa è stata determinata in base all’analisi con processo di metilazione (5) ed in base all’isolamento dell’ottoacetato di a-cellobiosio come prodotto di acetolisi (6) (7).
Nella molecola della lichenina Carter e Record (8) hanno supposto la presenza di 60-230, Meyer e Gurtler (9) di 330 e Meyer, Noetling e Bernfeld (10) di 160 radicali di glucosio. Hess e Lauridsen (11) considerarono che la molecola avesse struttura lineare. Meyer e Gurtler (9) mediante processo di ossidazione con periodato hanno rilevato la presenza di legami b-1:3 e b-1:4 nel rapporto di 27 ± 4:73 ± 4. Boissonas (12), usando un altro procedimento, confermò questo rapporto.
Più recentemente, nel 1957, Chanda e coll. (13) hanno dimostrato che la lichenina è un polimero lineare contenente circa il 30% di legami 1:3- e 70% di legami 1:4-b-D-glucosidici. Peat, Whelan e Roberts (14), nello stesso anno, hanno confermato l'esito delle esperienze di Chanda e coll. (13), stabilendo che la lichenina è un b-glucano lineare, in cui sono presenti legami 1:4 e 1:3 glucosidici nel rapporto variabile da 2:1 a 3:1.
Lichenina è stata trovata, oltre che nella Cetraria islandica, anche in numerosi altri licheni quali Usnea barbata, Evernia vulpina (15), Cladonia alpestris, Parmelia furfuracea (16).
Un poliosio, ritenuto simile alla lichenina è stato estratto dall’Avena sativa da Morris (17) e poi, nella quantità del 3,4%, da Letzig (18). Acker, Diemair e Samhammer (19), con la reazione al periodato, hanno successivamente rilevato nel polimero dell’Avena sativa la presenza di legami 1:4 e 1:3-glucosidici. Peat, Whelan e Roberts (14) hanno in seguito riconosciuta l’identità strutturale della lichenina della Cetraria islandica e di quella dell’Avena sativa, mettendo in evidenza che la seconda non è accompagnata da isolichenina.
Il rendimento di lichenina della Cetraria islandica, ottenuto da Drake (16), è stato pari al 20-30%. Meyer e Gurtler (9) ne hanno ricavato il 9,5% e Hess e Lauridsen (11) tra il 6 ed il 9%. Drake (16) da altre specie di licheni ne ha estratte quantità inferiori: 2 % dalla Cladonia alpestris e 13% dalla Parmelia furfuracea. Contenuto nullo lo stesso A. (16) ha riscontrato nella Cladonia rangiferina e C. silvatica.
2) Isolichenina (destrolichenina, amido di Lichene), (C6H10O5)n, è il poliosio, estraibile dalla Cetraria islandica insieme con lichenina, dalla quale può essere separato allo stato puro mediante il procedimento di Chanda, Hirst e Manners (13).
Oltre che nella Cetraria islandica la isolichenina è stata trovata anche nella Parmelia abissinica (20), nella Roccella montagnei (21) e in vari licheni giapponesi (22).
Secondo Pringsheim (23) la isolichenina produce per idrolisi con diastasi il 100% di maltosio. Dalla isolichenina Karrer (24) ha invece isolato il 6% di mannosio e lo stesso A. con Joos (3) ne ha separato due frazioni, una delle quali costituita dal 21 % di mannosio e dal 35% di galattosio, l’altra probabilmente da glucosio, Meyer e Gurtler (4) hanno ricavato dalla isolichenina della Cetraria islandica cinque frazioni (frazione A costituita dal 100 % di glucosio, frazione B e D con glucosio <100%, frazione C con glucosio, galattosio e mannosio e frazione E non identificata). Infine Chanda, Hirst e Manners (13) hanno constatato che l’isolichenina è formata solamente da molecole di glucosio, unite da legami 1:4 e 1:3 glucosidi. Peat, Whelan, Turvey e Morgan (25) hanno confermato le asserzioni di Chanda e Coll, (13) ed hanno inoltre stabilito che i legami glucosidici hanno configurazione a. Il rapporto tra i legami 1:3 e 1:4, trovato da Chanda e coll. (13), è di 60:40 ed è vicino al rapporto 55:45, segnalato poi da Peat e coll. (14).
Nel Lichene islandica è stato trovato l’11 % di destrolichenina (isolichenina) (14a).
Acidi lichenici
I cosiddetti acidi lichenici contenuti nella Cetraria islandica sono: 1) lattoni di acidi grassi; 2) depsidoni derivati dell’orcinolo; 3) derivati furanici.
1) Lattoni di acidi grassi
Acido l-lichesterico (acido lichesterinico), C19H32O4, separato per la prima volta dalla Cetraria islandica (27) ed estratto poi anche da altri licheni [Nephromopsis stracheyi var. ectocarpisma Hue. (28), Parmelia kamtschadalis (29)], è stato identificato con il lattone di formula I (30).
Acido protolichesterico (acido protolichesterinico), C19H32O4, ottenuto dapprima dalla Cetraria cucullata Bell. (31), è stato ricavato nella forma destrogira dalla C. islandica L. e nella forma levogira dalla C. tenuifolia (Retz.) Howe (32). Per opera degli studi di Asano e coll. (30) risulta essere il lattone (II), la cui sintesi nella forma racemica è stata ottenuta da van Tamelen e Bach (30a).

Nella Cetraria islandica è stato trovato un contenuto di 0,1-1,3% di acido protolichesterico (32a).
Acido l-allo-protolichesterico (acido l-allo-protolichesterinico), C19H32O4, è stato isolato dalla Cetraria islandica da Asahina e coll. (32) (33), i quali ne hanno determinato la struttura, corrispondente a quella dell’acido protolichesterico (II), ma con diversa configurazione spaziale nel C in posizione 3.
2) Depsidoni derivati dall’orcinolo
Acido cetrarico, C20H18O9, fu estratto per la prima volta, in forma impura, dalla Cetraria islandica da Berzelius (34) con il nome di «cetrarina». Schnedermann (35) l'ha ottenuto allo stato puro cristallino e l'ha denominato acido cetrarico. Il ritrovamento come sostanza primaria nella Cetraria islandica è stato però negato da Hesse (36) (37), che lo ha attribuito alla formazione di acido cetrarico per azione dell’alcool etilico sull'acido fumarprotocetrarico. La composizione dell'acido cetrarico è stata studiata da Simon (38) (39), da Koller e coll. (40) (41) e da Asahina e Asano (42) e riferita a quella del depsidone III.
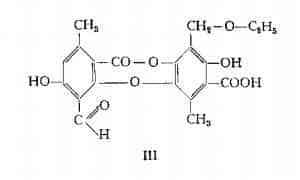
Acido protocetrarico, C18H14O9, è stato identificato agli acidi caprarico (43), fisodalico (44) e verosimilmente anche all’acido ramalinico (45), isolati rispettivamente dalla Parmelia caperata (46), P. physodes (47) e dalla Ramalina farinacea L. (48). Sembra che nella Cetraria islandica esso non si trovi originalmente come tale, ma derivi dalla decomposizione dell'acido fumarprotocetrarico (37). Asahina (49) ha identificato l’acido protocetrarico con il depsidone di formula IV.
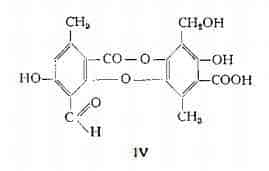
Acido fumarprotocetrarico, C22H16O12, Hesse (50) ha isolato dalla Cetraria islandica con il nome di acido protocetrarico. La formula grezza e quella strutturale, riferibile al depsidone V, sono state stabilite da Asahina e Tanase (51).
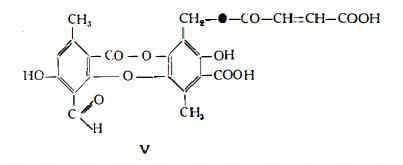
Per azione del calore, in soluzione acetonica, esso si scinde in acido fumarico ed acido cetrarico (40) (51).
Acido fumarprotocetrarico è stato estratto anche da diverse specie di Cladonia, quali Cladonia rangiferina Wainio (52), C. pyxidata var. neglecta (50), C. tenuis (53) e C. pityrea Fleck var. phyllophora Mudd. (54). Nel Lichene islandico è stato trovato il 2-3 % di acido fumarprotocetrarico (32a).
3) Derivati furanici
Acido usnico, C18H16O7, fu estratto in un primo tempo dall'Usnea barbata (55) (56) e così denominato da Knop (56). E’ stato designato anche con il nome di acido carbonusnico da Hesse (57), che l'ha isolato dalla stessa droga ed in seguito (48) l’ha identificato con l’acido usnico.
L’acido usnico è uno degli acidi lichenici più diffusi (26) (48) (57-62). Il composto destrogiro è stato trovato in molte specie di Usnea e di Ramalina ed in alcune specie dei generi Cladonia, Evernia, Parmelia, Lecanora, Nephroma, ecc.
La forma levogira è stata identificata in parecchie Cetraria e Cladonia ed in alcune specie di Alectoria, Haematomma, Placodium ecc.
Dalla Cetraria islandica e dalla Cladonia silvatica è stata ricavata la forma racemica.
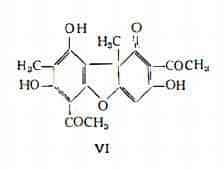
Lo studio della struttura dell’acido usnico ha condotto alla proposta dello schema VI di derivato (uranico (63) (64) (113).
Triterpeni
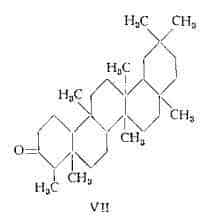
Friedelina, C30H50O, estratta per la prima volta dal sughero da Friedel (65), è stata isolata da Bruun (66) da 8 specie diverse di licheni, tra cui la Cetraria islandica; 10 kg di quest'ultima hanno prodotto 30 mg di friedelina (mg 0,3 % ). Gli studi sulla struttura, eseguiti da Drake e coll. (67-70) in un primo tempo e poi da Corey e Ursprung (71) e da Dutler, Jeger e Ruzicka (72) hanno permesso di assegnare alla friedelina la formula VII di chetone triterpenico pentaciclico saturo.
Componenti vari
Acido folico, acido folinico e vitamine del gruppo B12 (73), acido fumarico nel sublimato (74), mucillaggine, composta da glucosio, galattosio, da mannosio e da un acido uronico (75); ribonucleasi è stata trovata negli estratti di Cetraria islandica (76); grasso 1,4%, olio etereo 0,05 % e inoltre gomma, zuccheri e tracce di ferro (25a). Umidità nella droga commerciale 10-10,43% (in media 10,28%) (77). Ceneri 2,1% (78).
Il contenuto totale di glucidi è pari a circa il 70-80% (79).
Proprietà farmacologiche ed impiego terapeutico
Il Lichene islandico è noto da tempo alle popolazioni del Nord-Europa dalle quali era impiegato anche come alimento. Nell’Europa centrale e mediterranea venne conosciuto molto più tardi, tanto che le prime notizie di questo lichene si trovano nelle opere di Valerio Cordo che risalgono al 1627 (80). Il Dompier (81) in un suo scritto pubblicato nel 1698, lo raccomandava contro il morso degli animali velenosi e il Bartolino (1671) (82) considerava il Lichene un buon purgante da usarsi in primavera.
E' interessante notare come già nel 1700, Alao Borrichus, lo Scopoli e lo stesso Linneo, ne consigliassero limpiego nella terapia della tisi (83), impiego che potrebbe essere giustificato dai risultati delle recenti ricerche sull’attività antibiotica dell'acido usnico.
Questo componente del Lichene islandico, comune anche ad altri licheni, ha dimostrato infatti di essere dotato di una interessante attività antibiotica, estendentesi a diversi gruppi di germi.
Le prime ricerche farmacologiche sull’acido usnico sembrano essere quelle eseguite da Mikoshiba (84) il quale gli attribuì un’azione papaverinosimile sui muscoli lisci e ne determinò la tossicità su vari animali. Secondo i risultati ottenuti da questo A., la dose mortale nei topi è pari a 25 mg/kg endovena e a 700 mg/kg sottocute; nei ratti e nei conigli a 30 mg/kg endovena e a 40 mg/kg endovena nei cani.
Ma l’attività dell'acido usnico che ha destato il maggior interesse è quella antibiotica e le prime ricerche in questo senso ebbero inizio nel 1947, con quelle di Stoll e coll. (85), di Marshak (86), di Marshak e coll. (87) e di Barry e coll. (88).
Stoll e coll. trovarono che l'azione antibiotica dei licheni è legata al loro contenuto di acido usnico e che questa azione è notevolmente elevata contro il Mycobact. tuberculosis la cui crescita viene inibita già a concentrazioni di 1:500000-1:800000.
Bustinza e Caballero-Lopez (89) confermarono tale attività e trovarono che l'acido usnico associato alla streptomicina, ne aumenta l’attività sul Mycobact. tuberculosis e, inoltre, che è attivo anche sulla E. coli.
A queste prime ricerche seguirono numerose altre, quali quelle di Jantti (90) che saggiò l’attività antitubercolare dell’acido usnico in vivo sulla cavia, quelle di Meretoja (91)sull'azione antibatterica, quelle di Sato (92) sull’attività dell'usnina contro l’actinomicosi, quelle di Virtanen e coll. (93) sull’attività antibiotica di alcuni derivati dell'acido usnico, quelle di Virtanen (94) che dimostrarono che l'attività dell'acido usnico in vitro, sul bacillo tubercolare è dello stesso ordine di quella dei più noti antibiotici e chemioterapici quali la streptomicina, la diidrossistreptomicina, la neomicina, il PAS, l'idrazide dell'acido nicotinico e l'idrazide dell’acido cianacetico; quelle di Ascorbe (95) che dimostrarono l’attività antimicotica dell’acido usnico, quelle di Klosa (96) il quale trovò che diversi licheni sono attivi su alcuni piogeni, sui pneumococchi, sul difterico e sui tubercolari, sui quali ultimi però la sua attività viene ridotta in presenza di siero; quelle di Balegno e coll. (97) i quali trovarono l’acido usnico attivo verso alcuni germi gram-positivi ma non su quelli gram-negativi; quelle di Hildur-Krog (98) che dimostrarono l'azione batteriostatica dell’acido usnico sul B. subtilis alla concentrazione di 1:1000000 e stimolante l'accrescimento a conc. inferiori; quelle precedenti di Bylicka e coll. (99) secondo cui gli estratti acquosi alcalini e neutri di licheni, fra i quali la Cetraria islandica, non hanno attività antibiotica, mentre gli estratti ottenuti con solvente tamponato con fosfati a pH 7,4 o con HCl N/10, inibiscono la crescita della E. coli, dello St. aureus, del B. subtilis e di un micobatterio. L'attività degli estratti è, secondo questi AA., generalmente debole e dipende più dal metodo di estrazione che dalla specie dei licheni. Ma ciò che più sorprende è il fatto che i suddetti AA. avrebbero trovato che l'attività batteriostatica di cui sono dotati i licheni considerati, non è in relazione col loro contenuto di acido usnico.
Secondo ricerche precedenti di Doepp e Bersch (100) invece, l'estratto acquoso di Cetraria islandica e l'acido usnico sarebbero particolarmente attivi come tubercolostatici.
Mose (101), che impiegò per le sue ricerche sull'azione antibatterica dell'acido usnico, un prodotto puro, trovò, confermando i precedenti risultati ottenuti da Balegno e coll., che ad eccezione dei meningococchi e della Neisseria flava, solo i germi gram-positivi sono influenzati, mentre nessuna azione fu osservata sulle muffe e sui virus.
La concentrazione minima attiva sullo St. aureus e sulla Neisseria flava è stata trovata pari a 1:64000. Su 30 differenti ceppi di Clostridium tetani, l’acido usnico dimostrò aloni di inibizione di 10-12 mm, considerevolmente superiori quindi a quelli prodotti dalla penicillina e dalla streptomicina.
Quantunque esistano differenze di sensibilità fra ceppi molto diversi di St. aureus, soltanto uno si è dimostrato resistente all'azione dell'acido usnico. La sua attività differiva anche in relazione al solvente usato, al pH della soluzione ed era modificata dall'aggiunta di diverse polveri o eccipienti per pomate.
L'acido usnico non si altera per azione della temperatura o della luce e la tossicità sembra essere, anche secondo questo A., molto bassa. La somministrazione di 2 g di acido usnico puro a cavie di 408 g non ha provocato disturbi permanenti. Anche dopo la somministrazione di una dose così elevata, le urine emesse risultarono esenti da una qualsiasi attività batteriostatica.
Virtanen e coll. (102) studiarono il derivato 4-amino-3-isossazolidonico dell'acido usnico (cicloserina
Un sale dell’acido usnico, il benzildimetil-(2[2-(p-1,1,3,3-tetrametilbutilfenossi)-etossi]-etilusneato di ammonio, studiato dal Virtanen (104), è risultato particolarmente interessante per le sue caratteristiche di attività, di solubilità e di stabilità. Questo preparato, noto in Finlandia col nome di USNO, è impiegato con successo in alcune malattie della pelle (impetigine, piodermiti, dermatomicosi, moniliasi), nelle ustioni e nelle otiti [Paatsama e Talanti (105)].
Nella medicina veterinaria l’USNO è stato impiegato da Virtanen (106) nella terapia delle mastiti e da Virtanen e Kilpiò (107) nelle infezioni della cresta di gallo da Tricophyton gallinae, notando che le lesioni scomparivano dopo 9-12 giorni. Questi AA. hanno inoltre notato una azione inibente dell’acido usnico sui lieviti selvaggi.
In tutti i casi in cui è stato impiegato, l’USNO si è dimostrato più efficace della tirotricina e della bacitracina ed è risultato terapeuticamente attivo anche in quei casi in cui non si erano ottenuti risultati favorevoli con la tetraciclina.
La DL50 è risultata pari a 125 mg/kg per via endovenosa nel topo e la somministrazione di 25 mg al giorno a cavie, per un periodo di 119 giorni, non ha dato luogo ad alcun sintomo da intossicazione, mentre la somministrazione di 37,5 mg al giorno, nei conigli, per un periodo di 79 giorni ha prodotto alcuni effetti tossici [Virtanen e Kàrki (108)].
Mose (109) proseguendo le sue ricerche sull’azione dell'acido usnico, trovò che esso è capace di attenuare, sia in vitro che in vivo, l’attività della tossina tetanica mentre alcuna attività in questo senso, venne riscontrata per altri antibiotici (penicillina, streptomicina, tetramicina, cloromicetina, aureomicina, nebacetina).
La tossina tetanica miscelata in vitro con acido usnico, risultò meno attiva sui topi e una simile diminuzione di tossicità fu osservata dall’A. se l’acido usnico veniva iniettato agli animali entro 10’ dall’iniezione di tossina tetanica; nessun effetto invece è possibile ottenere se l’iniezione di acido usnico viene praticata dopo 10’.
Il massimo effetto dell’acido usnico sulla tossina tetanica si manifesta a pH 8,5.
Esperienze preliminari riguardanti l’impiego dell’acido usnico nel trattamento dell’infezione tetanica nei topi, dimostrarono anche in questo caso, un effetto positivo soltanto allorché esso veniva somministrato entro i primi 10’ dall’infezione, mentre nessun effetto si osservava se l’iniezione veniva praticata dopo un intervallo maggiore.
Un analogo effetto attenuante dell’acido usnico, venne osservato verso la tossina difterica ma, anche in questo caso, se la somministrazione dell’acido usnico avveniva non oltre i 10’ dall’infezione. Di una simile azione attenuante sulla tossina difterica sembrano essere dotati anche altri antibiotici, quali la penicillina, la terramicina e l’aureomicina, mentre la streptomicina è risultata inattiva sotto questo aspetto.
Sodeberg (110) ha studiato l’azione degli acidi lichenici (acido volpinico e acido usnico) sul metabolismo dei carboidrati. Questi acidi iniettati endovena nel gatto, sotto forma di sali sodici, alla dose di 10 mg/kg, provocano una immediata ipertermia.
Dosi superiori ai 10-30 mg/kg risultano generalmente letali. In alcuni casi la morte è probabilmente dovuta all’ipertermia, la quale in pochi casi supera i 45° (temp. rettale). Nei gatti in narcosi l’iniezione di usnato di sodio è seguita da un graduale aumento della glicemia arteriosa, la quale può raggiungere livelli di 300-400 mg%.
Nel lievito di birra i due acidi considerati, inducono una notevole fermentazione endogena, mentre la fermentazione dello zucchero risulta notevolmente inibita.
Marshal e Harting (111) hanno descritto l’azione antimitotica dell’acido usnico e Visner e Yudkin (112) studiando l’azione sulla fertilità delle sostanze antimitotiche sui topi, hanno notato che l’accoppiamento degli animali non era normalmente seguito da gravidanza allorché l’acido usnico veniva somministrato per os, alla dose di 1,5 mg in soluzione di NaOH N/100, prima o dopo la copulazione, ma si notava invece il regolare ritorno dell’estro e il ripetersi degli accoppiamenti.
Dopo somministrazione prolungata di acido usnico, gli animali presentavano una certa resistenza alla sua azione e la copulazione era regolarmente seguita da gravidanza la quale giungeva a termine, ma l’aspetto dei neonati e le curve di accrescimento, non si presentavano perfettamente normali. Alcuni soggetti tenuti in osservazione dimostrarono però di non aver subito alcuna conseguenza derivante dal trattamento materno con acido usnico.
Attualmente il Lichene islandico é impiegato di solito soltanto come amaro tonico mucillaginoso e come bechico emolliente. La presenza di sostanze mucillaginose conferisce ai preparati della droga, proprietà protettive sulle mucose infiammate o irritate, del tubo digerente, ottundendone la sensibilità di fronte agli stimoli fisici e chimici provenienti dal suo contenuto. In determinati casi esso può agire quindi come antiemetico e come antidiarroico e per queste proprietà i suoi preparati sono specialmente usati in pediatria.
Estratti e preparati vari
Estratto fluido (g 1 = XXXI gtt).
Dosi: g 0,5-1 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido lichene………………………………………………. ….g 20
Alcool di 20° g 80
(2,5-5 g pro dose).
Sciroppo
Estratto fluido lichene g 5
Sciroppo semplice F.U. ………………………………………………. g 95
(a cucchiaini o a cucchiai).
BIBLIOGRAFIA
(1) HONIG e SCHUBERT, Monatsh., 8. 452, 1887 – (2) KLASON, Ber.. 19, 2541, 1886 . (3) KARRER P. e JOOS B„ Z. physiol. Chem., 141, 311, 1924 – (4) MEYER K. H. e GURTLER P„ Helv. Chim. Acia, 30, 761, 1947 – (5) KARRER P, e NISHIDA, Helv. Chim. Àcta. 7, 363, 1924 – (6) KARRER P.. JOOS B, e STAUB M„ Helv. Chim. Ada. 6. 800, 1923 – (7) KARRER P. e JOOS B„ Blochem. Zeiischr., 136, 537, 1923 – (8) CARTER S. R. e RECORD B. R„ J. Chem. Soc., 664, 1939 – (9) MEYER K. H. e GURTLER P„ Helv. Chim. Ada, 30, 751, 1947 – (10) MEYER K, H„ NOETLING G. e BERNFELD P., Helv. Chim. Ada, 31, 103, 1948 â– (11) HESS K. e LAURIDSEN L. W„ Ber., 73B, 115, 1940 – (12) BOISSONAS R. A., Heiv. Chim. Ada, 30, 1703, 1947 – (13) CHANDA N. B„ HIRST E. L, e MANNERS D. J„ 1. Chem. Soc., 951, 1957; Chem. Abs., 51. 13774, 1957 – (14) PEAT S., WHELAN W. J. e ROBERTS J. G„ J. C/iem. Soc„ 3916, 1957 – (15) KARRER W„ Konslilution und Vorkommen der organischen PHanzensiofle, 1958, p. 282 – (16) DRAKE B„ Biochem. Zeiischr., 313, 388, 1943 – (17) MORRIS D. L., J. Biol. Chem., 143, 883, 1942 – (18) LETZIG E., Z. Lebensmit.-Vniersuch., 92, 170, 1951; Chem. Abs., 45, 4806, 1951 – (19) ACKER L„ DIEMAIR W. e SAMHAMMER E., Z. Lebensmil.-Vniersuch. u. Forsch., 100. 180, 1955; Chem. Abs., 49. 7142 f, 1955 – (20) KUMARA SASTRY V. V. e SESHADRl T. R., Froc. Indiati Acad. Sci., I6A, 137, 1942; Chem. Abs., 37, 1412, 1943 – (21) SUBBA RAO V. e SESHADRl T. R„ Froc. Indiali Acad. Sci.. 12A, 466, 1940; Chem. Abs., 36, 757, 1942 – (22) MINAGAWA T., J. Agrlc. Chem. Soc.. 9, 1198, 1933; Chem. Abs., 28, 2375, 1934 – (23) PRINGSHEIM H., Ber.. 57. 1581, 1924 – (24) KARRER P.. Z. physiol. Chem.. 148, 62, 1925 – (25) PEAT S„ WHELAN W. J„ TURVEY J. R. e MORGAN K„ J. Chem. Soc., 623, 1961 – (25a) Hagers Handubuch der pharmazeutischen Praxis, voi. li, 1927, p. 85 – (26) ASAHINA, Fortschritte der Chemie Organischer Naturstofle, 2, 27, 1939 • (27) SCHNEDERMANN G. e KNOP W., Lieb. Ann., 55, 144 e 159, 1845 – (28) ASANO M. e AZUMI T„ Ber., 68. 995, 1935 – (29) SHAH L. G.. J. Indian Chem. Soc„ 31, 253, 1954; Chem. Abs., 48, 13836, 1954 – (30) ASAHINA Y. c ASANO M„ J. Fharm. Soc. Japan, 539, 1, 1927; ASANO M. e KANEMATSU T„ Ber.. 65. 1175, 1932 . (30a) VAN TAMELEN E, E. e BACH S. R„ J. Am. Chem. Soc., 80, 3079, 1958 – (31) ZOPF v/„ Ueb. Ann.. 306, 282 e 292, 1899 – (32) ASAHINA Y. e YANAGITA M., Ber., 69. 120, 1936 – (32a) Kommentar zur Pharmacopoea Helvetica V, 1947, p, 525 – (33) ASAHINA Y. e YASUE M., Ber., 70, 1053, 1937 – (34) BERZELIUS, conlr. HERBERGER, Lieb. Ann., 21, 137, 1837 – (35) SCHNEDERMANN G., Ueb. Ann., 54. 143, 1845; SCHNEDERMANN G. e KNOP W„ Lieb. Ann., 55, 144, 1845 – (36) HESSE O, J. prakt. Chem., 62, 321, 1900 – (37) HESSE 0., ibid.. 70, 449, 1904 – (38) SIMON 0„ Arch. Pharm., 240, 521, 1902 . (39) SIMON 0„ Arch. Pharm., 244, 459, 1906 – (40) KOLLER G. e KRAKAUER E., Monatsh., 53/54. 931, 1929 – (41) KOLLER G. e KANDLER E., Monatsh., 56, 234, 1930 – (42) ASAHINA Y. e ASANO J„ Ber., 66, 893, 1933 – (43) ASAHINA Y. e YANAGITA M„ Ber., 66, 1217, 1933 – (44) KOLLER G. e LOCKER K„ Monatsh., 5S, 209, 1931 – (45) ASAHINA Y. e TUKAMOTO T„ Ber., 66, 1255, 1933 – (46) HESSE 0„ Ber., 30, 1983, 18J7 – (47) ZOPF W„ Lieb. Ann., 300, 322, 1898 – (48) HESSE O., J. prakt. Chem., 6S, 1, 1903 – (49) ASAHINA Y„ Chem. Zbl., II, 2728, 1926 – (50) HESSE O., J. prakt. Chem., S3, 22, 1911 – (51) ASAHINA Y. e TANASE Y., Ber., 67, 411, 1934 – (52) ZOPF W., Lieb. Ann., 346. 82 e 101, 1906 – (S3)HESSE O., J. prakt. Chem.. 92, 425, 1915 – (54) ASAHINA Y. e KUSAKA T„ Ber., 70. 1821, 1937 – (55) ROCHLEDER F. e HELDT W„ Lieb. Ann., 48. 1, 1843 – (56) KNOP W., Ibid., 49. 103, 1844 – (57) HESSE 0„ ibid.. 137, 241, 1866 – (58) HESSE 0„ Biochem. Hand Lexicon, 7, 32, 1912 – (59) ZOPF, Dìe Flechtenstoffe in chemìscher, botanìscher, pharmalcologischer und techntscher Beziehung, Jena 1907 – (60) ASAHINA Y. e SHIBATA S., Chemistry of Lichen Substances, Ed. Japan Society for thè Promotion of Science, Tokyo, 1954 – (61) Conlr. KJELLMANN H., Farm. Revy, 56, 567, 1957; Coll. Pharm. Suec., 11/12, 1956.1957 – (62) Conir. KARRER W., Konslilution und Vorkommen der organischen Pfianzensloffe, 1958, p. 711 – (63) CURO F. H. e ROBERTSON A., 1. Chem. Soc., 894, 1937 – (64) SCHOPF C. e ROSS F., Lieb. Ann., 546, 1, 1941 – (65) FRIEDEL C., BuU. soc. chim. Frange, 7, 164, 1892 – (É6) BRUUN T., Acla Chem. Scand., 8, 71, 1954; Chem. Abs., 49, 2378, 1955 – (67) DRAKE N. L, e JACOBSEN R. P„ J. Am. Chem. Soc.. 57. 1570, 1834, 1935 – (68) DRAKE N. L. e HASKINS W. T., ibid., 58. 1684, 1936 • (69) DRAKE N. L„ ibid., 61. 3074, 1939 – (70) DRAKE N. L. e WOLFE J. K„ ibid., 62, 3018, 1940 – (71) COREY E. J. e URSPRUNG J. J„ ibld„ 77, 3667, 1955 – (72) DUTLER H., JEGER O. e RUZICKA L., Helv. Chim. Acta, 38. 1268, 1955 – (73) SJOSTROM A. G. e ERICSON E., Acta Chem. Scandi 7, 870, 1953; Oiem. Zbi., 8830, 1954 – (74) KOFLER L. e RATZ H., Arch. Pharm., 270, 388, 1932 – (75) BEZANGER-BEAUOUESNE L., Prod. Pharm., 16, 349, 1961 (76) RENNERT A. e
GUBANSKI M„ Naturwiss.. 47, 18, I960; Chem. Abs., 54, 25093, 1960 – (77) KRONE W„ Pharmalie, 15, 502, 1960 – (78) PAECH K. e TRACEY M. V., Moderne Melhoden der PRanzenanalyse, Il voi., 1955, p. 176 – (79) OSOL A. e FARRAR G. E., The Dispensalory of Ihe United States of America, ed. 1960, p. 1623 – (80) CORDO V., cìt. da BENEDICENTI A. in «Malati, Medici e Farmacisti», Hoeplì, Miiano 1925, p. 672 – (81) DOMPIER, eli, da BENEDICENTI A., ibid., p, 1202 – (82) BARTOLINO, cii. da BENEDICENTI A., ibid. (83) Citati da BENEDICENTI A., ibid. – (84) MIKOSHIBA K., Jap. 1. Med. Sci. LV, Pharmacol., 9, 77, 1936; cil, da TOMASELLI R. in 11 Farmaco, Ed. Pr., 12. 137, 1957 – (85) STOLL A., RENZ J. e BRACK A., Experiemia, 3, 111, 1947; cil. da TOMASELLI R., loc. cit. in (84) – (86) MARSHAK A., Public. Health Rep, 62, 3, 1947; cit. da TOMASELLI R., toc. cit. in (84) – (87) MARSHAK A., BARRY G. T. e CRAIG L. C., Science, 106, 394, 1947; cit. da TOMASELLI R., loc. cil. in (84) – (88) BARRY V. C., O’RUERKE L. e TWOMEY D., Nature, 160, 800, 1947; cit. da TOMASELLI R., loc. cil. in (84) – (89) BUSTINZA e CABALLERO LOPEZ A., Ann. Jard. Bot. Madrid, 7, 511, 1948; cil. da TOMASELLI R., loc. cit. in (84) – (90) JANTTI K., Farmazeutinnen Aikakauslehti. 61, 139, 1952; cil, da TOMASELLI R,, toc. cit. in (84) – (91) MERETOJA A., Farmazeutinnen Aikakauslehti, 61, 130, 1952; cit. da TOMASELLI R., loc. cil. in (84) – (92) SATO M., Lichen Mise., 10, 37, 1954; cit. da TOMA- SELLI R., loc. cil. in (84) – (93) VIRTANEN O. E., VIRTATEN H. e KORTEKANGAS A. E., Suomen Kemislilehii, 27B, 18, 1954; cit. da TOMASELLI R., loc. eli. in (84) – (94) VIRTANEN O. E., Suomen Kemisrile/iri, 28B. 125, 1955; cit. da TOMASELLI R., loc. cil. in (84) – (95) ASCORBE F. J., Caribon Forester, 14, 136, 1953; Chem. Abs., 48, 12225, 1954 – (96) KLOSA J., Z. physiol. Chem., 287, 197, 1951; Chem. Abs., 48. 2822, 1954 – (97) BALEGNO H. F. e ORIOL-ANGUERA A., Congr. Ini. Bioch. Resumis Comm. 2» Congr., Pris 1952, 445; Chem. Abs., 48. 8489, 1954 – (98) HILDUR-KROG, Kgl. Norske Vivenskb. Seiskab. For/i, 27, 2, 1, 1954; Chem. Abs.. 50, 12172, 1956 – (99) BYLICKA J. e KUNICKI- GOLDFINGEN W., Acta Microbio!. Polon., I. 185, 1952; Chem. Abs., 49, 6364, 1955 – (100) DOEPP W. e BERSCH H. W., Pharmazie, 5, 603, 1950 – (101) MOESE J. R., Arzneim.-ForJCii., 5. 510, 1955 – (102) VIRTANEN O. E., VARATALO M. L. e KORTEKANGAS A. E., Suomen Kemislilehii, 29 B, 30, 1956; cil, da TOMASELLI loc. cit. in (84) – (103) KORTEKANGAS A, E. e VIRTANEN O. E.. Suomen Kemi- stilehti, 29B, 2, 1956; cit. da TOMASELLI R., /oc -cir. in (84) – (104) VIRTANEN O. E., Suomen Kemi- slilehli, 27 B, 67, 1954; cil. da TOMASELLI R., loc. cil. in (84) – (105) PAATSAMA S. e TALANTI S., Suomen Etàinliiiikàrilehdesiii, 12, 1, 1956; cil. da TOMASELLI R. i.c. in (84) – (106) VIRTANEN O. E., Suomen Kemistilehti, 5, 3, 1956 – (107) VIRTANEN O. E. e KILPIO O. E., Suomen Kemistilehti, 30, 8, 1957; Ciiem. Abs.. 51, 10743, 1957 – (108) VIRTANEN O. E. e KARKI N., Suomen Kemistilehti, 29B, 225, 1956, cil. da TOMASELLI l.c. – (109) MOESE J. R., Arznelm.-Forsch., 7, 65, 1957 – (110) SODEBERG U., Congr. Ini. Boi. Paris – Rapp. e Comun., 8 seti. 18-20, 29, 1954; Chem. Abs., 48, 11652, 1954 – (111) MARSHAL A. e HARTING J., Celi. Comp. Physiol.. 31. 321, 1948, cil, da VISNER e YUDKIN – (112) VISNER B, P. e YUDKIN J„ Nature. 176. 249, 1955 – (113) SHIBATA S. e coll., Ciiem. Pharm. Bull„ 10. 477, 1962.


