Lupino
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Lupinus albus L. – Fam. Leguminose/Papilionacee/Genistee) (Sin. – Lupinus sativus Gatereau – Lupinus albus typicus Fiori)
Lupino- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Lupinus: (Virgilio, Georg. 1,75) diminutivo di lupus = il lupo, per alcuni forse allusione al tegumento bigio, villoso del legume, per altri, invece, perchè la pianta esaurisce il terreno, vorace come il lupo. Da ciò fava di lupo, anche per l’amarezza dei semi.
albus – per i fiori bianchi, con lieve soffusione di azzurro (carena) (Lupinus sativus albo flore Clusius, 1605/11).
sativus – da seminativus, che può essere seminato; (P. Crescenzi. ed. 1538).
Nomi volgari – Lupino, lui (lomb.), fava luina (ver.). fusaglia (rom.), luppinu (sic.), dupino (basil.).
In antico Aurum comicum perchè i comici romani si servivano dei semi sulla scena per rappresentare le monete d'oro.
Turkische Bohne, Feigbohne, Wolfsbohne (ted.), the white lupine (ingl.), Lupine (fr.). Tremoço (port.), Altramuz (spagn.), Fehér csillagfurt (ungh.).
Habitat – La patria d’origine è incognita; sembra il Levante oppure l’Europa meridionale.
In Italia esiste soltanto coltivata. La coltivazione è antichissima. Si trova qua e là subspontanea, nelle località sabbiose. Gussone (1787/1866) la diede spontanea in Sicilia, sui colli aridi, sabbiosi e nei prati (in herbidis). Il Bertoloni (1833/1862) la indicò sui colli di Sarzana. Grisebach (1814/1879) la trovò nella Turchia Europea, presso Ruskoi, D’Urville la trovò abbondante nei boschi presso Costantinopoli. Alcuni Botanici russi la raccolsero nel Caucaso meridionale (Ladebour).
Una specie affine al L. albus L. è il Lupinus Termis Forsk. (sin. – Lupinus albus aegyptiacus Moench.) così vicina al L. albus che venne proposto di riunirle (Caruel) = Lupinus albus var. Termis. Coltivato insieme alla sp. tipo. Talora spontaneo sulle sabbie e sui colli nel Lucchese, in Sicilia, Sardegna, Linosa. Originaria dall’Egitto, selvatica e coltivata. Il nome Termis è arabo e deriva dal greco qermos = lupino (ha i fiori bianchi, con la sommità dello stendardo azzurra, semi lisci e bianchi, come nel tipo).
Altre specie spontanee o subspontanee sono, in Italia, il L. Cosentinoi Guss. (dedicata a Ferdinando Cosentino, botanico siciliano (1769/1840) (fiori bianchi) (Zone Napoletana e Catanese); il Lupinus hirsutus L. (fiori azzurri, inodori, semi lisci, brunastri, marmorizzati, con chiazze rossastre e strisce nere ai margini) (Italia media, inferiore ed isole), il Lupinus micranthus Guss. (Sicilia merid., isolette adiacenti), il Lupinus angustifolius L. (fiori azzurri, qualche volta macchiati di bianco, semi grossi grigio/biancastri, con chiazze fulve e strie biancastre) (Liguria occ., centro e sud della Penisola), Lupinus angustifolius var. linifolius Roth. (fiori azzurri, semi piccoli, bruno/rossastri o giallo/grigiastri, un po’ macchiettati, con linee rosso/cupo) (Liguria, Basilicata, Sicilia, Elba), il Lupinus luteus L. (fiori gialli, odorosi, semi lisci, nerastri, marmorizzati, con macchie bianche) (Italia centrale e meridionale, Sicilia, Sardegna, campi e luoghi arenosi), il Lupinus reticulatus Desv. (fiori azzurro/pallido, semi ovato/globosi, reticolati con linee nere) (questa specie, da alcuni Autori, è considerata sinonimo del L. angustifolius var, linifolius Roth., precitata), Lupinus pilosus Murr. (fiori azzurri, semi verrucosi).
I Lupinus sono piante erbacee annuali. Esistono però specie americane perenni Lupinus perennis L. (Virginia) (fiori azzurri con stendardo violetto) (sin. – Lupinus nortianus Hort.), Lupinus Kingii Wats. (U.S.A.) e Lupinus polyphyllus Lindl. (U.S.A., California).
Parti usate – I semi torrefatti.
Componenti principali
Alcaloidi con nucleo chinolizidinico: lupanina, C15H24ON2 (1-7), 13-ossi-lupanina, C15H24O2N2 (8), angustifolina, C14H22ON2 (9), multiflorina, C15H22ON2 (10) e probabilmente 13-ossi-multiflorina, C15H22O2N2 (11) (12), D5-deidro-13-ossi-multiflorina, C15H20O2N2 (11) (12) e un analogo dell’angustifolina, denominato metil-albina, C15H22ON2 (10) (12).
Sparteina è stata trovata nelle giovani piante, mentre vi risulta assente la ossilupanina; la sparteina scompare quando si formano i baccelli (13) ed è quindi assente nei semi (12).
Lupanina, rispondente alla formula centesimale C15H24ON2 (14) (15), si trova in natura nelle tre forme levogira, destrogira e racemica, delle quali la terza è predominante. Isolata per la prima volta dal Lupinus angustifolius (Lupino blu) da Eichhorn (16) e denominata lupanina da Hagen (14), è stata in seguito estratta anche dal Lupinus albus (1-7) e da altre specie di Lupino, oltre che dalla Virgilio capensis e da diverse specie di Cytisus e di Podalyria (17). Nel Lupinus albus sono presenti sia la forma racemica (1-4) (11) in quantità prevalente, sia la destrogira (1) (2) (4-7); la forma levogira, che pure vi è stata trovata (3) e che è identica alla tetraidroanagirina (18) ed alla idrorombinina (19), sembra che sia assente dal Lupino europeo (4).
Per la determinazione della formula di struttura della lupanina importanti ricerche sono state eseguite prima da Karrer (20), che ne ha messo in evidenza il nucleo basilare ottaidropiridocolinico (norlupinano) e poi da Ing (21) e da Clemo e Raper (22), che hanno stabilito la stretta relazione esistente tra l’anagirina, la lupanina e la sparteina. Delle due formule proposte da questi AA., quella di Ing con l’anello D a struttura metilpirrolidinica e quella di Clemo e Raper con l’anello D piperidinico, la formula (I) di Clemo e Raper è stata confermata dalla sintesi della dl-ossisparteina o isolupanina (23), dalla identificazione di un gruppo lattamico nella lupanina (24-26) ed infine dalla sintesi totale della sparteina, ottenuta da Léonard e Beyler (27).
Ossilupanina, C15H24O2N2, è stata isolata dapprima da Bergh (28) (29) dai semi del Lupinus perennis L. e successivamente anche dal Lupinus albus
(8), oltre che da altre specie del genere Lupinus (17). La (+)-ossilupanina è stata identificata alla ottalupina (30), estratta da Couch (31) dal Lupinus sericeus var. fiexuosus. In seguito agli studi di Bergh (29), di Ueno (8), di Beckel (32) e di Galinovsky, Pòhm e Riedl (33), i quali ultimi hanno assegnato all’ossidrile la posizione 13, la formula di struttura attualmente accettata per la ossilupanina è la II:

Angustifolina, C14H22ON2, estratta dal Lupinus angustifolius (34), dal L. polyphyllus (34) ed infine anche dal L. albus (9) è stata identificata con l’alcaloide III (35).
Multiflorina, C15H22ON2, già noto componente del Lupinus varius (36) e del L. multiflorus (37) ed equivalente alla D2-deidro-4-cheto-sparteina o 4-osso-2,3-deidrosparteina (IV) (38), è stata ricavata da Wiewiorowski e Wolinska-Mocydlarz (10) dalla frazione a basso punto di ebollizione del Lupinus albus.

13-Ossi-multiflorina, C15H22O2N2, e D5-deidro-13-ossi-multiflorina, C15H20O2N2, sono state identificate da Wiewiorowski, Bartz e Wysocka (11) nella frazione ad alto punto di ebollizione del Lupinus albus. Le formule dei due nuovi alcaloidi, proposte dai suddetti AA. (11), corrispondono alle V e VI:

N-metil-albina, C15H22ON2, è il nome dato da Wiewiorowski e Wolinska-Mocydlarz (10) all’alcaloide isolato dalla frazione a basso punto di ebollizione ricavato dal Lupinus albus. Per questa sostanza gli stessi AA. (10) hanno proposto la formula VII. Il nome di albina è stato riservato per una base ancora ignota, (VIlI) analoga all’angustifolina, che, secondo l’opinione degli AA. (10), dovrebbe essere presente nella miscela degli alcaloidi del L. albus.

Il contenuto di alcaloidi, espressi in lupanina, come risulta dalle analisi del Bellet(4), varia dallo 0,4 all’1,4% in semi di Lupino di origine francese. In letteratura sono indicati valori percentuali che si aggirano sull’1 % (39) (40) per i lupini amari e che oscillano tra lo 0,01 e lo 0,1 % per i lupini commestibili (40), i quali si ottengono eliminando per lavaggio la maggior parte degli alcaloidi responsabili del sapore amaro del seme fresco.
Oltre agli alcaloidi nei semi del Lupinus albus sono stati trovati i seguenti componenti:
Protidi
— azoto proteico circa 4 della droga secca. L’azoto totale e l’azoto non proteico sono presenti invece in quantità variabili e ciò sembra dovuto a differenze nel contenuto di peptidi (41),
— proteine grezze circa 44%, poco meno delle quantità date per altre specie di Lupini (circa il 50%) (42).
— conglutina (proteina ottenuta per estrazione con soluzione di cloruro di sodio) 10-18%, valori paragonabili a quelli trovati per i semi del Lupinus luteus e del L. angustifolius (42).
— due globuline (43).
— amminoacidi (g %) determinati in 100 g di proteina con 16% di
N (42):
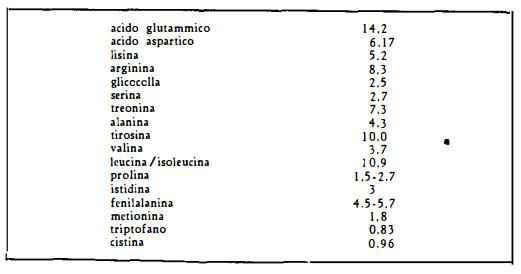
Fosfatidi (44-49) costituiti da lecitina (44) (46) 74,3% e da cefalina 25,7% (49) ed aventi la seguente composizione (49):

Gli acidi grassi identificati nei fosfatidi da Diemair e Weiss (49) comprendono gli acidi oleico, linoleico, palmitico e tracce di acido arachico.
Lipidi: circa 12%, valore vicino alla percentuale di lipidi trovata in altre specie di Lupino, secondo Hanson e Koch (42): 6,27 % di olio grasso con stearina, oleina e 0,98 % di frazione insaponificabile, secondo Grimme (50).
Dalla frazione insaponificabile sono state ottenute le seguenti sostanze:
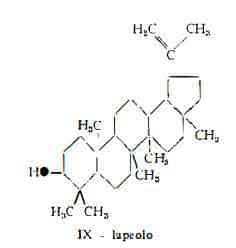
— l’alcool triterpenico lupeolo, C30H50O, la cui presenza nel tegumento del seme era già stata segnalata da Schulze (51) ed è stata confermata recentemente nel seme da Carelli e Marchini (52).
— 22-23-diidrostigmasterolo ed un secondo sterolo, equivalente alla sostanza C29H50O (52), isolata dalla Musa sapientum ed identificata con un 3-b-OH-D5-stenolo (53).
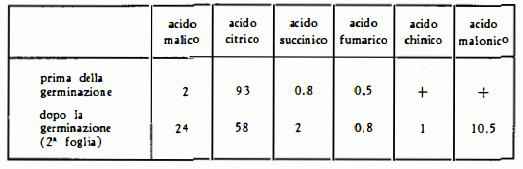
Acidi organici: acidi citrico, isocitrico, glicolico, malico, maionico, succinico e ossalico in forma di sali (54). Carles e Lattes (55) nei semi, prima e dopo la germinazione, hanno identificato i seguenti acidi nelle rispettive proporzioni percentuali sottoindicate:
Altri componenti: galattano (56) (57), arabano (56) (58) e xilano 8 % nel tegumento del seme (57); pectine da cui è stato ottenuto galattano (48); cellulosa (58); sostanze dotate di proprietà ipoglicemizzanti di natura chimica non definita (49-53), vaniglina(64) (65). Ceneri 3,14% con elevate quantità di fosfati (25,7 % di P2O5) e di manganese (1,58 %) (66).
Proprietà farmacologiche ed impiego terapeutico
Il Lupino era noto agli Egizi, ai Greci e ai Romani sia come alimento che come medicamento.
Plinio nota che il Lupino costituisce un buon foraggio per gli animali e che diviene adatto all'alimentazione dell’uomo dopo macerazione.
Analogamente, Dioscoride afferma che dopo aver eliminato il sapore amaro per macerazione, i lupini divengono commestibili, mentre per quanto riguarda l’uso terapeutico, lo stesso Dioscoride ricorda che la farina di lupini, diluita con miele e con aceto, provoca l’espulsione dei vermi e che la decozione di Lupino e di Mirra edulcorata con miele, determina nella donna, per applicazioni locali, un effetto emmenagogo e abortivo.
Ai Romani era nota l’azione insetticida del Lupino del quale ne impiegavano la decozione per lavaggi antiparassitari negli animali.
Fra le prime indagini cliniche sugli alcaloidi del Lupino, vanno annoverate quelle eseguite da Gemma (67) il quale basandosi su precedenti e non sufficientemente documentate osservazioni sull’attività antimalarica del Lupino, ne riprese lo studio impiegando un estratto alcaloideo ottenuto da Massa (68). Gemma trovò che questo estratto somministrato alla dose di 1-2 g poteva sostituire il chinino nel trattamento della febbre malarica.
Un estratto di Lupino e campioni di solfato di lupanina destrogira e racemica preparati da Campani (69), vennero studiati da Albertoni (70) il quale trovò identità di azione fra l'estratto molle di Lupino e il sale cristallizzato di lupanina. Ambedue i preparati determinavano una depressione dell’eccitabilità nervosa sino alla totale scomparsa, seguita da diminuzione dell’eccitabilità muscolare.
Successivamente il Luciani (71) studiò l'azione tossica di alcune estrazioni acquose ottenute dallo stesso Campani da diverse specie di Lupino (L. albus, L. luteus, L. angustifolius) e di un campione di solfato degli alcaloidi. Questo A. constatò che l’azione tossica del Lupino inizia con la depressione e quindi con l’abolizione dell’eccitabilità dei nervi di senso, cui seguono gli effetti sul cuore, sui nervi di moto e sull’irritabilità muscolare. Negli animali a sangue freddo (rane), la morte segue alla paralisi dei nervi e dei centri cerebro-spinali. Fra l’attività delle decozioni delle varie specie di Lupino, esisterebbero soltanto differenze di ordine quantitativo, nel senso che quelle di L. albus si sarebbero dimostrate alquanto più attive.
I risultati delle ricerche di Bellini (72) sull’azione prodotta nell’uomo e negli animali da decotti di Lupino e di quelle di Bettelli (73), non contribuiscono ad approfondire ulteriormente l’azione di questa droga e così pure quelle di Corso (74) dalle quali risulterebbe in più, che fra l’azione del decotto di Lupino e quella dell’estratto di Fava del Calabar, esiste un parziale antagonismo.
Lowenthal (75) trovò che gli alcaloidi del Lupino, allorché vengano impiegati a forti dosi, possono determinare un’azione curarosimile, ciò che venne confermato molti anni più tardi da Wachtel (76).
Ricerche comparative furono eseguite da Raimondi (77) con decozioni ottenute da diverse specie di Lupino e con sali degli alcaloidi da lui stesso preparati. Risulta da esse che l’azione delle decozioni ottenute dalle diverse specie (L. albus e L. luteus) è analoga e che l’azione tossica del principio amaro alcaloideo è molto meno intensa di quella del decotto, il che fa ritenere all’A. che in esso siano contenute, oltre il principio amaro alcaloideo, anche altre sostanze idrosolubili capaci di aumentare la tossicità della decozione.
Gli animali a sangue caldo, secondo l’A., sarebbero meno sensibili di quelli a sangue freddo all’azione tossica della lupanina la quale, contrariamente a quanto aveva ritenuto Siewert (78), non darebbe luogo ad assuefazione.
Per quanto riguarda la sindrome tossica osservata dall'A., essa coincide con quella precedentemente descritta dall’Albertoni e dal Luciani: depressione e paralisi dei centri e dei nervi di senso, di moto e delle giunzioni neuro-muscolari (azione curarosimile) e morte per paralisi respiratoria.
Lo studio del Lupino e dei suoi alcaloidi venne ripreso poi molto più tardi e cioè dopo il 1920 con le ricerche di Schaumann, di Valenti, di Couch, di Isaev, di Ligon, di Liberalli e con quelle più recenti di Bellet e Jequier.
Schaumann (79) studiò la lupanina e alcuni suoi derivati, sull’apparato cardiovascolare degli animali a sangue freddo e trovò che sul cuore isolato secondo Straub, la lupanina determina un aumento dell'ampiezza delle contrazioni, senza modificarne la frequenza. Sul preparato vascolare di rana secondo Trendelenburg, la lupanina determinerebbe un'azione vasocostrittrice. La tossicità di questa sostanza sarebbe molto debole, secondo l’A., e la sua zona maneggevole molto ampia.
Uno studio tendente a precisare il meccanismo farmacologico e tossicologico della lupanina fu eseguito da Valenti (80) il quale giunse alle seguenti conclusioni: «La destro-lupanina e la lupanina racemica, gli alcaloidi cioè contenuti nel Lupino bianco, sono veleni del sistema nervoso centrale e danno luogo ad una sindrome complessa di eccitazione e di paralisi che si manifesta con dispnea, tremori, contrazioni muscolari, paralisi motoria e poi sensitiva. La morte avviene per paralisi del centro respiratorio bulbare. Può manifestarsi vomito di origine riflessa.
Sul circolo la lupanina provoca dapprima una dilatazione dei vasi addominali per paralisi dello splancnico con caduta della pressione sanguigna che però tende a riportarsi alla norma per l'integrità del centro vasomotore, del miocardio e delle pareti vasali: un’ulteriore somministrazione del farmaco provoca però anche una paralisi dei centri vasomotori, vasale periferica e degli apparecchi eccitomotori cardiaci, cui segue un nuovo ed immodificabile abbassamento della pressione con diminuzione notevole del numero delle pulsazioni. Il miocardio è invece assai resistente.
La lupanina non dimostra di essere, se non a dosi assai elevate, un veleno muscolare (delle fibrocellule lisce e dei muscoli striati).
La lupinosi, malattia che si può manifestare negli erbivori e specialmente negli ovini che abbiano mangiato erba di Lupino, è con ogni probabilità da riferirsi all’azione degli alcaloidi della pianta, tanto è simile la sindrome clinica della malattia all’intossicazione sperimentale.
La lupanina non ha azione sugli organismi unicellulari se non in soluzioni molto concentrate.
Non diminuisce il volume della milza, tende anzi ad aumentarlo se somministrata da sola: associata alla chinina, prevale l’azione di questo alcaloide e la milza si trova costantemente rimpicciolita. Somministrata per os la lupanina facilita e rende più completo l’assorbimento della chinina.
Queste constatazioni di fatto mentre chiariscono, secondo l’A., il meccanismo d’azione del Lupino bianco e, con ogni probabilità, l'origine della lupinosi degli erbivori, spiegano anche l’insistenza con cui veniva attribuita da tempo al Lupino un’azione antimalarica la quale, per altro, sembra si possa manifestare solo quando esso venga associato con la chinina e ciò in accordo anche con quanto era stato già osservato da Lanza (81) e più recentemente confermato da Liberalli (82).
Ligon (83) sperimentò l’azione della lupanina, della lupinina e della trilupina (del L. laxus) sull’utero isolato, comparativamente con quella della sparteina, giungendo alla conclusione che fra questi alcaloidi che possono essere usati clinicamente come ecbolici, il più sicuro e il più attivo, sotto questo aspetto, è la sparteina alla quale seguirebbero a distanza e nell’ordine, la trilupina, la lupinina e la lupanina.
Bellet e Jequier (84), dopo aver posto in evidenza le analogie chimicofarmacologiche esistenti fra lupanina e sparteina, hanno confermato l’attività oxitocica della lupanina e anch’essi, come già Ligon, trovarono che fra l’azione oxitocica della lupanina e quella della sparteina, esiste un rapporto di attività pari a 1:15. Questi AA. notarono inoltre che la lupanina manifesta un’azione inotropa negativa sul cuore isolato di rana, una diminuizione dell’effetto acetilcolinico sull’intestino isolato di coniglio, un potenziamento dell’azione ipertensiva dell’adrenalina, effetti questi qualitativamente molto simili a quelli dovuti alla sparteina la quale agirebbe però, secondo gli AA., con un’attività superiore di 5-10 volte.
La lupanina è capace di paralizzare il vago, lasciando sussistere tuttavia, una leggera eccitabilità del nervo, mentre la sparteina, alla stessa dose, pur provocando lo stesso effetto, lo renderebbe completamente ineccitabile.
La differenza più importante notata dagli AA. fra l’azione dei due alcaloidi, sarebbe rappresentata dal fatto che l’ipotensione che segue alla iniezione di lupanina, è superiore a quella determinata dalla sparteina e non è preceduta, come in questo caso, da un transitorio effetto ipertensivo.
Azione ipoglicemizzante – Il Lupino venne preconizzato come succedaneo dell’insulina nel trattamento del diabete mellito leggero e di media gravità. Lo studio del Lupino come ipoglicemizzante fu iniziato da Horvath (85) nel 1930, su animali da esperimento e fu poi ripreso da altri autori che ne sperimentarono l’azione sugli animali e sull’uomo sano e malato.
Serio (86) trovò che l’azione della droga è indipendente, entro certi limiti, dalla dose somministrata e che il principio ipog
Nell’uomo sano e malato, decotti di Lupino torrefatto (12-50 g in 100-200 g di acqua), riducono secondo l’A., la glicemia ma danno luogo talvolta, a sintomi tossici collaterali che obbligano a sospendere la somministrazione.
Clementi e Tortisi (87) identificarono il principio ipoglicemizzante nella lupanina. Esperienze eseguite sugli animali con decotti di Lupino o con lupanina, dettero risultati piuttosto contradditori, mentre nell’uomo diabetico gli AA. osservarono abbassamento della glicosuria e della glicemia i cui valori risalirebbero però, più o meno rapidamente, al livello iniziale dopo la sospensione del trattamento.
Orestano (88) ottenne dal Lupino una sostanza diversa dalla lupanina, capace di abbassare del 10-20% la glicemia nel coniglio. Questo A. conclude ammettendo l’esistenza nei semi di Lupino, di sostanze agenti sul metabolismo dei glucidi con funzioni, in linea generale corrispondenti a quelle dell’insulina negli animali, ma esclude che l’uso di tali sostanze possano assumere un’importanza pratica, dato l’alto costo dei processi di estrazione e di purificazione.
Ferranini e Piroli (89), che sperimentarono l’azione di decotti di Lupino torrefatto nei diabetici, notarono un aumento della tolleranza verso gli idrati di carbonio e ritengono che questa droga sia praticamente utilizzabile nei casi di diabete leggero, in quanto permetterebbe di diminuire la quantità d’insulina normalmente necessaria e nei periodi di sospensione.
Risultati più brillanti furono ottenuti da Martini (90) sperimentando con l’estratto fluido di Lupino. Questo A. ritiene che per la sua spiccata azione ipoglicosurica e ipoglicemica oltre che per la sua perfetta innocuità, esso rappresenta uno dei migliori preparati antidiabetici per via orale, sia se somministrato isolatamente, sia se associato all’insulina. Secondo questo A., nei diabetici di media gravità, l’uso dell’estratto fluido di Lupino (che l’A. consiglia alla dose di un cucchiaino da caffè, due o tre volte al giorno dopo i pasti) offrirebbe anche la possibilità di variare la dieta e di renderla meno rigorosa, senza provocare sensibili aumenti della glicosuria e della glicemia.
Erspamer (91) ritiene che il Lupino rappresenti una delle droghe antidiabetiche più interessanti in nostro possesso e una di quelle più meritevoli di ulteriore sperimentazione, soprattutto clinica.
Tossicologia – La tossicità della lupanina non è elevata se somministrata per os. Somministrata per via sottocutanea la sua tossicità aumenta di 10 volte e, a parità di dose, l’attività delle soluzioni concentrate è superiore a quella delle soluzioni più diluite [Couch (92)] poiché, data la rapidità con la quale la lupanina viene eliminata attraverso l’emuntorio renale, la sua attività è condizionata dalla rapidità con cui viene assorbita.
Nella cavia la sintomatologia tossica inizia con irrequietezza e agitazione, cui segue depressione e paralisi che iniziando dagli arti posteriori, progredisce sino a raggiungere i muscoli toracici determinando prima difficoltà respiratoria e dispnea, poi arresto respiratorio mentre il cuore continua a pulsare ancora per qualche tempo.
Se la dose somministrata non è mortale, gli animali si ristabiliscono completamente dopo qualche ora, dopo cioè che la lupanina è stata completamente eliminata.
Secondo Couch, la lupanina sarebbe la più tossica fra gli alcaloidi contenuti nelle diverse specie di Lupino e sarebbe superiore di 1,15 volte a quella relativa alla sparteina.
La suddetta sintomatologia descritta da Couch, sarebbe identica a quella prodotta dalla «lupinosi» che si osserva negli erbivori di certe regioni mediterranee, per ingestione accidentale di Lupino: irrequietezza, paralisi progressiva, dispnea e morte per arresto respiratorio (Valenti).
Anche gli insetti sarebbero sensibili all’azione della lupanina, la quale sarebbe dotata secondo Isaev (93) di spiccate proprietà insetticide.
Casi di avvelenamento nell'uomo prodotti da Lupino, sono rarissimi, ne sono stati descritti, a quanto ci consta, tre da Bellini (72) in bambini cui erano stati praticati clisteri preparati con decozioni di Lupino a scopo antielmintico ed un altro caso è stato descritto più recentemente da Abbozzo (94). Quest’ultimo riguarda una donna che aveva ingerito 70-80 g circa di lupini che, senza precedente macerazione, erano serviti per preparare una decozione.
Circa due ore dopo l’ingestione, la paziente presentava una sintomatologia caratterizzata da violenti dolori epigastrici, conati di vomito, forte diminuzione del visus, pupilla fortemente midriatica, gola secca, polso quasi impercettibile alla radiale, agitazione e lieve dispnea. La reazione di Valenti per l’identificazione della lupanina, praticata nelle urine, fu nettamente positiva.
La paziente dopo un miglioramento, ebbe due ricadute caratterizzate dalla stessa sintomatologia. Durante questi periodi la glicemia scese a 0,80 mg %. Essa fu trattata con somministrazioni di glucosio sia per os che per ipodermoclisi e fu dimessa in 5a giornata completamente ristabilita.
Estratti e preparati vari
a) Estratto fluido (g 1 = XXXV gtt).
Dosi: 1 cucchiaino da caffè 2-3 volte pro die.
b) Estratto secco acquoso (1 p. = 6 p. circa di droga).
Dosi: g 1, 2-3 volte prò die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido lupino…………………………………………….. g 20
Alcool di 30°……………………………………………………………. g 80
(a cucchiai).
Estratto di lupino composto
Estratto fluido lupino……………………………………………… g 30
Estratto fluido galega……………………………………………. g 30
Saccarina…………………………………………………………………….. g 0,05
Estratto fluido menta alcool-idrosolubile g 1
(a cucchiaini).
BIBLIOGRAFIA
(1) SCHMIDT E.. Arch. Fharm., 235. 192, 1897 – (2) DAVIS L. S., Arch. Pharm., 235, 199, 1897 – (3) WHITE E. P., New Zealaad. J, Sci. TechnoL, B 38, 718, 1957 – (4) BELLE! P., Ann. pharm. /ranp., 8. 551, 1950 – (5) SOLDAINI A.. Arch. Pharm., 235, 368, 1897 – (6) NO!!BOHM F. E. c MAYER F.. Landwirtsch. Jahrb., 84, 335, 1937 – (7) LIBERALLI C. H„ Tribuna tarm.. 12. 1, 1944 – (8) UENO M., J. Pharm. Soc. Japan, 50, 435, 1930 – (9) WIEWIOROWSKI M., Roczicki Chem., 33, 1195, 1959; Chem. Abs.. 54, 9980, 1960 – (10) WIEWIOROWSKI M, c WOLINSKA-MOCYDLARZ I., Buii. Acad. Polon. Sci., Ser. sci. chim., 9, 11, 709, 1961 – (11) WIEWIOROWSKI M., BAR!Z J. e WYSOCKA W., Bull. Acad. Polon. Sci., Ser. sci. chim., 9, 11, 715. 1961 – (12)WIEWIOROWSKI M. e REIFER I., Bull. Acad. Polon. Sci., Ser. sci. biol., Cl. II, 9, 11, 441, 1961 – (13) WIEWIOROWSKI M. e BRA!EK M. D., fluii. Acad. Polon. Sci., Cl. II, 4, 3, 1956; Chem. ZÌI., 11571, 1958 – (14) HAGEN M., Lieb. Ann., 230. 367, 1885 – (15) SIEBER! C, Arch. Pharm., 229. 531, 1891 – (16) EICHHORN, Landw. Vers.-Stat.. 9. 272, 1867 – (17) MANSKE R. H. F. e HOLMES H. L.. !he Alkalolds, voi. Ili, 1953, pp. 123-124 – (18) INO H. R„ 2. Chem. Soc.. 136, 504, 1933 – (19) MARION L. e OUELLE!!., 2. Am. Chem. Soc., 70, 3076, 1948- (20) KARRER P.. CANAL F., ZOHNER K. e WIDMER R.. Neh. Chim. Aclo, 11. 1062. 1928 – (21) INO H, R., 2. Chem. Soc., 136, 504, 1933 – (22) CLEMO G. R. e RAPER R., 2. Chem. Soc.. 136, 644, 1933 – (23) CLEMO G. R.. MORGAN W. MC. G. e RAPER R„ 2. Chem. Soc., 1025, 1936 – (24) HOFFMANN E., HOLSCHNEIDER F. W. e WIN!ERFELD K.. Arch. Pharm.. 275, 65, 1937 • (25) WIN!ERFELD K. e HOFFMANN E., Arch. Pharm.. 275, 5. 1937 – (26) WIN!ERFELD K. e SCHIRM M., Arch. Pharm., 275, 630, 1937 – (27) LÉONARD N. J. e BEYLER R. E., 2. Am. Chem. Soc., 70, 2298, 1948 – (28) BERGH G. F. e SCHMID! E.. Arch. Pharm., 242, 4 09, 1904 – (29) BERGH G. F., Arch. Pharm.. 242. 416, 1904 – (30) MARION L. e DOUGLAS B„ Con. 2. Chem,, 29. 721. 1951 – (31) COUCH J. F.. 2. Am. Chem. Soc., 61, 1523, 1939 – (32) BECKEL A, Arch. Pharm., 248, 451, 1910 – (33) GALINOVSKY F., POEHM M. e RIEDL K„ Monatsh.. 81, 77, 1950 – (34) WIEWIOROWSKI M., GALINOVSKY F. e BRA!EK M. D„ Monatsh. Chem., 88, 663, 1957 – (35) MARION L„ WIEWIOROWSKI M. e BRA!EK M. D„ Teirahedron Lellers, n. 19. 1, 1960 – (36) CROW e RIGGS, Ausiral. 2. Chem., 8, 136. 1955; Chem. Abs., 50. 1057, 1956 – (37) COMIN eDEULOFEU. Austral. 2. Chem., 12. 468. 1959; Chem. Abs., 54, 5721, 1960 – (38) CROW, Austral. 2. Chem., 12. 474. 1959; Chem. Abs., 54. 4642, 1960 • (39) SCHMID! e GERHARD. Arch. Pharm.. 235, 342, 1897 – (40) HACKBAR!H J., Pharmazie, 12. 173, 1957 – (41) WIEWIOROWSKI M.. AUGUS!YNIAK J. e SKRZYPINSKA H„ Roczniki Nauk. Rolnlczych. A 79, 19. 1958; Chem. Abs.. 53. 11541C, 1959 • (42) HANSON H. e KOCH R„ Pharmazie, 7, 655, 1952 – (43) JOUBER! F. J„ Blochim. et Biophys. Ada, 19. 172, 1956; Chem. Abs., 50, 7964 1, 1956 – (44) SCHULZE e WIN!ERS!EIN, Z. physiol. Chem., 40, 101, 1903 – (45) WINTERSTEIN e HIESTAND, Z. physiol. Chem., 47, 496, 1906 – (46) SCHULZE E., Z. physiol. Chem., 52, 54, 1907 – (47) WINTERSTEIN e STEGMANN, Z. physiol. Chem, 58, 500, 1909 – (48) NJEGOVAN, Z. physiol. Chem., 76, 1, 1912 – (49) DIEMAIR W. e WEISS K., Biochem. Zeitschr, 302, 113, 1939 – (50) GRIMME, Chem. Rev. Fett. u. Harz-Jnd., 18, 53, 1911 – (51) SCHULZE E., Z. physiol. Chem., 41, 474, 1904 – (52) CARELLI V. e MARCHINI P., Ann. chimica, 46, 1023, 1956; Chem. Abs., 51, 6664 i, 1957 – (53) CARELLI V. e MARCHINI P. Ann. chimica, 45, 1133, 1955 – (54) HOLTON R. W. e NOLL C. R., Plant Physiol., 30, 484, 1955; Chem. Abs., 50, 2767 d, 1956 – (55) CARLES J. e LATIES F., Compt. rend., 249, 447, 1959 – (56) CASTORO, Z. physiol. Chem., 49, 96, 1906 – (57) SCHULZE E. e GODET, Z. physlol. Chem., 61, 279, 1909 – (58) VINOGRADOVA L. M., KONKIN A. A. e ROGOVIN Z. A., Zhur. Priklad. Khim., 27, 1302, 1954; Chem. Abs., 49, 9269, 1955 – (59) HORVATH A, A,, J, pharm., 38, 303, 1930 – (60) SERIO F., Fisiol. e Med., 5, 353, 1934 – (61) FERRARINI A. e PIROLI M., Folia Med., 32, 729, 1937 – (62) ORESTANO G., Arch. jarmacol. sper., 70, 113, 1940 – (63) ERSPAMER V., Droghe e principi ipoglicemizz.anti di origine vegetale, Quaderni di Fitoterapia, n. 5, ed. Inverni & Della Beffa – Milano 1943, p. 36 – (64) CAMPANI e GRIMALDI, Boll. Sezione Cult. Scienze Med. N.R. Accad. Fis. Siena, 5, 1, 1888 – (65) KARRER W., Konstitution und Vorkommen dcr organischen Pflanzenstoffc, 1958, p. 160 – (66) WEHMER C., Dic Pflanzenstoffe, II ed., pp. 524-525 – (67) GEMMA C., Gazz. med. ital. Lombarda, n. 30, 1881, cit, da VALENTI (80) – (68) MASSA A,, La Farmacia, 3, n. 5 e 6, cit. da VALENTI (80) – (69) CAMPANI G., L'Orosl, n. 1, 1884 e n. 4, 1888, cit. da VALENTI (80) – (70) ALBERTONI P., cit. da RAIMONDI, ved. (77) – (71) LUCIANI L., ibid. • (72) BELLINI R., Lo Sperimentale, 28, 260, 1875, cit. da VALENTI (80) – (73) BETIELLI C., La Farmacia, 2, n. 26, cit. da VALENTI (80) – (74) CORSO L., L'Orosi, 1879, cit. da VALENTI (80) – (75) LOWENTHAL, Dissert. Konigsberg 1889, cit. da VALENTI (80) – (76) WACHTEL, Therap. HalbmonatUch, cit. da VALENTI (80) – (77) RAIMONDI C., Annali di Chimica, Farmacia ecc., voi. 12, della serie VI, 1890, cit. da VALENTI (80) – (78) SIEWERT, Zeitschr. Ges. Nat. Wissensch., 70, 426, 1869 e p. 126, 1880, cit. da VALENTI (80) – (79) SCHAUMANN, cit. da VALENTI (80) – (80) VALENTI A., Arch. intern. pharmacod. et de thér., 34, 63, 1928 – (81) LANZA, Comunicaz. e relaz. alI’Uff. Sanit. Prov. Milano, 31 marzo 1926, cit. da VALENTI (80) – (82) LIBERALLI C., Tribuna farm. (Brasile), 12, 1, 1944 – (83) LIGON E. W., J. Pharmacol. exp. Ther., 73, 151, 1941 – (84) BELLET P. e JEQUIER R., Ann. pharm. frani., 8, 649, 1950 – (85) HORVATH A. A., J. Pharmacol. (Amer.), 38, 303, 1930 – (86) SERIO F., Fisiol. Med., 5, 353, 1934 – (87) CLEMENTI A. e TORRISI D., Boll. soc. it. biol. sper., 9, 1004, 1935 e Arch. Fisiol., 34, 290, 1935 – (88) ORESTANO G., Arch. Jarmacol. sper., 70, 113, 1940 – (89) FERRA- NINI A. e PIROLI M., Folia med., 32, 729, 1937 – (90) MARTINI A., Rinasc. med., 17, 303, 1940 – (91)
ERSPAMER V., Quaderni di Fitoterapia n. 5, ed. Inverni & Della Beffa, Milano 1943, p.36-41 – (92) COUCH J. F., J. Agric. Research., 32, 51, 1926 – (93) ISAEV S. I., Chem. Abs., 36, 5606, 1942 – (94) ABBOZZO G., Boll. soc. it. biol. sper., 28, 933, 1952.


