Quercia Marina
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Fucus vesiculosus L. – Fam. Pheophycee/Fucacee (Alghe brune)
Quercia Marina- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Fucus, dal greco fukion-fukos = alga.
vesiculosus – perchè sul tallo nastriforme porta delle vescichette vuote abbinate che servono per il galleggiamento (anche semplici).
Nomi volgari – Varech; etiope vegetabile (le ceneri).
Sea ware o wrack, bladder wrack, bladder fucus, common sea oack (ingl.), Meereiche (ted.), varech vesiculeux (fr.), alga vesiculosa, alface de mar, lechuga de mar (da non confondere con l’Ulva Lactuca L.) (spagn.), encina de mar (messic.).
Habitat – Coste dell’Oceano Atlantico, particolarmente della Groenlandia, della Norvegia, delle Isole Azzorre, delle Indie occidentali. Alligna sulle roccie sommerse.
Specie affini sono il Fucus nodosus L. (tallo compresso, con vescichette singole, rigonfie, grossette, ad intervalli) che spesso viene offerto come
F. vesciculosus. Fucus serratus L. Non vanno confuse con la droga tipo.
Parti usate – Il tallo.
Componenti principali
Sono stati identificati i seguenti componenti:
— Acido alginico (1) (2), identificato con un acido poliuronico, costituito da una catena di radicali dell’acido b-D-mannuronico, uniti da legami glucosidici nelle posizioni 1 e 4 (3-5). Per idrolisi dell'acido alginico, accanto ad acido D-mannuronico, C6H10O7, si forma anche una certa quantità di acido L-guluronico, C6H10O7 (6).
Alginati sono stati estratti con resa del 12% da campioni di Fucus vesiculosus del Mare Baltico da Kuznynski e Zagorski (7). Anche Chechelska e Urbanski (8) hanno segnalato un contenuto di acido alginico pari a circa il 12% della droga secca, raccolta in luglio ed in agosto.
— Fucoidina, estere solforico di un poliosio, che per idrolisi dà L-fucosio, C6H12O5, è stato trovato in varie specie di Laminaria (9) (10) e di Fucus (9), compreso il Fucus vesiculosus (1) (2). Lo studio della struttura della fucoidina (1) (11-13) ha permesso di attribuire a questa sostanza una struttura, rappresentata da una catena di radicali del L-fucopiranosio (13), uniti da legami glucosidici nelle posizioni 1 e 2 (1).
— Laminarina (1) (2), poliosio, che è composto di molecole di glucosio e che per idrolisi dà laminaribiosio [3-(b-D-glucosido)-D-glucosio], C12H22O11.
— Fucosio, xilosio e galattosio sono stati ottenuti come prodotti di idrolisi dal Fucus vesiculosus essiccato, nelle rispettive quantità di 9,2%, 1,1% e 0,4% (14). La presenza del galattosio tra i derivati idrolitici è stata in seguito confermata (15).
— D-mannitolo, C6H14O6 (1) (16) (17), libero e combinato, sia come monoacetato in posizione 1, C8H16O7, sia come b-D-glucopiranoside in posizione 1, C12H24O11, sia come di-b-D-glucopiranoside nelle posizioni 1 e 6, C18H34O16 (16) (17).
— Nella frazione protidica: azoto totale 1-3% della sostanza secca con variazioni stagionali, secondo le analisi di Smith e Young (18). Gli stessi AA. hanno analizzato i componenti azotati del Fucus vesiculosus ed hanno ottenuto i seguenti risultati:
a) composti azotati volatili [NH3; CH3NH2; (CH3)3N] 2-3 % dell’N totale;
b) amminoacidi liberi ca. 10% dell’N totale;
c) peptidi 7-8% dell’N totale;
d) proteine 82-83% nell'N totale: le proteine hanno composizione simile a quella delle proteine delle foglie e comprendono amminoacidi, costituenti il 17-20%) rispettivamente dell'N totale del prodotto di idrolisi;
e) solo circa il 50% dell’N totale è riferibile a proteine solubili.
Fenilalanina, tirosina ed un terzo amminoacido non identificato, che probabilmente è acido l-amminobutirrico, sono stati riconosciuti come derivati dall'idrolisi dei protidi del Fucus vesiculosus (19).
— Carotinoidi: b-carotene, fucoxantina, neofucoxantina, violaxantina, luteina, tracce di neoxantina nell’alga vivente in stagione invernale: nell’alga «post mortem» compare anche zeaxantina (20).
— Vitamina B1 (21).
— Acido pteroiltriglutammico, acido N10-formilpteroico, acido N10-formilfolico, acido folico, acido folinico, timidina ed altre tre sostanze non identificate, riconosciute mediante cromatografia su carta e risultate attive come fattori di crescita per lo Streptococcus faecalis (22).
— Fattori vitamina-B12-simili (22a).
— Olio volatile 0,1% (23).
— Olio grasso, il cui contenuto elevato, trovato talvolta nel Fucus vesiculosus, è stato attribuito ad alterazioni metaboliche dell’alga (24).
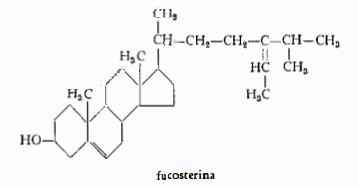
— Fucosterina, C29H48O, trovata per la prima volta nel Fucus vesiculosus (25) e poi in numerose altre alghe marine, è stata estratta nella proporzione di 40 g in forma grezza da kg 22,5 di F. vesiculosus, pari a g 0,177% nell’alga secca (26). La formula di struttura, proposta da MacPhillamy (26) e confermata da Hey, Honeyman e Peal (26a), è la seguente:
— Entriacontano (27).
— Un fattore, inibente la fertilità nel riccio di mare e l’azione della jaluronidasi, dell’a-amilasi, della ureasi e della ribonucleasi, è risultato essere una sostanza non dializzabile contenente 3-6% di solfati, 0,05% di fosforo, 0,2-1,6% di azoto e producente per idrolisi glucosio, fucosio, xilosio, mannosio e galattosio (28).
— Enzimi proteolitici, fosfatasi, b-glucosidasi (29) (30).
— Ceneri 1,59 % (31) anche 4,09 %, con gli ioni K, Na, Mg, Fe, Mn, Cl, Br, P, S, Si, (32).
— Jodio in combinazione organica, trovato in quantità variabili, secondo diverse referenze:

—- Bromo 0,015% nella droga secca (32).
— Arsenico mg 0,01 % (37).
— Umidità 73,7% nella droga fresca (32), 6-11,95% in media 9,07% nella droga essiccata all’aria (38).
— Radioattività: microcurie 0,76 x 10-5 per g di peso secco (39).
Negli elementi riproduttivi del fucus vesiculosus, Sosa-Bourdouil (30) ha trovato un contenuto di fosforo, azoto totale e di proteine rispettivamente pari a 1, 8,4, 7,8%; negli anterozoi e pari a 0,3, 4,7 e 4,5 % nelle oosfere. Secondo l’esito delle analisi dello stesso Autore, le oosfere hanno un più elevato contenuto di gruppi metossilici, di lipidi e di glucidi. Gli zuccheri riduttori sono in bassa quantità in entrambi. Gli acidi nucleici sono il 7 % degli anterozoi e solo il 2 % delle oosfere: negli anterozoi essi sono costituiti principalmente da acido desossi-ribonucleico, nelle oosfere da acido ribonucleico. Entrambi gli elementi contengono allantoina. Gli enzimi proteolitici sono in maggiore quantità negli elementi maschili. Le oosfere hanno una notevole attività b-glucosidasica.
Proprietà farmacologiche ed impiego terapeutico
Secondo alcuni la Quercia marina sarebbe stata impiegata fin dal 1600 nella terapia della scrofolosi, dell’obesità e del gozzo (40) ma di essa non dà notizia alcuna Durante (41) nel suo «Herbario Novo» (1657) e Lemery (42) (1735), descrive botanicamente la Quercia marina ma ne ignora le proprietà terapeutiche: «Non si adopera in medicina, dicesi che una volta servisse per la tintura».
Notizie più precise ci provengono da Duchesne-Duparc (43) il quale ha impiegato, forse per primo, la Quercia marina nella terapia dell'obesità, ottenendo dopo cure protratte per diversi mesi, una notevole diminuzione ponderale, senza ridurre la dieta e senza provocare alcuna azione secondaria dannosa.
Risultati pressocchè analoghi furono ottenuti da diversi altri autori fra i quali Potier (44), Conroy (45), Frank-Frisby (46), Godefroy (47), Kisch (48) (dal quale però la droga venne impiegata come coadiuvante di una dieta speciale) ed altri.
Occorre dire peraltro, che non tutti sono concordi nel riconoscere a questa droga un potere dimagrante e infatti essa non sembra agire in tutti i casi di obesità. Una possibile spiegazione di tale sua azione la si potrebbe trovare nei risultati ottenuti da Hunt e Seidell (49) i quali trovarono che un estratto di Quercia marina usato nelle loro esperienze era dotato di una potente azione stimolante dell'attività tiroidea. Tuttavia non è facile dire quale, tra i numerosi componenti della droga, sia responsabile di tale sua particolare attività.
Come risulta da quanto detto nella parte chimica, nella Quercia marina sarebbe contenuta una sostanza non dializzabile, dotata di un’azione inibente la fertilità nel riccio di mare e l'azione della jaluronidasi, dell’a-amilasi, della ureasi e della ribonucleasi.
Estratti e preparati vari
a) Estratto fluido (g 1 = LV gtt).
Dosi: g 0,5-1 pro dose.
b) Estratto secco acquoso (1 p. = 9 p. circa di droga).
Dosi: g 0,05-0,15 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido quercia marina g 20
Alcool di 60° …. g 80
(g 2,5-5 pro dose).
Sciroppo
Estratto fluido quercia marina………………………………….. g 10
Alcool e glicerina………………………………………………….. ana g 10
Sciroppo semplice F.U. …………………………………………… g 70
(a cucchiai).
Compresse nel trattamento dell’obesità
Estratto secco quercia marina………………………………….. g 0,10
Estratto secco frangola
Estratto secco carciofo
Estratto secco orthosiphon……………………………………. ana g 0,03
Solfato di potassio g 0,2
(per una compressa).
(iniziare con 3 compresse pro die, aumentare sino a 15 poi diminuire sino a 3 pro die).
BIBLIOGRAFIA
(1) O'NEILL A. N., J. Am. Chem. Soc., 76, 5074, 1954 – (2) ZAVOROKHINA N, A. e BEN’KOVSKII V. G., Kolloid Zhur., 20, 436, 1958; Chem. Abs., 52, 21007h, 1958 – (3) LINK K. P., Science, 76, 386, 1932 – (4) HIRST E. L., JONES J. K. N. e JONES W. O., J. Chem. Soc., 1880, 1939 – (5) CHANDA S. K., HIRST E. L., PERCIVAL E. G. V. e ROSS A. G., ibid., 1833, 1952 – (6) FISCHER F. G. e DORFEL H., Z. physio/. Chem., 302, 186, 1955 – (7) KUZNYNSKI W. e ZAGORSKI Z., Roczhfk/ Chem., 26, 690, 1952; Chem. Abs., 48, 6049 f, 1954 – (8) CHECHELSKA B. e URBANSKI T., Prace G/ownego Inst. Przemys/M Rolnego i Spozywczego, 4, n. 2, 39, 1954; Chem. Abs., 49, 14231 h, 1955 – (9) KYLIN H., Z. physiol. Chem., 83, 171, 1913; 94, 357, 1915 – (10) BIRO G. M. e HAAS P., Biochem. J., 25, 403, 1931 – (H) LUNDE G., HEEN E. e OY E., Z. physlol. Chem., 247, 189, 1937 – (12) PERCIVAL E. G. V. e ROSS A. G., J. Chem. Soc., 717, 1950 – (13) CONCHIE J. e PERCIVAL E. G. V,, ibid., 827, 1950 – (14) DEWAR E. T., Chem. lnd., 785, 1954; Chem. Abs., 48, 12241 f, 1954 – (15) BLACK W. A. P., DEWAR E. T. e WOODWARD F. N., J. Sci. Food Agr., 6, 754, 1955; Chem. Abs., 50, 5947c, 1956 – (16) LINDBERG B., Acta Chem. Scamd., 7, 1119, 1953; Chem. Abs., 49, 6840 g, 1955 – (17) LINDBERG B. e MCPHERSON J., Acta Chem. Scand., 8, 1547, 1954 – (18) SMITH D. G. e YOUNG E. G., J. Blol. Chem., 205, 849, 1953; Chem. Abs., 48, 3486 b, 1954 – (19) JACOBI G., Kie/ Meeresjorsch., 12, 65, 1956; Chem. Abs., 50, 9520 a, 1956 –
(20) LIAAEN S. e SORENSEN N. A„ Intern. Seaweed Symposium, 2 end, Trondheim, 25, 1955; Chem. Abs., 52, 2186, 1958 – (21) GERDES G., Arch. Mikrobiol., 16, 53, 1951; Chem. Abs., 49, 12618 a, 1955 – (22) ERICSON L. E., WIDOFF E. e BANHIDI G., Acta Chem. Scand.^ 7, 974, 1953; Chem. Abs., 48, 9463 e, 1954 – (22 a) KARLSTROM O., CALLIERI D. e BACK K., Arkiv Kemi, 16, 299, 1960; Chem. Abs., 55, 23686b, 1961 – (23) OSOL-FARRAR-PRATI – United States Dispensatory, 1960, p. 1695- (24) MTJLLER- STOLL W. R. e RUENZENBACH R., Arch. Protistenk., 101, 289, 1956; Chem. Abs., 51, 75Ug, 1957 – (25) HEILBRON I. M., PHIPERS R. F. e WRIGHT H. R., Nature, 133, 419, 1934 -(26) MACPHILLAMY H. B., J. Am. Chem. Soc., 64, 1732, 1942 – (26a) HEY D. M., HONEYMAN J, e PEAL W. J.,J. Chem. Soc., 2881, 1950 – (27) KARRER W., Konstitution und Vorkommen der organischen Pftanzenstoff'e, 1958, p. 19 – (28) ESPING U., Arklv Kemi, 11, 107, 1957; Chem. Abs.^ 51, 158101, 15811 a, 1957 – (29) SOSA-BOUR- DOUIL C., Compì. rend., 242, 1510, 1956; Chem. Abs., 51, 556 h, 1957 – (30) SOSA-BOURDOUIL C., Ann^e biol., 34, 501, 1958; Chem. Abs., 53, 18203 b, 1959 – (31) FRANK-FRISBY, Am. J. Pharm., 52, 434, 1880 – (32) MARCHAND. J. pharm. chim., 4, 2, 276, 1865 – (33) VIBRANS, Diss. «Die Zusammensetzung der Aschen verschiedener Ostseepftanzen», Rostok 1873 – (34) STANFORD, Amer. Drpgg., 146, 1884; Pharm. Zentralh., 614, 1884 – (35) ITALLIE, Arch. Pharm., 27, 1132, 1889 • (36) ESCHLE, Z. physiol. Chem., 23, 30, 1897 – (37) TASSILLY-LEROIDE, Bu//. sci. pharm., 17, 580, 19 1 0- (38) KRONE, Pharmazie, 15, 503. 1960 – (39) ALFIMOV N. N. e LESIOVSKII E. M., Botan. Zhur., 44, 516, 1959; Chem. Abs., 54, 1669 b, 1960 – (40) HERTWIG H., Acta Phytother., 3, n. 6, t, 1956 – (41) DURANTE CASTOR, Herbario novo, G. Hertz ed. Venezia 1657 – (42) LEMERY NICCOLÒ, Trattato universale delle droghe semplici, traduz. deU'ed. francese del 1721, Padova 1735, p. 142 – (43) DUCHESNE-DUPARC, Du fucus vesiculosus (chène marine, laitue marine) de ses propriétés fondantes et son emploi contre l'obésité et ses différentes complications. II ed., Baìllière, Paris 1863; J. pharm. chim., 42, 65, 1862 – (44) POTIER, Bull. soc. pharm. Bruxelles, n. 4, 1864 • (45) CONROY, Lancet, 15 ottobre 1879 • (46) FRANK-FRISBY, Am. J. Pharm., 52, 432 – (47) GODEFROY. J. pharm. chlm.^ 42, 67, 1862 – (48) KISCH, Real-EnzyklopS.die der gesamten Heilkunde, III ed., 7, 565, 1895 – (49) HUNT e SEIDELL, J. Pharmacol. exp. Ther., 2, 15, 1910.


