Orthosiphon
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Orthosiphon stamineus Benth. – Fam. Labiate/Ocimee/Moscosmee) (Sin. – Ocimum grandiflorum Blume)
Orthosiphon- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Orthosiphon – dal greco orqos = diritto, eretto e sifwn = sifone, cannello, allusione al tubo della corolla lungo e diritto.
stamineus – per gli stami molto lunghi.
Nomi volgari – Koemis Koetjing (malese), baffo di gatto, the di Giava (it.), moustache de chat, barbiflore (fr.), Java Thea (ingl.).
Habitat – Indie orientali (arcipelago malese, Giava), spontanea lungo i fiumi, presso le paludi, Australia, Filippine, America tropicale. Coltivata, anche come pianta ornamentale.
Arboscello perenne, legnoso-erbaceo (1-1,5 m.).
Parti usate – Le parti aeree (foglie e sommità, raccolte prima della fioritura). Gli indigeni fanno subire alle foglie delle manipolazioni analoghe a quelle per la preparazione del the, per seccarle conservando l'aroma.
Componenti principali
Si hanno poche e non approfondite notizie sui componenti dell’Orthosiphon stamineus. In letteratura si trovano indicate le seguenti sostanze:
— un glucoside (ortosifonina), di composizione chimica non definita, segnalato per la prima volta da van Itallie (1) e ritrovato da Perinelle e Guyon (2), da Kuhlmann (3) e da Schunck de Goldfiem (4). Non e stato invece trovato da Casparis e Février (5).
— una saponina (sapofonina) è stata estratta da Casparis e Février (5). Essa ha dato per idrolisi una sapogenina e tre zuccheri di identità non sicuramente accertata, identificabili forse con arabinosio, glucosio e fruttosio (5). Una saponina acida è stata pure ottenuta da Balansard (6) nella quantita dello 0,12%.
— olio essenziale 0,4%-0,5 %-0,7% in tre campioni di foglie analizzati da Peyer e Liebisch (7), sino allo 0,34 % secondo l’esito dei saggi di Caspans e Fevrier (5), eseguiti su sei campioni di foglie.
— olio grasso (piccole quantità) con gliceridi di acidi grassi, tra cui gli acigi linolenico, oleico e linoleico (5).
— gli acidi tartarico, citrico (8), glicolico, glicerico (9) e d-glucuronico (8).
— b-sitosterolo (10).
— a-amirina (10).
— carotene (4).
— limonene (4).
— mentolo, borneolo (4).
— timolo (4).
— glucosio, fruttosio e pentosi (8).
— urea totale mg 40% in forma libera mg 14 % nella droga secca, il
che indica la presenza di mg 26 % di urea in forma di ureidi (12).
— un principio diuretico è stato estratto in forma cristallina (p.f. 222-224°) nella quantità dello 0,22 % della droga (11).
— un alcaloide non determinato (13), non trovato da Keller (8).
— ceneri 11,66-13,72%, di cui 2,71-4,70% insolubili in acido cloridrico (5). In esse sono stati riconosciuti gli ioni Fe, Al, Zn, Ca, Mg, K, Na (5), Mn (8), Cl, SO4, PO4, e SiO3 (5), NO3 (8).
— potassio 0,631-0,738 % nella pianta fresca (14), 2,74% nelle foglie essiccate all'aria (5).
Sono state messe in evidenza anche elevate quantità di calcio oltre che di potassio; nella droga secca sono stati trovati (8):
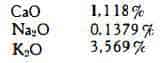
— umidità 6,88-12,54% in 6 campioni di foglie (5), non più di
13% (15).
Nell’Orthosiphon pallidus Royle è stata riscontrata la presenza di una sostanza alcaloidica, di zuccheri riduttori, di disaccaridi e di uno sterolo, denominato ortosifonolo, di formula grezza C30H50O2 (16) ed inoltre di colina nella pianta raccolta in aprile-maggio ed in settembre, e di colina e di betaina nella pianta raccolta in luglio (17).
Proprietà farmacologiche ed impiego terapeutico
L’Orthosiphon è estesamente usata come diuretico nella medicina dei paesi d’origine dove viene impiegata sotto forma di infuso (d’onde il nome di the di Giava).
I primi studi sulla composizione chimica della droga, che venne importata in Europa dagli olandesi in epoca difficilmente precisabile, risalgono al 1886-1887 e si debbono al van Itallie (1) ed a Perinelle e Guyon (2), ma l'interesse dei medici occidentali su di essa venne però attirato soltanto nel 1927 da uno studio con cui Gruber ( 18) confermò l’esistenza della sua azione notevolmente diuretica.
Tale effetto diuretico non sembrerebbe essere dovuto ad un semplice aumento della secrezione dell'acqua, poiché anche l'eliminazione dei cloruri e dell’urea appare notevolmente aumentata.
L'aumento della secrezione urinaria, secondo S. de Goldfiem (4) sembrerebbe essere dovuto, oltre a una modificazione della funzionalità renale, anche a una diminuzione della ritenzione d'acqua da parte dei colloidi tessutali e ematici; verrebbe cioè a diminuire la tenacità di quel legame che esiste fra acqua e colloidi o, in altri termini, verrebbe a diminuire per un modificato stato di idratazione dei colloidi stessi, la cosiddetta pressione oncotica o di imbibizione che, insieme con la pressione arteriosa, rappresenta appunto uno dei fattori che condizionano la secrezione urinaria.
L’Orthosiphon aumenta inoltre, il potere di concentrazione renale, e attiva la funzionalità degli elementi specifici del rene. L’urogenesi totale, secondo il citato A., è notevolmente stimolata e anche l’eliminazione dei cataboliti viene ad essere favorita. Il riassorbimento degli edemi viene attivato e così pure la dissoluzione più o meno completa dei depositi colesterinici, delle placche ateromatose, dei calcoli e anche la glicosuria verrebbe sensibilmente influenzata. Questi risultati ottenuti da S. de Goldfiem sulla cavia e sul cane, confermarono, per quanto riguarda l’aumento della diuresi, dell’eliminazione dell’urea e dei cloruri, quelli precedentemente ottenuti da Mercier e coll. (19) che sperimentarono sul coniglio e sul cane, mentre l’azione ipocolesterolemizzante venne più recentemente confermata da Cugurra e coll. (20), i quali sperimentarono l’azione dell’Orthosiphon sull'ipercolesterolemia indotta nel coniglio mediante triton.
Esperienze sull’uomo sano, condotte da de Goldfiem su se stesso e sui suoi collaboratori, dimostrarono che in seguito all’ingestione quotidiana di 10 cc di idrolito di Orthosiphon, la quantità delle urine eliminate, può essere triplicata. Sui malati questo A. osservò che la quantità delle urine eliminate e la loro composizione possono variare in relazione al quadro sintomatologico, pur manifestandosi sempre con un importante aumento della diuresi, con un’azione declorurante e azoturica, con un abbassamento del tasso uremico e con un miglioramento della pressione arteriosa.
All’Orthosiphon viene attribuita anche un’azione colagoga che secondo de Goldfiem sarebbe simile a quella dovuta al terpineolo ma di questa più debole.
Balansard (21) classifica l’Orthosiphon fra le droghe contenenti gli acidi glicolico e glicerico i quali esplicherebbero un’azione epato-renale, atta cioè a determinare un miglioramento della funzionalità epatica e renale, riflettentesi in particolare, sull’urogenesi, sulla diuresi e sul potere di concentrazione del rene. L’eliminazione dei cloruri, dell’urea e, in generale, dei cataboliti, verrebbe così favorita e i valori azotemici, uricemici e colesterolemici ridotti, se abnormemente elevati (22) (24).
Oltre il tasso colesterolemico, diminuisce nel sangue anche la concentrazione dei glicerofosfoaminolipidi, del destrosio e degli elettroliti, che verrebbe ricondotta alla norma.
Anche la viscosità del sangue diminuirebbe leggermente ed aumenterebbe il suo potere batteriostatico, durante il passaggio in circolo dei principi attivi della droga, per azione specialmente delle sostanze che entrano nella composizione dell’olio essenziale.
Un abbassamento della pressione arteriosa venne notato anche da questo A. il quale osservò anche una diminuzione della costante urosecretoria di Ambard.
Una parte del glicoside ortosifonina sembra si fissi sulle pareti vasali. Mercier e coll. (25) hanno notato che all’azione dell’Orthosiphon consegue anche un aumento della fissazione dei salicilati sul miocardio.
Per quanto riguarda le indicazioni terapeutiche, dai casi clinici trattati con Orthosiphon e descritti da diversi AA. [Mercier e Decaux (26), Decaux (27), Leclerc e Decaux (28), Leclerc e Van der Elst (29), Leriche (30), Letulle (31), S. de Goldfiem (4)] risulta che esse comprendono le malattie delle vie urinarie (nefriti, coliche nefritiche, cistite, uretrite, renella); le malattie del fegato e delle vie biliari (coliche epatiche, ittero, colecistite, colemia, epatite dei paesi caldi, diabete); le malattie del cuore e dei vasi (edemi, sclerosi, ateromasia, ipertensione); le malattie del ricambio (artritismo, gotta, reumatismo, alcune dermatosi eczematose, nevralgie e, infine, le turbe umorali che insorgono come conseguenza di interventi operatori (Leriche, Letulle).
I risultati spesso brillanti che si ottengono con preparati a base di Orthosiphon e per somministrazione opportunamente prolungata, nelle malattie reumartritiche, ci ha indotti a ritenere che anche nella composizione di questa droga entrasse qualche composto sterolico o triterpenico e che quindi agisse in questi casi, con meccanismo d'azione simile a quello ipotizzato a proposito di altre droghe in cui la presenza di queste sostanze è stata accertata (ved. Agrimonia eupatoria, Helichrysum italicum ed altre droghe ad azione simile). Da ricerche chimiche eseguite dal Di Modica (10), cui lo studio chimico di questa droga venne da noi affidato, risulta infatti che della composizione dell’Orthosiphon fanno parte una sostanza sterolica, la b-sitosterina e un triterpene, l'a-amirina.
Preparati e dosi – I preparati di Orthosiphon che nella pratica terapeutica meglio hanno corrisposto, sono rappresentati dall’infuso e dall’estratto fluido. L’infuso si prepara con g 1,5-5 di droga in g 500-1000 d’acqua, da sorbirsi nella 24 h, edulcorando con zucchero a piacere.
L’estratto si usa pure alle stesse dosi, diluendolo con acqua calda e, volendo, zuccherata.
Bouchillon-Limousin (32) indica le seguenti dosi: infuso 5%0; polvere delle foglie da 2 a 5 g; estratto secco, g 0,40 da 2 a 4 volte al giorno.
Per cure prolungate il de Goldfiem consiglia di intercalare 2 giorni di sospensione dopo ogni 8 giorni.
Secondo Attendoli sarebbero opportune le seguenti dosi: infuso di foglie dal 5 al 10 %0, zuccherato o non, da sorbirsi a bicchieri da 100 g; estratto totale stabilizzato, da g 0,50 a g 2 al giorno, in pillole o in cachets. Tale dose deve essere frazionata e somministrata in più riprese, preferibilmente durante i pasti; estratto fluido da g 0,50 a g 2 al giorno, diluito in acqua glicerinata e zuccherata, a dosi frazionate da somministrarsi come sopra.
Secondo questo A., i casi di intolleranza gastrica non sarebbero rari ma da noi non furono mai constatati, nè ci risulta che siano stati descritti da altri Autori.
Lo studio dei farmaci che associati all’Orthosiphon, possono agire sinergicamente, fu oggetto di accurato studio e di estese ricerche cliniche e le conclusioni degli AA. che si occuparono dell’argomento vennero cosi riassunte da Attendoli (33): nelle affezioni epatiche in generale, in quelle epato-renali, nelle litiasi, nell’ascite, è opportuna l’associazione con estratto fluido di Carciofo.
Nelle cardiopatie e soprattutto in quelle dovute a insufficienza valvolare, nelle affezioni cardiorenali, nell’ipertensione, nell’obesità, negli edemi dovuti a insufficienza cardiaca, può essere utile l’associazione coi digitalici (Adonide e Scilla in particolare). Nelle infezioni e nella congestione degli organi del piccolo bacino, è consigliata l’associazione con urotropina e tetrametiltionina.
Nelle autointossicazioni, nel reumatismo e nell’artritismo, sono consigliati i lassativi del gruppo antracenico e, potremmo aggiungere, i salicilici.
Fra le incompatibilità, de Goldfiem annovera quelle dovute ai sali di calcio, agli ossalati, al colesterolo. Tisane di Salvia officinale, somministrate durante il trattamento a base di Orthosiphon, darebbero luogo ad un'azione antagonistica. Lo stesso avverrebbe per somministrazione di adrenalina, di estratto ipofisario totale, di estratto epatico e di sali biliari.
Estratti e preparati vari
a) Estratto fluido (g 1 = XXX gtt).
Dosi: g 0,5-3 pro die.
b) Estratto molle idroalcoolico (1 p. = 6 p. circa di droga) .
Dosi: g 0,1-0,5 pro die.
c) Estratto secco acquoso (1 p. = 6 p. circa di droga).
Dosi: g 0,1-0,5 pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido orthosiphon……………………………………… g 20
Alcool di 20° ……………………………………… g 80
(g 2,5-15 pro die).
Sciroppo
Estratto fluido orthosiphon………………………………………… g 10
Sciroppo semplice F.U…………………………………………… g 90
(5-6 cucchiaini pro die).
Pozione colagoga e diuretica
Estratto fluido orthosiphon……………………………………… g 10
Estratto fluido ononide……………………………………………. g 6
Estratto fluido carciofo……………………………………………. g 5
Vino bianco……………………………………………………………. g 200
Sciroppo di arancio dolce………………………………………. g 50
Potassio joduro………………………………………………………. g 1
(a bicchierini).
Pillole colagoghe e diuretiche
Estratto secco acquoso orthosiphon
Estratto secco acquoso carciofo
Estratto secco acquoso uva ursina ana g 0,05
Eccipiente q. b. per una pillola
(2-10 pillole pro die).
BIBLIOGRAFIA
(1) VAN ITALLIE, Nieuw Ti)dschrift voor Pharmacie, 2, 69 e 5i6, i886 • (2) PERINELLE e GUYON, Nouveaux remèdes, 6 e 76, 1887 – (3) KUHLMANN, Pharm. Ztg., n. 26, 367, 1931 • (4) SCHUNCK. DE GOLDFIEM, Presse Méd., n. 52, 1039, 1938 – (5) CASPARIS P. e FEVRIER C., Pharm. Acta Helv., 8, 75, i933 • (6) BALANSARD, Buil. sci. pharm., 43, 148, i936 – (7) PEYER e LIEBISCH, Jahresber., Caesar e Loretz, i929 – (8) KELLER O., Arch. Pharm., 272, 245, i934 – (9) BALANSARD J., Prod. Pharm., 7, 457, i952 – (10) DI MODICA G. e ROSSI P. F., Gaz. Chim. Itat., 88, 737, 1958 – (ii) RAVENSBERG G. m. b. H., Brevetto Ger., 1.065.132, 10 settembre 1959; Chem. Abs., 55, 108i4 h, 1961 – (12) DIETZEL R. e SCHMIDT E., Arch. PhMm., 274, 10, i936 • (13) TANG e HSU, 1. Chin. Chem. Soc., 7, 116, 1940 – (14) BOORSMA, Jndische Mercuur, dk. 1931 – (15) GRAAF W. C., Ree. Trav. Chim., 59, 555, i940 â– (i6) BASU N. K. e SINGH H., l.A.Ph.A., ed. sci., 45, 595, 1956 – (17) BASU N. K. e SINGH H., l.A.Ph.A., ed. sci., 45, 598, 1956 – (i8) GRUBER, Thèse inaugurale, Marburg 1927 – (19) MERCIER F., MERCIER L. J. e DECAUX F., Soc. de Thérapeut., gennaio 1936 – (20) CUGURRA F., CHIARLO B. e PALAZZI A., Ct/n. terap., Ì5 bis, suppl. n. 4, 1958 – (21) BALANSARD J., Prod. Pharm., 7, 456, 1952 – (22) MERCIER F. e BALANSARD J., Congr. Diurèse, Vitte!, maggio 1939 – (23) HICKER W .F. e GOLD H., l.A.Ph.A., 31, 306, 1942 – (24) DELPHAUT J., Med. Troptc., n. 4, 641, i951 – (25) MERCIER F., DELPHAUT J. e JOUFFRET P., Comp. rend. soc. biot., 135, 1661, 1941 – (26) MERCIER L. e DECAUX F., Soc. de Thérapeut., gennaio 1936 – (27) DECAUX F., Presse Méd., p. 831, maggio 1935; Courrier Méd., 10 novembre 1935; Rev. de Phytothér., 16, 143, 1952 – (28) LECLERC H. e DECAUX F., J. Prattcìens, aprile 1936 – (29) LECLERC H. e VAN DER ELST, Presse Méd., n. 81, i571, 1936 â– (30) LERICHE, ibid., n. 45, 909, i935 – (31) LETULLE, ibid., n. 8i, 1568, 1935 – (32) BOUCHU,. LON-LIMOUSIN, cit. da S. DE GOLDFIEM l.c. – (33) ATIENDOLI, Presse Méd., n. 69, 1355, 1935; La Méd. Franp., marzo 1934.


