Ruta
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Ruta graveolens L. – Fam. Rutacee/Rutoidee/Rutee)
[Sin. – Ruta hortensis Miller – per distinguerla dalla Ruta divaricata Ten.,
che vegeta sulle roccie, vecchi muri, poggi aridi (quasi inodora)].
Ruta- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Ruta, dal greco ruth = ruta e dal latino ruta = id. probabilmente da roumai = salvo, libero, proteggo, difendo, perchè conserva a lungo le foglie ed anche perchè libera dal male, conserva la salute.
graveolens, da grave olens = fortemente odorante
hortensis, coltivata negli orti.
Nomi volgari – Rua, erba ruja (lig.), aruga amara, ridda (piem.), erba ruga (lomb.), ruda (ven.), ricola, ruda (emil.), aruta (nap. e sic.), arruda (sard.).
Raute (ted.), the common rue (lig.), rue (fr.), ruda (spagn.), arruda (port.), kòròsztòs ruta (ungh.).
Habitat – Europa meridionale. In Italia abbastanza frequente nei luoghi secchi e sassosi, aridi e soleggiati, dal mare alla regione montana. Coltivata negli orti. La Ruta divaricata Ten. alligna in Abruzzo, nel Gargano e in altre località della penisola media e inferiore e non va confusa con la Ruta divaricata Salzm. (sin. = Ruta Corsica DC.) (Corsica).
Suffrutice (pianta perenne con caule legnoso alla base).
Parti usate – Pianta intera (parti aeree) raccolta all’inizio della fioritura e privata dei cauli più grossi.
Componenti principali
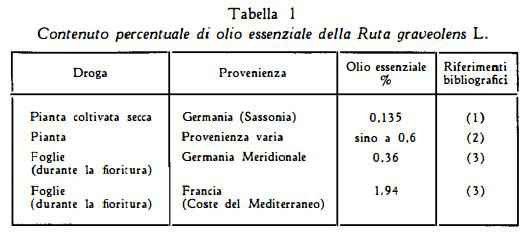
Olio essenziale in quantità notevolmente diverse secondo le referenze della letteratura (1-4) (tabella 1). Rutina (5), quercetina, due glucosidi flavonolici non identificati (3). Un glucoside antocianico, che per idrolisi produce glucosio, ramnosio e cianidina (6). Le furocumarine bergaptene (7-10) e xantotossina (10). Alcaloidi del gruppo della chinolina: cocusaginina (11) (12), skimmianina (11) (12), graveolina (12) (12a) e graveolinina (l2b). Inoltre vitamina C; da 0,650% a 1,5% di acido ascorbico, calcolato per le foglie secche, nel corso del ciclo vegetativo (13).
A) Olio essenziale
Si ricava generalmente per distillazione in corrente di vapore dalla pianta fresca raccolta in estate durante la fioritura. Il rendimento è di circa 1 kg di olio essenziale per 160 kg di pianta fresca. Dopo essiccazione o per esposizione della pianta all’aria per qualche giorno, la produzione di olio può diminuire anche di circa il 35% (4).
Secondo Naves (14), l’olio di Ruta prodotto in Spagna, deriva dalla Ruta montana L., mescolata con Ruta graveolens L. Anche Simmons (15) riferisce che la principale fonte dell’olio spagnolo è la Ruta montana L., mentre, secondo Dorronsoro (16), nella Spagna si usano la R. bracteosa L. e la R. graveolens L., Guenther (4), considerata l’epoca della raccolta della pianta fiorita (luglio-agosto), giudica più probabile che la Ruta usata in Spagna sia la R. montana L.
L’olio di Ruta francese deriva, secondo Naves (14), dalla R. graveolens L., quello siciliano dalla R. bracteosa L. e quello sardo dalla R. angustifolia Pers., mentre quello Nord-africano dalla R. montana, R. bracteosa e dalla R. angustifolia Pers.
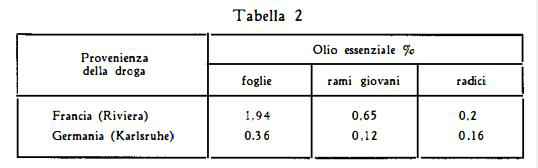
Lo studio condotto da Sprecher (3) circa l’influenza dei fattori genetici e climatici sulla composizione della Ruta graveolens ha messo in evidenza nella pianta dell’età di due anni, raccolta durante la fioritura lungo la Riviera francese (capo Rosso), un contenuto di olio volatile superiore a quello della pianta raccolta nelle stesse condizioni nella Germania Meridionale (Karlsruhe) (tabella 2).
Composizione chimica dell’olio essenziale
L’olio essenziale della Ruta graveolens L. è costituito dal 90% e più di due chetoni, metilnonilchetone, C11H22O, e metileptilchetone, C9H18O, quest’ultimo presente in quantità inferiore, come è dimostrato dal punto di congelamento dell’olio, corrispondente alla temperatura tra + 5,8° e + 10,5°, comunemente circa + 7° (4).
Nell’olio di Ruta di diverse origini (Ruta graveolens L. ed altre specie) sono state inoltre trovate piccole quantità di metil-n-ottil-chetone ( 17), l-a-pinene, l-limonene, cineolo, metil-n-eptilcarbinolo, metil-n-nonil-carbinolo, esteri dell’acido valerianico, acido salicilico, acido caprilico (2), estere metilico dell’acido metilantranilico, una base (?) e un azulene (?) (4).
B) Flavonoli
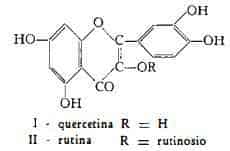
Rutina, C27H30O16, estratta per la prima volta dalla Ruta graveolens L. da Weiss (5), che l’ha così denominata, è stata poi identificata in numerose altre specie di piante, appartenenti ad oltre 30 famiglie diverse. A questa sostanza, così diffusa nel mondo vegetale, sono state assegnate parecchie altre denominazioni — acido rutinico, soforina, melina, osiritrina, mirticolorina, violaquercitrina, globulariacitrina, eldrina, paliuroside — derivanti dal nome delle piante, da cui è stata estratta.
E’ il rutinoside (18) in posizione 3 (19) della quercetina, C15H10O7, cioè del 3′,4′,5,7-tetraossiflavonolo. Per idrolisi produce quercetina, una molecola di ramnosio ed una di glucosio.
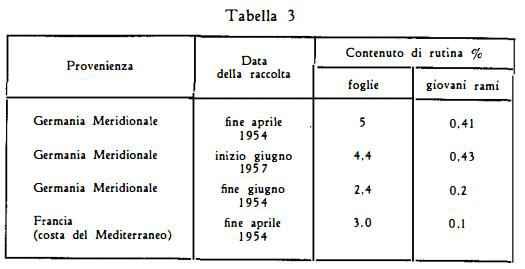
Il contenuto di flavonoli è risultato più elevato nella droga della Germania Meridionale rispetto a quella cresciuta sulla costa francese del Mediterraneo (tabella 3) (3).
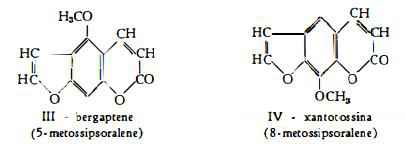
C) Furocumarine
1) Bergaptene, C12H8O4, è stato isolato in un primo tempo da Brandt (7) dai frutti e poi da Muhlemann (8) dalla pianta nella quantità dello 0,1 %, da Rodighiero e coll. (9) nella proporzione di g 1,8 da kg 1,5 di pianta (foglie, rami e fusti) (10) e da Ohta, Mori, Noda e Aoki (19a) dalle foglie secche con una resa dello 0,05 %.
Si tratta della furocumarina estratta per la prima volta dall’olio di Bergamotto da Mulder (20) e denominata bergaptene da Ohme (21). E’ nota anche sotto il nome di majudina e di eraclina, come componente dell’Ammi majus L. e dell’Heracleum giganteum, rispettivamente.
2) Xantotossina, C12H8O4, furocumarina già estratta dai frutti della Fagara xanthoxyloides Lam. (22), della Ammi majus, della Ruta chalepensis (7) e della R. montana (23), è stata identificata anche nella Ruta graveolens L. da Rodighiero, Caporale e Albiero (10).
D) Alcaloidi del gruppo della chinolina
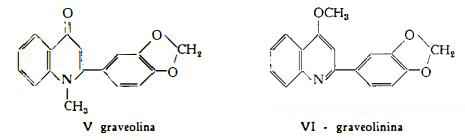
1) Graveolina, C17H13O3N, nuovo alcaloide isolato da Arthur e Cheung (12) dalla pianta della Ruta graveolens L., proveniente dalla Cina (Hong-Kong), è stato identificato dagli stessi AA. all’1-metil-2-[3′,4′-metilendiossifenil]-4-chinolone, composizione che è stata poi confermata per sintesi (12a).
2) Graveolinina, C17H13O3N, è stata estratta dalla Ruta graveolens L. ed identificata, mediante confronto con il prodotto di sintesi, da Chatterjee e Deb (12b) alla 2-[3′-4′-metilendiossi-fenil]-4-metossichinolina, trovata da Goodwin e coll. (12c) nella Lunasia amara Bianco.
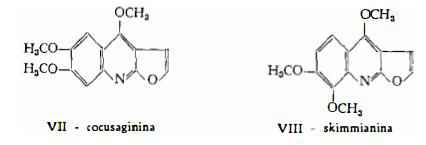
3) Cocusaginina, C14H13O4N, già nota come componente delle foglie e della corteccia della radice della Orixa japonica Thunb. (24) (25), di alcune specie di Evodia, E. xanthoxyloides F. Muell. (26), E. littoralis Endl. (27), E. alata F. Muell. (28), e della Fluidersia maculosa Lindl. (29), è stata estratta anche dalla pianta della Ruta graveolens L. da Ohta e Miyazaki (11) e nella quantità di g 0,1 da 1 kg di foglie secche da Ohta, Mori, Noda e Aoki (19a). La presenza della cocusaginina nella Ruta è stata confermata da Arthur e Cheung (12). La struttura VII con nucleo furo-(2,3-b)-chinolinico, assegnata all’alcaloide da Anet e coll. (30), è stata confermata dallo studio dei prodotti di degradazione e di sintesi (31).
4) Skimmianina, C14H13O4N, l’alcaloide così denominato per essere stato estratto per la prima volta dalla Skimmia japonica Thunb. (32), è stata isolata anche dalla Ruta graveolens L. da Ohta e Miyazaki (11) e poi da Arthur e Cheung (12). Dalle foglie secche è stata ottenuta con una resa di g 0,1 per kg (19a). La formula di struttura dell’alcaloide con nucleo furo-(2,3-b)-chinolinico, è stata stabilita da Asahina e Naka- nishi (33).
Proprietà farmacologiche ed impiego terapeutico
La Ruta era nota ad Ippocrate e a Teofrasto col nome di Péganon e venivano ad essa attribuite le proprietà di inibire la germinazione dei semi e di impedire la procreazione; era ritenuta afrodisiaca nell’uomo ed erano già note le sue proprietà oxitocica ed abortiva.
Essa era inoltre impiegata come farmaco emmenagogo, antiepilettico e per rendere più acuta la vista, proprietà quest’ultima che venne riconosciuta più tardi anche dalla Scuola Salernitana; Nobilis est ruta quae lumina reddit acuta» (34).
Attualmente la Ruta ha scarse applicazioni terapeutiche; le vengono tuttavia riconosciute le proprietà antispasmodica, antielmintica, emmenagoga, oxitocica ed abortiva. Tali azioni sembrano dovute all’olio essenziale il quale è dotato anche di un’elevata azione irritante locale, ma mentre talune delle suddette attività si manifestano già a dosi terapeutiche, quella oxitocica e quella abortiva essendo più deboli (35), non compaiono che a dosi tossiche e spesso si accompagnano a sintomi gravi; secchezza della bocca, gastroenterite, eccitazione dei centri nervosi, stato confusionale, fenomeni convulsivi di tipo spastico, abbattimento, poliuria, ipotermia, indebolimento dell’attività cardiaca, nefrite e, nei casi più gravi, coma e morte.
Anche attualmente la Ruta è usata criminosamente a scopo abortivo ma spesso con conseguenze gravi, poiché tale attività, più che ad un’azione diretta sull’utero è dovuta alla sua tossicità generale.
Più interessante è la Ruta per il suo contenuto in rutina, glicoside flavonolico estratto da Weiss (5) nel 1842 (vedi anche parte chimica) e studiato molto più tardi (1936) da Mascré e Paris (36) i quali avendola sperimentata sul cane cloralosato, hanno potuto constatare che essa, alla dose di 1-5 mg/kg determina un leggero e transitorio effetto ipotensivo con un abbassamento della pressione di 30-50 mmHg per la durata di 3-5’ e, inoltre, una riduzione del volume renale.
Immediatamente dopo l’iniezione e durante il periodo della diminuzione del volume renale, è stata notata anche una riduzione della secrezione urinaria, la quale può essere ridotta alla metà od anche arrestarsi completamente per poi tornare ai valori normali.
Gli AA. hanno tentato anche di determinare il grado di tossicità della rutina, data però la sua insolubilità in acqua, essi hanno dovuto ricorrere a soluzioni in piridina ma, al fine di evitare che la tossicità di questa potesse influire sui risultati, non fu possibile iniettare dosi superiori a g 0,25-0,50/kg, dosi che, peraltro, non determinarono alcun effetto tossico.
Wilson e coll. (37) trovarono che una dose di 200 mg di rutina iniettata nei conigli, non provoca alcun effetto tossico e che una dieta contenente l’1 % di rutina, somministrata ai ratti per oltre un anno, non produce alcun disturbo della crescita e nessuna alterazione dello stato generale o a carico degli organi e dei tessuti.
La dose di g 2,25 al giorno somministrata per os a diversi pazienti per un periodo di 7 giorni, venne perfettamente tollerata e così pure la dose di 60 mg al giorno per un periodo di 5 anni [Porter e Coll. (38)].
Una transitoria e modesta caduta della pressione arteriosa per somministrazione parenterale di rutina negli animali, venne osservata anche da Armentano (39) e da Androse e De Eds (40).
Clerc e Paris (41) notarono successivamente, che il rutoside è dotato di una moderata attività diuretica, inferiore comunque a quella prodotta dallo scoparoside con il quale venne sperimentato comparativamente.
Lavollay e Neumann (42) hanno supposto che le sostanze analoghe alla citrina studiata dal Szent-Gyorgyi, esercitino la loro azione sulla resistenza capillare, non direttamente, ma con la mediazione dell’adrenalina e i risultati delle loro ricerche hanno dimostrato che esse sono capaci di prolungare l’azione dell’adrenalina sia sulla muscolatura liscia dell’intestino isolato e della vescichetta seminale di cavia, che sulla pressione del cane cloralosato. Gli AA. ritengono che tale attività sia dovuta ad un’azione inibitrice che queste sostanze eserciterebbero sull’autossidazione dell’adrenalina ed hanno trovato che le sostanze da essi studiate, il quercitoside, il rutoside e il naringoside, sono tutte dotate di tale azione, la quale varia quantitativamente in ordine decrescente, secondo la suddetta successione.
Gli AA. hanno osservato inoltre che nel cane cloralosato cui sia stata somministrata una di queste sostanze ed adrenalina, le manifestazioni tensoriali da shock determinato da iniezioni di peptone, si limitano ad un leggero e transitorio abbassamento della pressione.
La proprietà di inibire l’autossidazione dell’adrenalina sarebbe comune a tutta una famiglia di corpi (flavonoli, flavononi) i cui membri possiedono in diverso grado questa proprietà che gli AA. considerano come caratteristica della vitamina P. Essi sono capaci di opporsi efficacemente al collasso vascolare e quindi alle manifestazioni dello shock ed il significato fisiologico della loro presenza nell’organismo sarebbe quello di contribuire a stabilizzare la concentrazione dell’adrenalina circolante ad un liveIIo optimum.
L’azione inibitrice di alcuni fiavonoidi sull’autossidazione dell’adrenalina in vitro venne notata anche da Clark e Geissman (43), mentre Robertson e coll. (44) non trovarono che la rutina potenzi l’azione della adrenalina nell’uomo.
Selvin (45) trovò che i flavonoli sono molto più attivi dei flavononi come inibitori dell’autoossidazione dell’adrenalina e che i loro agliconi sono più attivi, in vitro, sotto questo aspetto, degli eterosidi corrispondenti, ma è probabile che questi, data la maggior solubilità e quindi il più rapido assorbimento e la più facile diffusibilità, esplichino nell’organismo la stessa attività dei loro agliconi.
Analoga osservazione, per quanto riguarda l’attività della rutina e del suo aglicone, venne fatta più tardi da Griffith e coll. (46).
Non tutti gli autori sono però concordi nell’attribuire l’azione dei flavonoidi sulla permeabilità capillare, unicamente ad un meccanismo basato sulla protezione adrenalinica.
Haley e Rhodes (47) ritengono che questi composti agiscano con un meccanismo, almeno prevalentemente, biochimico; essi inibirebbero cioè, la conversione dell’ADP ad ATP, prevenendo così il rilassamento della muscolatura precapillare.
Rhodney e coll. (48) dimostrarono l’attività antijaluronidasica della rutina, alla quale essi attribuiscono la sua azione sulla permeabilità e Sokoloff e Redd (49) formularono l’ipotesi secondo cui la vitamina P sarebbe dotata di un’azione diretta sulla sostanza cementante intercellulare. Verrebbe escluso comunque, che l’attività della vitamina P sulla permeabilità capillare, sia dovuta ad un eventuale effetto di questi flavonoidi sul meccanismo della protrombina sulla coagulazione (50).
Dopo che Griffith, Couch e Lindauer (51) ebbero sottolineata l’importanza della rutina nella terapia della fragilità capillare, l’attenzione di molti ricercatori venne attirata da questo argomento sul quale esiste oggi una vasta letteratura. Il fatto però che non è possibile riprodurre sperimentalmente una sindrome da carenza di vitamina P negli animali e nell’uomo, ha condotto a ricerche i cui risultati sono tutt’altro che univoci. Tuttavia, l’efficacia di queste sostanze ad attività vitaminica P e in particolare della rutina, nel controllare e prevenire le emorragie capillari (retiniche, coronariche, cerebrali, renali ecc.) è oggi clinicamente riconosciuta, nonostante le incertezze che tuttora sussistono sul loro meccanismo di azione.
Anche per quanto riguarda l’eliminazione della rutina e dei composti simili, i pareri non sono concordi. Lavollay e Neumann (42) hanno potuto svelare piccole quantità di queste sostanze nelle urine umane, i cui estratti, opportunamente preparati, si sono dimostrati capaci di prolungare l’effetto adrenalinico negli organi isolati.
Porter e coll. (52) trovarono nelle urine soltanto tracce di rutina anche dopo somministrazione quotidiana di g 2,25 per una settimana, mentre le feci ne erano completamente esenti.
Clark e Mac Kay (53) non trovarono invece, quantità apprezzabili di rutina o di altri flavonoidi nelle urine e nelle feci, dopo somministrazione orale di una dose pari a 50 mg/kg.
Murray e coll. (54), al contrario, riuscirono ad isolare dalle urine un prodotto metabolico della quercetina e acido 3-4-idrossifenilacetico, in quantità pari al 25 % della dose di quercetina somministrata e Griffith e coll. (55) osservarono una radioattività delle urine dopo somministrazione di quercetina marcata con C14, dopo 3 ore e nelle feci dopo 8 ore e per la durata di 24 ore.
Le indicazioni terapeutiche della rutina sono molto estese in rapporto alle numerose condizioni patologiche in cui è possibile riscontrare alterazioni della resistenza e della permeabilità capillare. Essa trova le sue più comuni indicazioni nell’ipertensione arteriosa in cui un aumento della fragilità capillare può essere riscontrata nel 16-19 dei casi (55). Nel diabete mellito, ove la percentuale dei casi in cui può osservarsi un aumento della fragilità capillare può raggiungere il 40 %, nel 100 % dei quali si verifica una retinopatia diabetica [Rodriguez e Root (56)].
Nella porpora emorragica, nelle encefalopatie emorragiche, nei casi di glaucoma semplice in cui lo Stocker (57) impiegò la rutina in associazione con miotici; in alcuni casi di teleangectasia emorragica ereditaria e di emofilia [Quick (58)]; miglioramenti furono osservati anche in casi di febbre reumatica trattati con rutina [Kugelmass (59), Schnir (60)]; in alcuni casi di ematuria idiopatica [Foucar (61)] e di nefrosi, [Thomas (62)]; nell’edema idiopatico degli arti inferiori (61); nella tossiemia gravidica [Dickmann e coll. (63) , Burger (64) ]; nell’aborto abituale [Greenblatt (65)]; nella menorragia [Grasset e coll. (66)]; nel trattamento delle varici [Marshall (67)]; nelle emorragie gengivali dovute a cause non determinate [Faller (68)]; nella diatesi emorragica [Gale e Thewlis (69) ] e lo Schweier (70) impiegò la rutina anche nei casi di scarlattina.
Nei casi di ipertensione con fragilità capillare, che non furono trattati con rutina, venne osservata dal Griffith (55) una mortalità superiore di 2,5 volte a quelli trattati e di 8 volte su tutta la popolazione.
Nei pazienti in cui il livello creatininemico era molto elevato, fu osservata una mortalità notevolmente superiore che veniva però ridotta a percentuali minime nei casi trattati con rutina.
Nei pazienti ipertesi, con fragilità capillare, l’incidenza della emorragia cerebrale viene pure notevolmente ridotta col trattamento rutinico, il quale può prevenire nell’ 80 % dei casi la morte per apoplessia.
Buoni risultati si ottengono anche nel trattamento delle emorragie retiniche in ipertesi, mentre nelle retinopatie emorragiche in soggetti diabetici non sono infrequenti gli insuccessi (56).
La rutina viene normalmente somministrata alla dose di 3 mg, 3 volte al giorno e può venire aumentata ogni 6 settimane. In pochi casi è necessario superare i 60 mg, 3 volte al giorno e raramente si raggiunge la dose di 400 mg-1 g. Il trattamento con rutina deve essere protratto almeno per 3 mesi.
L’olio essenziale di Ruta è dotato di attività batteriostatica. Maruzzella e Sicurella (71) avendone sperimentata l’azione su diversi germi (E. coli, Staph. aureus, B. subtilis, Str. fecalis, Salm. Typhosa, Mycrobact. avium), hanno trovato che esso è notevolmente attivo soltanto sul Mycrobact. avium, sulle cui colture determina aloni di inibizione di 90 mm di diametro.
Crediamo di non poter chiudere questo capitolo senza un breve cenno sulle caratteristiche farmacologiche di altre due sostanze contenute nella Ruta, il bergaptene e la xantotossina, dotate prevalentemente, come altre furocumarine, di attività fotosensibilizzatrice cutanea.
Alcune piante contenenti sostanze di questo tipo, fra le quali il psoralene, considerato come il composto più attivo sotto questo aspetto, erano usate empiricamente sin dall’antichità per restituire il colore normale alle zone depigmentate della cute, considerate allora come una manifestazione lebbrosa.
In uno dei testi sacri indiani, l’Atharva Veda, sono menzionate alcune piante che venivano impiegate a questo scopo, una delle quali venne poi identificata con la Psoralea corylifolia.
Anche in Egitto, una pianta che cresce spontanea nella valle del Nilo, l’Ammi majus, il cui studio venne approfondito in questi ultimi anni, era usata nel trattamento della leucodermia fin dal secolo XIII.
Le sostanze furocumariniche, note anche col nome di psoraleni, sono caratterizzate soprattutto da un’azione fotosensibilizzante per la quale esse determinano eritema, abbronzamento o pigmentazione cutanea, dopo esposizione alla luce solare o ultravioletta a determinate lunghezze d’onda.
Il loro studio ebbe inzio con le ricerche del Kuske (72) che datano dal 1938, con le quali l’A. studiò le fitofotodermatiti che si manifestano allorché la cute viene in contatto con certe piante e successivamente esposta alla luce solare. A queste ricerche seguirono quelle più estese degli AA. egiziani Fahmy, Abu Shady, Abdel Monem El Mofty ed altri e quelle di Lerner, Denton e Fitzpatrick nel 1953 (73), di Kelly e Pinkus sul trattamento della vitiligo nel 1955 (74) e di numerosi altri.
In Italia l’argomento venne ripreso dal Musajo e dai suoi collaboratori Rodighiero, Caporale, Albiero (9-10, 75-83) i quali studiarono 19 furocumarine naturali e 13 composti furocumarinici da essi stessi sintetizzati oltre a molte altre sostanze in relazione strutturale con le furocumarine. Dal complesso di questa prima serie di lavori che cominciarono a comparire nel 1954, risulta che l’attività delle suddette sostanze è legata al nucleo furocumarinico e che il psoralene, furocumarina lineare, è il termine più attivo della serie dei composti studiati, ciò che venne confermato in seguito da altri [Pathak e Fitzpatrick (84)].
Importante ai fini dell’attività fotodinamica, sarebbe secondo Musajo e coll., che l’anello furanico si trovi legato alla cumarina in posizione 6-7; l’attacco in 7-8 condurrebbe ad una diminuzione di attività, come avviene nell’angelicina e nell’isobergaptene, mentre la sostituzione dell’anello furanico con l’anello piranico, come nell’eselina, o l’introduzione di un ossidrile fenolico in posizione 5 o 8 del nucleo furocumarinico, come nel bergaptolo e nel xantotoxolo, ne provoca la scomparsa. Con la metilazione dell’ossidrile si ottiene un ritorno dell’attività, ma un po’ indebolita rispetto al psoralene, come nel bergaptene e nella xantotossina.
Anche al
tre variazioni apportate alla molecola della furocumarina con l’introduzione in posizioni varie, di altri gruppi, conduce sempre o ad una diminuzione o alla scomparsa dell’azione fotodinamica.
Gli AA. diressero inoltre le loro indagini alla ricerca delle sostanze ad azione fotodinamica, nei vegetali commestibili (81). Tali indagini, estese ad una cinquantina di prodotti vegetali di corrente uso alimentare (verdure, frutta, cereali, olii grassi), condussero ad accertare la presenza di bergaptene nel Sedano e nel Prezzemolo, mentre incerta è risultata la sua presenza nell’Aglio.
Queste sostanze furocumariniche contenute nei suddetti vegetali commestibili, la cui tossicità sarebbe irrilevante, entrano indubbiamente, anche se in piccola quantità (82), nella normale alimentazione umana e ciò fece logicamente supporre a Musajo, Rodighiero e Santamaria (85) e successivamente a Labby e coll. (86) e a Tucker (87), che esse possano svolgere un loro particolare ruolo nella fisiologia e nella biochimica della pelle umana. II Fitzpatrick ed altri (88) hanno affrontato il problema della prevenzione delle ustioni solari e dell’abbronzamento, mentre diversi altri autori hanno indagato sull’eventuale influenza delle furocumarine nel favorire l’insorgere del cancro da luce.
Dalle ricerche di O’Neal e Griffin (89), di Griffin (90), di Urbach (91), di Pariser (92) sono state tratte conclusioni alquanto discordi, ma dai risultati di più recenti indagini di Pathak e coll. (93), sembrerebbe che le furocumarine non siano dannose sotto questo aspetto.
Per quanto riguarda il meccanismo d’azione delle furocumarine fotosensibilizzanti, non si può dire che sia stato ancora completamente chiarito. Un notevole contributo alla soluzione di questo non semplice problema, è stato recentemente apportato dal Musajo e dai suoi collaboratori, i quali in un primo tempo hanno studiato l’azione delle furocumarine comparativamente con altre sostanze fotodinamiche, rispetto a quattro tests scelti fra i più significativi: fotossidazione dell’a-terpinene ad ascaridolo, emolisi dei globuli rossi, fotossidazione delle proteine del sangue, effetto ottenuto per applicazione epicutanea ed iniezione intradermica nella cavia e successiva irradiazione.
Le furocumarine fotosensibilizzanti, hanno dimostrato di possedere proprietà particolari, diverse da quelle di cui sono dotate altre sostanze fotodinamiche. Il loro meccanismo d’azione cioè, a differenza di queste ultime, non può essere riportato, secondo gli AA., ad una fotossidazione di substrati proteici (85).
Più recentemente Musajo e Rodighiero (94) sono riusciti a porre in evidenza alcuni fatti molto interessanti che contribuiscono notevolmente a chiarire il complesso problema del meccanismo d’azione di queste sostanze.
Oltre l’azione fotodinamica, per la quale possono essere impiegati ai fini terapeutici, i psoraleni sono dotati di altre interessanti attività biologiche, fra le quali ricorderemo quella ittiotossica posseduta in misura notevole specialmente dal bergaptene, il quale può agire sui pesci alla diluizione di 1:93000 [Spath e Kuffner (95)]; quella battericida [Del Pianto (96), Oginsky, Green, Griffith e Fowlks (97), Fowlks, Griffith e Oginsky (98)]; quella fungicida, battericida e inibente l’attività enzimatica dopo irradiazione ultravioletta, notata da Pathak e Fowlks (99) e da Chakraborty, Das Gupta e Bose (100); quella tossica sui molluschi, per la quale diverse furocumarine naturali, quali il bergaptene, l’isopimpinellina e la xantotossina, furono impiegate per la disinfestazione di alcuni molluschi d’acqua dolce [Schònberg e Nazih-Latif (101)], ospiti intermedi di vari Schistosomi che compiono in essi uno stadio del loro ciclo evolutivo e che espulsi allo stato larvale di cercaria, trasmettono all’uomo e agli animali le diverse forme di bilharziosi.
Un’attività interessante delle furocumarine per il significato che potrebbe essere attribuito a queste sostanze nel campo della fisiologia vegetale, è quella inibitrice della crescita delle radici, dei germogli e della germinazione dei semi, posseduta da numerose furocumarine [Gandini (102), Ciferri e Arnulfo (103), Moewus (104), Rodighiero (105)], ed è degno di nota il fatto che l’azione inibitrice sulla germinazione dei semi venne intravista nella Ruta, come già fu detto, sin dai tempi di Dioscoride.
Altra attività di cui pare siano dotate alcune furocumarine è quella carioclasica e quindi quella mutagena che ne può derivare. E’ da notare che tale attività era conosciuta per la cumarina e per alcuni suoi derivati, ma non per le furocumarine che vennero studiate sotto questo aspetto da Dokher, da Rodighiero e da Caporale (106) e non può sfuggire l’interesse di tale attività se si considera che essa si ricollega con importanti problemi riguardanti sia la genetica che la terapia antiblastica.
Ricerche sulla protezione dalla carcinogenesi da raggi U.V. con i psoraleni (8-metossipsoralene), sono state eseguite infatti da O’Neal e Griffin (107) con risultati favorevoli e successivamente da Pathak e coll. (108) i quali ultimi dimostrarono che il psoralene, nelle condizioni sperimentali in cui venne impiegato, non protegge i topi albini dalla carcinogenesi da raggi U.V., mentre risultati apprezzabili essi avrebbero ottenuto sui topi pigmentati in bruno e in nero.
Indipendentemente da queste particolari attività, le furocumarine hanno trovato pratico impiego nella terapia della vitiligo con risultati generalmente buoni [Lerner (109), Elliot (110), London (111), Fitzpatrich (112), Daniels e coll. (113), Imbrie e coll. (114), Elliot ( 115), Kanoff
(116), Stegmaier (117), Hoekenga (118), Chan e coll. (119) ecc.], ma il loro meccanismo d’azione non è stato ancora ben precisato come del resto non è ancora ben nota la patogenesi della vitiligo stessa [Fowlks(120), Pinkus (121), Lerner e Case (122)].
Concludendo potremo dunque dire che pur non potendo attribuire oggi alla Ruta che un molto modesto ruolo per quanto riguarda le sue dirette applicazioni alla terapia, può invece assumere una certa importanza ove la si consideri come fonte di sostanze, quali la rutina e le furocumarine, sostanze verso le quali si volge oggi l’attenzione di molti ricercatori per l’innegabile importanza che esse presentano in relazione allo studio di particolari problemi che interessano attualmente non soltanto la terapia ma anche la biochimica e la biologia generale.
Estratti e preparati vari
Estratto fluido (g 1 = LIV gtt).
Dosi: g 0,5-1 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido ruta……………………………………………………….. g 20
Alcool di 50°………………………………………………………………… g 80
(g 2-5 pro dose).
Sciroppo
Estratto fluido ruta……………………………………………………….. g 5
Alcool di 95° e glicerina…………………………………………… ana g 10
Sciroppo semplice F.U………………………………………………… g 75
(a cucchiaini).
BIBLIOGRAFIA
(1) HAENSEL, fharm. Zit„ SI, 323, 1906 – (2) WEHMER C., Die Pflaneenstofle. II ed., p. 611 – (3) SPRECHER E„ Pharmazie. 13, 151, 1958 – (4) GUENTHER E., The Essenlial Oils, III voi., 1949, pp. 379 e 383 – (5) WEISS A., Phartn. Zeniralh., 13, 903, 1842 . (6) SPRECHER E., Pianta, 41, 323, 1956; Chtm. Abs., SO, 148791, 1956 – (7) BRANDT W., Chem. Zbl., II, 1199, 1915 – (8) MUHLEMANN H., ibidem, II, 3950, 1938 . (9) RODIGHIERO G., CAPORALE G. e RAGAZZI E„ Atti Isl. veneto sci. lettere ed arti. Classe sci, mal. e nat.. Ili, 125, 1952 – (10) RODIGHIERO G„ CAPORALE G. e ALBIERO G.. Gazz. CMm. Ital., 84, 874, 1954 – (11) OHTA T, e MIYAZAKI T„ Yakugaku ZassHi, 78, 538, 1958; Oiem. Abs.. S2, 17311 a, 1958 – (12) ARTHUR H. R. e CHEUNG H. T., Australian 1. Chem., 13, 510, 1960; Chem. Abs., SS, 8766 f, 1961 – (12 a) ARTHUR H. R, e LOH L. Y. S., J. Chem. Soc., 4360, 1961; Chem. Abs.. 56, 4806 d, 1962 – (12 b) CHATTERJEE A. e DEB A., Chem. Ind., 1982, 1962 – (12 c) GOODWIN S., SMITH A. F„ VELASQUEZ A. e HORNING I. C., J. Am. Chem. Soc.. 81, 6209, 1959 – (13) GUNTHER E., HEEGER E. F. e ROSENTHAL C., Pharmaeie, 7, 24. 1952 – (14) NAVES, Perfum. Essem. OH Record., 30, 93, 1939 – (15) SIMMONS ibidem, 14, 236, 1923 – (16) DORRONSORO, Mem. Acad. ciencias exactas Madrid, 29, 1919; GUENTHER E„ loe, cit, (4)- (17) PFAU A. S„ Helv. CWm. Acta. 15, 1267, 1932 – (18) CHARAUX C., Compì, rend., 178, 1312, 1924 – (19) ATTREE, F. e PERKIN A. G., J. Chem. Soc.. 234, 1927 – (19 a) OHTA T„ MORI Y., NODA C, e AOKI T., Chem. Pharm. Bull., 8, 377, 1960; Chem. Abs., SS, 15528 d, 1961 – (20) MULDER G. 1., Lieb. Ann., 31, 67, 1839 –
(21) OHME C„ ibidem, 31, 316, 1839 – (22) PRIESS H.. Chem. Zbl., Il, 94, 1911 – (23) PFAU A. S.. Helv. Chtm. Acta 22, 382, 1939 – (24) TERESAKA M., J. Pharm. Soc. Japan, SI, 707, 1931 – (25) TERESAKA M„ OHTA T. e NARAHASHI, ibidem. 73, 773, 1953 – (26) HUGHES G. K e NEILL K. G., Australian 1. Sci. Research, A2, 429, 1949 . (27) COOKE R. G. e HAYNES H- F, Australian 1. Chem., 7, 273, 1954 – (28) GELL R. J., HUGHES G. K. e RITCHIE E., Ibidem, 8, 114, 1955 – (29) BROWN R. F. C„ GILHAM P. T„ HUGHES G. K. c RITCHIE E„ ibidem, 7, 181, 1954 – (30) ANET F. A. L„ GILHAM P, T., GOW P., HUGHES G. K. e RITCHIE E., Australian J. Sci. Research, AS, 412, 1952 – (31) TERESAKA M., NARAHASHI K. e OHTA T„ I. Pharm. Soc. Japan, 75, 1040, 1955; OHTA T., MORI Y., NODA C. e AOKI T., Chem. Pharm. Bull., 8, 377, 1960; Chem. Abs., SS, 15528 d, 1961 – (32) HONDA J„ Arch. exp. Path. u. Pharmakol., 52, 83. 1904 – (33) ASAHINA Y. e NAKA- NISHI S., Ber., 63, 2057, 1930 – (34) LECLERC H„ Rev. de Phylolhér., 17, 99, 1953 – (35) PROCHNOW, Arch. ini. pharmacodyn. et de Ihér., 21, 314, 1911 – (36) MASCRÉ M. e PARIS R„ Bull. sci. pharm., 38, 279. 1936 – (37) WILSON e coll.. Proc. Soc. Exp. Biol. Med., 64, 324, 1947 – (38) PORTER e coll., Arch. Biochem., 21, 273, 1949 – (39) ARMENTANO, Ztschr. Ges. exp. Med., 102, 219, 1938 – (40) ANDROSE e DE EDS, J. Pharmacol. exp. Ther.. 97. 115, 1949 – (41) CLERC A. e PARIS R., Comp. rend. soc. biol, 133, 49. 1940 – (42) LAVOLLAY J. e NEUMANN J., Comp. rend., 212, 251, 1941 . (43) CLARK c GEISSMAN, Nature, 163, 36, 1949; J. Pharmacol. exp. Ther., 95, 369, 1949 – (44) ROBERTSON e coll.. Proc. Soc. Exp. Biol. Med., 77, 164, 1951 – (45) SELVIN A., Comp. rend., 216, 505, 1943 – (46) GRIFFITH e coll., Arch. Int. med., 94, 1037, 1954 – (47) HALEY T. I. e RHODES B. M„ J.A.Ph.A., 40, 179, 1951 – (48) RHODNEY G., SWANSON A. L„ WHEELER L. M.. SMITH G. N. e WORREL C. S., J. Biol. Chem.. 183, 739, 1950 – (49) SOKOLOFF B. Th. e REDO J. B„ Monograph.
1 pari. 1, Fla-So-College Lakeland, Fla, 1949; CìL da GALLA F. e VERZA G. in aL’Hyperlcum perfo* ratum L. e ITperinaa – Quaderni di Fitoterapia n. 8, 1957, Inverni Se Della Bella ed. Milano – (50) MAC LEAN e BRAMBEL, Am. J. Ophtalm., 30, 1093, 1947 – (51) GRIFFITH, COUCH e LINDAUER. Proc. Soc. Biol. Med, SS, 228, 1954 – (52) PORTER e coll., Arch. Biochem., 21, 273, 1949 – (53) CLARK e MAC KAY, J.A.M.A., 143, 1411, 1950 – (54) MURRAY e coll., J.A.Ph.A., 43, 361, 1954 – (55) GRIFFITH, KREWSON e NAGHSKI, Rulin and related ilavonoids 1955 – (56) RODRIGUEZ e ROOT, New Engl. J. Med, 238, 391, 1948 – (57) STOCKER, Arch. Ophtalmol., 41, 429, 1949 – (58) QUICK, J.A.M.A., 145, 4, 1951 – (59) KUGELMASS, Arch. Otolarlng, 46, 684, 1947 – (60) SCHNIR, Rev. Argent. Reumatol., 15, 232, 1951 – (61) FOUCAR, Canad. Med. Ass. J., 60, 402, 1949 – (62) THOMAS, Med. Clin. North. Amer, 31, 134, 1947 – (63) DIECKMANN c coll.. Am. 3. Obstet. Gyn., 57, 711, 1949 – (64) BURGER, Ztschr. Geburtsh. Gyndk., 135, 182, 1951 – (65) GREENBLATT, Obstet. GynSk.. 2, 530, 1953 – (66) GRASSET, Semaine des HSp.. Paris, 29, 542, 1953 – (67) MARSHALL, Am. J. Surg., 80, 52. 1950 – (68) FALLER, Zahnarztl. Rdsch, 60, 211, 1951 – (69) GALE e THEWLIS, Gerlatrics, 8, 80. 1953 – (70) SCHWEIER, Klin. IVoch, 29, 328, 1951 – (71) MARUZZELLA J. C. e SICURELLA N. A., J.A.Ph.A., 49, 692, 1960 – (72) KUSKE H„ Arch, Dermatol. Syph, 178, 112, 1938 – (73) LERNER A. B., DENTON C. R. e FITZPATRICK T. B., J. Investigative Dermal, 20, 299, 1953 – (74) KELLY E. W.- e PINKUS H„ ibid, 25, 453, 1955 – (75) MUSAJO L., RODIGHIERO G. e CAPORALE G., La chimica e l’Industria, 3S, 13, 1953; Bull. soc. chim. biol., 36, 1213, 1954 – (76) MUSAJO L„ RODIGHIERO G., CAPORALE G. e ANTONELLO C., Il Farmaco, ed. sci, 13, 355, 1958 – (77) RODIGHIERO G. e CAPORALE G., ibid, 10, 760, 1955 – (78) RODIGHIERO G. e ANTONELLO C„ Ibid, IO, 889, 1955 – (79) ANTONELLO C„ Catt. Chim. Ital., 88, 415, 430, 1958 – (80) CAPORALE G„ Ann. Chim. (Roma), 48, 650, 1958 ; 50, 1135, 1960 – (81) MUSAJO L., CAPORALE G, e RODIGHIERO G., Gazz. Chim. Ital, 84, 870, 1954 – (82) RODIGHIERO G. e ALLEGRI G„ II Farmaco, ed. sci, 14, 727, 1959 – (83) MUSAJO L„ Il Farmaco, 10, 539, 1955 – (84) PATHAK M. A. e FITZPATRICK T. B., J. Investigative Dermat., 32, 255, 1959; 32, 509, 1959 – (85) MUSAJO L, RODIGHIERO G. e SANTAMARIA L., Atti Soc. Ital. Pat, S, 1, 1957 – (86) LABBY D. H„ IMBRIE J. D. e FITZPATRICK T. B„ J. Investigative Dermat, 32, 273, 1959 – (87) TUCKER H, A., ibid., 32, 279, 1959 – (88) FITZPATRICK T, B. e coll, ibid, 25, 187, 1955 – (Conf. Symposium Psoralens and Radiant Energy, Kalamazoo (Michigan U.S.A. 1958), Ibid.. 32, 132, 1959 – (89) O’NEAL M. A. e GRIFFIN A. C., Cane. Research, 17, 911, 1957 – (90) GRIFFIN A. C, J. Investigative Dermat, 32, 367, 1959 – (91) URBACH F. J., Ibid, 32, 373, 1959 – (92) PARISER H., J.A.M.A, 170, 19, 1959 – (93) PATHAK M. A., DANIELS F., HOPKINS C. E. e FITZPATRICK T. B., Nature, 183, 728, 1959 – (94) MUSAJO L., RODIGHIERO G., Nature, 190, 1109, 1961 – (95) SPAETH E. e KUFFNER F., Monatschr. Chem, 69, 75, 1936 -(96) DEL PIANTO E., Rend. Acc. Naz. Lincei, 6, 714, 1949 – (97) OGINSKY E. L., GREEN G. S., GRIFFITH D. G. e FOWLKS W. L., J. Bact, 78, 1959 – (98) FOWLKS W. L., GRIFFITH D. G. e OGINSKY E. L., Nature, I8I, 571, 1958 – (99) PATHAK M. A. e FOWLKS W. L., cit. da PATHAK e FELLMANN in Nature, 185, 382, 1960 – (100) CHAKRABORTY D, P., DAS GUPTA A. e BOSE P. K., Ann. Biochem. Exp. Med, 17, 57, 1957 – (101) SCHONBERG A. e NAZIH-LATIF, J. Am. Chem. Soc, 76, 6208, 1954 – (102) GANDINI
A. , Atti Acc. Ugure di Scien, 5, 316, 1949 – (103) CIFERRI R. e ARNULFO M„ Atti Ist. Bot. Univ. Lab. Crittogam. Pavia. 3. 315, 1947 – (104) MOEWUS, cit. da BEPPE L. in Pharmazie, 9, 278, 1954 – (105) RODIGHIERO G., Giorn. di Bioch, 3, 138, 1954 – (106) DOLCHER T., Nuovo Giorn, Bot. It.. 67, 190, 1960; RODIGHIERO G., CAPORALE G. e DOLCHER T., Atti Acc. Nat Lincei,8, 30, 84, 1961 – (107) O’NEAL M. A. e GRIFFIN D. G.. Cane. Research, 17, 911, 1957 – (108) PATHAK M. A., DANIELS F., HOPKINS C. E. e FITZPATRICK T. B., Nature, 163, 728, 1959 – (109) LERNER A. B., J. Investigative Dermat, 32, 285, 1959 – (110) ELLIOTT J. A., Ibid, p. 311 – (111) LONDON I. D., ibid, p. 315 – (112) FITZPATRICK T B., Ibid, p. 319 – (113) DANIELS F., HOPKINS C. E., IMBRIE I. D., BERGERON L., MILLER O., CROWE F. e FITZPATRICK T. B., ibid, p. 321 – (114) IMBRIE I. D., DANIELS F., BERGERON L., HOPKINS C. E. e FITZPATRICK T. B., ibid, p. 331 – (115) ELLIOTT J. A., Ibid, p. 339 – (II6) KANOFF N. B., Ibid, p. 343 – (117) STEGMAIER O. C., ibid, p. 345 – (118) HOEKENGA M. T., Ibid., p. 351 – (119) CHAN M. M., LEVY E. J. e SHAFFER
B. , Ibid, p. 355 – (120) FOWLKS H., Ibid, p. 233 – (121) PINKUS H., ibid, 281 – (122) LERNER H. e CASE J. D., ibid, p. 211.


