Sanguinaria
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Sanguinaria canadensis L. – Fam. Papaveracee/Papaveroidee/Chelidoniee) (Sin. – Sanguinaria acaulis Moench.)
Sanguinaria- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Sanguinaria, dal latino sanguis = sangue, per il succo rosso che fuoresce dal rizoma inciso. Era usato nel sud/Carolina per tingersi la pelle e come accessorio per il tatuaggio dagli Indios dell’America del nord.
canadensis – del Canada.
acaulis – dal greco a (privato) e kaulos = fusto, per il caule poco appariscente, perchè breve.
Nomi volgari – Sanguinaire du Canada, beauharnoise, grande célandine (fr.), Canada blootroot, red-root, red puccoon, red indian plant, puccoon-root, coon-root, white puccoon, pauson, snake-bite, sweet-slumber (ingl.), Blutwurzel (ted.), in Italiano, Sanguinaria (da non confondere con le c.d. Sanguinaria (volg.) – Polygonum aviculare L., Digitaria sanguinalis Scop., Geranium sanguineum L.).
Habitat – Canada, nei boschi e terreni ricchi del Manitoba n/e., U.S.A. (Nebraska, Florida).
Pianta erbacea perenne, con una sola foglia radicale.
Parti usate – Rizoma e radici.
Componenti principali
Alcaloidi derivati dall’isochinolina: a) (gruppo della benzofenantridina) cheleritrina (1), sanguinarina (2), ossosanguinarina (3). – b) (gruppo della protopina) allocriptopina e protopina (1). – c) (gruppo della protoberberina) berberina e coptisina (4).
Recentemente sono state isolate dai rizomi della Sanguinaria canadensis L. quattro nuove basi, chelirubina, chelilutina, sanguirubina e sanguilutina (4) (5).
Cheleritrina, [C21H18O4N]OH, (I) (6-12) è stata isolata dalla Sanguinaria canadensis L. (1) (6), dal Chelidonium majus L. e da altre Papaveracee (7).
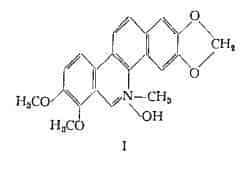
Sanguinarina (y-cheleritrina), [C20H14O4N]OH, estratta per la prima volta in forma impura dalla Sanguinaria canadensis L. (13), è stata poi ottenuta pura con il nome di y-cheleritrina dalla chelidonina (14) e per separazione dal Chelidonium majus (15). Le è stata assegnata la formula strutturale Il (10) (14).
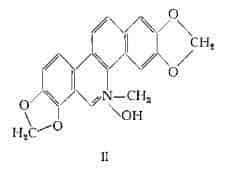
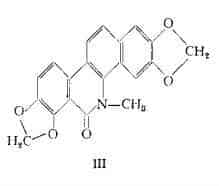
Ossosanguinarina, C20H13O5N, è stata isolata con metodo cromatografico dagli alcaloidi della Sanguinaria ed è stata identificata con il prodotto di ossidazione (III), ottenibile dalla sanguinarina per trattamento con ferricianuro di potassio in soluzione alcalina (3).
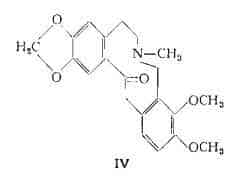
Allo-criptopina, C21H23O5N, (IV) (17) (18) si trova oltre che nella Sanguinaria canadensis L. (1) anche in numerose altre Papaveracee, ad esempio nel Chelidonium majus L., in alcune specie di Bocconia, di Corydalis ecc. (16). Esiste nelle forme a e b e nella radice della Sanguinaria canadensis è stata identificata nella forma a (4).
Protopina, C20H19O5N, (V) (19-23) è stata isolata per la prima volta dall’Oppio ed in seguito anche dalla Sanguinaria canadensis L. (1), dalla Corydalis bulbosa Pers. e da numerosissime altre piante (19)(20).
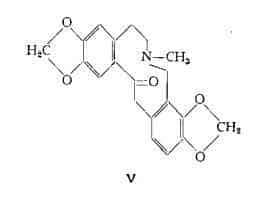
Berberina, C20H19O5N, (VI e VII) (24-33) estratta per la prima volta dallo Zanthoxylum caribaeum con il nome di «xantopicrite» (24), fu denominata berberina quale componente del Berberis vulgaris (25). E’ stata recentemente trovata, mediante esame cromatografico, anche nella Sanguinaria canadensis (4).
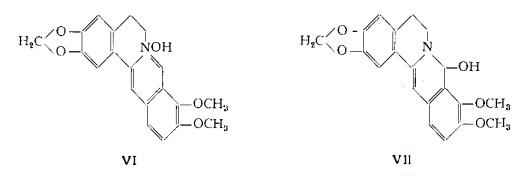
Coptisina, C19H15O5N, (VIII) (34) (36) separata dapprima dagli alcaloidi della Coptis japonica in forma di joduro (34), fu poi trovata anche nella Corydalis ambigua (35) e nella Sanguinaria canadensis L. (4).
Sanguirubina, [C23H20O5N]OH, sanguilutina, [C23H24O5N]OH, chelilutina [C23H24O5N]OH e chelirubina, [C20H18O5N]OH, le due prime estratte per la prima volta dalla Sanguinaria canadensis (4), le due ultime ottenute prima dal Chelidonium majus (5), poi anche dalla Sanguinaria canadensis (4), appartengono probabilmente al gruppo degli alcaloidi benzofenantridinici, ma la loro struttura non è stata sinora chiarita.
Il contenuto di alcaloidi dei rizomi sembra essere massimo nel periodo della fioritura. Sono state trovate quantità variabili dal 4 al 7% nei rizomi e circa l’1,8% nelle radichette (37).
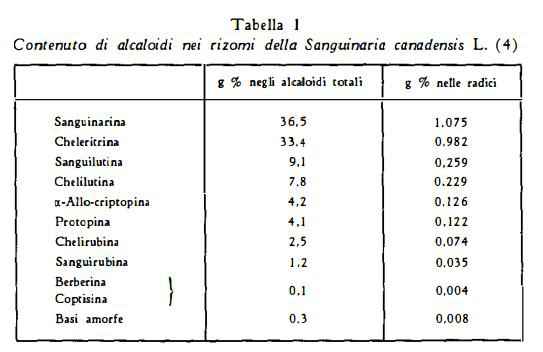
In rizomi con un contenuto di alcaloidi totali pari al 3 % sono state determinate le quantità percentuali delle singole basi (tabella 1), previa separazione con metodo cromatografico (4).
L'«acido sanguinarinico», segnalato in un primo tempo come componente dei rizomi, sembra sia da identificarsi con una miscela di acido citrico e di acido malico (38).
Proprietà farmacologiche ed impiego terapeutico
Gli indiani del Nord-America usavano già la Sanguinaria prima della colonizzazione europea, come droga emetica, per curare alcune forme ulcerative cutanee e, inoltre, per tingere la cute ed i tessuti.
Dell’azione farmacologica della sanguinarina, della chelidonina, della cheleritrina ecc. abbiamo già trattato a proposito della Chelidonia, la cui composizione chimica è molto simile a quella della Sanguinaria. Nel presente capitolo aggiungeremo alcune notizie a complemento di quanto già detto a proposito della Chelidonia ed alcune altre riguardanti più specificamente l’attività e l’impiego della Sanguinaria.
La Sanguinaria applicata localmente sulla cute, vi determina una notevole azione irritante seguita da anestesia. Analoga azione irritante manifesta se portata a contatto delle mucose delle prime vie respiratorie, determinando un effetto sternutatorio e tosse.
Somministrata a dosi terapeutiche, svolge azione espettorante ed è impiegata nel trattamento delle bronchiti subacute e croniche. A dosi elevate provoca nausea ed emesi più o meno violenta, pirosi gastrica, sete, vertigini, disturbi visivi e prostrazione grave.
L’azione dei suoi alcaloidi, già descritta a proposito della Chelidonia, raramente si manifesta per somministrazione orale della droga, sia che essa venga somministrata a dosi normali, nel qual caso il contenuto alcaloideo non raggiunge la dose attiva, sia che venga somministrata a dosi elevate, caso in cui prevalendo l’azione irritante sulla mucosa gastrica, l’ulteriore assorbimento viene ostacolato o completamente impedito dall'effetto emetico che ne consegue.
Gli alcaloidi della Sanguinaria, sotto forma di una miscela di nitrati, sono stati studiati da Reynolds (39) sull'utero di cavia, di ratto, di coniglio, di gatto e su segmenti di utero umano, l'A. ha notato che il complesso alcaloidico impiegato, determina un forte effetto contratturante sui segmenti di utero isolato ed anche in vivo, ma in quest'ultimo caso, l'effetto che segue alla somministrazione endovenosa di una dose pari a mg 0,5/kg è molto fugace.
I segmenti di utero umano gravido, reagiscono con un marcato aumento del tono e dell'ampiezza delle contrazioni, all'aggiunta di g 0,0001 del suddetto complesso alcaloidico a 100 g di liquido nutritizio (1:1000000), mentre la frequenza delle contrazioni è poco influenzata.
In maniera simile reagiscono anche i segmenti di utero di ratto, di cavia, di coniglio e di gatto, indipendentemente dallo stato dell'organo.
L'azione in vitro è più persistente e non è influenzata per aggiunta al liquido nutritizio di atropina o di ergotamina, il che dimostra che l'azione del complesso alcaloidico impiegato è, almeno prevalentemente, muscolare.
La sanguinarina alla dose di 5-10-15 mg/kg e la chelidonina alla dose di 20-30 mg/kg, somministrate endovena negli animali da esperimento, determinano, secondo Kelentey (40), un debole aumento della pressione arteriosa ed un aumento del tono e delle contrazioni intestinali. Esse inoltre, somministrate alle stesse dosi, diminuiscono l'effetto ipertensivo dell'adrenalina e della noradrenalina. L'effetto di 100 g di adrenalina viene completamente inibito per la durata di 31/2-4 ore.
Tale azione adrenolitica si manifesta anche nell'animale decapitato, ciò che dimostrerebbe che l'azione delle due suddette sostanze è periferica.
Sull'intestino isolato di cavia e di coniglio la sanguinarina e, in misura maggiore la chelidonina, svolgono un'azione decontratturante e antagonizzano lo spasmo determinato dal cloruro di bario.
Tanto la sanguinarina quanto la chelidonina sarebbero dotate, secondo l’A., di una netta azione anestetica locale, azione che sarebbe quantitativamente superiore a quella della procaina ma inferiore a quella della pantocaina.
Di una analoga azione anestetica locale sarebbe dotata anche la b-omochelidonina la quale è però priva dell'azione irritante caratteristica della sanguinarina.
Hakim e coll. (41) hanno notato che la sanguinarina pura possiede un’azione edemigena negli animali e produce in essi un primo stadio di glaucoma caratterizzato da un aumento della pressione endoculare. Gli AA. attribuiscono una forma di glaucoma epidemico osservata in India, al consumo di olio di semi di una papaveracea, l’Argemone mexicana, nella quale sarebbe contenuta la sanguinarina insieme con altri alcaloidi dello stesso tipo. Essi hanno studiato la composizione dell’olio dei semi di 53 varietà di papaveracee, riscontrando in 49 di esse la presenza di sanguinarina, di cheleritrina, di coptisina e di berberina.
Dobbie e Langham (42) hanno studiato comparativamente l'azione della sanguinarina pura e dell'olio di semi di Argemone mexicana constatando che la sanguinarina determina una variazione transitoria della pressione endoculare. L'olio di semi di Argemone, somministrato ai polli, provoca la formazione di edemi sulla cresta e sui bargigli, mentre tale azione edemigena non sarebbe stata riscontrata dopo somministrazione di sola sanguinarina.
L'azione antiblastica degli alcaloidi contenuti nella Chelidonia e nella Sanguinaria, oltre dagli AA. citati a proposito della Chelidonia, è stata studiata più recentemente anche da Widmann (43) il quale ha sperimentato l'azione carcinostatica della chelidonina, della sanguinarina, della cheleritrina e di un pigmento, la chelidoxantina, dimostrando che queste sostanze esplicano un effetto inibente sull'accrescimento del tumore-ascite nel topo.
Gli estratti di Sanguinaria, analogamente a quelli di Chelidonia, manifestano un’azione batteriostatica su diversi gruppi di germi. Tale azione venne studiata presso il nostro laboratorio dalla D'Amico (44), la quale trovò che un estratto fluido ottenuto per estrazione della droga con alcool di 60°, si è dimostrato attivo, fra i germi studiati, sullo Staph. aureus, sullo Staph. albus, sullo Staph. di Oxford, sul Dipl. vitelli, sul B. anthracis e sul B. coli mentre si è dimostrato inattivo sullo Strep. vitelli e sul B. appendicularis.
Estratti e preparati vari
Estratto fluido (g 1 = LVI gtt).
Dosi: g 0,4-0,8 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido sanguinaria…………………………………………….. g 20
Alcool di 60°………………………………………………………………….. g 80
(g 2-4 pro dose).
Sciroppo
Estratto fluido sanguinaria…………………………………………….. g. 5
Alcool di 95° e glicerina……………………………………………. ana g 10
Sciroppo semplice F.U………………………………………………….. g 75
(a cucchiaini).
BIBLIOGRAFIA
(1) SCHMIDT E., KOENIG G. e TIETZ W., Arch. Pharm., 231, 136, 1893; KOENIG G. e TIETZ W., Ibidem, 231, 145, 1893 – (2) FISCHER R„ ibidem., 239, 421, 1901 – (3) SPAETII E., SCHLEMMER F„ SCHENCK G. e GEMPP A., Ber., 70, 1677, 1937 – (4) SLAVIK J. t SLAVIKOVA L., Coliection Czecb. Chem. Commun., 25. 1698. 1960 – (5) SLAVIK J. e SLAVIKOVA L„ ibidem, 20, 21. 1955 – (6) FISCHER R., Arch. Pharm.. 239, 1901 – (7) MANSKE R. H. F. The Alkaloids, voi. IV, 1954. p. 254 – (8) KARRER P., Ber., 50, 212, 1917 – (9) GADAMER J., Arch. Pharm., 258, 160. 1920 – (10) SPAETH E. e KUFFNER F., Ber., 64, 2034. 1931 – (11) MANSKE R. H. F.. Can. J. Research, 21B, 140. 1943 – (12) BAILEY A. S. e WORTHING C. R.. 1. Chem. Soc., 4535. 1956 – (13) DANA, Mag. Pharm., 23, 125. 1829 – (14) GADAMER J. e WINTERFELD K., Arch. Pharm., 262, 452. 1924 • (15) GADAMER J. e STICHEL A., ibidem, 262, 452 e 498. 1924 – (16) MANSKE R. H. F. in MANSKE R. H. F. e HOLMES H. L., The Alkaloids, 1954. voi. IV, pp. 159-160 – (17) GADAMER J, Arch. Pharm., 257, 298. 1919 – (18) HAWORTH R. D. e PERKIN W. H., J. Chem. Soc.. 445. 1926 – (19) DANCKWORTT P. W., Arch. Pharm., 250, 590. 1912 – (20) MANSKE R. H. F. e HOLMES H. L., The Alkaloids, 1954. voi. IV. pp. 157-158 – (21) GADAMER J., Habililations Schrift, Bresiau, 1912. p. 25 – (22) PERKIN W. H., J. Chem. Soc., 109, 815-1028. 1916 – (23) PERKIN W. H., ibidem, 115, 713-790. 1919 – (24) CHEVALIER M. e PELLETAN G., J. chim. med., 2, 314. 182 6 – (25) BUCHNER J. A. e BUCHNER C. A., Ann., 24, 228. 1837 – (26) PERKIN W. H. Jr., J. Chem. Soc., 55, 63, 1889 – (27) PERKIN W. H., Ir., ibidem., 57, 992. 1890 – (28) PERKIN W. H. Jr. e ROBINSON R., ibidem., 97, 305. 1910 – (29) GADAMER J., Arch. Pharm., 243, 31. 1905 – (30) GADAMER }., ibidem, 239, 648. 1901 – (31) GADAMER J., Chem. Zeit., 26, 291. 1902 – (32) TINKLER C. K., 1. Chem. Soc., 99. 1340. 1911 – (33) FREUND M. e BECK H., Ber., 37, 4673. 1904 – (34) KITASATO Z., Proc. Imp. Acad. (Tokyo), 2, 124, 1926 – (35) HUANG-MINLON, Ber., 69, 1737. 1936 – (36) SPATH E. e POSEGA R., ibidem. 62. 1029. 1929 – (37) BERINGER e HOMBERG, Am. 1. Pharm., 97, 1915 – (38) WEHMER C., Die Pflanzenstofte. Il ed., p. 378 – (39) REYNOLDS, cit. da MANSKE R. H. F. in tThe alkaloids – Chemistry and Physiology», New York 1955, voi. V, p. 189 – (40) KELENTEY B., Arvteim.-Forsch., 10, 135, 1960 – (41) HAKIM S. A. E., MIJOVIC V. e WALKER J., Nature ,189, 198, 1961 – (42) DOBBIE G, C. e LANGHAM M. E, Brit. 1. Ophthalmol., 45. 81. 1961 – (43) WIDMANN H., Arch. Ceschwulstforsch., 9, 6, 1955, rif. in Ber. Physiol., 186, 283, 1957 – (44) D’AMICO M. L„ Fitoterapia, 21, n. 1. 77. 1950.


