Stramonio
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
Datura Stramonium L. – Fam. Solanacee/Daturee
(Sin. Stramonium foetidum Scop. – Stramonium spinosum Lamk. Stramonium vulgatum Moench.)
Stramonio- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Datura, dall’indiano Dhatura = mela spinosa, mela della morte (Kipling), da tat = pungere, da cui Tatula (persiano), per i frutti spinosi.
Stramonium, origine incerta: o dal greco strumonios da Strumwn fiume della Tracia (Struma) o da stremma = distorsione e da monh = arresto, insensibilità per le proprietà stupefacenti o da strucnon = Solano e mania = pazzia, cioè pianta che provoca un’ebbrezza frenetica (delirio).
spinosum – per la cassula coperta di spine.
vulgatum – comune.
Nomi volgari – Numerosi. Noce mettella, noce vomitta, paracoculi (antiq.), strimonio, mazzettoni, noce puzza, pomo spinoso, erba dei ladri, erba degli incantesimi o del diavolo, ecc. (tosc.), erba ratta, turtaiu (lig.), erba torpisera o carogna o tarponera, spungiun (piem.), stremonio, endormia, tossico, scarmon (lomb.), sdormia (ven.), tromba del giudezz (emil.), fetusa, fetienti, cacapuzza fetente, calamone (nap.), stramoniu, pipazzu, castagnazza servaggia (sic), ischizza-babbau (sard.).
Stramoine, pomme épineux, herbe aux sorciers, chassetaupe (fr.), Stechapfel, Tollkraut (ted.), thorn-apple (ingl.), psinki szaleywielki (pol.), dunnischnik (russo), maszlag tsattanto (ungh.), figuiera do inferno, ambaiatinga, zabumba, figuiera brava o branca, erva dos magicos (port.), estramonio (spagn.), sada-dhatura (beng.), ummatai tam., chedecq eljemel (la mascella del cammello, aspetto del frutto quando si apre), chejrat el jenna (albero del paradiso), tatoùra (arab. marocch.), tabourzigt, bour jijt (berbero), mezerbà (da zerebà = parola) (parlare, mormorare) (tigrai), tirufrah, scerefraf (da sceraf = senza denti (cioè parlare fuor dei denti) (tigre), attafaris (parlare in sogno), astanagher (far raccontare) (amarico), asanagher (oromo, galla).
Habitat – Si ritiene originaria dall'Asia occidentale (regione sud del M. Caspio); ora diffusa, naturalizzata, in tutto l’emisfero boreale, Libia, Marocco, Eritrea, Somalia. In Italia frequente nei ruderati, negli incolti, lungo le strade e le siepi, presso le case rurali, dal mare alla regione submontana. Coltivata.
Pianta erbacea annua.
Oltre la forma tipo (eu-Stramonium) (foglie verdi e fiori bianchi) esiste la var. o s. sp. Tatula L. (fusto sfumato di violaceo, fiori con calice e corolla violacei).
Parti usate – Le foglie (Stramonii folia F.U.).
Componenti principali
Alcaloidi del gruppo del tropano: «daturina» è stata isolata in un primo tempo dai semi della Datura Stramonium (1) ed è stata poi identificata con l’atropina (2) (3); l-josciamina si trova in tutte le parti della droga fresca (4), mentre nella droga conservata, in seguito a racemizzazione della l-josciamina, sono presenti quantità variabili di atropina (dl-josciamina); inoltre piccole quantità di scopolamina
(4), scopina, scopolina e apoatropina (5), basi volatili, che sembrano identiche a quelle presenti nella Belladonna (6), nicotina (5a) e piccole quantità di tetrametilendiamina (putrescina) (7).
Più recentemente dalle radici dello Stramonio sono stati isolati altri alcaloidi derivaci dal tropano e cioè meteloidina C13H21O4N (7a), tiglioilmeteloidina (estere ditiglioilico della teloidina) C18H27O5N (7a) e ditiglioil-d-diossitropano C18H27O4N (8).
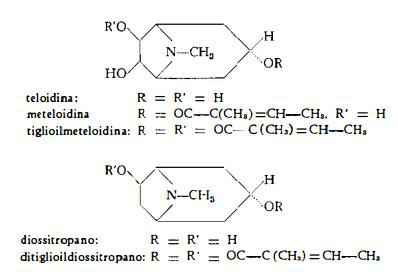
Come le radici della Atropa Belladonna e dello Hyoscyamus niger, già qui trattati, anche le radici della Datura Stramonium contengono l’alcaloide pirrolidinico cuscoigrina, che è stato isolato mediante analisi cromatografica su carta (9). Degli alcaloidi tropinici — josciamina, scopolamina, scopina, scopolina e apoatropina — e della cuscoigrina, si è qui trattato nel capitolo riguardante il Giusquiamo.
Contenuto di alcaloidi
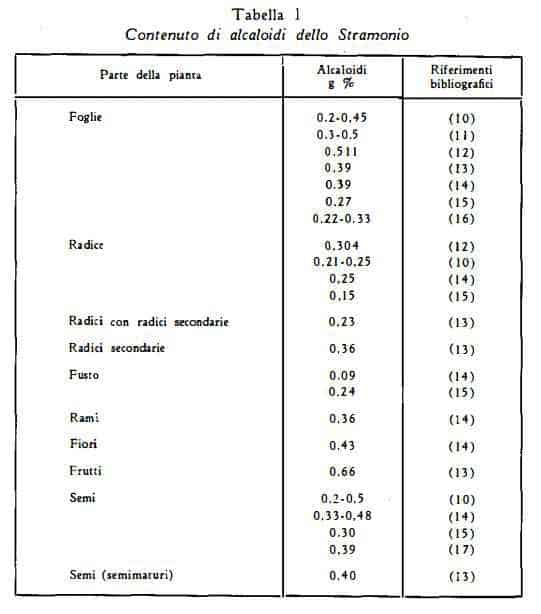
Il titolo di alcaloidi delle foglie essiccate di Stramonio oscilla tra 0,2- 0,5% (10-16) (tabella 1).
La determinazione del contenuto di alcaloidi del fumo e delle ceneri, prodotti dalla combustione di foglie di Stramonio per polveri e sigarette antiasmatiche, ha dato titoli rispettivamente pari all’8-11% ed a meno dell’1 % della quantità presente nel materiale originale (18).
Studi eseguiti per stabilire la localizzazione degli alcaloidi nello Stramonio hanno dimostrato che questi sono identificabili in tutte le parti della pianta e che vi è un maggiore contenuto di essi nelle nervature (19) e nel picciolo (13) (20) piuttosto che nelle lamine fogliari.

Non si è trovata differenza sensibile nel titolo delle foglie vecchie e giovani (14). Per foglie della stessa età, si è notato che quelle più piccole sono più ricche di alcaloidi rispetto alle foglie di maggiori dimensioni. Mentre per foglie di diversa età, le più vecchie e più piccole sono più povere di alcaloidi di quelle più giovani e di maggiore estensione (21). D’altra parte per droga coltivata sono stati trovati anche i seguenti valori: nelle foglie di larghe dimensioni 0,05 % di josciamina e atropina e
0,13% di scopolamina, nelle foglie di piccole dimensioni 0,04 % di josciamina e atropina e 0,16% di scopolamina (22).
Dall’analisi di piante tetraploidi di Datura Stramonium si è rilevato un contenuto di alcaloidi superiore di circa il 30% al titolo delle piante diploidi (23) (24). Secondo le analisi di Miller e Fischer (25), piante tetraploidi di Datura Stramonium, ottenute per trattamento con colchicina, e piante normali (diploidi) non differiscono sensibilmente per il contenuto di acqua e di ceneri, mentre il titolo alcaloidico tende ad essere generalmente più elevato, specialmente nelle foglie, nei fusti e nei semi. Neppure la proporzione dei singoli alcaloidi è notevolmente alterata. Tanto le foglie normali che quelle tetraploidi contengono principalmente josciamina (95% degli alcaloidi), poca scopolamina (5% degli alcaloidi) e quantità minime o nulle di atropina.
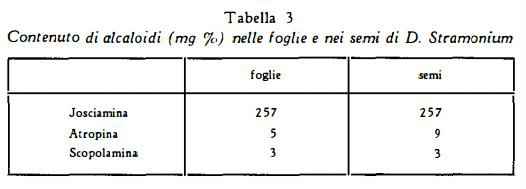
L’analisi degli alcaloidi singoli nelle foglie e nei semi ha dato i seguenti risultati, secondo le segnalazioni di Gstirner e Stein (6):
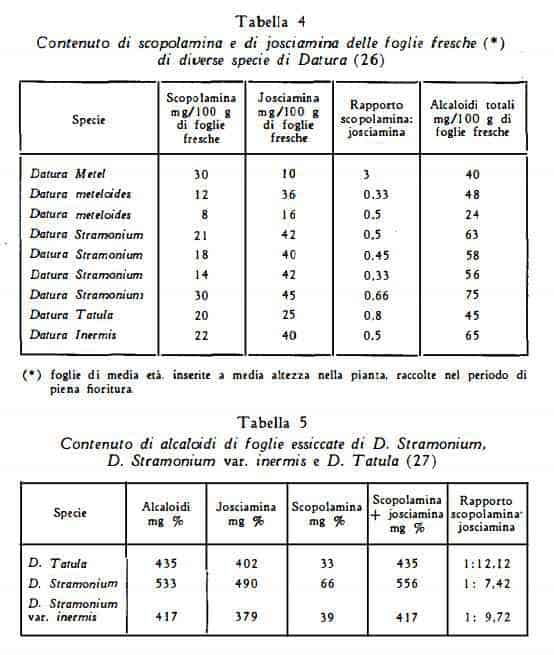
Secondo i dati analitici, pubblicati dal Romeike (26) e dal Beal e coll. (27) per il titolo dei singoli alcaloidi di diverse specie di Datura, nello Stramonio vi è una più elevata proporzione di scopolamina rispetto ai dati sopracitati di Gstirner e Stein (6), come risulta dai valori elencati nelle tabelle 4 e 5.
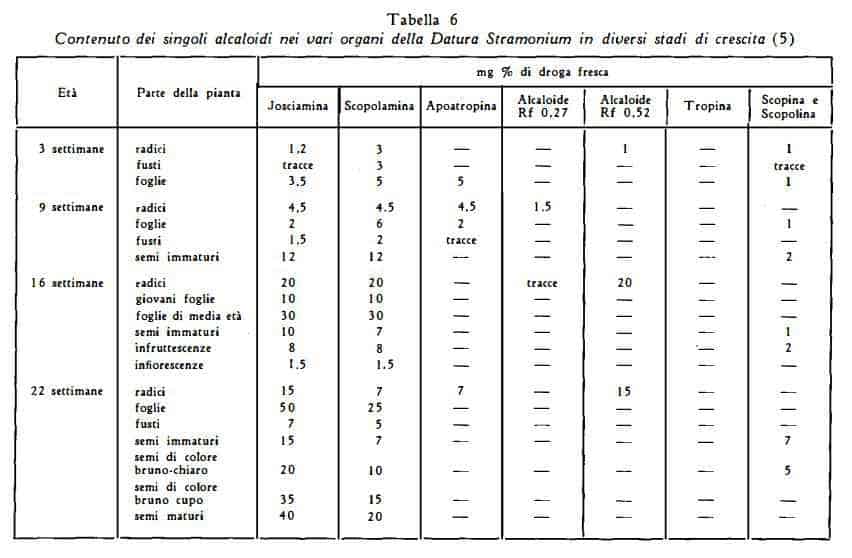
Sia il contenuto di alcaloidi totali che quello degli alcaloidi singoli subisce variazioni notevoli nel corso del ciclo vegetativo (26) (28-30). La scopolamina è sintetizzata soltanto nei primi stadi di crescita della pianta (30-32). La pianta appena germogliata contiene nelle radici quantità più elevate di josciamina che di scopolamina, mentre nelle parti aeree la scopolamina predomina largamente. Con la maturazione della pianta si ha invece prevalenza della josciamina (30).
E' stato notato che il più elevato titolo di alcaloidi nelle foglie si ha nel periodo di fioritura della pianta (33-35) e quando inizia la fruttifi-
cazione (35) o la maturazione del frutto (36a). Durante gli stadi iniziali il più elevato contenuto è nelle radici, durante il periodo di fruttificazione nelle foglie giovani, nelle parti giovani dei fusti, nei frutti giovani e nelle radici secondarie (36). A risultati differenti da questi ultimi hanno condotto esperienze fatte in Germania da Romeike (5) (tabella 6).
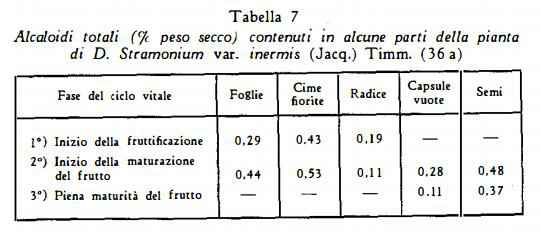
Per la D. Stramonium var. inermis Karkoszka, Rogoyska e Krasowska (36a) hanno trovato i valori quantitativi indicati nella tabella 7.
Nelle radici dello Stramonio è stato determinato un contenuto di ditiglioildiossitropano pari al 10% degli alcaloidi totali (7b),
Variazioni del titolo alcaloidico sono state notate anche durante il
giorno (37-39) con valori superiori al mattino rispetto al pomeriggio (37) (38). Da risultati di analisi, eseguite a distanza di 4 ore durante un periodo di 24 ore, si è dedotto che nelle foglie la quantità di alcaloidi totali diminuisce dalle ore 17 alle 23 e aumenta durante le seguenti ore della notte, mentre nelle radici aumenta durante le ore giornaliere sino ad un titolo massimo, alle ore 19, e diminuisce nelle successive ore notturne. La differenza tra il maggiore ed il minore titolo delle foglie è risultata pari al 29%, calcolata con riferimento al peso delle foglie secche (39).
Anche le condizioni climatiche possono contribuire a variare il titolo alcaloidico dello Stramonio. E’ stato ad esempio provato che la pioggia (38) (40) (41) ed il gelo (38) provocano una diminuzione della quantità percentuale di alcaloidi e si consiglia quindi di tenerne conto per la scelta del periodo di raccolta.
L’influenza di vari processi di essiccazione delle foglie sul contenuto di alcaloidi è stata studiata da Fluck (41a) (42). L’essiccazione a temperatura ambiente, a 35°, 60°, 90° non causa perdita di alcaloidi. A temperature superiori fino ai 140°, si ha una perdita del 9% di alcaloidi. Il confronto di diversi metodi di essiccazione ha dimostrato che le foglie di Datura Stramonium, di Atropa belladonna e di Hyoscyamus niger, essiccate a 60° per 13-16 ore, conservano un contenuto di alcaloidi maggiore in confronto con le foglie essiccate più a lungo a temperatura inferiore (43). L’essiccazione della pianta al sole è più dannosa dell’essiccazione in stufa (28). L’essiccazione con una lampada a raggi infrarossi ad una distanza di 30 cm causa una piccola perdita di alcaloidi, mentre non si ha alcuna diminuzione di titolo, se la lampada è posta alla distanza di 50-70 cm (42).
La conservazione della droga secca per 1-2 anni non ha determinato alcuna diminuzione del titolo alcaloidico (14).
Altri componenti
Oltre agli alcaloidi, nelle foglie di Stramonio sono stati trovati mg 75 % di acido citrico, mg 212% di acido malico (44), gli acidi ferulico, caffeico, clorogenico, neoclorogenico (45). Le ricerche qualitative degli acidi hanno dimostrato che in tutte le parti della pianta (radichette, radici, fiori, frutti ecc.), accanto a fosfati, solfati, cloruri, nitrati e ossalati, come acidi principali si trovano gli acidi malico e citrico. Come acidi secondari (in quantità inferiori ai 5 mg % del peso fresco) sono presenti gli acidi fumarico, succinico, glicolico, malonico, lattico, a-chetoglutarico e aconitico: essi però non sono in tutte le parti della pianta. Il più abbondante fra gli acidi principali è l’acido malico. La maggiore quantità è stata trovata nei pericarpi dei frutti a completo sviluppo (1,155 g %), la minore nei semi maturi (30 mg %). L’acido citrico è contenuto per la massima parte nella placenta dei frutti a completo sviluppo (222 mg %) e in minima quantità nelle radici principali (11 mg %). Per quanto riguarda il titolo di acidi principali durante il periodo vegetativo, l’acido citrico presenta due massimi (100 mg %) e precisamente prima della fioritura ed a metà del periodo della fioritura (variazioni massime 1:2). La quantità di acido malico è bassa (inferiore a 100 mg %) nelle piante giovani e vecchie, durante la fioritura aumenta, presenta un massimo (450 mg %) a metà del periodo della fioritura e diminuisce rapidamente all’inizio della maturazione dei frutti (variazione totale 1:6). Il rapporto fra acido citrico e acido malico varia da 1:2 nelle piante giovani, sale a 1:4,5 a metà del periodo della fioritura, diminuisce a 1:1 durante la maturazione dei frutti per invertirsi a 2:1 nelle ultime foglie delle piante più vecchie (44).
Sono stati inoltre trovati tannino 1,7% (46), anche 4,38-7,15% (47); secondo Herrmann (45) invece i tannini sarebbero assenti; vitamina C mg 655-931 %, titolo determinato nelle foglie fresche, ma espresso in rapporto alla droga secca (48); non sono stati trovati flavonoidi (49); due sostanze neutre, C13H20O2, e C16H22O5, indicate rispettivamente con i nomi di «datugene e datugenina», estratte da droga coltivata in Cina (50). Acqua 86,6% nella droga fresca (51); azoto nelle foglie g 4,66%, calcolato sul peso della sostanza secca (51); ceneri 8-23,7 % (16), anche 14,2-16,1% (52) e 17,75-19,30% (25).
Le foglie, i fusti ed i fiori hanno prodotto nel distillato in corrente di vapore gli alcooli metilico, etilico, butilico, le aldeidi formica, propionica, isobutirrica, acetone ed esteri, quali formiati ed acetati (53).
Nei semi olio grasso («olio di datura») ca. 25% (11) con gli acidi daturico (acido eptadecilico) 2,5%, palmitico 10%, linoleico 15% e oleico 62%; frazione insaponificabile 1% (54), anche 2,13% (55) con sitosterolo (56). Nell’olio è stato trovato anche acido lignocerico (acido tetracosanico) (57).
Nei germogli e nelle radici della Datura Stramonium v. inermis godronii sono state identificate cumarine, costituite da scopoletina (mg 0,5 e 0,1 % rispettivamente) con tracce di esculetina e di esculina (57a).
Dalla pianta della D. Stramonium è stato ottenuto l’enzima atropina-esterasi, che scinde la josciamina in tropina ed acido tropico. Preparati derivanti da piante di età da 10 a 15 settimane non hanno esplicato attività esterasica, mentre quelli di piante di 19-24 settimane hanno scisso il 26,5% ed il 43% di josciamina rispettivamente (57b).
Proprietà farmacologiche ed impiego terapeutico
La Datura stramonio era completamente sconosciuta in Europa, nell’Antichità e nel Medioevo.
Questa pianta venne importata dal Messico in Spagna nel 1577 e venne poi coltivata nei giardini botanici d'Italia e d’Austria. In Francia venne menzionata per la prima volta nel 1601 ma essa era nota allora soltanto come pianta ornamentale.
Il primo a riconoscere le proprietà terapeutiche dello Stramonio, sembra sia stato lo Stòrck nel 1762 (58) ed è oggi noto che l’azione di questa droga non differisce fondamentalmente da quella delle altre sue congeneri, Belladonna e Giusquiamo.
La composizione del fitocomplesso attivo contenuto in queste solanacee è qualitativamente lo stesso ma differisce quantitativamente sia per il contenuto medio degli alcaloidi totali che è maggiore nella Belladonna e minore nel Giusquiamo, che per il rapporto esistente fra il contenuto di atropina e di scopolamina.
Nel Giusquiamo e nello Stramonio, il contenuto medio relativo di scopolamina è superiore a quello della Belladonna e da ciò deriva una maggiore azione depressiva centrale ed ipnotica, correlata alle due suddette droghe, azione che nella Belladonna generalmente mancano.
Tuttavia lo Stramonio, sebbene meno usato, trova in terapia le stesse applicazioni della Belladonna.
Un impiego piuttosto vasto trovarono e trovano tuttora le foglie di Stramonio, sole od associate con quelle di Belladonna, di Giusquiamo e di altre droghe, nella terapia antiasmatica sotto forma di carte fumigatorie e di sigarette il cui uso ebbe inizio dopo il principio del secolo scorso allorché un medico di Madras, Enderson (59) e alcuni anni più tardi il Christie (60), medico degli ospedali di Ceylon, fecero conoscere in Europa la pratica popolare diffusa nelle Indie orientali, di inalare il fumo prodotto dalla combustione delle foglie di alcune specie di Datura (D. metel L., D. fastuosa L.) per combattere gli accessi asmatici.
Sigarette preparate con la specie europea di Datura (D. Stramonium L.) furono sperimentate con successo da alcuni medici inglesi [Sims (61), Englis (62), Meyer (63) ed altri] e francesi [Lòennec (64), Trousseau (65), Bretonneau (66) ecc.], dai quali le suddette sigarette vennero sperimentate, oltre che nell’asma, anche nella tosse dei tisici e nella pertosse.
Vincet e coll. (67-70), sperimentarono più recentemente l’effetto protettivo del fumo di sigarette preparate con foglie di Stramonio, di Belladonna e di Giusquiamo, contro il broncospasmo prodotto facendo inalare alla cavia un areosol di acetilcolina o di istamina.
Essi conclusero che la cavia è totalmente protetta dagli effetti broncospastico (asma acetilcolinico) e tossico prodotti dell’aerosol di acetilcolina, dopo soggiorno per qualche minuto in un ambiente in cui il fumo prodotto dalla combustione delle suddette foglie si trovava in concentrazione anche molto moderata.
Il cane cloralosato, dopo inalazione di questo fumo, appare totalmente insensibile all'aerosol di acetilcolina, sia nelle sue manifestazioni respiratorie che circolatorie e perde gran parte della sua sensibilità all’acetilcolina anche allorché essa venga iniettata endovena a piccole dosi.
Per quanto riguarda l’attività del fumo delle suddette sigarette nel risolvere il broncospasmo prodotto da una soluzione aerosolizzata di cloridrato di istamina (al 4%), gli AA. hanno notato che pur non determinando esso, un effetto così costante e così specifico come nel risolvere il broncospasmo acetilcolinico, le cavie preventivamente esposte a questo fumo, tollerano tuttavia l’aerosol istaminico assai meglio e senza crisi mortali.
Vincent e Segonzac (70), hanno inoltre notato che il fumo prodotto dalle foglie delle tre suddette Solanacee, inibisce marcatamente l’eccitabilità del vago cardiaco nei cani cloralosati e diminuisce o sopprime l’effetto ipotensivo prodotto dall’iniezione endovenosa di piccole dosi di acetilcolina, ciò che dimostra, secondo gli AA., che l’assorbimento degli alcaloidi atropinici per mezzo del fumo, è sufficiente a produrre i caratteristici effetti parasimpaticolitici di questi alcaloidi.
Ervenius, Holmstedt e Wallen (71) calcolarono la quantità di atropina contenuta nelle sigarette, che passa nel fumo e che viene assorbita per inalazione del fumo stesso. Essi trovarono che il fumo di sigarette contenenti g 0,2 di tabacco a basso contenuto nicotinico e mg 5-20 di solfato di atropina, contiene il 25 % di questo alcaloide.
Il fumo di sigarette antiasmatiche preparate con foglie di Stramonio, contiene soltanto una piccola quantità di atropina in relazione, secondo l’A., al basso contenuto dell’alcaloide nella droga.
Profonde inalazioni determinerebbero la ritenzione nei polmoni di circa l’80% dell’atropina contenuta nel fumo e soltanto il 20% allorché le sigarette vengono fumate superficialmente.
Gunter (72) precedentemente aveva trovato che il fumo di sigarette preparate con g 1,25 di foglie di Stramonio, contiene mg 0,5 di atropina.
Secondo Cavanna e Rocchietta (73) le sigarette antiasmatiche possono agire efficacemente nel momento della crisi asmatica, particolarmente in quelle forme cliniche in cui l’accesso é determinato da una componente colinergica dominante o, accessoriamente, istaminica ma, secondo Carryer e coll. (74), il temporaneo miglioramento dell’asma così ottenuto, può essere seguito da un attacco dovuto ad irratazione bronchiale.
Nella terapia del parkinsonismo postencefalitico, l’associazione dello Stramonio e del Giusquiamo con la Belladonna, può dare risultati migliori della sola Belladonna usata empiricamente nella cosiddetta «cura bulgara» sotto forma di decozione vinosa delle radici. Con l’impiego degli estratti fluidi titolati delle tre solanacee (estr. fluido titolato di Belladonna radice, estratti fluidi titolati di Stramonio e di Giusquiamo), si può ottenere un’azione più completa e più costante negli effetti terapeutici ed il vantaggio di poter praticare una posologia molto più precisa.
Tossicologia – La sintomatologia degli avvelenamenti acuti da Stramonio é simile a quella caratteristica prodotta dalla Belladonna; secchezza alle fauci, disfagia, dislalia, midriasi e perdita dell’accomodazione visiva, arresto della secrezione sudorale, tachicardia e tachipnea, ipertensione, eccitazione psicomotoria, delirio gaio o furioso, allucinazioni visive e, nei casi più gravi, depressione dei centri bulbari con ipotensione, ipotermia, respiro periodico, stupore, collasso e morte. Nell’avvelenamento da Stramonio il delirio é più intenso e così pure lo stato allucinatorio, per il quale gli intossicati sono soggetti a visioni stranissime, tanto che in Francia lo Stramonio è noto popolarmente anche con i nomi di herbe aux sorciers e di herbe aux diables.
Gli avvelenamenti da Stramonio sono rari e, in generale, accidentali, per ingestione delle sue foglie commiste ad altre verdure commestibili.
Boissier e Abdullah (75) hanno descritto un curioso caso di avvelenamento collettivo da Stramonio, provocato a scopo di furto a Kabul.
Secondo gli AA. i veleni rappresenterebbero un'arma molto usata nell’Afghanistan e, fra essi, l'arsenico sotto forma di anidride arseniosa, la morfina sotto forma di decozione di capi di Papaver somniferum, le solanacee e in particolare le foglie e i semi di Datura, sarebbero quelli cui più comunemente si ricorre a scopo criminoso.
Nell’Afghanistan abbondano le Dature di cui se ne trovano varie specie (D. metel, D. fastuosa. D. alba, D. innoxia, D. tatula, D. Stramonium) e sembra sia nata nella vicina India l’idea di preparare con queste droghe un veleno detto «Dhat» da cui, peraltro, si vorrebbe far derivare il nome di «Datura».
Questi avvelenamenti avvengono per lo più nei bazar a scopo di furto. Il dhat viene somministrato commisto alle bevande o agli alimenti, provocando in coloro che se ne cibano un profondo sonno durante il quale essi possono essere tranquillamente derubati.
Il caso descritto dagli AA. riguarda un gruppo di cinque mercanti giunti dall’interno per vendere la loro merce nel bazar di Kabul. Il veleno venne loro propinato commisto al pilaw (piatto nazionale a base di riso) preparato presso il «serraglio» in cui essi erano alloggiati.
Al risvelgio dal lungo e profondo sonno in cui erano piombati quasi immediatamente dopo il pasto, constatarono la scomparsa di tutto il loro denaro e la morte di uno di essi.
Di solito i malcapitati superano l’intossicazione senza conseguenze troppo dannose ma, o che la dose del veleno fosse stata un po’ più generosa del solito, o che la quantità di pilaw ingerita da colui per il quale l’intossicazione riuscì fatale, fosse stata più abbondante di quella ingerita dagli altri, le conseguenze furono in questo caso, più gravi di quelle volute.
La sintomatologia osservata nei sopravvissuti e in particolare la considerevole e persistente midriasi, fecero subito pensare agli AA. ad un avvelenamento da solanacee. L’esame tossicologico eseguito dagli AA. stessi presso l’Istituto di Farmacologia della Facoltà di Medicina di Kabul, confermò la diagnosi.
Nel contenuto gastrico del mercante deceduto, vennero trovati 25 semi di Datura, dai quali furono isolati 12 cgr di alcaloidi totali. Nel contenuto intestinale vennero trovati 17,2 mg di alcaloidi, 3 mg vennero trovati nel fegato e 9,2 in un rene.
Il fatto però che l’intossicazione si sia manifestata con uno stato di profonda narcosi non preceduta da eccitazione psicomotoria, da delirio, allucinazioni ecc. potrebbe far pensare, benché nella relazione degli AA. non se ne trovi cenno, che nella composizione del veleno usato, entrasse, oltre la Datura, anche una non trascurabile percentuale di oppiacei.
La terapia dell’avvelenamento acuto da Stramonio è la stessa di quella indicata per le altre solanacee atropiniche: somministrazione degli antidoti generali degli alcaloidi (acido tannico, soluzione jodo-jodurata), adsorbenti (carbone attivato), lavanda gastrica e purganti, in primo tempo. Ad assorbimento avvenuto, la terapia è sintomatica e deve essere volta ad antagonizzare gli effetti della droga: pilocarpina a dosi piuttosto elevate, sedativi durante il periodo di eccitazione e di delirio, analettici (caffeina in particolare) e, ove occorra, respirazione artificiale durante il periodo depressivo e comatoso.
Estratti e preparati vari
a) Estratto fluido titolato allo 0,25 % di alcaloidi (g 1 = L gtt).
Dosi: I-II gtt pro dose più volte pro die.
Dosi massime: g 0,1 pro dose, g 0,4 pro die.
b) Estratto molle acquoso titolato allo 0,8% di alcaloidi.
Dosi: g 0,01-0,02 pro dose.
c) Estratto secco acquoso titolato all'1 % di alcaloidi.
Dosi: g 0,005-0,01 pro dose.
d) Tintura titolata allo 0,025 % di alcaloidi.
Dosi: X-XX gtt pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido stramonio………………………………………………… g 10
Alcool di 50° g 90
(X-XX gtt pro dose).
Sciroppo
Tintura di stramonio………………………………………………………. g 5
Sciroppo semplice F.U………………………………………………….. g 95
(1 cucchiaino pro dose, 2-3 pro die).
Pozione antiasmatica
Tintura stramonio………………………………………………………….. g 2
Tintura aconito……………………………………………………………… g 2
Bromuro di potassio…………………………………………………….. g 15
Sciroppo arancio amaro……………………………………………….. g 30
Acqua……………………………………………………………………… .g 75
(un cucchiaio durante l'accesso).
BIBLIOGRAFIA
(1) GEIGER P. e HESSE O., An11. Chem., 7, 272, 1833 – (2) PLANTA A. v., ibid., 74, 252, 1850 – (3) LANDENBURG, ibid., 206, 290, 1881 – (4) SCHMIDT E., Arch. Pharm., 208, 196, 1881; 230, 207, 1892; 243, 306, 1905; Ber., 13, 370, 1880 – (5) ROMEIKE A., Pharmazie, 8, 729, 1953 – (Sa) WAHL, Tabak-Forsch., n. 8, 3, 1952; n. 10, 3, 1953 – (6) GSTIRNER F. e STEIN G., Pharmazie, 7, 362, 1952 –
(7) CIAMICIAN G. e RAVENNA C., A((( R. Accad. dei Lincei, 20, 614, 1911; CRONWELL B. T., Biochem. J., 37, 722, 1943 – (7a) ROMEIKE A., Flora, 143, 67, 1956; Chem. Abs., 52, 16485, 1958 – (7 b) EVANS W. C. e PARTRIDGE M. W., J. Chem. Soc., 1102, 1957; Chem. Abs., 51, 10547, 1957 –
(8) EVANS W. C. e WELLENDORF M., J. Chem. Soc., 1991, 1958 – (9) REINOUTS VAN HAGA P., Nature, 174, 833, 1953 – (10) HENRY T. A., The Plani Alkaloids, IV ed., p. 65 – (11) WEHMER C., Die Pflanzenstoflfc, II ed., p. 1106 â– (12) KOCH, Amer, J. Pharm., 91, 11, 1919 – (13) OLLSON O., Farm. Revy, 49, 617, 1950 – (14) FELDHAUS J., DiSS. Marburg, 1903; Arch. Pharm.. 243. 328, 1905 – (15) PATER B., Pharm. Monatsh., 4, 63, 1923 – (16) JONAS ST., Magyar Gyogysc. Tars, Ertes., 6, 307, 1930; Chem. Zbi, II, 1878, 1930 – (17) KULESHOVA M. I., Nekotoroye Voprosy Lekarstvoved., 33, 1959 –
(18) TERP P., Acta PharmacoL Toxtcoi, 4, 135, 1949 – (19) HEGNAUER R., Pharm. Weekbl., B6. 935, 1951 – (20) EBY F. H., SCHOLL F. M. e PHILLIPS D. I., J.A.Ph.A., 17, 474, 1938 – (21) ANDEREGG G. c FLUCK H., Dtsch. Ap. Ztg., 97. 1019, 1957; 9fi, 1125, 1958 – (22) QUINN T. J., JEFFREY J. G. e MACAULAY W. C, J.A.Ph.A., ed. sci., 46, 384, 1957 – (23) ROWSON J. M., Quart. J. Pharm. PharmacoL 18. 175, 1945; JACKSON B. P. e ROWSON J. M., J. Pharm. PharmacoL, 5. 778, 1953 – (24) STEINEGGER E., Pharm. Acta Helv., 26. 188, 1951; 27, 251, 1952 – (25) MILLER O. H. e FISCHER L., J,A.Ph.A., 35, 23, 1946 – (26) ROMEIKE A., Pharmazie, fi, 668, 1953 – (27) ALAMI R. R., CHRI- STENSEN B. V c BEAL J. L., l.A.Ph.A., ed. sci.. 44. 710, 1955 – (28) BOSHART K., Heil-u. Gewurz- Pfianzen.. 2, 108, 1918-19; 13. 97, 1931-32 – (29) SANDFORT E., Angew. Botan., 22, I. 1940 – (30) ROMEIKE A., Pianta Med., fi, 491, 1960 – (31) MARION L. c THOMAS A., Can. J. Chem., 32, 1116, 1954; 33, 1853, 1955 – (32) LEETE E., J. Am. Chem. Soc., 82. 612, 1960 – (33) LYALIKOV S. L, Trudy Kishinev. Med. Inst., 3. 45, 1953; Chem. Abs., 49, 7814, 1954 – (34) KOLODZIEJSCKI c KULESZYNA A., Acta Polon. Pharm., 16, 287, 1959; Chem. Abs., 54, 1665 d, 1960 – (35) FRENCLOWA L, Biuletyn Naukowy., II, 87, 1956; Dtsch. Ap. Ztg., 98, 86, 1958 – (36) KULESZYNA A., Farm. PoLska, 13, 240, 1957; Chem. Abs., 52, 4108 d, 1958 – (36 a) KARKOSZKA A., ROGOYSKA K. c KRASOWSKA H., Dissert. Pharm., 10. 311, 1958 – (37) PLOSKI W., Roczyn. Nauk. Rolniczych., 16. 186, 1927; Chem. ZbL, ir, 291, 1927 – (38) BOSHART K. c BERGOLO M., Heil-u. Gewurz-Pfianzen.. fi, 177, 1926; 9, 112, 1927 – (39) HEMBERG T. c FLUCK H., Pharm. Acta Helv., 28. 74, 1953 – (40) MOTHES K., Dtsch. Ap. Ztg., 53, 1271, 1938 – (41) SCHRATZ E. c SPANINO M., Dtsch. Hellpfi., fi, 69, 1942 â– (41a) FLUCK H., Heii-u. Gewurz-Pfianzen., 18, 109, 1939 – (42) HEGGIN A. e FLUCK H., Pharm. Weekbl, 93, 407, 1958 – (43) ZDERKIEWICZ T„ Ann. Vniv. Mariae Curle-Sklodowska, Lublin – Polonia, 14D, 311, 1959; Chem. Abs.. 55. 9793 c, 1961 – (44) POHLOUDEK-FABINI R. e WOLLMANN H., Pharmazie. 16. 442, 1961; 17, 5, 1962 – (45) HERRMANN K., ibid.._ 13, 266, 1958; HERRMANN K., Arch. Pharm., 292, 325, 1959 – (46) PRITZKER J. c JUNGKUNZ R., Pharm. Acta Helv., 19, 225, 1944 – (47) VOLLNER H., Arch. exp. Path. u. PharmakoL, 176. 550, 1934 – (48) GUNTHER E., HEEGER E. F. e ROSENTHAL C, Pharmazie,
7. 39, 1952 – (49) STEINEGGER E. c SONANINI D.. Pharm. Acta Helv., 36. 662, 1961 – (50) CHOU, Chinese J. Physioi, 9. 77, 1935 – (51) CROOK E. M. e HOLDEN M., Biochem. J., 43, 181, 1948 – (52) WINKLER M., Pharm. Zentralh., 73, 614, 1932 – (53) SSIWOLOBOW, J. Russ. Phys. Chem. Ges., 47, 1561, 1915 – (54) MEYER H. e BEER, Monatsh. Chem., 33, 311, 1912 – (55) VERKADE c COOPS, Bioch. Zeitschr-, 206, 468, 1929 – (56) GISVOLD O., J.A.Ph.A.. 23. 106, 1934 . (57) KARRER W„ KonsUtution und Vorkommen der organischen PAanzenstoffe, 1958, p. 295 • (57a) KALA H., Pianta Med.. 6, 186, 1958 – (57b) JINDRA A., SOFROVA D. c LEBLOVA S., Collection Czech. Chem. Commun., 27. 2467, 1962; Chem. Abs.. 58, 1675, 1963 – (58) STORCK, cit. da MADAUS in Lehrbuch der Biologischen Heilmittel G. Thieme, ed. Lipsia 1938, voi. IH, p. 2628 – (59) ENDERSON, ciC, da VINCENT, SEGONZAZ c BOUAZIZ [vcd. (67)] – (60) CHRISTIE, Edinburg Med. and Surg. J., 7, 1811, cit. da VINCENT, SEGONZAC e BOUAZIZ, Le. (67) – (61) SIMS, ibid., 8, 1812, cit. da VINCENT idem. – (62) ENGLISH, ibid., 7, 1814, cit. da VINCENT, idem. – (63) MEYER, J. d’Vfeland, aprile 1827, cit. da VINCENT, idem. (64) LÒENNEC, cit. da VINCENT, SEGONZAC e BOUAZIZ, idem. – (65) TROUSSEAU, idem. – (66) BRETONNEAU, idem.. – (67) VINCENT D., SEGONZAC G. e BOUAZIZ A., Ann. pharm. franf.. 12. 509, 1954 – (68) VINCENT D., SEGONZAC G. e BOUAZIZ A., Traveaux Soc. Pharm. Montpellier, 14. 288, 1954 – (69) VINCENT D„ SEGONZAC G. e BOUAZIZ A., Soc. de Pharm. de Toulouse, 10 febbr. 1955; Toulouse Pharm. 1955 – (70) VINCENT D. e SEGONZAC G., C.R. Soc. BioL. 152, 666, 1958 •
(71) ERVENIUS 0„ HOLMSTEDT B. e WALLEN O., Arch. exp. Path. u. Pharmakql. 234, 343, 1958 •
(72) GUNTER. Wien. KHn. Woch.. 748, 1911 – (73) CAVANNA D. e ROCCHIEITA S., Min. Med., 47, 439, 1956 â– (74) CARRYER e coll., J.A.M.A.. 131, 25, 1946 – (75) BOISSIER J. e ABDULLAH, Ann. pharm. franf., 10, 117, 1952.


