Melograno
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Punica granatum L. – Fam. Punicacee/Granatee)
Melograno- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Punica (sottint. mala) = pomo cartaginese. Da punicus o poenicus, cioè dei Poeni = Punici, Fenici, Cartaginesi.
In senso traslato = color porpora, purpureo. Pomo cartaginese color porpora (fiori e frutti rossi).
granatum – da granum, perchè il frutto è pieno di grani, somiglianti per il colore rosso a granuli di granato (piròpo), pietra ornamentale. Secondo alcuni, anche perchè abbondante a Granata (Spagna).
La mitologia greca attribuì al Melograno un’origine mitica: il mito di Agdeste, specie di mostro, il cui sangue, essendo stato mutilato, avrebbe dato origine al pomo granato.
Nomi volgari – Pomo granato, granato (tosc.) migranié, migran (lig.), pomm granaa (lomb.), ranatu (sic.), arenata (sard.) ecc.
Granatbaum (ted.), pome granate tree (ingl.), grénadier (fr.), granado (spagn.), romeira (port.), piros pomagrànat (ungh.), granàt (russo).
Habitat – Selvatica nelle località rocciose della Persia, del Kurdistan, dell’Afghanistan e Belucistan, nel mezzodì del Mar Caspio (Mazanderan), a mezzodì del Caucaso. Asia Minore, Grecia, nella regione del Mar Mediterraneo. Naturalizzata nel bacino mediterraneo per propagazione naturale (uccelli) o per coltura. Coltivato da antichissimo tempo in Palestina, in Egitto. I Romani ritenevano il Melograno migliore quello proveniente da Cartagine (da ciò il nome – punica). Oggi coltivata in quasi tutti i paesi temperati. In Italia qua e là inselvatichita dei boschi e nelle siepi, dal mare alla regione montana.
Alberello o arbusto cespuglioso.
Parti usate – La corteccia della radice e dei rami (Granati cortex F.U.).
Componenti principali
Alcaloidi con nucleo piperidinico, dei quali, tra quelli riportati in letteratura, — cioè pseudopelletierina, pelletierina (forma levogira) , isopelletierina (dl-pelletierina) e metilpelletierina, isolate da Tanret (1) (2) (3), isometilpelletierina estratta da Piccinini (4), pelletierina (forma racemica = isopelletierina di Tanret) e isopelletierina di Hess (5), metilisopelletierina (= metilpelletierina di Tanret, isometilpelletierina di Piccinini) di Hess e Eichel (6) (7) —, soltanto la pseudopelletierina di Tanret, la isopelletierina di Hess e la metilisopelletierina di Hess e Eichel sono riconosciute attualmente come reali costituenti del Melograno. Oltre a questi tre alcaloidi, più recentemente Wibaut e coll. (8-10) hanno estratto tre nuove basi con formula grezza, C9H17O2N, C10H19O2N e C7H9ON.
Con il nome di pelletierina Tanret (1) (2) ha designato l’alcaloide, C8H15ON, che egli stesso avrebbe estratto dalla corteccia della radice del Melograno nella forma levogira. L'alcaloide levogiro non è stato invece trovato da Hess e Eichel (7) tra le basi estratte dal Melograno: essi vi identificarono la forma racemica, denominata isopelletierina da Tanret (2) (3) e le trasferirono il nome di pelletierina (7). In seguito allo studio dei derivati e dei prodotti di sintesi (11-15) (16), la pelletierina fu considerata equivalente alla b-(2-piperidil)-propionaldeide (I). Più recentemente Galinovsky e coll. (17) e Wibaut e coll. (18) (19) hanno escluso la presenza nella corteccia di Melograno della b-(2-piperidil)-propionaldeide, cioè della pelletierina quale era stata indicata nella letteratura. La pelletierina della letteratura è probabilmente da identificarsi alla isopelletierina, cioè all’a-(2-piperidil)-propan-b-one (17). Le proprietà della isopelletierina e dei suoi derivati sono simili infatti a quelle descritte da Hess (20) per la pelletierina e per i derivati di questa.
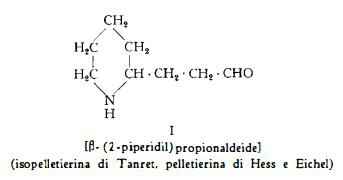
La isopelletierina, C8H15ON, isolata da Hess (5) dalla corteccia della radice del Melograno, ha la struttura II, che è stata confermata per sintesi (15-15c).
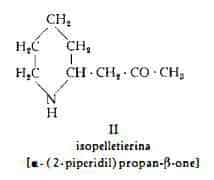
La metilisopelletierina, C9H17ON, è stata così denominata da Hess e Eichel (6), che la identificarono alla metilpelletierina di Tanret (2) (3) ed alla isometilpelletierina di Piccinini (4). A questo alcaloide fu in seguito assegnata la struttura di a-(2-N-metilpiperidil)-propan-b-one (III) (21) (22), struttura confermata poi per sintesi (15a-15c) (23).
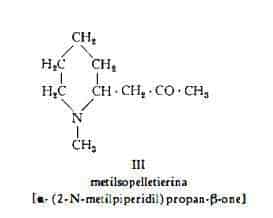
dl-Isopelletierina e dl-metilisopelletierina sono state ottenute sia attraverso sintesi, sia per estrazione dalla corteccia della Punica granatum, ma è stata avanzata l’ipotesi che entrambi gli alcaloidi si trovino nella pianta in forma otticamente attiva e che essi si racemizzino poi nel corso del processo di isolamento (23a). Isopelletierina nella forma levogira è stata infatti estratta in seguito dalla corteccia del Melograno (17).
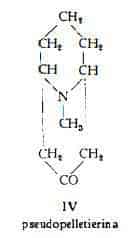
Pseudopelletierina, C19H15ON, è stata isolata da Tanret (2) (3). La sua composizione chimica è stata oggetto di studi approfonditi ad opera specialmente di Ciamician e Silber (24) (27), di Piccinini (28-32), Willstàtter e coll. (33-36), Harries (37), Robinson e coll. (38-40), Blount (41) (42) e di Schòpf e Lehmann (43). La sua formula di struttura, confermata per sintesi (43a-43d), è la IV.
Il contenuto di alcaloidi totali del Melograno (radici e corteccia di radici) varia largamente (44-46): la droga fresca contiene una più elevata quantità di alcaloidi totali rispetto alla droga vecchia. In cinque campioni di droga d’Italia e di Algeria è stato trovato lo 0,25% di alcaloidi grezzi (47). Secondo Goodson (44), il titolo varia da 0,074 a 0,58%.
Altri componenti: tannino 20-22%, anche 28,3% (48), gli acidi gallico ed ellagico (48) (49), amido e resina (48). Nella corteccia della radice essiccata g 0,3367% di boro (50).
Proprietà farmacologiche ed impiego terapeutico
L’azione antielmintica del Melograno era nota a Dioscoride, a Plinio, a Celso e nel Medioevo a Barthelemy (1200) che impiegava i fiori, i frutti e la corteccia per com- battere le elmintiasi intestinali e a Paracelso che lo impiegava contro «le infiammazioni».
Più tardi Mattioli e altri lo impiegarono, oltre che come antielmintico, anche come «rinfrescante», febbrifugo e ipotensivo.
In Cina il frutto era usato contro la dissenteria e altre forme infiammatorie muco-catarrali del tubo gastroenterico e anche nel Sudan la corteccia viene impiegata come antidissenterico, spesso associata con l’Oppio.
Sembra che l’ingresso di questa droga nella medicina ufficiale europea sia avvenuto soltanto nel 1807, dopo che un medico di Calcutta, il Buchanam, avendo constatato che essa era usata popolarmente in India e con successo, contro le tenie, attirò su di essa l’attenzione dei medici occidentali (51) e le ricerche che alcuni AA., fra i quali Flemming, Pollock, Breton, Comes (52), eseguirono sulla corteccia della radice, contribuirono a diffonderne l’uso.
La scoperta di quattro nuovi alcaloidi, avvenuta per merito di Tanret nel 1878 dimostrò che l’attività della corteccia della radice è dovuta specialmente a due di questi alcaloidi e cioè alla pelletierina e all’isopelletierina.
La pelletierina in soluzione all’1:10000, uccide la Taenia serrata del gatto in 10 minuti [Schroeder (53), Rebello e coll. (54)].
Duguid e Heathcote (55) osservarono che il solfato di pelletierina alla diluizione di 1:200000 può ancora determinare una paralisi reversibile delle proglottidi della Moniezia expansa e della Taenia saginata.
La pelletierina è notevolmente tossica anche per gli animali superiori e per i mammiferi in particolare, nei quali determina un aumento dell’eccitabilità riflessa seguito da paralisi del sistema nervoso centrale e da morte per paralisi respiratoria.
Nell’uomo, dosi non molto superiori a quella terapeutica (g 0,50-0,60) possono determinare vertigini, nausea e vomito, diarrea, turbe visive e torpore degli arti.
La pseudopelletierina, esente da azione antielmintica, è dotata di notevole tossicità per l’uomo e dovrebbe essere eliminata completamente, secondo Goodson (56), dai preparati di pelletierina del commercio, nei quali di solito vi è contenuta in percentuali assai elevate (fino al 50%).
Secondo Vincent e Beaujard (57), la pelletierina possiede un’azione inibente la colinesterasi, mentre l’olio fisso estratto dai semi, sarebbe dotato secondo Chopra e coll. (58) di attività batteriostatica verso la S. Typhosa. la S. paratiphi, la S. Rexeneri e il Kl. pneumoniae.
Analoghe proprietà batteriostatiche, verso il B. anthracis, il B. subtilis, lo S. aureus e lo S. piogenes, sono state attribuite dal Gavarron (59) all’acido tannico contenuto nella corteccia.
Gujral e coll. (60) infine, hanno dimostrato che preparati di Melograno, somministrati oralmente a ratte e a cavie femmine, ne riducono la fertilità.
In terapia si usa il decotto di corteccia della radice di Melograno di recente raccolta, all'8%, somministrandone da 500 a 750 cc in 3-4 volte nello spazio di 2 h. Tale somministrazione è di solito preceduta e seguita (un’h prima e un’h dopo) da un purgante.
Il decotto può essere sostituito anche da soluzioni di estratto fluido il quale può essere usato anche come tale.
Queste preparazioni hanno il vantaggio di essere meglio tollerate dei sali di pelletierina perchè questa, (come pure gli altri alcaloidi) nelle suddette preparazioni si trova combinata col tannino ed è quindi meno assorbibile e in grado di agire più elettivamente sui parassiti che sull’organismo ospite.
La pelletierina, che si usa nell’adulto sotto forma di solfato e alla dose massima di g 0,30 nell’adulto, viene a volte, associata all’acido tannico per le ragioni suddette.
Estratti e preparati vari
Estratto fluido (g 1 r= LI gtt).
Dosi: g 20-40 come tenifugo da somministrarsi in tre volte a digiuno con l’intervallo di ½ h.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido melograno………………………………………………. g 20
Alcool di 60°………………………………………………………………….. g 80
Pozione tenifuga
Estratto fluido melograno………………………………………………. g 20
Elisir Garus……………………………………………………………………. g 25
Sciroppo semplice F.U………………………………………………….. g 50
(da prendersi in tre volte alla distanza di ½ h, facendo seguire un purgante).
BIBLIOGRAFIA
(1) TANRET C.. Compt, remi.. 86, 1270. 1878 – (2) TANRET C., Compì, remi., 88, 716, 1879 – (3) TANRET C.. Compr. rena., 90. 695, 1880 – (4) PICCININI A., Gazz. Chim. Uà!., 29, II. 311, 1899 – (5) HESS K., Ber., 52, 1005, 1919 – (6) HESS K. e EICHEL A., Ber., 50, 380, 1917 – (7) HESS K. e EICHEL A., Ber., 50. 1386, 1917 – (8) WIBAUT J. P.. BEYERMAN H. C. e ENTHOVEN P. H., Ree. Trae. Chim., 73, 102, 1954 – (9) WIBAUT J. P., BEYERMAN H. C.. HOLLSTEIN U„ MULLER Y. M. F. e GREUELL E,. Koninkl. Ned. Akad. M'eiemchap., Proc. B58, 56, 1955; Chem. Abi., 49, 105830, 1955 – (10) WIBAUT J. P. e HOLLSTEIN U., Koninkt. Ned. Akad. tVetenschap.. Proc-, Ser. B59. 426, 1956; Chem. Abs., SJ, 11364 i, 1957 – (11) LOEFFLER K. e KAIM H., Ber., 42. 94. 1909 – (12) WIBAUT K. c EICHEL A., Ber., 50, 1192, 1917 – (13) WIBAUT J. P. e BEETS M. G. Ree. Trav. Chim., 59, 653, 1940 – (14) WIBAUT J. P.. Ree. Trai . Chim.. 60, 905. 1941 – (15) WIBAUT J. P„ KLOPPENBURG C. C. e BEETS M, G. J.. Ree. Trav. Chim., 63, 134, 1944 – (15 a) SCHOEPF C., Angew. Chem., 61, 31, 1949 – (15b) SCHOEPF C., BRAUN F., BURKHARDT K., DUMMER G. e MUELLER H., Lieb. Ann.. 626. 123, 1959; Chem. Abs., 54. 2395, 1960 – (15c) ANET E. F. L. J., HUGHES G. K. c RITCHIE E., Nature, 164, 501, 1949; Austraì. J. sci'. Res.. A3, 336. 1950; Chem. Zbì., 7344, 1952 – (16) SPIELMAN M. A.. SWADESH S. e MORTENSON C. W., J. Org. Chem.. 6, 780, 1941 – (17) GALINOVSKY F. e HOELLINGER R., Monatsh., 85, 1012, 1954: Chem. Ahs., 49, 6951c, 1955 – (18) WIBAUT J. P. e HOLLSTEIN U., Koninkl. Ned. Akad. Wetenschap., Proc., Ser. B 59, 426, 1956; Chem. Abs., SI, 11364i, 1957 – (19) WIBAUT J. P. e HIERSCHEL M. I.. Ree. Trav. Chim., 75, 225, 1956; Chem. Ahs., SO. 13908e, 1956 – (20) HOLLSTEIN
U., Thesis, Università di Amsterdam, 1956; MANSKE R. H. F., The Alkaloids, voi. VI, 1960, p. 126 – (21) MEISENHEIMER J. e MAHLER E., Lieb. Ann., 462, 301, 1928 – (22) HESS K. e LIITMANN O., Lieb. Ann., 494, 7, 1932 – (23) WIBAUT J. P. e KLOPPENBURG C. C., Ree. Trav. Chim., 65, 100, 1946 – (23 a) GALINOVSKI F., BIANCHETII G. e VOGL O., Monatsh., 84, 1221, 1953; Chem. Zbl., 8865, 1955 – (24) CIAMICIAN G. e SILBER P., Ber., 26, 2738, 1893– (25) CIAMICIAN G. e SILBER P., Ber., 27, 2850, 1894 – (26) CIAMICIAN G. e SILBER P., Ber., 29, 481, 1896 – (27) CIAMICIAN G. e SILBER P., Ber,, 29, 490, 1896 – (28) PICCININI A., Gazi. Chim. Ital., 29, I, 408, 1899 – (29) PICCININI A., Gazz. Chim. ìtal., 29, li, 104, 1899 – (30) PICCININI A. e QUARTAROLI A., Gazz. Chim. I/al., 29, Il, 115, 1899 . (31) PICCININI A., Gazz. Chim. Ital., 32, I, 260, 1902 – (32) PICCININI A., Atti accad. Lincei, (V), 8, ii, 219, 1899 – (33) WILLSTAETTER R. e VERAGUTH H., Ber., 38, 1975, 1905 – (34) WILLSTAET- TER R. e VERAGUTH H., Ber., 38, 1984, 1905 – (35) WILLSTAETTER R. e WASER E., Ber., 44, 3423, 1911 – (36) WILLSTAEITER R. e HEILDELBERGER U.,Ber., 46, 517, 1913 – (37) HARRIES C., Ber., 41, 671, 1908 – (38) ROBINSON R. e MENZIES R. C., J. Chem. Soc., 125, 2163, 1924 – (39) ROBINSON R. e BLOUNT B. K., J. Chem. Soc., 1429, 1932 – (40) ROBINSON R. e BLOUNT B. K., J. Chem. Soc., 2485, 1932 – (41) BLOUNT B. K., J. Chem. Soc., 553, 1933 – (42) BLOUNT B. K., J. Chem. Soc., 287, 1936 – (43) SCHOEPF C. e LEHMANN G., Lieb. Ann., 518, 1, 1935 – (43a) MENZIES R. e ROBINSON
R. , J. Chem. Soc., 2163, 1924 – (43b) ZIEGLER K. e WILMS H., Lieb. Ann., 567, 31, 1950 – (43c) COPE A. C. e coll., J. Am. Chem. Soc., 73, 3416, 1951 • (43d) PUTNEY B. F. e SOINE T. O., J.A.Ph.A., 44, 17, 1955 – (44) GOODSON, Quart. J. Pharm. Pharmacol., 13, 51, 1940 – (45) EWERS, Arch. Pharm., 237, 49, 1899 – (46) CHILTON J. e PARTRIDGE M. W., 1. Pharm. Pharmacol., 2, 784, 1950 – (47) VOGL O. e BIANCHEITI G., Mona/sh., 86, 1024, 1955; Chem. Abs., 50, 4985d, 1956 – (48) WEHMER C., Die Pflanzenstoffe, II ed., p. 817 • (49) KARRER W., Konstitution und Vorko^mcn der Organischen Pflan- zenstoffe, 1958, p. 361 – (SO) HIDEO KAKAOKA, Ann. Rept. Tohoku Coll. Pharm., n. 3, 17, 1956; Chem. Abs.. 51, 4504h, 1957 – (51) cit. da LECLERC in Précis de Pbytothérapie, Masson, Parigi 1935, p, 27 – (52) FLEMMING, POLLOCK, BRETON, GOMES, cit. da LECLERC H. ibid. – (53) SCHROEDER W., Arch. exp. Path. u. Pharmakol., 18, 381, 1884 – (54) REBELLO S., GOMES DA COSTA S. F. e TOSCANO RICO J., Comp. rend. soc. biol., 98, 473, 1928 – (55) DUGUID A. M. E. e HEATHCOTE R.
S. A., Arch. intern. pharmacod. et de /hfr., 82, 309, 1950 e 84, 159, 1950 – (56) GOODSON J. A., Quart. J. Pharm. Pharmacol,, 13, 57, 1940 – (57) VINCENT D. e BEAUJARD P., Bull. soc. chim. biol., 25, 1358, 1943 • (58) CHOPRA C. L., BHATIA M. C. e CHOPRA J. C., J.A.Ph.A., 49, 780, 1960 – (59) GAVAR- RON F. F., Ciencia Mexico. IO, 9 e 285, 1950 – (60) GUJRAL M. L., VARMA D. R. e SAREEN K. N., Indian J. Med. Research, 48, 46, I960; Chem. Abs., 54, 10147c, 1960.


