Menta Piperita
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Mentha piperita (L.) Huds. – Fam. Labiate/Saturiee/Menthiee) (Sin. – Mentha officinalis Soleirol)
Menta Piperita- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Mentha, dal latino Mintha o Minta, dal greco minqa o minqh nome della ninfa, figlia di Cocito, il fiume infernale, amata da Ades (Plutone) e da Persefone (Proserpina) mutata, per gelosia, nella pianticella (silvestris?).
Oppure da mens, mentis = la mente, perchè si riteneva che fortificasse il cervello, risvegliando il pensiero e la memoria (sec. XVIII, Lemery).
piperita – per il sapore piccante, dal latino piperatus (col nome di piperita viene volgarmente indicato il Lepidium latifolium L. (Crucifere), col quale non va confusa) .
Nomi volgari – Menta pepe, piperita, piperina, viperina (tosc.), pipirita (lig.), erba diaoluna (lom.), menta da diavoloni (ven.) – (diavoloni o pasticche a base di essenza di menta, che si ritenevano afrodisiaci), ecc. – Menta napoletana (è la forma subspontanea, descritta dal Tenore nel Napoletano = Mentha neapolitana Ten.).
Pfeffermunze (ted.), the pepermint (ingl.), menthe poivrée (fr.), hortela (galiz.), menta pebrera (catal.) (spagn.), hortelaa o hortelan pimentosa (port.), borsos menta (ungh.), miàta (russo).
Habitat – Non si conosce allo stato selvaggio. Qua e là subspontanea, sfuggita alle colture. La Mentha piperita (L.) Huds. è un ibrido.
Da alcuni Autori è stata considerata una varietà della Mentha hirta Willd. (sin. M. silvestris L.); da altri, un ibrido fra la Mentha viridis e la Mentha aquatica L. o fra la Mentha viridis L. e la Mentha citrata Ehrh. (var. della M. aquatica L.).
I lavori di Bunkner, Bacon e specialmente di Schurhoff hanno confermato che la «piperita» non è una specie a se, ma un incrocio fra la Mentha aquatica L. X Mentha viridis L. L'ibrido non occupa la posizione intermedia fra le due piante. La Mentha viridis L. è pur essa un ibrido fra la Mentha silvestris L. X Mentha rotundifolia L.; perciò la «piperita» è un triplice ibrido Mentha silvestris X Mentha rotundifolia X Mentha aquatica.
Non fu conosciuta se non dopo la fine del sec. XVII.
Nel 1696 il botanico inglese John Ray ricevette dalla contea di Herfordshire (Inghilterra del sud) un esemplare apparso nelle colture di Mentha viridis L., avente caratteri diversi. Ray la descrisse col nome di Mentha palustris Ray. Da questo esemplare (non si conoscono ancora le determinanti di questo incrocio: si tratta, probabilmente, di un fatto naturale di fecondazione incrociata entomofila (?), non del risultato d’una selezione botanica artificiale) è derivata la Mentha piperita, moltiplicata nelle coltivazioni per stoloni, essendo infeconda. Dà raramente dei semi: ma sterili. Se, eccezionalmente, germinano, non danno mai la pianta d’origine. Coltivata dal 1750 in Inghilterra [Mitcham (Surrey), Market – Dee ping, Hitchin, Wisbeach]; del 1780 in Francia (Alpi Marittime, Grasse, Cannes, Villeneuve-Loubet, Basse Alpi, Barrème, Castellabe, Isère, Haute Garonne, Cher, Yonne, Oise (Ribécourt), Seine et Oise (Milly); in Germania (Palatinato, Lipsia, Thuringia, Slesia, Baviera, Baden); nell’America del nord, regioni del nord/est (Michigan, Indiana, New York), Canada (Ontario, Nuova Scozia); Belgio (Lessines), Olanda (Utrecht), Ungheria, Russia, Giappone, Australia. In Italia dal 1870 (Piemonte, prov. di Torino e Cuneo, Pancalieri, Lombriasco, Casalgrasso, Polonghera, Vigone, Carignano – Limitatamente, in prov. di Verona e Padova).
Della Mentha piperita (L.) Hds. si distinguono due forme:
a) Mentha piperita officinalis pallescens Camus (steli verdognoli, calice
pubescente, fiori bianchi = Menta bianca (White-mint).
b) Mentha piperita officinalis rubescens Camus (detta anche vulgaris) (steli bruno/rossastri, foglie con macule rosso/porpora, fiori rosso/bruni) = Menta nera (Black-mint).
La forma bianca dà un’essenza fine e delicata; la nera è più ricca di essenza, ma meno fine.
Pianta erbacea perenne.
Parti usate – Le foglie (Menthae piperitae folia F.U.).
Componenti principali
Olio essenziale 0,3-0,4% ed oltre 1% nelle foglie, secondo il grado di essiccazione (1).
Il titolo di olio essenziale varia sensibilmente nelle droghe di diversa provenienza (ved. la tabella 1).
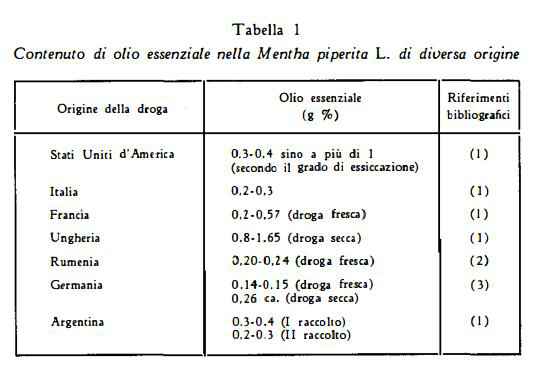
Nella Mentha piperita L. le foglie hanno il massimo contenuto di olio essenziale, ma anche la pianta ne contiene una notevole quantità secondo Blazek e Suchar (4), che hanno eseguite analisi delle foglie e della pianta in differenti stadi di crescita (ved. tab. 2). D’altra parte dai saggi, fatti da Rehfeld (5) su droghe commerciali, costituite da foglie e fusti con una percentuale di fusti variante dal 10 al 70%, è risultato un titolo di olio etereo oscillante tra lo 0,09 e l’1,78%, essendo nei fusti una bassa quantità di olio: 0,1-0,16%.
Per il contenuto di olio etereo della Mentha piperita L. sono state osservate variazioni in rapporto all’età della pianta (piante del I-II-III anno) (6), alla temperatura ambiente (7) (8), all’esposizione al sole (9). Sono state notate anche rilevanti differenze a seconda della posizione delle foglie sul fusto: risulterebbe un maggiore contenuto in quelle della parte alta dello stelo (6) (10). Mutamenti nella quantità percentuale di olio essenziale si verificano nel corso del ciclo vegetativo della pianta con valori massimi nel periodo precedente di poco la fioritura, secondo Madaus e Schindler (11), tra l’inizio della fioritura e la piena apertura dei fiori, secondo Sardanovsky (12), durante la piena fioritura, secondo Ellis e coll. (13). Comunque ai fini della scelta dell’epoca migliore per la raccolta, in pratica si ritiene che il maggiore contenuto di olio essenziale con la maggiore quantità di mentolo sia nella pianta in piena fioritura (12-14). Ellis e Gaylord (15), che hanno studiato il rapporto tra produzione di olio e contenuto di mentolo libero, hanno indicato quale periodo adatto alla raccolta quello in cui la quantità percentuale di mentolo libero nell’olio è pari o superiore al 45 %: è pressapoco a questo punto che si avrebbe anche il maggiore contenuto di olio nelle foglie.
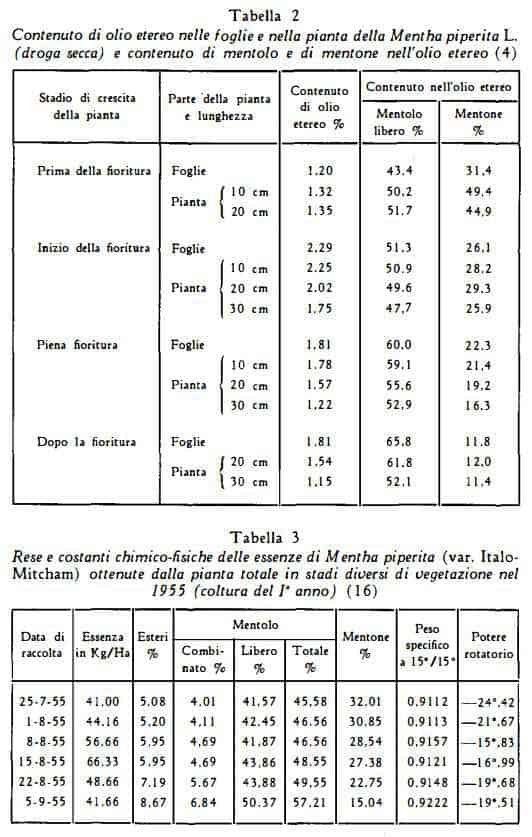
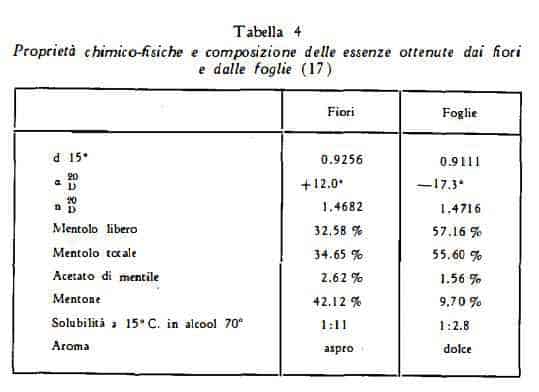
L’olio essenziale più pregiato contiene un’elevata quantità di mentolo libero ed esterificato ed un basso titolo di mentone, il quale ultimo conferisce all’olio un odore aspro. Deve contenere non meno di 50% di mentolo in base alle prescrizioni della Farmacopea Italiana, non meno di 48-50 secondo le Farmacopee estere. Il titolo di esteri, calcolati come acetato di mentile, è prescritto che sia al minimo 4-5% al massimo 21%, secondo i dati inscritti nelle Farmacopee estere.
Lo studio della composizione qualitativa dell’olio essenziale nel corso della crescita della pianta ha messo in evidenza che le foglie giovani contengono una quantità di composti insaturi più elevata che in epoca di maggiore sviluppo (17a). Negli stadi precedenti la fioritura vi è assenza di mentofurano, mentre vi è un forte contenuto di terpeni e di sesquiterpeni (18); vi è un graduale aumento del contenuto di mentolo libero e di esteri (19) e al momento della fioritura vi è una rapida formazione del mentone (18); durante la fioritura si notano un rapido aumento del contenuto di mentolo e degli esteri, una contemporanea diminuzione del mentone (19-21) e formazione del mentofurano (18), il cui contenuto è massimo in piena fioritura (14) (18) (19); con la sfioritura si hanno ancora un aumento del mentolo (15), un aumento degli esteri ed una diminuzione del mentone (18) e del mentofurano (19).
Poiché l'aumento del titolo di mentolo durante la fioritura è accompagnato da una contemporanea diminuzione del mentone, è stata avanzata l’ipotesi che il mentolo si formi a spese del mentone (22). E’ stato però successivamente dimostrato che si può avere un contemporaneo aumento del mentolo e del mentone (23) e che l’aumento del primo non è proporzionale alla diminuzione del secondo (19). Risulterebbe quindi che il mentolo ed il mentone sono entrambi sintetizzati dalla pianta, sebbene non sia da escludersi che per un processo di riduzione il mentolo possa formarsi anche dal mentone (19) (24).
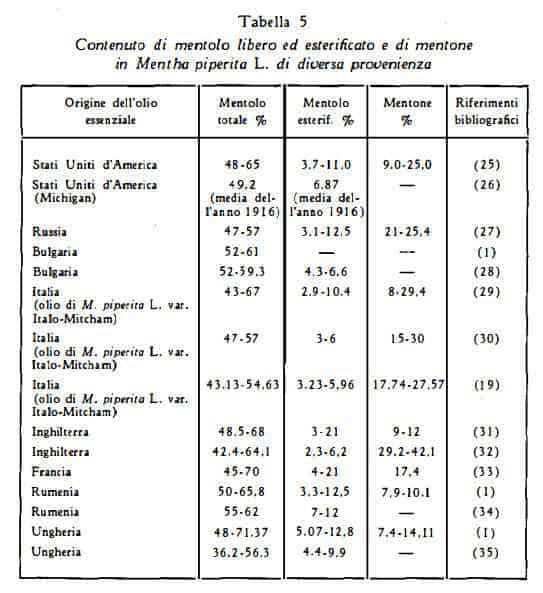
Le ricerche sulla composizione chimica dell’olio essenziale di Mentha piperita L. sono state specialmente approfondite per l’olio di provenienza americana (U.S.A.), nel quale sono stati trovati i seguenti componenti:
— l-mentolo, il principale componente, isolato da Power e Kleber (36) in forma libera e combinata come acetato, isovalerianato e come estere di un acido C8H12O2.
— d-neomentolo (37).
— l-mentone (36), d-mentone (38), un mentenone (39), un chetone (40) identificabile con l'1-p-menten-3-one (piperitone) già isolato da olio di Menta piperita giapponese.
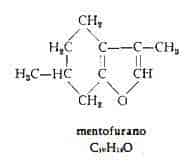
— mentofurano, isolato per la prima volta da olio essenziale di Menta italiana (ved. sotto), è stato separato anche dall’olio americano da Bedoukian (41).
— a-pinene (42), fellandrene, l-limonene (36), terpinene (38), transsabinene idrato (43).
— cadinene (44).
— cineolo (36).
— aldeidi acetica ed isovalerianica (36).
— un lattone C10H16O2 (36).
— acidi acetico e valerianico liberi e come esteri del mentolo (36).
— alcooli amilico (45) e isoamilico (46).
— solfuro di dimetile (45).
Da olio essenziale italiano è stata isolata da Carles (30) una sostanza, che non era stata in precedenza trovata nell’olio di M., sostanza che è stata poi identificata da Wienhaus e Dewein (55) (56) con il 3,6-dimetil-4,5,6,7-tetraidro-benzofurano (mentofurano), C10H14O.
Nelle frazioni ad alto punto di ebollizione di olio essenziale d’Italia, Russia, Bulgaria e d’America sono stati identificati da Schmidt (47) i seguenti costituenti:
— un acido ottilico insaturo libero ed esterificato.
— timolo.
— carvacrolo.
— mentofurano.
— alcooli sesquiterpenici, C15H26O.
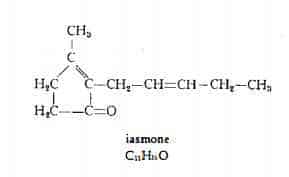
— iasmone.
— un chetone sesquiterpenico.
— un sesquiterpene biciclico C15H24.
— l-cariofillene.
— cineolo.
Nell’olio ottenuto per ridistillazione (coobazione) delle acque distillate Kremers (48) ha identificato come principale componente il mentolo ed inoltre 3-metil-1-cicloesanone, pulegone e piperitone.
Nell’olio essenziale di Menta d’Inghilterra sono stati trovati i seguenti
composti:
— mentolo libero e come acetato e isovalerianato, fellandrene (49), pinene (?), limonene (?), probabilmente cadinene (50).
Nell’olio essenziale di Francia:
— l-mentolo, d-mentone, esteri degli acidi acetico e valerianico, cineolo, l-a-pinene, 3-p-mentene (?), alcool isoamilico e aldeide isovalerianica (51) (52).
Nell’olio essenziale di Russia:
— mentolo libero ed esterificato con gli acidi acetico e valerianico, d– e l-mentone (53), cineolo, dl-pinene, dipentene (54), l-limonene (53), mentofurano (54).
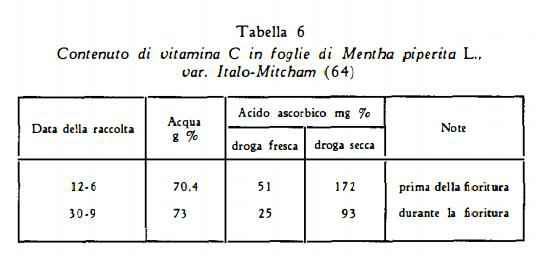
Oltre all’olio essenziale nelle foglie di Mentha piperita L. sono stati trovati gli acidi piruvico e chetoglutarico (57); ossidasi, perossidasi in un primo tempo in piccole quantità; il contenuto di questi enzimi aumenta poi nel periodo della formazione dei fiori (58) (59) e diminuisce durante la fioritura (59): polifenolossidasi (60) (61): vitamina C. il cui contenuto diminuisce durante la fioritura (ved. tabella 6) (62): gli acidi clorogenico, caffeico, ferulico e p-cumarico (63); 3,5-4,5% di un complesso polifenolico (64), che è stato dapprima considerato come tannino ed in seguito come composto di acido caffeico e di un ossiacido.
Nel succo della pianta con prove microbiologiche si è rilevata la presenza di sostanze antibiotiche (fitoncidi), la cui attività è solo in parte alterata, se si sottopone il succo ad essiccazione (65).
Proprietà farmacologiche ed impiego terapeutico
La Menta va annoverata fra quelle droghe le cui proprietà terapeutiche sono conosciute sin dalla più lontana antichità. Questa droga era nota nell’antica medicina indiana, cinese ed egiziana e di essa si trova menzione nel Papiro di Ebers (1550 a.C.). Nota e molto usata era anche nella medicina greco-romana. Ippocrate attribuiva già alla Menta proprietà stomachiche e diuretiche e da Dioscoride, da Teofrasto, da Galeno, da Plinio, da Ovidio, da Celso e da tutti i maggiori fitoiatri dell’antichità classica, era tenuta in considerazione di prezioso rimedio.
La Menta va annoverata anche fra quelle droghe la cui coltura venne resa obbligatoria dal Capitulare di Carlo Magno, ma occorre ricordare che la Menta degli antichi non corrisponde esattamente all’attuale Mentha piperita var. officinalis, la quale è un ibrido ottenuto nelle colture inglesi iniziate intorno al 1750 e diffuso in seguito nel resto dell’Europa, in America e in Giappone.
La Menta deve la sua attività farmacologica e terapeutica principalmente al suo olio essenziale ed alle sostanze che entrano nella sua composizione. Ad essa vengono attribuite proprietà tonico-eupeptiche, leggermente analgesiche e carminative, utili in alcuni stati di atonia del tubo digerente, specie se associata ad altri farmaci dotati di analoghe proprietà. Usata anche per combattere la nausea e, in alcuni casi, come spasmolitico gastro-intestinale.
Chabrol e coll. (66) trovarono che gli estratti di Menta sono dotati di spiccata attività colagoga ciò che venne notato sperimentalmente anche da Steinmetzer (67) sui cani, nei quali notò che alla somministrazione di Menta, sotto forma di infuso, seguiva un aumento del flusso biliare che poteva aumentare sino a 9 volte il valore iniziale.
Per il suo odore e per il suo sapore particolarmente gradevoli, la Menta è molto usata nella tecnica galenica come correttivo di preparati contenenti antibiotici, antistaminici, preparati di calcio, di ferro, derivati della piperazina, sulfamidici, reserpina, glicocolla, vitamine, urea, uretano, idrato di cloralio, paraldeide, jodoformio, formaldeide, salicilato di metile, salolo; estratti di Camomilla, di Coloquintide, di Digitale, di Frangola, di Hamamelis, di Idraste, di Ipecacuana, di Podofillo, di Rabarbaro, di Ratania, di Salicaria, di Scilla, di Sena, di Tormentilla; polveri adsorbenti, antiulcera, preparati odontoiatrici, preparati contro la tosse, sostanze di sapore metallico, alcalino, bruciante; sostanze saline e amaro-saline (68).
L’olio essenziale, secondo Lesieur (69) sarebbe dotato di un’azione eccitostupefacente a dosi elevate, ma a dosi terapeutiche, le sue caratteristiche di attività corrispondono in linea di massima, a quelle del mentolo che rappresenta il suo principale costituente. Tuttavia, per uso interno, l’olio essenziale è preferito al mentolo perchè meglio tollerato dalle mucose del tubo digerente. Analogamente ai preparati della droga, l'olio essenziale viene impiegato come ottimo carminativo [Sapoznik (70)], come stimolante della motilità gastro-intestinale, come antinausea e antiemetico e come blando analgesico in alcune gastralgie [Tukakov (71) ed altri].
Secondo Van Liere e Northrup (72) esso non sarebbe però dotato di alcuna rilevabile azione sul tempo di vuotamento dello stomaco.
Da Heinz (73) l’olio essenziale è considerato un ottimo colagogo e ne consiglia l’uso anche nelle colelitiasi. Pater (74) e Kuhn (75), come già Chabrol e coll., avrebbero constatato la stessa attività nei preparati della droga.
Per applicazioni locali, l’olio essenziale in soluzione allo 0,5-1 % in olio di olive, è usato nella corizza; incorporato in pastiglie trova impiego come antisettico del cavo orofaringeo ed anche per correggere il cattivo odore dell’alito.
Secondo Wegener (76), vaporizzazioni di olio essenziale di Menta, aspirate attraverso le narici (chiudendo gli occhi al fine di evitare irritazione congiuntivale), possono risolvere alcuni stati infiammatori dei seni frontali.
Internamente si usa incorporato con lo zucchero, sotto forma di spirito di Menta o in soluzione o dispersione acquosa.
Nella tecnica galenica l'olio essenziale è impiegato, analogamente ai preparati della droga, come correttivo nei casi anzidetti.
Il mentolo applicato localmente sulla cute e sulle mucose determina eccitazione delle terminazioni nervose sensibili al freddo [Goldscheider (77)] e di quelle sensitive che vengono successivamente paralizzate. Ne consegue senso di freddo limitato al punto di applicazione e anestesia locale più o meno completa e della stessa azione sarebbero dotati tutti gli isomeri del mentolo [Macht (78)]. Castagna (79) notò un’azione paralizzante anche sulla sensibilità gustativa.
Il mentolo è poco solubile in acqua, tuttavia le sue soluzioni sature, per quanto diluite (1:1200 circa), sono dotate di proprietà antisettiche superiori a quelle del fenolo [Gerschenfeld e Muller (80)]. Secondo Zeeti (81), il mentolo manifesterebbe un effetto batteriostatico selettivo verso alcune specie di Brucella. Esso inibisce la crescita del B. melitensis, del B. paramelitensis e del B. suis ma non sarebbe attivo su alcun ceppo del B. abortus.
Per quanto riguarda l’attività di alcuni isomeri del mentolo, sotto questo aspetto, Wokes (82) trovò che il d-mentolo è dotato di un'attività germicida notevolmente superiore a quella del l-mentolo, mentre l’attività del dl-mentolo sarebbe intermedia.
Secondo Bliss e Glass (83), il potere raffreddante, il sapore e l’odore del l-mentolo, sarebbero invece superiori a quelli degli altri isomeri i quali inoltre, determinerebbero effetti irritanti sgradevoli.
Il mentolo somministrato internamente a dosi elevate determina negli animali inferiori, atassia, aumento della frequenza respiratoria, convulsioni e morte per asfissia. La d. m. I. sarebbe, secondo Seel (84), pari a 1 g/kg di p. c.
Nei mammiferi il mentolo determina un’azione nettamente depressiva, sino alla paralisi più o meno completa, con abolizione della sensibilità e dell’eccitabilità riflessa [Pellacani (85) ] .
La tossicità del mentolo non è però molto elevata; forti dosi possono tuttavia provocare sintomi di avvelenamento specialmente nei bambini.
Schwenkenbecher (86) riferì che avendo ingerito una dose di 8 g di mentolo, non ebbe a rilevare altro sintomo che quello che si manifestò con una sensazione di freddo.
Wetzel (87) riferì a sua volta il caso di un bambino in cui l’ingestione di un liquore di Menta contenente mentolo, determinò una intossicazione caratterizzata da dolori addominali, vomito, atassia, stupore, rossore del viso e bradipnea.
In un altro caso l’A. notò rigidità muscolare persistente per alcuni giorni.
Evidentemente, nel caso di Schwenkenbecher il mentolo, ingerito come tale, sebbene in dose molto elevata, data la sua esigua solubilità in acqua, l'assorbimento è avvenuto molto lentamente e la sua azione è stata molto blanda. Nei casi descritti dal Wetzel invece il mentolo è stato ingerito in soluzione e quindi l’azione che ne conseguì va posta in relazione con la maggior velocità con cui è avvenuto l’assorbimento.
Casi di asfissia seguiti da morte, si sono verificati per applicazioni locali di mentolo in bambini affetti da corizza [Lublinski (88)].
Rakieten e coll. (89) che studiarono l’azione tossica del mentolo su ratti esposti ai suoi vapori a diverse concentrazioni (0,078 ± 0,021, 0,148 ± 0,031, 0,259 ± 0,166 per milione) e per periodi variabili (da 75 a 79 giorni), non constatarono la comparsa di effetti tossici tali da influire sull’accrescimento, sul valore emoglobinico e sulla formula ematica. Anche i reperti istopatologici non hanno posto in evidenza alterazioni significative dei vari organi degli animali trattati, in confronto coi controlli. Raramente è stata osservata la comparsa di una con
Rakieten e Rakieten (90), trovarono successivamente che l’inalazione di vapori di mentolo nell’uomo, conduce ad una dilatazione dei vasi della mucosa nasale. Questa constatazione indusse gli AA. a studiare le variazioni della pressione eventualmente prodotte da iniezioni endovenose di mentolo negli animali da esperimento. Essi poterono così constatare che la dose di 25 mg/kg di mentolo, disciolto in glicole propilenico e iniettata nella femorale, determina nei gatti e nei conigli, una caduta della pressione e che il mentolo, iniettato insieme con la nicotina, ne blocca completamente l’azione vasocostrittrice, ove la dose del mentolo sia di 40-80 volte superiore a quella della nicotina. Dosi inferiori di mentolo determinano soltanto una parziale riduzione dell'azione vasocostrittrice nicotinica.
Abbiamo accennato precedentemente agli usi terapeutici del mentolo, aggiungeremo ora che questa sostanza trova vasto impiego in dermatologia come antipruriginoso, come deodorante e come energico antisettico (specialmente in soluzione alcoolica), nelle infiammazioni superficiali, casi nei quali si usa in soluzioni, lozioni idroalcooliche o alcooliche dal 0,25 all’1 % o anche al 10-50% in soluzione eterea per applicazioni locali ripetute 2-3 volte al giorno nelle infiammazioni superficiali. Oppure in pomate o creme (0,25-1%) o anche sotto forma di matite nelle nevralgie superficiali.
In soluzione all’1-2% per inalazioni, è impiegato come antisettico, analgesico e decongestionante in alcune affezioni della mucosa nasale e delle prime vie respiratorie, casi nei quali viene associato anche a sostanze vasocostrittrici.
Internamente trova impiego come antiemetico ed anche come antisettico intestinale.
La somministrazione di preparati a base di Menta può provocare, secondo Meyer e coll. (91), sia su soggetti normali che in quelli portatori di ulcera gastrica o duodenale, un aumento della secrezione cloridrica, ma non sembra che di questa azione sia responsabile il mentolo.
L’azione biologica dell'olio essenziale e di diversi suoi componenti (mentolo, mentone, cineolo, pulegone e metilisovalerianato), è stata studiata dal Dinkler (92), il quale determinò la loro tossicità e la loro azione sulla fibra muscolare liscia.
Il mentolo è eliminato attraverso l’emuntorio renale e lo si ritrova nelle urine accoppiato con l’acido glucuronico.
Estratti e preparati vari
a) Estratto fluido (g 1 = LIII gtt.)
Dosi: g 1-2 o più pro dose.
b) Estratto fluido alcool-idrosolubile (g 1 = LIII gtt).
Dosi: come sopra.
c) Olio essenziale trirettificato.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido menta g 20
Alcool di 70° g 80
(g 5-10 pro dose).
Sciroppo
Estratto fluido menta alcool-idrosolubile g 5
Sciroppo semplice F.U. g 95
Tinture eupeptiche
Estratto fluido menta g 20
Estratto fluido maggiorana g 20
Estratto fluido limone g 55
Alcool di 70° g 55
(gtt XL-L pro dose).
Estratto fluido menta g 10
Estratto fluido angelica
Estratto fluido assenzio ana g 2
Estratto fluido calamo aromatico g 8
Alcool di 70°
Glicerina ana g 15
(gtt XL-L pro dose).
BIBLIOGRAFIA
(1) GUENTHER E., The Esscntial Oils, 1949, voi. Ili, pp. 586-640 – (2) KOPP, Fharm. Zentralh., 71, 577, 1930 – (3) SCHIMMEL, Ber. Schimmel, 66, 1939 – (4) BLAZER L. e SUCHAR A., Pharmazie, II. 671, 1956 – (5) REHFELD L., Pharmazie. IO, 118, 1955 – (6) BORKOWSKI B. e SUCHOCKA H., Disserl. Pharm.. 8, 181, 1956; Chem. Abs., 51, 29531, 1957 – (7) BORKOWSKI B. e CHOCHLEW L, Biul. insl. roslin Ceczrticzycb, 3, 123, 1957; Dtsch. Ap. Ztg.. 100, 398, 1960 – (8) MIKHALOV, Masìoboino Zhirovoe Deio. n. 11, 63, 1929; Chim. Ind., 23, 1225, 1930; Chem. Abs.. 25. 4086, 1931 – (9) SOBOLEVSKAYA, Trans. Sci. Chem. Pharm. Inst. Moscove. 19. 194, 1928; Ber. Schimmel, 159, 1929 – (10) GRAHLE A., Pharmazie, 10, 494, 1955 – (11) MADAUS G. e SCHINDLER H., Arch. Pharm., 285, 1936 – (12) SAR- DANOVSKY, Farm. Zhurn., 18, 1929; Chem. Abs., 25. 4577, 1931 – (13) ELLIS, FAWCETT, GAYLORD e BALDINGER, A Sludy of Some Faclors Affecting thè Veld and Market Value o( Peppermint Oli, Purdue Univ., Agr. Expt. Sta., Lajayette, Indiana, Ball. n. 461, 1941 – (14) WATSON V. K. e JOHN I. L. ST, J. Agr. Food Chem.. 3, 1033, 1955 – (15) ELLIS e GAYLORD, Proc. Am. Soc. Mori. Sci., 45, 451, 1944 – (16) BOITA A. e MORASSUTrI BOTTA M,, Rii'. Hai. ess. prò/., 39, 466, 1957 – (17) SACCO T„ Riv. ir. ess. prò/., 33, 387, 1951 – (17a) HEFENDEHL K. W„ Pianta Med., 10, 241, 1962 – (18) DE SEGURA S„ CABRERÀ C. F. e GUZMAN E., Riv. Hai. ess. prò/., 38, 10, 1956 – (19) BOTIA A„ e BOTTA M, M„ Riv, imi. ess. prò!., 37. 383, 1955; 39, 466, 1957 – (20) RUTOVSKI e TRADIN, RiechstoB Ind., 4. 124, 1929 – (21) LA FACE D„ Boll. U§. Staz. Sper. Reggio Calabria, 21, 69, 1951 – (22) KLEBER Ber. Schimmel, 79, aprile 1914 – (23) SACCO T., Riv, II. ess. prof., 33. 214, 1951 – (24) BALDINGER, Ind. Eng. Chem., Anal. Ed., 14. 15, 1942 – (25) GILDEMEISTER e HOFFMANN, Die Aelherischen Oele, HI ed., voi. Ili, 820 – (26) Ber. Schimmel, 1920, 43 – (27) GILDEMEISTER e HOFFMANN, Die Aethe-
rischen Oele, III ed„ voi, HI, 854 – (28) SIMMONS', Per/um. Essenl. Oli Record.. 31, 92, 1940 – (29)
GILDEMEISTER e HOFFMANN, Die Aelherischen Oele, III ed,, voi. III, 850 – (30) CARLES, La Menthe et ses plantations, Pancalieri; Guenther E., loc, cit. (1) – (31) GILDEMEISTER e HOFFMANN, Die Aelherischen Oele, III ed„ voi. Ili, 844 – (32) PARRY e FURGUSON, Chem. Drugg., 124, 37, 1936 – (33) GILDEMEISTER e HOFFMANN, Die Aelherischen Oele, III ed,, voi. III, 847 – (34) STRAUSZ, IW Congrés Inler. de.s Planies Medie, et des Planles à Essences, Paris 1931, 270; Ber. Schimmel, 49, 1933 –
(35) ROM, KisMelUgyi Kòzieménrek, 42, 93, 1939; Chem. Abs., 33, 7485, 1939 – (36) POWER e KLEBER, Pharm. Rundschau. Sew York. 12, 157, 1894 – (37) SCHMIDT H., Chem. Zbì., II, 148, 1951 – (38)
GORDON, Amer. J. Pharm.. 99. 523, 1927 – (39) KREMERS, Amer. J. Pharm., 97, 663, 1925 – (40)
KREMERS, Amer. 2. Pharm., 97, 660, 1925 – (41) BEDOUKIAN, Ber., SO. 538, 1947 – (42) Ber. Schimmel., aprile 1894, 42 – (43) DALY J, W„ GREEN F. C, e EASTMAN R, H., J. Am. Chem. Soc., 80, 6330, 1958; Chem. Abs., 53, 16195b, 1959 – (44) HALSEY. Proc. Wisconsin Pharm. Ass., 90, 1893 – (45) Ber. Schimmel, ottobre 1896, p, 61 – (46) GORDON, J.A.Ph.A., 16, 130, 1927 – (47) SCHMIDT, J.A.Ph.A., 10, 835, 1921; J, Bici, Chem., 52, 443, 1922; Am. 1 Pharm., 97, 658, 1925 – (48) KREMERS, J.A.Ph.A., 10. 835, 1921 – (49) UMNEY, Pharm. J., 56, 123, 1896; 57, 103, 1896 – (50) FLUECKIGER e POWER, Pharm. J., Il, 220, I8B0; Arch. Pharm., 218. 222, 1881 – (51) Repts. Roure-Bertrand Fits, marzo 1900, 17; CHARABOT, Bull. Soc. Chim., 19, 117. 1898 – (52) Repts. Roure-Berirand Flit, 40. 909; GILDEMEISTER e HOFFMANN. Die Aetherisehen Ode. Ili ed., voi. III. p. 848 – (53) ANDRES e ANDREEF. Ber., 25. 609. 1892 – (54) SCHINDELMEISER. Apolh. Z., 21, 927, 1906 – (55) WIENHAUS H. e DEWEIN H.. Z. angew. Chem., 47, 415. 1934 – (56) WIENHAUS H, e DEWEIN H.. Ber., 91, 256. 1958; Chem. Abs., 52, 12804 i, 1958 – (57) TOWERS G. H. N., THOMPSON J. F. e STEWARD F. C., J. Am. Chem. Soc., 76, 2392. 1954 . (58) BROOKS, J. Am. Chem. Soc., 34, 67. 1912 – (59) GORDON, Bolan. Gk., SS, 110, 221. 1928 – (60) PSHENOVA K. V., Blokhimlya, 21, 279, 1956; Chem. Abs., 50, 15754h, 1956 – (61) HERRMANN K„ Pharmazie, S, 853, 1953 – (62) GUENTHER E., HEEGER E. F. e ROSENTHAL C„ Pharmazie, 7, 24, 1952 – (63) HERRMANN K., Pharmazie, 11, 356. 1956; 13, 268, 1958 – (64) HERRMANN
K., Arch. Pharm., 192, 325, 1959; 193, 1043, 1960 – (65) ROSENFELD L. I. e CHAZANOWITSCH R. L.. Apiechnoe Deio, 7, 22, 1958; Disch. Ap. Zig., 100, 161, 1960 – (66) CHABROL E., CHARONNAT R., MAXIMIN M. e BUSSON A., Comp. rend. soc. blol., 109, 275, 1932 – (67) STEINMETZER W„ KUn. fVoch., n. 49, 50, 1962 – (68) CAPRA C., Il Farmaco, 13, 10. 499, 1958 – (69) LESIEUR, cit. da PIC A. e BONNAMOUR S. in Phytothérapie Médicaments Vesetaux. Bailliére – Paria 1923, p. 515 – (70) SAPOZNIK, J.A.M.A., 104. 1792. 1935 – (71) TUCAKOV J., Am. Perlumer Aroma!., 75, n. 6. 85. 1960 . (72) VAN LIERE e NORTHRUP, 1. Pharmacol. exp. Ther., 76, 38. 1942 – (73) HEINZ, Therap. Halbmonaish., Aprile, 1. 1920 – (74) PETER, Pharm. Zeruralh.. n. 51. 1922 – (75) KUHN R„ Forischr. d. Med., 8, 921. 1920 – (76) WEGENER G. G.. Disch. Hellpfianzen, p. 51. 1937 – (77) GOLDSCHEIDER, Ceniralbl. Med. msseasch., 1886 – (78) MACHT, Arch. ìniera. pharmacod. ei de thér., 63, 43, 1939 – (79) CASTAGNA S, Studi Sassaresi, 2. 2, 1924 – (80) GERSCHENFELD e MULLER, Am. 1. Pharm., 105, 490. 1933 – (81) ZEETI R., Boll. Isl. Sleroier. Mi!., 18. 140. 1939 – (82) WOKES, Quarl. J. Pharm. Pharmacol., 5, 233, 1932 – (83) BLISS e GLASS, J.A.Ph.A., 29. 171. 1940 – (84) SEEL, Arch. exp. Path. u. Pharmakol.. 122, 338, 1927 – (85) PELLACANI P., cil. da Simon J. in Farmacologìa U.T.E.T,, 1930, p. 619 – (86) SCHWENKENBECHER, Mùnch. med. IFoch., 1908 – (87) WETZEL, Arch. /. Kinderheilk., 129, 74. 1943 – (88) LUBLINSKI, Beri. KUn. Woch., 49, 1912 – (89) RAKIETEN N„ RAKIETEN M. L. e BOYKIN M., l.A.Ph.A., 43, 390, 1954 – (90) RAKIETEN N. e RAKIETEN M. L.. l.A Ph.A., 46, 82, 1957 – (91) MEYER J„ SCHEMAN L. e NECHELES H„ Centralbl. /fin, Med., n. 10, 186, 1936 – (92) DINKLER. Pharm. Zentralh., 77, 281, 1936.


