Uva Ursina
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Arctostaphylos Uva-Ursi (Adans.) Spreng. – Fam. Ericacee/Arbutee) (Sin. – Arbutus Uva-Ursi L. – Uva-Ursi procumbens Moench. – Arbutus officmalis Wim. et Grab. – Mairania Uva-Ursi Desvaux)
Uva Ursina- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Arctostaphylos Uva-Ursi, dal greco artos = orso e stafulh = uva, cioè uva dell’orso; in latino: uva ursi.
Arbutus – Nome usato da Virgilio (Georg. II, 69), dal celtico arbois = frutto verrucoso, per indicare il Corbezzolo (Arbutus Unedo L.) – Secondo altri da arbor, diminutivo = piccolo albero.
procumbens – che sta rasente a terra.
Mairania – dedicato a Maire, botanico parigino del XIX sec. (1840).
Nomi volgari – Numerosi. Uva d’orso (tosc.), uga d’ursu (lig.), uva d’I ours, ughetta, orsella, pan de feino, buseròla (piem.), coccola, laorina, farinello (lomb.), martilari, azaròla, bus, gransier, brusies, luz, stornele (ven.), ova orseina (emil.), uva della Madonna o selvaggia (abr.), uva S. Giovanni (nap.), uva ursi (sic.), martel, zate d’ors (trentino).
Barentraube (ted.), bears whortleberry (ingl.), bousserole, raisin d’ours (fr.), gayuba, galluvera, aguavilla, uvas de oso, buxerola, ecc. (spagn.), uva de urso (port.), borowka (pol.), orvosi medveszòlò (ungh.).
Habitat – Quasi tutta l’Europa, Asia settentrionale e temperata, America del nord. Nei boschi di conifere, sui pendii scoperti, sulle rocce delle alte montagne. In Italia, nei pascoli asciutti, luoghi petrosi e solatii, nei boschi radi e asciutti di Pinacee, al margine dei boschi, sui terreni di riporto e sul pietrisco, della zona submontana e montana. Alpi, Appennini (sino a 2780 m. sm,).
Piccolo arboscello sempre verde (15-20 cm.) cespuglioso, prostrato, con rami ascendenti. I cauli striscianti possono raggiungere 1 m. e più.
La pianta, Uva Ursina vera (drupe rosso scarlatte), non va confusa con la congenere Arctostaphylos alpina Spreng. – Uva ursina falsa (drupa rossa, se acerba; nero-azzurra a maturazione).
Parti usate – Le foglie (Uvae Ursi folia F.U.).
Sofisticazioni – Spesso mescolate foglie di Mirtillo e di Bosso.
Componenti principali
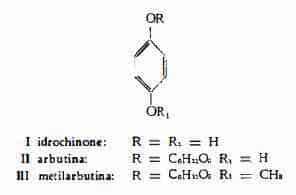
I glucosidi idrochinonici arbutina (1-12) e metilarbutina (6) (7) (13-17), i derivati triterpenici acido ursolico (18-52) e uvaolo (49) (51) (53) (54), i flavonoidi isoquercitrina (55) e iperina (56) (57) e tannini (6a) (10) (58) (59).
Glucosidi idrochinonici
Arbutina (arbutoside, cricolina), C12H16O7, è il nome dato da Kawalier (1) al glucoside estratto dall’Arbutus Uva-Ursi L. (= Arctostaphylos Uva-Ursi Spr.). Lo stesso A. (1) ne ha ottenuta la scissione con formazione di glucosio e di «arctuvina», identificata poi da Strecker (2) all’idrochinone. Secondo Dieterle e Dorner (3), l'«ericolina», estratta da diverse Ericacee, è da considerarsi come arbutina impura.
L’arbutina è piuttosto diffusa nella famiglia delle Ericacee nei Ledum, Rhododendron, Azalea, Vaccinium, Epigaea, Gaultheria, Arbutus, Calluna, Erica; ma si trova anche nelle Saxifragacee (Bergenia sp.), nelle Rosacee (Pirus sp., Prunus sp.), nelle Papilionacee (Lathyrus niger (L.) Bernh.), nelle Proteacee (Grevillea sp., Hakea sp.) e nelle Pirolacee (Pirola sp. e Chimophila sp.) (4).
Metilarbutina (metilarbutoside), C13H18O7, isolata in un primo tempo da Schiff (13) dall’arbutina grezza, è stata poi estratta dalle foglie di diverse specie di Pirus (14) e dalle foglie dell’Arctostaphylos Uva-Ursi Spr. (6). Akhtardzhiev (6a) non ha invece trovato metilarbutina nelle foglie di Uva ursina. Hlasiwetz e Habermann (15) hanno per i primi segnalato la presenza di metilidrochinone tra i prodotti derivanti dalla scissione dei preparati di arbutina.
L’idrochinone, C6H6O2, che si può trovare libero nelle foglie (0,2% ca.) (11), molto probabilmente è soltanto un prodotto secondario, derivante dall’idrolisi dell’arbutina (12).
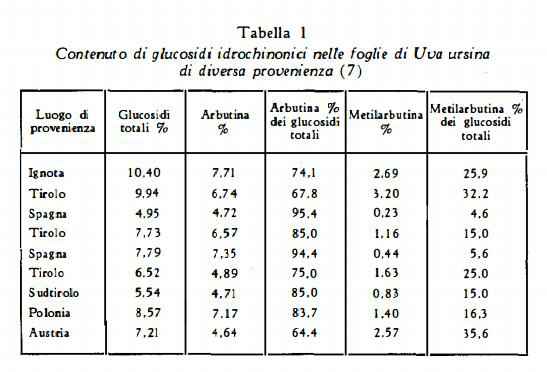
Il titolo di arbutina delle foglie secondo le analisi di Zechner (5a) oscilla tra il 5 ed il 12%. Racz e coll. (5b) ne hanno trovato dal 2,66 al 6,73% nelle foglie, 0,01-0,81% nei rami.
Il contenuto di arbutina prevale in ogni caso su quello della metilarbutina. Secondo Rosenthaler (6), esistono due gruppi di Arctostaphylos Uva-Ursi Spr., che sono diversi dal punto di vista biochimico, uno con sola arbutina, l’altro con arbutina e metilarbutina. Piccole quantità di quest’ultima sono state trovate in foglie di Arctostaphylos Uva-Ursi di Spagna (6) (7) e di Norvegia (16), mentre elevate quantità sono state notate in foglie di Uva ursina d’Austria (Tirolo) (17) (7) (tabella 1).
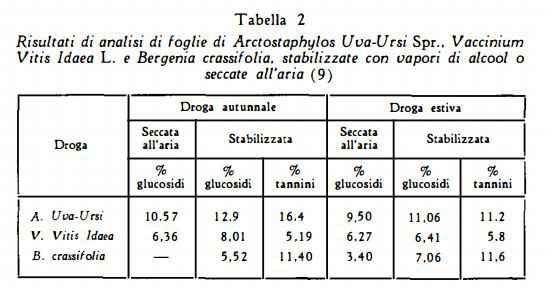
L’arbutina si trova in quantità più elevata nelle foglie rispetto ai germogli ed ai rami; nelle foglie, durante la crescita, è stato notato un aumento del 50% del titolo (8). Questa constatazione conferma perciò l’opportunità di raccogliere le foglie a stagione avanzata, cioè in autunno, come è stato consigliato da Weisflog e Buchi (9).
Perdite di glucosidi si verificano per le foglie non stabilizzate, come si nota confrontando i dati della tabella 2 (9). Tuttavia è stata anche riconosciuta la relativa stabilità dell’arbutina nelle foglie di Uva ursina per l’azione inibitrice, che i tannini, presenti in quantità elevate (7-19%), esplicano verso l’azione idrolizzante della b-glucosidasi (10).
Acido ursolico e uvaolo
Acido ursolico (ursone, prunolo, malolo, masterina), C30H48O3, fu estratto per la prima volta dalle foglie dell’Arctostaphylos Uva-Ursi Spr. e fu denominato «ursone» da Trommsdorf (18) sin dal 1854. Con il nome di «prunolo» è stato ottenuto dalle foglie del Prunus serotina (Rosacee) (19), con quello di «malolo» dalla cera del Pyrus malus (Rosacee) (20); con la denominazione di acido ursolico fu definitivamente designato da Van der Haar (21), che riconobbe il malolo ed il prunolo identici all’ursone di Trommsdorf (18). All’acido ursolico è stata pure identificata la «masterina» (22), isolata dalle foglie dell’llex paraguariensis St. Hil. (Maté) (23).
Secondo le odierne conoscenze, l’acido ursolico è il più diffuso dei derivati triterpenici nel campo vegetale. Specialmente numerose sono le referenze circa la sua presenza, sia nelle Ericacee – nelle foglie del Rhododendron hymenanthes (24), nella cuticola del frutto dell’Oxycoccos macrocarpa Pers. (25), nell'Epigaea asiatica Swartz. (26), nella Kalmia angustifolia L. (27) e nelle foglie dell'Arbutus unedo L. (28) -, sia nelle Labiate – Thymus vulgaris L. (29), Salvia officinalis L. (30), S. sclarea L., S. praltensis L., Teucrium scorodonia L., Clinopodium volgare L. (31), Hyssopus officinalis L., Lavandola spica L. (32), L. vera DC. (31), Marrubium vulgare L., Mentha piperita Hudson., Origanum majorana L., Rosmarinos officinalis L., Satoreja hortensis L. (32) e Leonurus cardiaca L. (33) – E' stato trovato inoltre in diverse specie di Ilex (34) (35); in Solanacee – Duboisia sp. (36) (37) e Anthocercis sp. (38) – ; in Oleacee – Chionanthus virginica L., Forsythia viridissima Lindl., Fraxinus excelsior L., Fraxinus Ornos L., Jasminum sp., Ligustrum sp., Osmanthus fragrans Thumb., Phillyrea sp., Syringa sp., (39) – ; in Apocinacee – Amsonia Tabernaemontana Walt., Holarrhena africana A. DC., Pleioceras Barteri Baill., Raowolfia vomitoria Afz., Thevetia neriifolia Juss., Vinca major L. (40); in numerose Rosacee – Pirus communis L. (41 ), Prunus avium (L.) Desf. (42), P. laurocerasus L., P. Mahaleb L., P. pados L. (43), Crataegus sp. (44-47), Agrimonia Eupatoria L., Cotoneaster vulgaris Lindl., Cydonia vulgaris L., Fragaria vesca L., Kerria japonica DC., Mespilus germanica L., Potentilla fruticosa L., P. recta L., Rhodotypos Kerrioides Sieb. et Zucc., Rosa centifolia L., R. gallica L., Rubus odoratus L., Sanguisorba officinalis L., Spiraea Aruncus L., S. Filipendola L., S. Ulmaria L. (43).
Uvaolo, C30H50O2, è Stato ottenuto da Huzii e Osumi (53) nel 1939 dalle foglie di Arctostaphylos Uva-Ursi Spr. Secondo segnalazione di Orr, Parks, Dunker e Ubl (49), pubblicata nel 1945, già nel 1938 Parks (54) avrebbe estratto uvaolo dalle foglie di Uva ursina.
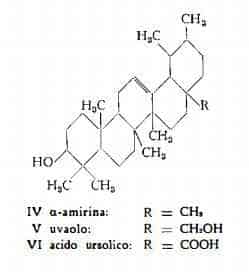
Dopo i lavori di Goodson (48), che ottenne la trasformazione dell’acido ursolico in a-amirina, e dopo le ricerche di Orr, Parks, Dunker e Ubi (49), che hanno preparato l’uvaolo per riduzione dell’acido ursolico, e di Huzii e Osumi (53), che hanno stabilito nell’uvaolo la presenza di un gruppo —CH2OH in luogo del gruppo —COOH dell’acido ursolico, seguirono gli studi di Ruzicka e coll. (50) (51), che giunsero a definire la posizione 17 per i suddetti gruppi funzionali. Pertanto alle due sostanze sono state assegnate le formule strutturali V e VI rispettivamente.
L’acido ursolico è stato trovato in quantità variabili dallo 0,4 allo 0,75% nelle foglie secche (52).
Flavonoidi
Glucosidi della quercetina, cioè isoquercitrina ed iperina, sono stati estratti dalle foglie. L’isoquercitrina è stata isolata nelle proporzioni dello 0,8-1% da Nakamura e coll. (55) e l’iperina nella quantità dell’1,27% da Borkowski (56) (57).
Il contenuto di flavonoidi totali fu trovato da Davidek (60) pari al 4,32% e da Borkowski e coll. (56) (57) all’1,57%.
Tannino
Tannino è presente in quantità elevate, 9,5-17,27%, secondo i dati pubblicati da Moritz (58) e 7-19%, secondo le referenze di Friedrich (10); 17,1% secondo Akhtardzhiev (6a).
Il tannino, isolato dalle foglie in forma purificata, è di tipo pirogallico. Sottoposto ad idrolisi con acido solforico a caldo per 48 h, esso ha prodotto 84-85,8 % di acido gallico, 3,7-4,3 % di acido ellagico e 19,6-21 % di glucosio (59).
Altri componenti
Acido chinico 0,169%, acido formico (tracce), acqua 45,3% nelle foglie fresche (9), 6,64-8,7% in media 7,43% nelle foglie essiccate all’aria (61). Ceneri 3% ca. (62). Boro mg 5,07% nelle foglie secche (63).
Proprietà farmacologiche ed impiego terapeutico
Le proprietà terapeutiche dell’Uva ursina sarebbero state descritte per la prima volta dal Clusio, secondo Dezani (64) o dal Wales secondo Kreitmair (65). I risultati delle prime prove cliniche vennero però riferiti soltanto nel 1758 da de Haen (66) il quale affermò che l’Uva ursina è il miglior rimedio nella terapia di tutte le infezioni suppurative delle vie urinarie.
Alcuni anni dopo (1764) Murray (67) attribuì alla droga anche proprietà litontriche, facendo però contemporaneamente notare che la sua azione è nulla allorché la presenza di pus o di calcoli, abbiano prodotto fatti degenerativi.
Desessartz (68), non altrettanto convinto delle virtù curative dell’Uva ursina, espresse l’opinione che i risultati che si possono ottenere con l’impiego di questa droga, non sono poi tali da giustificare le lodi che le sono state tributate.
In Europa l’uso terapeutico dell’Uva ursina, si diffuse soltanto dopo la metà del secolo scorso, epoca in cui essa entrò a far parte dell’armamentario farmaceutico, per merito specialmente del medico francese Debout (69) il quale la riabilitò descrivendola come uno dei modificatori più attivi degli stati infiammatori mucopurulenti dell’apparato urinario.
L’Uva ursina esercita un’azione astringente dovuta all’acido tannico ed un'azione antisettica sulle mucose delle vie urinarie, dovuta ai glucosidi arbutina e metilarbutina che eliminandosi attraverso l’emuntorio renale, si scindono a contatto con le urine, dando luogo a glucosio e idrochinone [Saget e Rajat (70)]. Secondo alcuni autori però, la concentrazione dell’idrochinone che si stabilisce nelle urine dopo somministrazione dei preparati della droga, sarebbe troppo scarsa per giustificare l’azione antisettica che le viene attribuita.
Madaus e Koch (71) ritengono che l’idrochinone, in determinate condizioni, possa esercitare una buona azione antisettica. Esso sarebbe infatti molto attivo nelle urine alcaline e a basso peso specifico, mentre sarebbe inattivo nelle urine acide.
Queste conclusioni non concorderebbero però con quelle ottenute in vitro e in vivo da altri autori, tanto più che come noi stessi abbiamo osservato, sia pure in ricerche preliminari, l’idrochinone, molto probabilmente, non è l’unico principio batteriostatico contenuto nella droga (72).
Estratti acquosi di Uva ursina si sono dimostrati notevolmente attivi verso gli stafilococchi e il coli e tale attività non ha subito importanti modificazioni dopo ebollizione dell’estratto o dopo riscaldamento in autoclave a 120°, anche in soluzione acida, il che dimostrerebbe che l’attività dell’arbutina non aumenta sensibilmente dopo la sua completa scissione che certamente avviene nelle suddette condizioni. Da prove da noi eseguite risulterebbe che l’attività dell’idrochinone verso gli stafilococchi, a parità di concentrazione, è simile a quella dell’estratto acquoso della droga, mentre risultò inattivo verso i coli. Ciò farebbe logicamente presumere che l’azione batteriostatica verso questi ultimi, analogamente a quanto venne già osservato per il Vaccinium Myrtillus, sia dovuta a qualche altro componente del fitocomplesso contenuto nella droga.
La sensibilità degli stafilococchi all’idrochinone, sia in vitro che in vivo, venne più recentemente confermata da Winter e Hornbostel (73), i quali constatarono che lo Staph. aureus è inibito da una soluzione contenente 11 g di idrochinone per cc, mentre per ottenere l’inibizione di altri batteri, occorrono concentrazioni molto più elevate.
Quantità variabili di idrochinone (da 11 g a 50 g per cc) vennero trovate nelle urine di ratti e dell’uomo, dopo somministrazione di quantità variabili di un estratto di Uva ursina.
Gli AA. concludono che l’attività antibatterica non è proporzionale alla concentrazione dell’idrochinone nelle urine e che data la relativa sensibilità di molti germi all’idrochinone, l’impiego dell’Uva ursina non permette una terapia generale per le infezioni del tratto urinario.
Danilowski (74) trovò che l’idrochinone è molto attivo anche sulle amebe e sugli infusori.
Borkowski (75) ha studiato l’azione diuretica di molte droghe contenenti composti flavonici, fra le quali l’Uva ursina, nella quale i flavonoidi totali e l'iperoside sono stati trovati nelle proporzioni dell'1,5% e dell’1,3% rispettivamente.
Sperimentati sulla diuresi i preparati di Uva ursina hanno prodotto una diminuzione, piuttosto che un aumneto della secrezione urinaria.
Anche ricerche precedenti, eseguite da Hildebrandt (76) con lo scopo di controllare l'azione di alcune droghe considerate diuretiche nella medicina popolare, avevano dimostrato che l’Uva ursina non esercita alcuna azione diuretica.
L’Uva ursina è indicata nel trattamento di diverse affezioni infiammatorie delle vie urinarie (cistopieliti, cistiti catarrali e mucopurulente, uretriti, fermentazioni ammoniacali delle urine). Saget e Rajat (70) l’impiegarono con buoni risultati, nell’ipertrofia prostatica con piuria, nell’incontinenza e nella ritenzione urinaria.
Prima dell'avvento della terapia sulfamidica e antibiotica, l’Uva ursina era impiegata, sola od associata con altre droghe, nelle cistiti e nelle uretriti blenorragiche.
La somministrazione dei preparati della droga in dosi elevate, può determinare disturbi gastroenterici ed anche fenomeni di intossicazione.
L’elevato contenuto di tannini può produrre irritazione della mucosa gastrica e vomito [Eichler e Vollmer (77)].
Talvolta, in alcuni soggetti, si è osservata una forma di ipersensibilità all’Uva ursina, di tipo allergico, con sintomi di urticaria, vomito, cianosi, aritmia e dispnea [Lewin (78), Meyers (79)],
Lewin (80) descrisse un caso in cui, dopo somministrazione di una dose troppo elevata di un preparato della droga, si manifestò uno stato uremico di notevole gravità, che si protrasse per 6-7 giorni.
Estratti e preparati vari
a) Estratto fluido (g 1 = XXVIII gtt).
Dosi: g 1,5 pro dose più volte pro die.
b) Estratto molle acquoso (1 p. = 4 p. circa di droga).
Dosi; g 0,3-0,4 pro dose più volte pro die.
c) Estratto secco acquoso (1 p. = 5 p. circa di droga).
Dosi; g 0,3 pro dose più volte pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido uva ursina…………………….. g 20
Alcool di 20‘………………………………………… g 80
(a cucchiaini).
Sciroppo
Estratto fluido uva ursina g 10
Sciroppo semplice F.U. g 90
(a cucchiai)
Pozioni
1) Estratto fluido uva ursina………………………………….. g 5
Estratto fluido eucalipto………………………………………….. g 5
Tintura noce vomica…………………………………………….. g 0,5
Glicerina………………………………………………………………. g 10
Urotropina………………………………………………………………. g 3
Sciroppo semplice F.U…………………………………………. g 20
Acqua distillata…………………………………………………….. g 80
(2-3 cucchiai nelle 24 ore).
2) Estratto fluido uva ursina………………………………….. g 10
Estratto fluido mirtillo rosso…………………………………….. g 5
Estratto fluido balsamo tolù……………………………………. g 8
Urotropina………………………………………………………………. g 5
Sciroppo semplice F.U…………………………………………. g 30
Acqua distillata q.b. a………………………………………………… g 200
(2-3 cucchiai nelle 24 ore).
BIBLIOGRAFIA
(1) KAWALIER A., Ueb. Ann., S2, 241, 1852; 84, 356, 1852 – (2) STRECKER A., ibld., 107, 228, 1858 – (3) DIETERLE H. e DORNER 0„ ,4rc*. Pharm., 398, 1939 – (4) FRIEDRICH H„ Relaz. alla Deutsche Gescll. fiir Arzneipllanzenforschung und therapie in Bad Berneck, 4-7/10/1956 – (5 a) ZECHNER L„ Pharm. Monaish., 12, 5, 1931 – (5 b) RACZ G., FURI J„ KISGYORGY Z. e ILIES G., Farmacia (Bucha- rest), 9, 505, 1961; Chem. Abs., 56, 5124 b, 1962 – (6) ROSEKFHALER L., Phann. Acta Helv., 1, 147, 1926: 2, 181, 1927; 4, 55, 1929 – (6 a) AKHTARDZHIEY K., Farmalslya, lì (2), 23, 1963: Chtm. Abs., 59, 6722, 1963 – (7) KUHN e SCHAFFER, Sci pharm., 10, 47, 1939- (8) RACZ G, KOTILLA E„ KISGYORGY
L. e FUZI J., ,4rvoji Sztmle, 2, 41, 1956; Chem. Abs., 18672 f, 1958 – (9) WEISFLOG G. e BUCHI J,, Pharm. Acta Helv., 19, 433, 1944; 20, 211, 1945 – (10) FRIEDRICH H„ Arch. Pharm., 288, 583, 1955; Chem. Abs., 50, 8040 c, 1956 – (11) MEYERS, Pharm. Weekbl., 76, 1099, 19.39 – (12) FRIEDRICH H„ Pianta Med., 4, 178, 1956 – (13) SCHIFF H„ Lieb. Ann., 206, 159, 1881 – (14) BOURQUELOT E, e FICHTENHOLZ A., 1. pharm. chim., ì, 5, 1911 – (15) HLASIWETZ H. e HABERMANN J., Lieb. Ann., 177, 334, 1875 – (16)BIORN JOHANNESEN, Medd. Norsk Farm. Selskap, 18, 120, 1956: Chem. Abs., 50, 16985 8, 1956 – (17) MANNICH, Arch. Pharm., 250, 547, 1912 – (18) TROMMSDORF, ibid., 130, 273, 1854 – (19) POWER F. B. e MOORE C. W., 1. Chem. Soc.. 97, 1009, 1910 – (20) SANDO C. E., 1. Biol. Chem., 56, 457, 1923 – (21) VAN DER HAAR A. W., Ree. Trav. Chim., 43, 548, 1924 – (22) MENDIVB J. R„ J. Org. Chem., 5, 235, 1940 – (23) HAUSCHILD W., Chem. Zbl, I, 3593, 1936 – (24) KUWADA S. e MATSUKAWA T., 1. Pharm. Soc. Japan, 53, 55, 1933; 53, 129, 1933; Chem. Zbl., II, 2142, 1933 – (25) MARKLEY K. S. e SANDO C. E., /, Biol. Chem., 105, 642, 1934 – (26) FUJII K., SHIMADA N. e SASAKI F., 1. Pharm. Soc. lapan, 55, 650, 1935 – (27) JACOBS e LLOYD, dt da PAECH K. e TRACEY
M. V. in Moderne Methoden der Pflanzenanalyse, 1955, voi. Ili, p. 119 – (28) SOSA A., Bull. soc. chim. biol., 32, 344, 1950 – (29) ROWE E. J., ORR J. E., UHL A. H. e PARKS L. M., l.A.Ph.A., 38. 122, 1949 – (30) BRIESKORN C. H. e SCHLUMPRECIIT L., Arch. Pharm., 284, 239, 1951 – (31) LE MEN J. e POURRAT H., Ann. pharm. frane., H, 190, 1953 – (32) BRIESKORN C. H„ BRINER M., SCHLUMPRECHT L. e TÈBERHARDT K. H„ Arch. Pharm., 285. 290, 1952 – (33) BRIESKORN C. H., EBERHARDT K. H. e BRINER M., ibid., 286, 501, 1953 – (34) NOOYEN A. M., DIss. Leyden 1920; Pharm. IVeekbl., 57, 1128', 1920; Chem. Zbl., Ili, 932, 1920 – (35) KARIYONE T., HASHIMOTO Y. e KIGUCHI T., J. Pharm. Soc. Japan, 60, 314, 1939 – (36) TRAUTNER E, M. e NEUFELD O. E., Ausimi Chem. Inst. 1. and Proc., 14, 17, 1947 – (37) BOriOMLEY W. e WHITE D. E., Ausimi. 1. Sci. Res., A 3. 516, 1950 – (38) ANSTEE 1. R., ARTHUR H. R., BECKWITH A. L., DOUGALL D. K., JEFFERIES P. R„ MICHAEL M., WATKINS J. C. e WHITE D. E., 1. Chem. Soc., 4067, 1952 – (39) POURRAT H., LE MEN 1. e BOUSTANY N,, Ann pharm. frane-, 12, 59, 1954 – (40) LE MEN 3. e POURRAT H., ibid., 11, 449, 1953 – (41) MARKLEY K. S„ HENDRICKS S. B. e SANDO C. E., 1. Biol. Chem., Ili, 133, 1935 – (42) MARKLEY K. S. e SANDO C. E., ibid., 116, 641, 1937 – (43) LE MEN J. e POURRAT H., Ann. pharm, frane., 13, 169, 1955 – (44) ZIMMERMANN J., Helv. Chim. Acta, 27, 332, 1944 – (45) SCHINDLER H., Arch. Pharm., 284, 132, 1951 – (46) BERSTN TH. e MULLER A., Helv. Chim. Acta, 34, 1868, 1951; 35, 1891, 1952 – (47) TSCHESCHE R., HEESCH A. e FUGMANN R., Ber., 86, 826, 1953 – (48) GOODSON 5. A., 1. Chem. Soc., 999, 1938 – (49) ORR J. E., PARKS L. M., DUNKER M. F. W. e UBL A. H., J.A.Ph.A., 34, 39, 1945 – (50) DREIDING J., JEGER O, e RUZICKA L., He/v. Chim. Acta, 33, 1325, 1950 – (SI) ZURCHER A., JEGER O, e RUZICKA L., Ibld., 37, 2145, 1954 – (52) NIILO SYRJA, Suomen KemistHehti, B27, 71, 1954;Chem. Abs., 49, 15944 e, 1955 – (53) HUZII K. e OSUMI S., J. Phorm. Soc. Jflpan, 59, 176, 1939; 60, 178, 1940 – (54) PARKS L. M., Diss. Univ. of Wisconsin 1938 – (55) NAKAMURA H., OHTA T. e HUKUTI G., J. Pharm. Soc. Japon, 70, 24, 1939 – (56) BORKOWSKI B., KRUG H. e WROCINSKI T., BiuZ. Inst. Ros/ln. Lecznlceych, 6, 18, 1960; Chem. Abs., 54, 23199 c, 1960 – (57) BORKOWSKI B., Pianta Med., 8, 95, 1960 – (58) MORITZ O., Dtsch. Ap. Ztg., 53, 653, 1938 – (59) HERRMANN K., Arch. Pharm., 286, 515, 1953 – (60) DAVIDEK J. e FRAGNER J., Ceskos/ov. farm. 6, 449, 1957 – (61) KRONE, Pharmozie, 15, 503, 1960 – (62) WEHMER C., Die Pflanzenstoffe, II ed., p. 913 – (63) HIDEO KATAOKA, Ann. Rept. Tohoku Co//. Pharm., n. 3, 17, 1956; Chem. Abs., 51, 4504, 1957 – (64) DEZANI S., Trattato di Farma- cognosia, Utet, Torino 1920, p. 266 – (65) KREITMAIR H., Pharrnmie, 8, 346, 1953 – (66) DE HAEN A., cit. da LECLERC H. in Précis de Phytothérapie, Masson, Paris 1935, p. 52 – (67) MURRAY A., cit. da LECLERC H. ibid. – (68) DESESSARTZ, cit. da LESLERC H. ibid. – (69) DEBOUT, cit. da LECLERC H. Ibid. – (70) SAGET e RAJAT, cit. da LECLERC H. Ibid. – (71) MADAUS e KOCH,
Ztrchr. ges. exp. Med., 105, 679, 1939 – (72) BENIGNI R., Fito/erapio, n, 3, 1948 – (73) WINTER A. G.
e. HORNBOSTEL M., No/urwlss., 44, 379, 1957 – (74) DANILOWSKI B., Arch. exp. Po/h. u. Phormako/., 35, 105, 1895 – (75) BORKOWSKI B., P/nn/a Med., 8, 96, 1960 – (76) HILDEBRANDT F., MUnch. med. Woch., n. 49, 1999, 1936 – (77) EICHLER e VOLLMER, Fortschr. der Ther., n. 67, 317, 1939, cit. da
KREITMAIR H. in (65) – (78) LEWIN, Nebenwirkungen d. Arzneimittel. Berlin 1899, p. 573, cit. da
MA.DAUS G. in Lehrbuch der Biologischen Heilmittel, Thieme ed. Lipsia 1935, voi. III, p. 2763 – (79) MEYERS, Nederl. T. Geneesk. 1902, cit. da KREITMAIR H. in (65) – (80) LEWIN, Gifte u. Vergiftungen, Berlin 1829, p, 769, cit, da KREITMAIR H. in (65).


