Senecio o Senecione
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Senecio vulgaris L. – Fam. Composite/Senecionee)
Senecio o Senecione- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Senecio, dal latino senex = vegliardo, allusione ai capolini in frutto che diventano bianchi come la testa di un vecchio, per il pappo lungo e candido degli acheni, simile a capelli bianchi.
vulgaris – comune.
Nomi volgari – Numerosi. Peleciosa, cilicione (antiq.), erba cardellina o verzellina, erba calderugia, spellicciosa, ecc. (tosc.), selissun, erba da canarin (lig.), margrita, erbassun (piem.), fior d’ogni mese (ven.), erba cardlina (emil.), cardillo (nap.), erva di li cardiddi (sic.), erba de cardellinas, perdufexi (sard.).
Herbe au charpentier, tonte venue, senecion des oiseaux, herbe de la chardonerette (fr.), Gemeine Kreuzkraut (ted.), the common groundsel (ingl.), hierba cana (spagn.), tasneirinha (port.), przymictowe ziele (pol.), òzònséges aggófu (ungh.).
Habitat – Europa, Asia e in quasi tutto il mondo. In Italia frequentissima lungo le siepi, nei prati, negli incolti, presso le case, dal mare alla regione subalpina.
Pianta erbacea annua.
La pianta tipo ha i capolini senza linguette. Esiste una var. con rare linguette brevissime = radiatus.
Parti usate – La pianta intera, raccolta prima che si inizi la fioritura.
Componenti principali
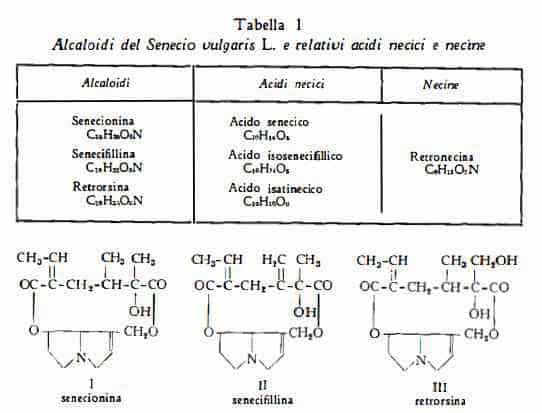
Gli alcaloidi pirrolizidinici senecionina (1-5), senecifillina (6) (7), retrorsina (8), appartenenti alla serie delle basi pirrolizidiniche. Una quarta base, senecina, è stata segnalata (1) (2), ma non è stata successivamente studiata. Più recentemente sono state estratte altre basi amorfe non identificate (8).
Come per la maggior parte degli alcaloidi dei Senecio, si tratta di esteri di alcammine, che, per idrolisi alcalina danno un’alcanolammina (necina), comune in genere a molti altri alcaloidi, ed un acido (acido necico), che invece è per lo più caratteristico per ciascuna base.
La senecionina, C18H25O5N, isolata dal Senecio vulgaris (1-5), oltre che da numerose altre specie di Senecio (9), è composta da acido senecico, C10H16O5, e da retronecina, C8H13O2N, la stessa necina componente della senecifillina e della retrorsina, gli altri due alcaloidi isolati dal Senecio vulgaris, e di numerosi altri alcaloidi delle piante del genere Senecio, (dicrotalina, echimidina, echiumina, granzianina, integerrimina, jacobina, ecc.) (10).
La struttura completa della retronecina, compresa la posizione del carbonio asimmetrico, è attualmente nota (9) (10). Si tratta della 7-b-ossi-1-ossimetil-D1-deidro-8-a-pirrolizidina. L’acido senecico, C10H16O5, è l'acido 2-ossi-3-metilept-5-ene-2,5-dicarbossilico (10). La senecionina (I) è un diestere ciclico derivante dall’unione di una molecola di acido senecico e di una molecola di retronecina, nella quale entrambi gli ossidrili sono esterificati (10) (11).
Senecifillina, C18H23O5N, estratta per la prima volta dal Senecio platyphyllus (12-14), è stata poi isolata da altre specie di Senecio (9) (10), oltre che dal Senecio vulgaris L. (6) (7). E’ il diestere ciclico dell’acido isosenecifillico (II), che per idrolisi alcalina si scinde, producendo la necina retronecina e acido senecifillico o acido isosenecifillico, C10H14O5 (14-14b). L’acido isosenecifillico è l’acido 2-ossi-3-metilenept-5-ene-2,5-dicarbossilico (15).
Retrorsina, C18H25O6N, dopo d’essere stata ottenuta dal Senecio retrorsus L. e da parecchie altre specie di Senecio (9) (10), è stata isolata più recentemente anche dal Senecio vulgaris L. (8). Per idrolisi produce una molecola di acido isatinecico ed una molecola di retronecina, corrispondendo l’alcaloide al diestere ciclico III, cioè al prodotto della combinazione di questi due composti (7). L’acido isatinecico, C10H16O6, è l’acido 1,2-diossi-3-metilept-5-ene-2,5-dicarbossilico (cis) (9) (10) (16) (17).
Il contenuto di alcaloidi del Senecio vulgaris L. è risultato variare dallo 0,053% allo 0,095% (titoli della droga secca) (18).
Sono stati inoltre trovati inulina ed una sostanza non azotata di struttura non determinata, attiva sull’utero isolato (18): azoto 4,68% nelle foglie essiccate (19); ceneri 12,21% (20).



Proprietà farmacologiche ed impiego terapeutico
Come a molte altre droghe, anche al Senecio vennero attribuite in passato, numerose proprietà terapeutiche: rinfrescante, emolliente, antispastica, antiemorragica e nel Medioevo, alcune specie di Senecio (vulgaris, jacobea) erano considerate attive perfino contro il colera, l’itterizia, la sciatica e contro numerose altre affezioni (21).
Finazzi nel 1831 (22) lo sperimentò come emmenagogo e per tale sua proprietà il Senecio venne più tardi impiegato nella terapia delle amenorree e delle dismenorree dal Murrel (23), da Bardet e Bolognesi (24), da Sigaut (25), da Dalchè (26) e da Dalchè e Heim (27), i quali ultimi trovarono una certa analogia fra l’azione emostatica del Senecio e quella dell’ergotina.
Del Senecio sono note molte specie la cui composizione chimica, notevolmente complessa e variabile, contribuisce a renderne più difficile e complicato lo studio.
In Europa viene per lo più usato il Senecio vulgaris ed anche il S. jacobea; il S. aureus è considerato officinale dal National Formulary 5a ed. (28).
Nel Sud-Africa gli indigeni usano diverse specie di Senecio nella terapia di varie affezioni [Watt e Breyer-Brandwijk (29)] ed anche nella medicina cinese il Senecio (S. campestris, S. mikaensis e S. scandeus), venne impiegato durante parecchi secoli (30).
Alcune specie sono dotate di tossicità notevolmente elevata e sono stati descritti casi di avvelenamento anche mortali del bestiame, nel Sud-Africa, nella Nuova Zelanda, nel Canada, nel Nebraska, nel Texas ed anche in Norvegia (31-33).
Le lesioni anatomo-patologiche constatate negli animali intossicati, sarebbero simili a quelle che si notano nella cirrosi epatica.
L’azione emmenagoga del Senecio venne attribuita da Wiet (34) alla senecionina, la quale agirebbe, secondo questo A., determinando una iperemia e una congestione passiva, per paralisi dei nervi vasomotori, soprattutto in quegli organi in cui questi fenomeni si manifestano periodicamente.
Secondo Leclerc (35) l'azione emmenagoga del Senecio si manifesterebbe soprattutto nelle anemiche, nelle neuroartritiche, nelle malate affette da disturbi intestinali e epatici, in cui la funzione mestruale, irregolare o insufficiente, determina frequentemente, turbe congestizie, nevralgie pelviche e lombari. In questi casi, secondo Leclerc, il Senecio si dimostrerebbe realmente efficace per ristabilire il flusso mestruale e anche, contrariamente all’opinione di altri osservatori, per calmare i fenomeni dolorosi.
La tossicologia del Senecio e di alcuni suoi alcaloidi venne studiata da diversi autori e presenta alcuni lati farmacologici e biologici interessanti.
Cushny (3) dimostrò forse per primo, che la senecifolina e la senecifolidina determinano alterazioni epatiche nel gatto e nel ratto e lo stesso Cushny in collaborazione col Watt (37), pur impiegando principi attivi non puri, dimostrarono successivamente che alcune specie di Senecio (jacobea, silvestris e vulgaris), sono tossici negli animali da esperimento.
La retrorsina studiata da Chen, Chen e Rose (38), determina degenerazione e necrosi epatica nel topo e Kochmann (39) riferì che un alcaloide grezzo isolato dal Senecio buchsii, deprime il sistema nervoso centrale della rana e l’attività motoria dell’utero isolato di cavia.
Van der Meer (18) isolò dal Senecio un principio attivo non determinato (ved. parte chimica), dotato di attività contratturante sull’utero simile a quella dovuta all’istamina, ma di questa più attiva di circa il doppio.
Chen, Harris e Rose (40) e Harris, Anderson e Chen (41), studiarono sperimentalmente la tossicità della senecifillina e della platifillina e per quanto riguarda la prima, essi trovarono che se iniettata endovena in dosi letali o subletali, determina nel topo, nel ratto e nella cavia, convulsioni toniche. L’esame necroscopico rivelò una necrosi localizzata intorno alla vena centro-lobulare del fegato, con infiltrazione di leucociti e vacuolizzazione del citoplasma delle cellule parenchimatose, lesioni queste che apparivano evidenti specialmente nel topo e nel ratto. Nel rene gli AA. notarono la comparsa di una congestione venosa glomerulare e in alcuni casi la presenza di una struttura semilunare nelle capsule glomerulari.
Sull’intestino isolato di coniglio, la senecifillina manifesta un’azione decontratturante mentre i segmenti isolati di utero di coniglia, vengono da essa contratti.
La pressione arteriosa nel gatto anestetizzato può essere talvolta aumentata dalla senecifillina.
La platifillina iniettata endovena a dosi letali o subletali, determina nei topi, nei ratti, nelle cavie e nelle scimmie, uno stato convulsivo e così pure nelle rane, allorché l’alcaloide venga iniettato nel sacco linfatico. Tale azione non è influenzata dalla decerebrazione ma non si manifesta dopo distruzione del midollo spinale.
Contrariamente a quanto è stato osservato con la senecifillina, la platifillina non produce intossicazioni mortali e non determina alterazioni epatiche e renali negli animali da esperimento, anche se somministrata a dosi molto elevate.
Gli AA. attribuiscono alla platifillina un'azione atropinosimile che si manifesta antagonizzando l’azione dell’acetilcolina, inibendo la peristalsi intestinale e determinando midriasi ma senza perdita del riflesso alla luce.
Successivamente Rose, Fink, Harris e Chen (42) hanno istituito una serie di ricerche al fine di determinare il tempo di protrombina nei ratti, dopo iniezione endovenosa di senecionina, di retrorsina, di pterofina, di spartioidina, di monocrotalina o sceleratina; inoltre, di vedere se una simile azione è posseduta dai prodotti di degradazione della retrorsina e della monocrotalina e, infine, se il menadione e altri fattori dietetici, sono capaci di antagonizzare l’ipotrombinemia prodotta dai suddetti alcaloidi. Essi hanno trovato che la senecionina, la retrorsina, la pterofina, la spartioidina e la monocrotalina, somministrate a dosi sufficienti, prolungano il tempo di protrombina nei ratti.
La retronecina, il lattone retronecico e l’acido monocrotalico, prodotti di degradazione, questi ultimi, della retrorsina e della monocrotalina, non determinano necrosi epatica nel topo e nel ratto o ipotrombinemia nel ratto. Alimentando i ratti con preparati di vitamina K o menadione, sembra che l'azione ipotrombinemica della retrorsina e della monocrotalina venga inibita.
Variazioni del contenuto proteinico nella dieta e l’addizione di lievito di birra e di estratto di fegato, non produrrebbero un effetto apprezzabile sull’azione ipotrombinemica della senecionina.
Rosenfeld e Beath (43) hanno notato che la somministrazione di un alcaloide impuro di Sencio riddelii ai topi, determina una intossicazione acuta seguita da periodi di remissione e di ritorno della sintomatologia e quindi da morte.
La dose tossica venne determinata per somministrazione per os e per via endoperitoneale.
La pianta utilizzata come alimento, determina sintomi tipici di avvelenamento cronico, simili a quelli che si osservano nel bestiame accidentalmente alimentato con Senecio.
Il residuo resinoso privato dell’alcaloide, produce turbe vascolari nel tratto intestinale con sviluppo di cangrena. L’iniezione dell’alcaloide determina una riduzione di vitamina A nel fegato.
Klein (44) avendo sperimentato l’azione di alcune frazioni grezze isolate da varie parti del Senecio, ha trovato che queste sono dotate di un effetto paralizzante sui nervi motori, di un’azione contratturante sull’utero di cavia e di un’azione digitaloidesimile sul cuore.
Schoental e Mattocks (45) hanno studiato numerosi composti, quali il cloridrato di retronecina, il sale sodico del lattone dell’acido monocrotalico, il sale sodico dell’acido tiglico, la tigliamide, il sale sodico dell’acido senecioico, la senecioamide, la butirrilretronecina, la divalerilretrocina, la diisovalerilretronecina, la ditiglioilretronecina e la disenecioilretronecina. Gli AA. hanno osservato che i diesteri sperimentati per somministrazione endoperitoneale determinano convulsioni e morte dei ratti con edema, impiegando dosi pari ad 1/5 di quelle atte a produrre gli stessi effetti se somministrati per os. Lesioni epatiche subacute e lesioni citologiche non distinguibili da quelle che compaiono dopo somministrazione degli alcaloidi naturali pirrolizidinici, sono state prodotte con i diesteri della retronecina, con l’acido tiglico e con gli acidi senecioici somministrati per OS. Le dosi sufficienti a determinare queste alterazioni erano dell’ordine di 250-500 mg/kg, più elevate quindi di quelle impiegate per gli alcaloidi naturali sufficienti a determinare gli stessi effetti.
Ciò può essere dovuto, secondo gli AA., al fatto che i prodotti di sintesi sono stati impiegati come tali e senza previa separazione degli isomeri otticamente attivi.
Le lesioni epatiche prodotte dalla diisovalerinilretronecina, alla dose di 1300 mg/kg, erano paragonabili, anche se non così evidenti, alle lesioni che compaiono nel fegato dei ratti dopo somministrazione di divalerilretronecina alla dose di 730 mg/kg.
Secondo gli AA. sembrerebbe che l’azione epatotossica di questa classe di composti, sia legata alla ramificazione della catena laterale.
Precedentemente Schoental (46) aveva osservato che la somministrazione degli alcaloidi pirrolizidinici, lasiocarpina e retrosina, a ratti femmine, ha prodotto l’avvelenamento dei piccoli ratti nutriti con il latte degli animali trattati. L’avvelenamento con lesioni epatiche e morte degli animali, è avvenuto anche quando le nutrici non avevano apparentemente subito alcun danno e neppure alcuna variazione nella produzione del latte.
Le lesioni epatiche sono state più gravi nei giovani ratti i quali sono morti all’età di 3-7 settimane. L’A. ha dimostrato che la sensibilità dei ratti alla retrosina diminuisce con l’aumentare dell’età. I lattanti sono più sensibili mentre le femmine adulte sono le più resistenti all'azione epatotossica di questi alcaloidi.
L’A. ritiene che certi disturbi epatici che si osservano nei lattanti, possono essere dovuti ad avvelenamento prodotto dal latte della madre cui siano stati somministrati medicamenti contenenti alcaloidi pirolizidinici oppure attraverso il latte di mucche che si siano cibate di piante di Senecio.
Schoental e Mage (47) osservarono poi che la presenza di lesioni epatiche subacute e croniche conseguenti alla somministrazione di determinate singole dosi di alcaloidi pirrolizidinici, eliotrina, lasiocarpina, e suoi n-ossi- di retrorsina, riddeliina e senecifìllina. La biopsia del fegato dimostrò che queste lesioni vengono provocate senza essere precedute da una necrosi zonale.
Raymond-Hamet (48) ha ripreso recentemente lo studio delle proprietà simpaticolitiche che vennero attribuite agli alcaloidi del Senecio, prima da Chen e coll. (40) e successivamente da autori russi e in particolare da Babskii e Zibert ( 49) per quanto riguarda la senecionina.
Egli ha constatato che la senecionina non ha che una piccola influenza sulla pressione arteriosa e che non modifica l’eccitabilità del moncone periferico del vago cardiaco, la quale verrebbe soltanto molto transitoriamente e parzialmente inibita, anche impiegando dosi tossiche di questo alcaloide.
L'A. si riteine quindi autorizzato a concludere che anche indipendentemente dalle lesioni epatiche che l'impiego prolungato degli alcaloidi del Senecio possono determinare nell’uomo, essi, o almeno la senecionina, non possono essere considerati come dei veri succedanei dell’atropina.
Quanto agli effetti emmenagoghi del Senecio, ammessi da alcuni autori [Sigaut (25)], essi sarebbero dovuti, secondo van der Meer(18), ad una sostanza non azotata la cui attività sull’utero sarebbe superiore a quella dell’istamina.
Estratti e preparati vari
Estratto fluido (g 1 = XXXVI gtt).
Dosi: g 2-3 pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido senecio……………………………………………….. g 20
Alcool di 20°…………………………………………………… g 80
(10-15 g pro die).
Sciroppo
Estratto fluido senecio……………………………………………….. g 5
Sciroppo semplice F.U………………………………………………. g 95
(3-4 cucchiai pro die).
Elisir
Estratto fluido senecio……………………………………………….. g 5
Elisir Garus………………………………………………………………… g 200
(a bicchierini).
BIBLIOGRAFIA
(1) GRANDVAL a. e LAJOUX H., Compt. rend., 120, 1120, 1895 – (2) GRANDVAL A. e LAJOUX H., Buli. soc. chim., 13, 942, 1895 – (3) MANSKE R. H. F., Can. J. Research, I4B, 6, 1936 _ (4) BARGER G. e BLACKIE J. J., J. Chem. Soc., 743, 1936 – (5) KONOVALOVA R. e OREKHOV A „ BuU. soc. chim., 4, 1285, 1937 • (6) ADAMS R. e GOVINDACHAR! T. R., J. Am. Chem. Soc., 71, 1956. I9s; – (7) ADAMS R. e LOOKER J. H., ihid., 7.?, 134. 1951 • (8) SHUN T., KOLUCH J. e SANTAVY F., Coliect'ion Czech. Chem. Commun., 25, 934, 1960 – (9) LEONARO N. J., in MANSKE R. H. F. e HOLMES H. L., The AlkaJoids, voi, I, 1950, pp. 108-164 – (10) LEONARD N . Jibid., voi , Il , 1960, PP- 35-141 – (11) ADAMS R. e GOVINDACHARI T. R., J. Am. Chem. So;., 71, 1953 , 1949 – (12) OREKHOV A. e TIEDEBEL W., Ber., 68. 650, 1935 – (13) OREKHOV A., KONOVALOVA R. A. e TIEDEBEL W., ibid., 68, 1886, 1935 – (14) KONOVALOVA R. A. e OREKHOV A., BuU. soc. chim., 4, 2037, 1937 – (14a) KONOWALOVA e DANILOWA, J. allg. Chem.. 18, 1198, 1948 – (14b) ADAMS R. e GOVINDACHARI T. R., J.. Am. Chem. Soc., 71, 1180, 1949 – (15) MASAMUNE S., Chem. Ind., 21, i959; Chem. Abs., 53, 15971, 1959 • (16) CHRISTIE S. M. H., KROPMAN M., LEISEGANG E. C. e WARREN F. L., J. Chem. Soc.. 1700, 1949 – (17) LEISEGANG E. C. e WARREN F. L., ibid., 702, 1950 • (18) van der MEER Y., Thése Doct. Se. Groningen 1937; Pharm. Weekbl., 75, i169, 1938 • (19) CROOK e. M. e HOLDEN M., Biochem. J., 43, 181, 1948 – (20) WEHMER C., Die Pftanzenstoffe, II ed., p. 1252 – (20a) Confr. con BOIT H., Ergebnisse der Alkaloid Chemie bis 1960, Berlin 1961, pp. 90-97 – (21) BLACKIE, Pharmaceut. J., 138, 102, 1937 – (22) FINAZZI, cit. da MADAUS in Uhrbuch der Biologischen Heilmittel G. Thieme, edit. Leipzig 1938, voi. III, p. 2528-29 – (23) MURREL W., Brit. Med. J., 1894, cit. da MADAUS I.c. (22) – (24) BARDET e BOLOGNESI, Bull. de Thcr., i896, I.c. (22) – (25) SIGAUT M., Thése Doct. Med. Se. Groningen 1896, cit. da RAYMOND-HAMET in (47) – (26) DALCHÈ, Bull. Soc. Thér., 26 ott. 1904, cit. da MADAUS I.c. (22) • (27) DALCHÈ e HEIM, Bull. Gen. de Thér., luglio 1896, idem. – (28) The National Formulary Am. Pharm. A., Mack Printing Co. Easton Pa. 5th. ed. 1926, p. 392 – (29) WATT e BREYER-BRANDWIJK, The Medicina! and Poissonous Plants of Southern Africa, E. e S. Livingstone, Edinburgh p, 198, 1932, cit. da CHEN e Coli. in (40) – (30) READ, Chincse Medicinal Plant from the Pen Ts’ao Kang mu, Peking Natural History Bulletin, Peking, China 3rd ed., p. 10, 1936 – (31) VAS ES, CANTWELL, MARTIN e KRAMER, Univ. Neb. Research Bull., 43, 1929 – (32) MAITEWS, Tex. Agric. Exper. Sta. BuU., 481, 1933 – (33) CLAWSQN, Vet. Med.. 28, 105, 1933 • (34) WIET, Union Méd. du Nord-Est 1895 – (35) LECLERC H., Précis de Phytothéraple, Masson, Paris 1935, p. 190 – (36) CUSHNY J., J. Pharmacol. exp. Ther.. 2. 531, 1910-11 • (37) CUSHNY J. e WATT, Lancet, 2, 1089, 1920 – (38) CHEN, CHEN e ROSE, J. Pharmacol. exp. Ther., 54, 299, 1935 – (39) KOCHMANN, Heil. u. Gewurz-Pftamen, 7, 132, 1924-25, cit. da CHEN e Coli. in (40) – (40) CHEN K. K., HARRIS P. N. e ROSE CH. L., J. Pharmacoi. exp. Ther., 68, 130, 1940 – (41) HARRIS P. N., ANDERSON R. C. e CHEN K. K., ibid., 75, 78 e 83, 1942; 78. 372, 1943; 79, 133, 1943 – (42) ROSE CH. L., FINK R. D., HARRIS P. N. e CHEN K. K., ibid.. 83, 265, 1945 – (43) ROSENFELD I. e BEATH O. A., Gostroenterol.. 13, 1949, riass. in Rev. de Phytothér., 17, 143, 1953 – (44) KLEIN G., Pianta Med.. 1, 88, 1953 – (45) SCHOENTAL R. e MATIOCKS A. R.. Nature, 185, 842, 1960 – (46) SCHOENTAL R., J. Phat. a. Bacterioi., 77, 485, 1950 – (47) SCHOENTAL R. e MAGE P. N., ibid.. 78, 471, 1959 • (48) RAYMOND-HAMET, Comp. rend. soc. biol., 155, 261, 1961 – (49) babskii e. B. e ZIBERT A. S., Farmakol. i Toksikol., 8, 10, 1945, cit. da RAYMOND HAMET l.c.


