Segale Cornuta o Clavice
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Claviceps purpurea Tulasne – Fam. Ifomiceti/Ascomiceti/Pirenomiceti)
Segale Cornuta o Clavice- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Claviceps, ritengo derivi da clavus-clavi = chiodo e da cespes (o caespes) = zolla, cioè sclerozio (a forma di chiodo) in funzione di zolla germinante i corpi fruttiferi a forma di chiodetti.
purpurea – per il colore rosso porporino delle capocchie (sferidii) contenenti i periteci ascofori.
Lo sclerozio è denominato Sclerotium clavus DC. – Secale cornutum Auct., dal greco sklhros = duro, secco e dal latino clavus = chiodo.
Secale – perchè lo sclerozio ricorda, deformato e ingrandito, la cariosside della Segale. La parola secale deriva da seco = taglio, dal celtico segal, da cui sega = falce e il latino seges = messi, biade; piante che si tagliano colla falce.
cornutum – per la forma a cornetto dello sclerozio.
Lo stato miceliale è denominato Sfacelia segetum Tul., dal greco sfakelos= cancrena, per la massa mucillaginosa, vischiosa, puzzolente che invade l’ovario dell'ospite (la melata).
segetum, dal latino seges, segetis = messe, seminato / gen. pl. = delle messi.
Nomi volgari – In quasi tutte le provincie italiane viene designata col nome del titolo. Il Santi propose di adottare la denominazione Clavice, generica per tutte le specie affini, del loglio, della festuca, ecc. Mal d'Ia seel (emil.), madre segal (Sondrio), mascarella (Trapani), fong de la segala (Trento).
Mutterkorn, Kornmutter, Roggenmutter, Zapfenkorn, Hungkorn (ted.), seigle ergoté, blé cornu, ergot de seigle (fr.), ergot of rye, rye smut, mother of rye, cock spur rye (ingl.), cornezuelo de centeno, nieblons, cornadillo, cornichuelo, cornichos (spagn.), esporào de centeio, cravagem de centeio, centeio espigado (port.), anyarozs (ungh.).
Habitat – In tutta l'Europa: Russia, Polonia, Estonia, Lettonia, Lituania, Germania, Austria, Spagna, Portogallo, Africa del nord, Isola di Tenerife (Canarie), Asia (India), America del sud.
In Italia ovunque si coltiva la segale, specialmente durante le annate piovose e calde, e particolarmente nelle alte valli alpine. Invade anche i seminati delle basse colline.
Fungo parassita.
Parti usate – Gli sclerozi (inodori, se freschi) (Secale cornutum F.U.).
Componenti principali
Le prime sostanze di natura alcaloidica, estratte dalla Segale cornuta, sono state l’ergotina e l’ecbolina, ottenute da Wenzell (1) (1864), e la cornutina da Kobert (2) (1884). Si trattava però di prodotti amorfi, male definiti. L’isolamento del primo alcaloide cristallino avvenne per opera di Tanret (3-5); ad esso fu dato dall’A. il nome di ergotinina. La picrosclerotina, separata in seguito da Dragendorff e Podwissotski (6), la sclerocristallina da Podwissotski (7) e la secalina da Jacoby (8) sono certamente da identificarsi con l’ergotinina di Tanret.
Una frazione amorfa, molto attiva, fu in seguito studiata e denominata ergotossina da Barger e Carr (9) (10) ed idroergotinina da Kraft (11). L’ergotossina fu poi cristallizzata da Smith e Timmis (12), che (13) nel 1931 isolarono un altro alcaloide, y-ergotinina. Intorno al 1920 Stoll (14) (15) (16) estrasse dalla Segale cornuta ergotamina ed ergotaminina e più tardi nel 1935 (17) dimostrò che la sensibamina, segnalata quale nuovo alcaloide dalla S. A. «Chinoin» e Wolf (18), era una miscela equimolecolare di ergotamina e di ergotaminina.
Un altro alcaloide, indicato in un primo tempo da Kussner (19) con il nome di ergoclavina, fu successivamente identificato con un complesso cristallino, costituito da due alcaloidi interconvertibili, ergosina ed ergosinina (20) (21).
Si era intanto notato che gli alcaloidi, isolati sino a quel punto, erano insolubili in acqua ed avevano proprietà farmacologiche diverse da quelle degli estratti acquosi, pure molto attivi (22). Queste considerazioni con-

dussero contemporaneamente, intorno al 1935, all'isolamento di un alcaloide idrosolubile, designato sotto i nomi diversi di ergometrina da Dudley e da Moir (22) (23) (24), ergobasina da Stoll (25-27), ergotocina da Kharasch e coll. (28-30) ed ergostetrina da Thompson (31). Che si trattasse di un'unica sostanza fu stabilito da Dudley (32). Il nome di ergonovina è stato proposto per questo nuovo alcaloide dal Council on Pharmacy and Chemistry della American Medical Association ed è stato adottato negli Stati Uniti d'America, mentre in Europa è stato fissato il nome di ergometrina. All’ergometrina corrisponde l'isomero ergometrinina, trovato da Smith e Timmis (33).
Successivamente Stoll e coll. (34-36) dimostrarono essere l'ergotossina di Barger e Carr (9) (10) non una sostanza unica, ma una miscela di alcaloidi. Da questa essi infatti, nel 1937, isolarono ergocristina, destrogira, (34) (35) e, nel 1943, ergocriptina ed ergocornina, convertibili rispettivamente negli alcaloidi destrogiri, ergocriptinina ed ergocorninina (36). Anche l'ergotinina di Tanret (3-5) e la y-ergotinina di Smith e Timmis (13) risultarono essere basi impure.
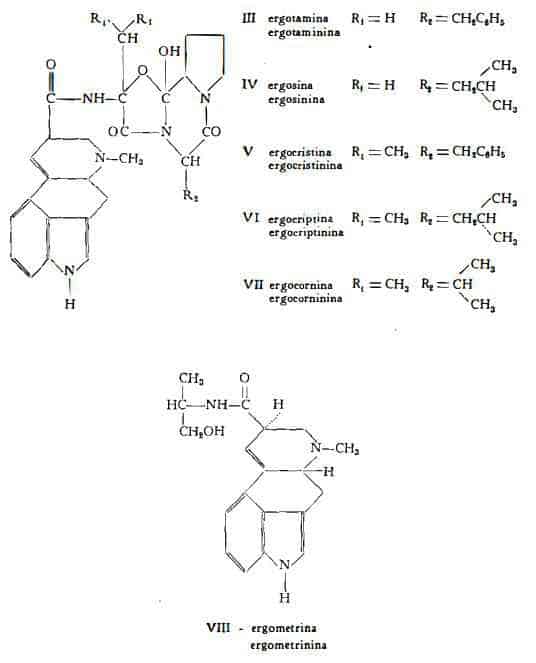
Stoll (37) stabilì infine che negli sclerozi della Claviceps purpurea Tul. si trovano sei paia di alcaloidi, ripartiti nei tre gruppi dell’ergotamina, ergotossina e dell’ergometrina qui elencati nella tabella 1.
Altri alcaloidi ergosecalina (38a), un alcaloide idrosolubile (38b) ed uno del tipo dell’ergotossina (38c) sono stati estratti più recentemente, ma la loro struttura non è stata definita.
Composizione chimica degli alcaloidi
Allo studio della composizione chimica degli alcaloidi della Segale cornuta hanno portato sostanziale contributo le ricerche sui prodotti di decomposizione, condotte da Barger ed Ewins (39), da Smith e Timmis (20) (40) (41), da Jacobs e Craig (42-45). Jacobs e Timmis (46) e da Stoll e coll. (37) (47-59).
E' stato messo in evidenza quale prodotto di idrolisi degli alcaloidi l’acido lisergico (41) (42), che è stato identificato con la 9,10-deidro-6-metil-8-carbossiergolina (I) (60-62). L’ergolina (Il) risultò essere un composto tetraciclico, derivato dall'indolo.
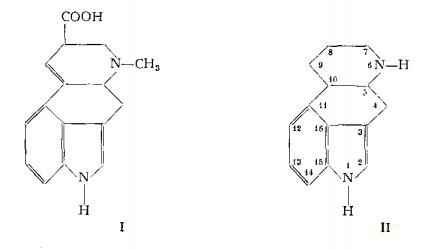
Entrambe le formule di struttura I e II sono state confermate dalla sintesi dell’ergolina, operata da Jacobs e Gould (63) e da quella dell'acido lisergico, ottenuta da Woodward e coll. (64). La struttura spaziale, che è qui indicata nella fig. 1 e che definisce la configurazione degli stereoisomeri, acido lisergico ed acido isolisergico, è stata chiarita da Leeman e Fabbri (65c).
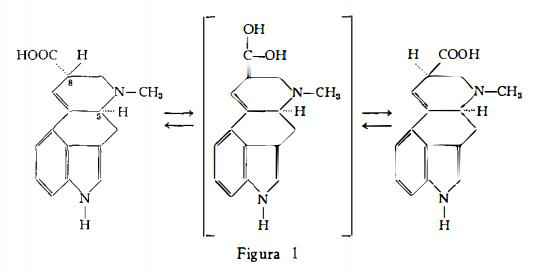
L’acido lisergico e i derivati di questo, cioè gli alcaloidi levogiri, si trasformano facilmente negli steroisomeri destrogiri, acido isolisergico e derivati rispettivamente. Questa trasformazione avviene facilmente durante l’invecchiamento della droga oppure nel corso dei processi di estrazione, specialmente in mezzo alcalino, ed è molto importante dal punto di vista farmacologico, poichè gli alcaloidi naturali levogiri sono molto più attivi degli stereoisomeri destrogiri.
Ai sei alcaloidi derivanti dall'acido lisergico corrispondono quindi sei isomeri derivanti dall'acido isolisergico. Data l'identità della composizione chimica del nucleo basilare, la frazione distintiva nella molecola è propriamente il radicale attaccato al nucleo carbossilico degli acidi lisergico ed isolisergico. Questo radicale può essere costituito da un peptide oppure da un amminoalcool e si distinguono pertanto alcaloidi di tipo peptidico e di tipo alcanolamminico.
Ergotamina, ergosina, ergocristina, ergocriptina ed ergocornina sono alcaloidi di tipo peptidico, poichè il radicale, unito al gruppo carbossilico, è un tripeptide ciclico. Essi sono divisi in due gruppi (tabella I) quello dell'ergotamina, in cui il carbossile nell'ergotamina e nell’ergosina è legato con il gruppo amminico dell’a-ossialanina e quello dell'ergotossina, in cui il carbossile nell’ergocristina, nell'ergocriptina e nell’ergocornina è legato con il gruppo amminico dell'a-ossivalina. La composizione del radicale peptidico è caratterizzata dall’unione di un gruppo a-ossi-a-amminoacido con un nucleo azotato di nove membri, costituito da un anello pentatomico unito con un anello esatomico a formare una struttura ciclica. A seconda che l'a-ossi-a-amminoacido è costituito da a-ossialanina o da a-ossivalina, nella scissione della frazione peptidica si forma acido piruvico od acido dimetilpiruvico rispettivamente (schema 1). Così, ad esempio, l’idrolisi parziale con potassa alcoolica dell’ergotamina e dell’ergocristina conduce alla formazione dell’ammide dell’acido lisergico e ad un peptide acido costituito da piruvoil-L-fenilalanil-L-prolina nel caso dell’ergotamina ed a dimetilpiruvoil-L-fenilalanil-L-prolina nel caso dell’ergocristina.
L’argometrina (formula VIII) è di tipo alcanolamminico; in essa il radicale acido è attaccato con legame ammidico all’alcool L-(+)-2-amminopropilico (1).


Derivati dell’acido lisergico e degli alcaloidi della Segale cornuta
Lo studio del rapporto tra la composizione chimica e l’azione farmacologica degli alcaloidi della segale cornuta ha dimostrato che l’idrogenazione del doppio legame in C9-C10 modifica profondamente l’attività delle singole sostanze. Sono stati così ottenuti derivati idrogenati e cioè diidroergotamina, diidroergocornina, diidroergocristina e diidroergocriptina (65a) con proprietà farmacologiche modificate in modo da renderne possibile una più vasta applicazione nel campo terapeutico.
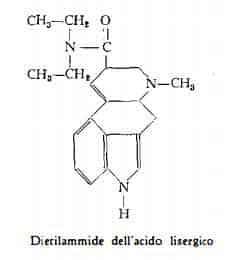
Mediante sintesi parziale Stoll e Hofmann (65b) hanno ottenuto inoltre diverse ammidi dell'acido lisergico e dell’acido isolisergico (ammide, metilammide, etilammide, propilammide, ecc.), tra cui la dietilammide dell'acido lisergico (N,N-dietil-D-lisergamide, LSD-25, Delysid), notevole per le proprietà psicotrope.
Contenuto percentuale di alcaloidi
Il contenuto di alcaloidi della droga, secondo le analisi di Kussner e Wolff (66), varia dallo 0,025 allo 0,108%. Stivic (67) ha trovato da 0,027 a 0,138%, Békésy (68) 0,025-0,4% di alcaloidi totali. La quantità percentuale di alcaloidi idrosolubili presenta variazioni indipendenti da quelle che si notano per il titolo degli alcaloidi totali, come è stato dimostrato dall’analisi di sclerozi singoli (69). In 10 campioni di Segale cornuta è stato trovato un contenuto di ergometrina, calcolato come malato acido, oscillante tra 16 e 32 mg (70). L'ergobasina è contenuta in piccole quantità: 3-5 mg % (71).
Secondo il British Pharmaceutical Codex (72), la droga portoghese e spagnola contiene per lo più 0,2-0,25 % di alcaloidi totali; delle varietà dell'Europa occidentale, quelle coltivate in Ungheria, possono contenere sino a 0,5 % di alcaloidi totali. Il Brit. Pharm. Codex (72) prescrive che il contenuto degli sclerozi della Claviceps purpurea (Ergot) sia non inferiore allo 0,19 %, di cui almeno il 15%, deve essere di alcaloidi idrosolubili calcolati come ergometrina. Le prescrizioni dell'United States National Formulary (73) indicano invece un titolo non inferiore allo 0,15 % di alcaloidi totali, calcolati come ergotossina, e di alcaloidi idrosolubili non inferiore allo 0,01 % di ergonovina. La Farmacopea Internazionale (74) richiede che gli sclerozi della Segale cornuta contengano non meno dello 0,15 % di alcaloidi totali, espressi in ergotamina, e non meno dello 0,023 % di alcaloidi idrosolubili, calcolati come ergometrina. La stessa Pharm. Intern. prescrive inoltre una polvere titolata «Pulvis secalis cornuti standardisatus», che è costituita dagli sclerozi polverizzati ed immediatamente privati dalla maggiore parte del grasso. E' preparata con eventuale aggiunta di polvere inerte, in modo da contenere 0,2 % (limiti 0,19 e 0,21) di alcaloidi totali, calcolati in ergotamina, e non meno dello 0,030 % di alcaloidi solubili in acqua, espressi in ergometrina.
Rilevanti oscillazioni sono state trovate per il titolo delle droghe commerciali. Stoll (75) ha pubblicato i risultati analitici, ottenuti per 45 campioni commerciali di diversa provenienza, il cui contenuto alcaloidico variava dallo 0 allo 0,206 % e che, a seconda del titolo, erano ripartibili nel modo seguente:
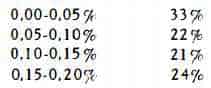
Queste prove hanno quindi dimostrato che il gruppo più numeroso (33 % ) era costituito da droghe a basso titolo.
Valori percentuali bassi sono stati segnalati per le droghe della Germania. Infatti il contenuto di alcaloidi, rilevato dall'analisi di 153 campioni di droga spontanea di diverse zone, è stato trovato per lo più inferiore allo 0,05 %. Soltanto il 17 % dei campioni saggiati conteneva una quantità di alcaloidi superiore allo 0,1 %. Due sole droghe sono risultate molto ricche, una proveniente dall'Harz con 0,563 %, l'altra da Crailsheim con 0,506 % di alcaloidi totali (76).
Il titolo medio di alcaloidi totali, ottenuto da Schulze (77) per 48 campioni di droga spontanea della Germania, è stato pari allo 0,068 %, essendo i dati limite degli alcaloidi totali e di quelli solubili in acqua pari a 0,014-0,197% e 0,000-0,020 % rispettivamente.
Freudenberg-Rosendahl e Markus (78), per partite di droga di due annate, hanno constatato che solo il 2 % dei campioni saggiati raggiungeva il titolo minimo dello 0,05 % di alcaloidi insolubili in acqua prescritto dalla D.A.B. VI (79).
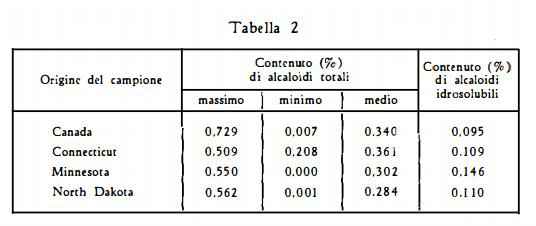
Per droga dell’America del Nord, Atal e Schwarting (80) hanno trovato valori molto variabili (tabella 2).
In droga spontanea jugoslava Kovacic e coll. (81) (82) hanno trovato un contenuto elevato di alcaloidi. Di 48 campioni soltanto due avevano un titolo inferiore allo 0,100%, mentre gli altri ne contenevano quantità superiori allo 0,100% e due campioni raggiungevano persino lo 0,226% e lo 0,332% rispettivamente (71). Per altri 9 campioni sono stati ottenuti i seguenti risultati (82):

0
In 49 campioni di droga spontanea slovena Kolsek, Kornhauser e Perpar (83) hanno notato un titolo di alcaloidi totali, variabile dallo 0,044 allo 0,152%, calcolati come ergotamina, in cui il 6,5-21,4% era costituito da acido lisergico e da alcaloidi solubili in acqua, il 21,8-37,5% da alcaloidi del gruppo dell'ergotamina (10,7-22,1 % levogiri, 2,4-19,3% destrogiri) ed il 51,3-63,1% da alcaloidi del gruppo dell’ergotossina.
In differenti campioni di sclerozi cresciuti su Segale è stato trovato un contenuto di alcaloidi totali, variante dallo 0,06 allo 0,2 %, valori molto bassi in confronto con i titoli 0,4-0,56% della droga coltivata. Negli alcaloidi totali è stata determinata una quantità di ergocristina pari al 60 % e più e di ergocriptina pari al 12-13 % (83a).
Dalle numerose referenze sopracitate risulta quindi che il titolo di alcaloidi della Segale cornuta varia molto secondo la provenienza della droga. E’ stato inoltre osservato che gli sclerozi della Segale cornuta, cresciuti spontaneamente in varie zone mondiali, appartengono a diverse razze chimiche. I caratteri genetici rappresentano un fattore importante nella formazione e nella composizione degli alcaloidi (77). Békésy (84) ha segnalato che in Ungheria esistono due razze di Segale cornuta, una ricca e l’altra povera di alcaloidi, mentre tutti i campioni provenienti dalla Spagna hanno titoli elevati.
Mediante analisi cromatografica di campioni di origine diversa Carless (85) ha rilevato che la droga di Spagna e del Portogallo non contiene ergotamina, mentre quella dell'Europa centrale (Odenwald, Alsazia, Foresta nera, Austria) contiene ergotamina, ma ha piccole quantità di ergosina. L'assenza di quantità apprezzabili di ergotamina e di ergotaminina nella droga della Spagna è stata confermata da Mosqueira (86). Lo stesso A. (86) nella droga spagnola ha trovato un notevole contenuto di ergocristina e di ergocristinina. La droga degli Stati Uniti d’America, del Canada e del Giappone contiene invece tutti e tre i tipi di alcaloidi, cioè dei tre gruppi dell'ergotossina, dell'ergotamina e dell’ergometrina (87).
Al fine di migliorare il rendimento dei raccolti e di diminuire quindi il prezzo elevato della droga, sin dal 1920 sono stati intrapresi studi circa le possibilità di coltivazione della Segale cornuta, specialmente nell’Europa centrale, in Svizzera, in Austria ed in Ungheria (88-98). Buoni risultati sono stati ottenuti, ad esempio in Ungheria mediante coltivazioni su larga scala, da cui si sono ricavati sclerozi contenenti sino allo 0,5 % di alcaloidi totali.
Sul titolo degli alcaloidi, esercitano notevole influenza l’altitudine, l’esposizione al sole, la composizione del terreno, la pianta ospite e lo stato di maturazione di questa. Una droga con elevato titolo si può ottenere, secondo Schlemmer, Wirth e Peters (100), quando la pianta ospite cresce su terreno cretaceo, in zona meridionale ed in clima temperato e quando la raccolta si fa nel periodo di non completa o completa maturazione del cereale.
L’analisi del fungo nel corso della crescita ha messo in evidenza che il contenuto alcaloidico è massimo verso la piena maturazione degli sclerozi (101). Anche durante la giornata sembra che il titolo degli alcaloidi subisca oscillazioni, raggiungendo due massimi alle cinque antimeridiane e pomeridiane e due minimi all’una antimeridiana e pomeridiana (102).
In prove su sclerozi, ottenuti infettando artificialmente piante di Segale, è stato notato che le variazioni nel contenuto di alcaloidi, rispetto agli sclerozi originali, derivano specialmente dalle variazioni della temperatura e dell’umidità durante lo sviluppo del fungo. Se gli sclerozi iniziali sono ricchi di alcaloidi, il titolo della droga che ne deriva è più elevato di quello della droga originale, mentre da campioni di basso contenuto si ottengono sclerozi con titolo basso (103).
Gli sclerozi più grossi e più pesanti danno rese più elevate rispetto a quelli più piccoli (104). Lo strato esterno fortemente colorato è più ricco della parte interna biancastra (101) (104). Anche nella parte basale sembra vi sia una quantità maggiore di alcaloidi in confronto con la parte apicale. Per gli sclerozi bianchi — leucosclerozi — è stato trovato un titolo più basso (0,120%) rispetto a quelli colorati normalmente (0,210%) (104).
Gli sclerozi cresciuti alla base della pianta della Segale hanno un più elevato contenuto di alcaloidi rispetto a quelli cresciuti sulla cima. L’aumento del numero di sclerozi per ettaro di terreno comporta anche un aumento del titolo alcaloidico sino ad un massimo, oltre al quale per un ulteriore aumento della resa in quantità di droga si ha il fenomeno inverso. Gli sclerozi, ottenuti da una seconda infezione, hanno titolo superiore a quello degli sclerozi derivanti da una prima infezione (105).
Negli sclerozi non risulta vi sia alcuna relazione tra il contenuto di alcaloidi, di azoto (105) e di grasso (77) (106).
Fattori alteranti il titolo di alcaloidi
La Segale cornuta con l’andar del tempo perde, come è noto, parte della propria attività. La rapidità dell'alterazione è in relazione specialmente al grado di umidità della droga (106-108). Per una droga, conservata per un anno e mezzo, con un contenuto di umidità inferiore all’8 %, la diminuzione dell’attività è risultata appena sensibile.
L'esposizione alla luce per 11 settimane ha causato una diminuzione del titolo di ergotamina pari al 18% negli sclerozi interi, al 29 % in quelli polverizzati e sgrassati ed al 61 % in quelli polverizzati e non sgrassati. Al contrario, nello stesso tempo, aumenta il contenuto di ergotaminina. Esposti alla luce ultravioletta, gli sclerozi si alterano più rapidamente: dopo 12 ore di esposizione, ad esempio, la diminuzione del titolo alcaloidico è del 40 % (109).
E’ stata studiata l’influenza della temperatura sullo stato di conservazione della droga fresca, intera o polverizzata, mantenuta per 154 giorni, al riparo dalla luce, a differenti temperature. La diminuzione del titolo di alcaloidi per la droga intera è stata di 4,7 % a 4°C, di 7,15 % a 20°C, di 17,9 % a 30°C e proporzionalmente maggiore sino al 67,9 % a 80°C. Per la droga polverizzata la perdita di alcaloidi è stata pari al 38,8 % a 4°C, al 42,9 % a 20°C, al 54,7 % a 30°C e sempre maggiore sino al 91,5% a 80°C. Secondo Hubik (110), che ha eseguito queste esperienze, per la buona conservazione della droga occorre quindi curare che la temperatura sia la più bassa possibile.
L’alterazione più rapida per opera della temperatura si ha per gli alcaloidi del gruppo dell’ergotamina (110) (111). L’ergometrina è più stabile degli alcaloidi del gruppo dell’ergotossina (110),
Gli alcaloidi della Segale cornuta sono molto sensibili alla luce. Stoll e Schlientz (112) ed Hellberg (113) hanno studiato i lumiderivati che si formano dai diversi alcaloidi per azione dei raggi luminosi.
La conservazione della droga in presenza di gas inerti (anidride carbonica, anidride solforosa) non presenta alcun vantaggio rispetto alla conservazione in presenza di aria (114).
Saggi analitici sono stati eseguiti da Speichert (115) su droga conservata per 42 mesi in diverse condizioni di luce, temperatura, umidità, in presenza o non di grasso, di vapori di cloroformio e di etere. La droga saggiata conteneva in media 8 % di acqua, 25 % di grasso e 0,33 % di alcaloidi. Sono stati ottenuti i seguenti risultati: i campioni conservati al buio contenevano 10-15 % di alcaloidi in più rispetto a quelli mantenuti alla luce. Abbassando la temperatura ambiente da +17°/+23° a -2°, la perdita di alcaloidi si è ridotta del 10-20 %. La droga conservata in presenza di agenti disidratanti conteneva 20% di alcaloidi in più rispetto alla droga esposta all’umidità. I campioni mantenuti in sacchi di carta hanno perduto 10% di alcaloidi in più in confronto con quelli sigillati ermeticamente. Gli sclerozi ridotti in polvere e sgrassati si sono dimostrati più sensibili agli agenti atmosferici in rapporto con la droga integra. Nè i vapori di cloroformio, nè quelli di etere hanno manifestato azione stabilizzante sugli sclerozi interi. In base ai risultati di queste prove sembra sia consigliabile la conservazione della droga con una quantità d’acqua non superiore al 4-5 %, in recipienti ben chiusi, al buio ed a temperatura vicina a 0°.
La determinazione del contenuto di ergotamina degli sclerozi interi o polverizzati, conservati in diverse condizioni, durante il magazzinaggio, ha dimostrato che l’esposizione all’umidità, alla luce ed alla temperatura ambiente, mentre ha influenza non molto elevata sul titolo della droga integra, produce una notevole perdita di titolo nella droga polverizzata (116). Dopo un anno la droga intera, mantenuta al riparo dalla luce, in essiccatori su ossido di calcio ed in ambiente freddo secondo la Farmacopea finlandese (117), ha conservato il titolo iniziale di ergotamina. Le perdite di alcaloidi della stessa droga conservata per 12 mesi alla luce od al riparo dalla luce sono state pari al 13,4% ed al 3,5 % rispettivamente. In vaso aperto, al riparo dalla luce ed a bassa temperatura oppure alla luce ed a temperatura ordinaria si è avuta una perdita del 13,8 % e del 19,3% rispettivamente. La droga polverizzata al riparo dall'umidità, conservata al riparo dalla luce ed a bassa temperatura, ha subito una perdita di titolo pari all’8,7 %, mentre, conservata alla luce ed a temperatura ordinaria, ha perduto il 67,3 % del titolo originale. In vaso aperto al riparo dalla luce ed a bassa temperatura si è avuta una caduta del titolo equivalente al 56,7% ed alla luce ed a temperatura ordinaria una diminuzione del 74,4% (116).
Tra i fattori alteranti, che interessano i procedimenti di estrazione degli alcaloidi, è da ricordarsi, oltre alla temperatura ed all’umidità, già citate, anche il trattamento con alcali e con certi solventi, che attivano i processi di isomeria degli alcaloidi (111).
Durante il processo di essiccazione della droga si può avere una notevole diminuzione del contenuto degli alcaloidi, se si opera a temperatura troppo elevata. Blazek e coll. (118) hanno ottenuto i migliori risultati mediante essiccazione a 40° ed esito lievemente inferiore sotto vuoto a 30°. In pratica l’essiccazione a temperatura ordinaria all’ombra dà risultati soddisfacenti. Una diminuzione del titolo degli alcaloidi è stata notata a temperature più elevate, specialmente per la droga in polvere (111)
(118). Secondo Kaczmarek e Speichert (119) per l’essiccazione la temperatura «optimum» è quella di 60° per la durata di 3 ore e mezza, mentre la temperatura ordinaria dà buon esito, ma prolunga troppo il tempo di essiccazione e conduce ad una umidità finale più elevata (7%). Temperature superiori ai 60° causano rilevanti perdite di alcaloidi.
Altri componenti degli sclerozi
Amminoacidi liberi: acido aspartico, leucina (120) (121), acido glutammico, serina, glicina, asparagina, treonina, alanina, glutammina, gli acidi a- e g-butirrico, prolina, valina, lisina, arginina, fenilalanina (121), tirosina, istidina (121) (122) e due amminoacidi non definiti (121). Tutti questi amminoacidi sono stati trovati nei vari stadi di sviluppo degli sclerozi (121). E' stato trovato anche triptofano (122), presente però in quantità apprezzabili soltanto nelle fasi iniziali di sviluppo degli sclerozi (121). Mentre il contenuto degli alcaloidi risulta notevolmente variabile, quello degli amminoacidi appare relativamente stabile (121).
Ammine: metilammina, trimetilammina (123) (124), etilammina, n-propilammina, isopropilammina, isobutilammina (124), isoamilammina (trovata in piccole quantità in estratto di Segale cornuta) (125), n-esilammina, b-feniletilammina (124), colina, acetilcolina (123), tiramina 0,01-1% (126), putrescina, cadaverina (127), istamina (128-130) e agmatina (131).
Steiner e Stein v. Kamienski (132) hanno analizzato 7 campioni di Segale cornuta e non hanno trovato alcuna relazione tra il contenuto delle ammine volatili e quello degli alcaloidi. Due campioni dei sette analizzati privi di alcaloidi, contenevano le medesime ammine (tabella 3).

1
Betaine ed altre sostanze azotate
Uracile, trovato in estratto di Segale cornuta (131).
Guanosina, isolata in un primo tempo con il nome di vernina, in quantità pari sino allo 0,1 % (133) ed identificata poi con il nucleoside (guanosina), che per idrolisi dà d-ribosio e guanina (134).
Betaina (120) ed ergotioneina, estratta per la prima volta da Tanret (135) nella quantità dello 0,1 %. .
Sostanze coloranti
Ergocrisina, C28H28O12 (136), identificata da Barger (137) e Bergmann (136) con tre sostanze estratte da precedenti AA.: sclero-cristallina di Dragendorff e Podwyssotzky (6) (138), ergocrisina di Jacoby (139) e acido secalonico di Kraft (140).
Ergoflavina, C15H14O7, (136) (141), pigmento giallo estratto da Freeborn (142).
Acido secalonico, isolato da Kraft (140) ed identificato da Franck e Reschke (143) con l’acido crisergonico di Stoll, Renz e Brack (144). Secondo Franck e Reschke (143) questa sostanza con formula C32H30.34O14 è il dimero di un cromone.
Endocrocina, C16H10O7, è il pigmento giallo, isolato da Franck e Reschke (143) ed identificato con l’acido 1,6,8-triossi-3-metil-antrachinone-2-carbossilico, già estratto da Asahina e Fuzikawa (145) dal lichene Nephromopsis endocrocea Y. Asahina.
Clavorubina, C16H10O7, pigmento rosso, isomero della endocrocina, è stato ottenuto da Franck e Reschke (143). Secondo gli stessi AA., corrisponderebbe all’acido 1,4,8- oppure 1,5,8-triossi-3-metilantrachinone-2-carbossilico.

2
Glucidi: trealosio (147-149) e, secondo vecchie analisi, anche mannano (150).
Trealosio [1-(a-D-glucosido)-a-D-glucosio (151-154)], C12H22O11 è lo zucchero estratto da Wiggers (147) per la prima volta dalla Segale cornuta. Denominato poi micosio (148) ed infine trealosio per essere stato isolato dalla «trehala-manna» (149), è stato estratto nella quantità di 50 g da kg 3,5 (1,42%) di Segale cornuta (155).
Altri componenti: Vitamina D in piccole quantità (156) nell'estratto petroletereo degli sclerozi (157), squalene (158), 1,5-2% di clavicepsina, C18H34O16, che per idrolisi con acidi produce mannitolo e due molecole di glucosio (159), inoltre mannitolo libero (160), acido lattico, che si formerebbe per fermentazione (161) ed acido secaleamminosolfonico (acido ergotico), NH2—C15H26O15-SO3H (2) (11) (162).
Olio grasso 14,6-24% in droga slovena (83), 23-37% in droga tedesca (76), anche 19-40% con gli acidi ricinoleico 34%, palmitico 30 %, oleico 23%, stearico 12%, acetico 0,1%, capronico 0,01% e tracce di acido linoleico (163). In olio di droga fresca è stato trovato il 2%, in olio di polvere vecchia il 36,17% di acidi grassi liberi (67). In due campioni di olio è stato trovato il 3,3 e l’1,3% rispettivamente di frazione insaponificabile (163).
Nella frazione insaponificabile sono state identificate a-diidroergosterina, C28H46O, che costituirebbe sino al 30% del contenuto totale di sterine (164), fungisterina (g-ergostenolo), C28H48O, (165), ergosterina, C28H44O (163) (165) e un altro sterolo probabilmente identificabile con lo stigmasterolo (166). Fungisterina ed ergosterina furono così denominate da Tanret (165), che le estrasse per la prima volta dalla Segale cornuta.

3
Ceneri 2,4-4,66% in droga slovena (83), 2-7% in droghe di varia origine (72), in media 5% nella droga seccata a 100° (167) con fosfato acido di potassio come principale componente. Nelle ceneri sono stati trovati il 30,06% di K2O ed il 45,12% di P2O5 (167). Alla quantità percentuale elevata di anidride fosforica 45-51 % nelle ceneri corrisponde un contenuto della stessa pari a 1,4-1,6% nella droga seccata (168).
E’ stata calcolata la seguente ripartizione del fosforo in composti solforati della Segale cornuta (tabella 5) (168):

4
La composizione chimica totale delle ceneri contenute in media nella proporzione del 5 % nella droga essiccata a 100° è risultata essere la seguente (167):

5
Nella Segale cornuta è stato trovato, oltre a ferro e manganese, anche zinco e cobalto (169).
In 29 campioni di diversa provenienza con alcaloidi di tipo argotaminico il contenuto di ferro è risultato variante da 0,0028 a 0,019% con maggiore incidenza dei valori inferiori allo 0,01 %. Non è stata rilevata alcuna relazione tra il titolo di ferro e il titolo di alcaloidi (170).
La quantità di manganese della droga determinata come MnO4 è stata riconosciuta variabile tra 0,0022 e 0,0034% e sembra essere inversamente proporzionale al contenuto di alcaloidi (171).
Acqua sino al 10% (172), in droga slovena 8,87-13,5% (83).
Enzimi: diastasi, lipasi (173) ed un fermento del tipo dell'emulsina (174).
Proprietà farmacologiche ed impiego terapeutico
Sembra che la Segale cornuta fosse completamente ignorata dagli antichi popoli occidentali ed orientali, ad eccezione dei cinesi cui pare fosse nota sin da lontane e imprecisabili epoche.
Gli accenni agli avvelenamenti prodotti da questo fungo infestante delle graminacee che, secondo alcuni, si troverebbero in qualche passo della Bibbia (175), sono invero assai vaghi e tali da dar adito a molti dubbi.
Altrettanto incerto appare un riferimento che si trova in un libro sacro Parsi (400-300 a.C.) nel quale si accenna ad «erbe nocive che provocano la caduta dell'utero nelle donne gravide e la loro morte durante il puerperio», in quanto effetti simili possono essere prodotti anche da altre «erbe nocive» con le quali Io sclerozio della Segale non poteva essere confuso.
E’ anche probabile che un accenno alla Segale cornuta sia stato fatto da Galeno nel suo Alimentorum facultatis (libro I, cap. 37), laddove allude ad un «grano nero» che si formerebbe per una «mutazione» del grano. Egli considera tuttavia questo «grano nero» soltanto dal punto di vista economico, trovando che esso è meno dannoso della zizzania e del lollio.
Manifestazioni tossiche, con la comparsa di mal di capo e di ulcere che potrebbero ricordare le lesioni prodotte da intossicazione cronica da Segale cornuta, vengono però attribuite dallo stesso Galeno ad un non precisato agente infestante del grano.
Le prime notizie sicure di intossicazioni collettive che, in base alle cognizioni successivamente conseguite sulla tossicologia della Segale cornuta, possono essere con certezza attribuite a farine di cereali inquinate da questo fungo, risalgono all’857 e si trovano negli annali dell'Abbazia di Xanten.
Fra le tante intossicazioni a tipo epidemico di cui si ha notizia, tristemente famose per la loro gravità ed estensione, sono alcune di quelle che si verificarono durante i secoli X e XI in Germania, in Inghilterra e in Francia, dove la malattia era nota con le denominazioni di ignis sacer, di mal des ardents, di fuoco di S. Antonio, ecc. Particolarmente catastrofica fu quella che si verificò in Francia, nelle regioni di Aquitania e di Limosino nel 994, che produsse la morte di 40000 persone.
Lo sclerozio della Segale cornuta non era noto come il responsabile di queste intossicazioni collettive, ma sembra che sin dal 1096 Siegebert Gremblour intuì che esse fossero correlate con una qualche alterazione delle farine, alterazione che soltanto molto più tardi venne attribuita alla presenza di questo fungo infestante. Occorre però giungere al secolo XVI per trovare la prima menzione sicura della Segale cornuta ed è appunto il Lonicerus (176) che nel suo Krauterbuch, accenna alle proprietà tossiche di questo fungo ed anche all'uso che ne facevano le donne «per produrre dolori all'utero, assumendola alla dose di 3 sclerozi, ripetuta varie volte».
Intossicazioni più o meno estese si verificarono però anche dopo che ne venne individuata la causa: nel 1600, nel 1700 e nel 1800 in molti Paesi dell'Europa centrale e settetrionale (Francia, Germania, Svizzera, Inghilterra, Irlanda, Svezia) e, fra le più recenti, sono da annoverare quelle che si ebbero a lamentare in Russia nel 1927-1928 nelle regioni degli Urali, di Vostiak e di Perm, durante le quali si contarono oltre 11000 intossicati con 93 casi mortali.
Non risulta che epidemie gravi abbiano colpito l’Italia, se si eccettuano quelle, molto circoscritte del resto, che si verificarono a Torino nel 1789 e a Milano nel 1795, fra i bambini ospiti di due orfanotrofi.
Torneremo su questo argomento nel paragrafo dedicato alla tossicologia e accenneremo intanto brevemente alle azioni farmacologiche e terapeutiche della droga e dei suoi alcaloidi naturali, in quanto esse si trovano molto ampiamente svolte in tutti i normali trattati di farmacologia. Più ampio spazio, benché contenuto entro certi limiti, sarà dato invece alla descrizione delle proprietà farmacologiche e terapeutiche dei derivati idrogenati degli alcaloidi naturali, dell'acido lisergico e dei suoi composti, attenendoci specialmente a quanto è stato più recentemente acquisito in proposito.
Per quanto l'impiego della Segale cornuta nella medicina popolare fosse noto da tempo, l’ingresso della droga nella medicina ufficiale è relativamente recente risalendo esso al 1808, anno in cui il ginecologo americano Starns (177) pubblicò una memoria sulle sue proprietà uterotoniche ed emostatiche.
L'azione caratteristica della Segale cornuta e dei suoi preparati totali si manifesta con un'energica contrazione dell’utero, azione che rappresenta la risultante delle azioni proprie ai singoli alcaloidi che compongono il fitocomplesso attivo contenuto nella droga.
Essa viene impiegata terapeuticamente soprattutto come uterotonico e come emostatico nelle metro- e menorragie dovute alle più varie cause. La sua azione contratturante si esplica elettivamente sull’utero ma le contrazioni che vi provoca sono molto persistenti, non sono alternate con periodi di rilasciamento e non avvengono in senso espulsivo come quelle fisiologiche che compaiono normalmente durante il parto.
La Segale cornuta, come i suoi preparati, non è quindi utilizzabile al fine di favorire l'espulsione del feto poichè, specialmente ove esistano ostacoli meccanici, potrebbe rappresentare un serio pericolo sia per la gestante, nella quale può provocare la lacerazione dell’utero, sia per il feto di cui potrebbe provocare la morte per asfissia.
Essa trova invece utile e precisa indicazione come rimedio preventivo e curativo nelle emorragie post-partum e, come già detto, nelle metro- e menorragie dovute ad altre cause (tumori, ecc.); inoltre, nel periodo iniziale del puerperio per favorire la retrazione dell'utero ed in altri stati patologici dovuti alla sua incompleta involuzione (metriti, ipertrofie croniche dell'utero). La Segale può essere inoltre impiegata per favorire il secondamento, ma soltanto nel caso in cui il distacco della placenta sia già avvenuto e che essa abbia già raggiunto il collo dell’utero.
L'azione della Segale cornuta o Claviceps purpurea, è dovuta ai suoi alcaloidi e noi considereremo soltanto quelli che sono contenuti nello sclerozio della Claviceps che si forma sulla Segale. Dagli sclerozi che si formano su altre graminacee, oltre gli alcaloidi contenuti in quello della Segale, ne sono stati isolati alcuni altri ma essi sono ancora farmacologicamente poco studiati.
Gli alcaloidi naturali contenuti nella Segale cornuta possono essere distinti, in base alla loro natura chimica, in alcaloidi polipeptidici ed in alcaloidi alcanolamminici.
Nel novero degli alcaloidi polipeptidici rientrano l'ergotamina, l'ergosina, l’ergocristina, l’ergocriptina (o ergomollina), l’ergocornina e i loro d-isomeri [rispettivamente, l'ergotaminina, l'ergosinina, l'ergocristinina, l’ergocriptinina (o ergomollinina) e l'ergocorninina]. Del gruppo degli alcaloidi del tipo alcanolamminico, fa parte l'ergobasina (o ergonovina, o ergometrina o ergotocina) e il suo d-isomero l'ergometrinina (o ergobasinina).
Da ciascuno degli alcaloidi del I gruppo sono stati ottenuti per emisintesi, i rispettivi prodotti idrogenati: diidroergotamina, diidroergosina, diidroergocristina, diidroergocriptina, diidroergocornina e da quello che può essere considerato come il più interessante prodotto della loro idrolisi, l'acido lisergico, sono stati ottenuti la sua dietilamide e altri derivati di notevole importanza terapeutica.
Dalla ergobasina (o ergonovina, o ergometrina, ecc.) è stata ottenuta per emisintesi la metilergobasina che è il prodotto dotato della più elevata e più specifica attività uterotonica.
Altri prodotti di idrolisi dei suddetti alcaloidi naturali, che non hanno importanza farmacologica, sono stati descritti nella parte chimica.
L’azione farmacologica degli alcaloidi naturali della Segale cornuta, dei loro isomeri e dei loro derivati idrogenati, presenta sensibili differenze quali e quantitative che Goodman e Gilman hanno riassunto nel seguente schema:

6
Uno schema più dettagliato dell’azione dei vari alcaloidi contenuti nella Segale cornuta e dei loro derivati diidrogenati ci è dato da Rothlin e Fanchamps (179).

7
Prima dell'isolamento degli alcaloidi, la Segale cornuta veniva usata sotto forma di polvere sgrassata, di estratto fluido e di preparazioni speciali note sotto il nome di «ergotine», alcune delle quali anche iniettabili. La prima di tali preparazioni fu l’ergotina di Wiggers che rimase nell'uso solo per poco tempo. Ad essa seguirono l’ergotina di Bonjean, di Bombelon, di Wernich e varie altre quali quelle di Wenzel, di Denzel, di Yvon, alcune delle quali vennero iscritte anche in alcune farmacopee (ergotina di Bonjean e di Yvon) e non si può dire che il loro impiego pratico in ostetricia, sia del tutto abbandonato.
Il contenuto alcaloideo di queste preparazioni è minimo o addirittura nullo, ciò nonostante è possibile svelare, sia sperimentalmente che clinicamente, una loro non trascurabile attività uterotonica tale da sodisfare le esigenze terapeutiche. Evidentemente tale attività, in assenza degli alcaloidi, deve essere in gran parte attribuita alle varie amine biogene contenute nella droga, particolarmente all’istamina e alla tiramina, che più facilmente degli alcaloidi, potevano essere estratte dalla droga con le tecniche e con i solventi previsti dai metodi usati per ottenere le suddette preparazioni.
Per lungo tempo si discusse anzi se l’attività della droga potesse essere dovuta soltanto agli alcaloidi o anche ad alcune delle numerose amine in essa contenute, sinché Rothlin in collaborazione con Schegg (180) prima e con Stoll (181) poi, dimostrarono che solo gli alcaloidi possono essere considerati come responsabili degli effetti specifici della Segale cornuta.
Più tardi Langecker (182) dimostrò che una droga contenente lo 0,3 %o di alcaloidi totali era molto più tossica per gli animali da laboratorio, di una quantità di alcaloidi puri, superiore di 2 a 6 volte.
Questo argomento, secondo Rothlin e Fanchamps (179) dimostrerebbe ulteriormente la superiorità degli alcaloidi puri sulle preparazioni galeniche della Segale cornuta «essendo ormai stabilito che le sostanze accessorie contenute nella droga non fanno che aumentare la sua tossicità senza rinforzarne i suoi effetti terapeutici».
Tanret nel 1875-1879 (3, 4, 5) isolò dalla Segale cornuta il primo alcaloide cristallizzato, l’ergotinina, senonchè essa risultò essere una base impura simile alla ergotossina isolata da Barger e Carr (9, 10) nel 1906, la quale a sua volta, risultò essere un miscuglio variabile di tre alcaloidi: ergocornina, ergocristina, ergocriptina [Stoll e coll. (34, 36)].
Il primo alcaloide veramente puro e cristallizzato, l’ergotamina, venne isolato nel 1918 da Stoll (14), il quale poco dopo constatò che esso poteva essere trasformato nel suo isomero ergotaminina, fortemente destrogiro e farmacologicamente inattivo.
Le prime ricerche complete sulla farmacologia dell'ergotamina, si debbono a Rothlin (183, 184, 185, 186), ricerche che condussero ad una più esatta conoscenza delle caratteristiche farmacologiche di questo alcaloide e che permisero di estendere le sue indicazioni terapeutiche dal limitato campo di applicazione come oxitocico a quelle più vaste delle simpaticotonie, degli squilibri neurovegetativi e di alcune forme di emicranie.
Gli alcaloidi naturali della Segale cornuta, ad eccezione dell’ergobasina (ergonovina, ergometrina), la cui attività è più specificamente uterotonica, sono dotati di una complessa azione centrale e periferica la quale, pertanto, si riflette sulla funzionalità di diversi organi e sistemi.
L’azione uterotonica di tutti gli alcaloidi naturali della Segale cornuta, è dovuta ad una stimolazione diretta della fibra muscolare liscia alla quale l'organo reagisce, per le piccole dosi, con una contrazione normale seguita da rilasciamento. Dosi più elevate determinano invece contrazioni più energiche e di tipo tetanico.
L’utero è più o meno sensibile all’azione degli alcaloidi della Segale cornuta, a seconda della sua maturità e delle condizioni fisiologiche in cui si trova: l'utero gravido, specie se a termine o immediatamente dopo il parto, dimostra una sensibilità notevolmente più elevata.
L’azione uterotonica degli alcaloidi naturali, è qualitativamente simile, ma differisce quantitativamente. I più attivi sotto questo aspetto sono la ergobasina e l'ergotamina. L’ergobasina presenta di fronte all’ergotamina tre notevoli vantaggi: agisce più prontamente e cioè senza il periodo di latenza caratteristico all’ergotamina, può essere somministrata per os mentre l'ergotamina è attiva soltanto se somministrata per via parenterale e, infine, l’ergobasina è meno tossica (vedi tab. 2).
A proposito dell’ergobasina è opportuno ricordare che un suo derivato di semisintesi, la metilergobasina, è il composto più attivo sotto questo aspetto, ma per quanto meno tossico dell’ergotamina, è sensibilmente più tossico dell’ergobasina da cui deriva.
Gli alcaloidi della classe dell'ergotossina (ergocornina, ergocristina, ergocriptina), come pure l'ergosina, sono più tossici dell’ergotamina da 1,5 a 3 volte (secondo la specie animale) e la loro azione uterotonica è più debole (circa 1/3) rispetto all'ergotamina.
Azione cardiovascolare – Gli alcaloidi naturali della Segale cornuta manifestano un’azione vasodilatatrice centrale per abbassamento del tono vasale ed un’azione vasocostrittrice periferica dalla quale la prima viene di solito mascherata. Tale azione vasocostrittrice, dovuta ad una stimolazione diretta della muscolatura liscia vasale, è massima per l’ergotamina e per gli alcaloidi della classe dell'ergotossina, debole per l’ergobasina, quasi nulla per il suo metilderivato.
Questi alcaloidi non esercitano sui muscoli lisci di altri organi la stessa azione che essi manifestano sulla muscolatura liscia dell’utero e su quella vasale.
Sulla muscolatura liscia del tratto gastro-intestinale per es., la loro azione è trascurabile. Sull’iride di alcuni animali e in particolare su quella del gatto, essi provocano una miosi per azione diretta sullo sfintere. L’azione vasodilatatrice centrale è nulla per l’ergobasina e per la metilergobasina, è debole per l’ergotamina e più elevata per gli alcaloidi ergotossinici.
Tutti gli alcaloidi naturali, ad eccezione dell’ergobasina e del suo metilderivato, e cioè l’ergotamina e gli alcaloidi ergotossinici (ergocornina, ergocristina e ergocriptina), esplicano un’azione bradicardizzante.
Questa azione di origine centrale, si manifesta anche con un effetto inibitore sulle zone vasosensibili senocarotidee. Essi determinano inoltre un leggero effetto sedativo per il quale l’azione dei sedativi e dei narcotici viene potenziato (179).
Azione adrenosimpaticolitica. Anche questa azione, come quella bradicardizzante, è posseduta soltanto e pressocchè in ugual misura, dell'ergotamina e degli alcaloidi ergotossinici, mentre ne sono privi l'ergobasina e il suo metilderivato.
L'azione adrenosimpaticolitica dell'ergotamina (187), oltre sull’attività stimolante o inibitrice dell'adrenalina, si manifesta anche sugli effetti che essa esplica sul metabolismo basale e sulla glicemia (179).
La tossicità degli alcaloidi ergotossinici e quella dell’ergosina, è più elevata di quella dell’ergotamina e le loro attività sono qualitativamente simili ma quantitativamente inferiori o al massimo uguali (188, 189) e, per quanto riguarda l'ergosina, l'impiego terapeutico è molto scarso o praticamente nullo.
Le modificazioni della ghiandola mammaria e della secrezione lattea provocati da alcuni alcaloidi naturali della Segale cornuta è stata studiata da alcuni autori. Grosvenor (190), somministrando tartrato di ergotamina a ratte allattanti, alla dose di 3 mg/kg giorno, post partum per la durata di 9-12 giorni, e misurando il contenuto di lattosio nel tessuto mammario per 12 giorni, ha trovato che nè il contenuto di latte nella ghiandola mammaria, nè le caratteristiche istologiche della ghiandola stessa, vengono influenzati. E’ stata invece osservata una significativa perdita di peso delle madri durante il trattamento, fatto che è stato posto all’A. in rapporto con la diminuita assunzione di cibo. Una uguale perdita di peso è stata osservata anche nei figli delle ratte trattate, durante lo stesso periodo, quantunque la frequenza delle suzioni da parte dei piccoli, era aumentata durante il trattamento. Al termine dell’allattamento gli animali riacquistavano però il peso normale.
Chandhury e Dikshit (191) successivamente, trovarono invece che, tanto l’ergotamina quanto l’ergobasina, a dosi più deboli (50-10 g) provocano un aumento della secrezione lattea nelle ratte allattanti e antagonizzano gli effetti inibitori sulla secrezione lattea, dell'alcool, dell’adrenalina e dell'atropina.
Alcaloidi idrogenati
Fin dal 1943 Stoll e Hofmann (192) notarono che negli alcaloidi della Segale cornuta la presenza del doppio legame nell’anello D, in posizione
9-10, ha una grande importanza agli effetti della loro azione farmacologica. Basta infatti saturarlo per riduzione catalitica con idrogeno, perchè tutti gli alcaloidi naturali perdano le loro proprietà uterotoniche. In quelli della classe polipeptidica (ergotamina e alcaloidi ergotossinici) inoltre, si osserva anche un notevole aumento delle loro proprietà adrenosimpaticolitica e vasocostrittrice e una diminuzione di tossicità nei confronti dell’alcaloide naturale corrispondente. Più precisamente si può anzi dire, che l’abbassamento della tossicità degli alcaloidi diidrogenati è tanto più marcato quanto più è elevata la tossicità dell’alcaloide naturale da cui derivano.
L’effetto uterotonico è attenuato per le piccole dosi, nel caso della diidroergotamina e praticamente soppresso per gli alcaloidi ergotossinici e altrettanto avviene per quanto riguarda l’effetto vasocostrittore periferico.
L’azione vasodilatatrice centrale è, al contrario, rinforzata nei diidroalcaloidi ergotossinici. Nel caso della diidroergotamina invece, i due effetti, il vasocostrittore periferico e il vasodilatatore centrale, si equilibrano: nell'uomo l'effetto vasocostrittore prevale spesso e, soprattutto, allorchè esso si esercita su vasi ipotonici (179).
L'effetto adrenosimpaticolitico è aumentato nella diidroergotamina e nei diidroalcaloidi ergotossinici. Secondo Konzett e Rothlin (193), soltanto l'azione inotropa dell'adrenalina sul cuore e la componente vasodilatatrice della sua azione non sono inibite.
Anche gli effetti della noradrenalina vengono inibiti, dai suddetti alcaloidi, dopo l'idrogenazione, ma in misura inferiore a quelli dell'adrenalina.
Secondo Rothlin e Cerletti (194), l'effetto rallentatore sul ritmo cardiaco, come l'inibizione centrale dei riflessi seno-carotidei sono conservati, mentre la sensibilità del cuore verso gli agenti generatori di eterotopie o di fibrillazioni (ciclopropano, cloroformio, adrenalina) è abbassata.
Secondo Bircher e Cerletti (195) il grado di attività di ciascuno dei tre diidroderivati degli alcaloidi ergotossinici (diidroergocornina, diidroergocristina e diidroergocriptina) è diverso e dipende essenzialmente dalla sensibilità individuale, ma l'associazione in parti uguali di questi tre diidroderivati, come è stata realizzata in un preparato in commercio sotto forma di specialità medicinale, evita questo inconveniente e permette di ottenere un effetto terapeutico relativamente indipendente dalle reazioni individuali. Secondo Rothlin e Cerletti (194) gli alcaloidi diidrogenati attenuano o sopprimono alcune alterazioni funzionali di tipo anossemico dell'ECG (slivellamento del tratto ST e appiattimento dell'onda T).
La loro attività sedativa centrale è più marcata di quella dei corrispondenti alcaloidi naturali e si manifesta con un rinforzo dell'azione degli ipnotici della serie barbiturica (196, 197).
Al contrario degli alcaloidi naturali, i quali determinano a forti dosi, aumento della temperatura corporea, i derivati idrogenati provocano invece una leggera ipotermia.
Secondo Cerletti e Kallenberger (198) gli alcaloidi idrogenati possono, in certe condizioni sperimentali, determinare un abbassamento del metabolismo basale, una riduzione del bisogno di ossigeno e un aumento della resistenza dell'organismo all'ipossia.
I diidroderivati degli alcaloidi ergotossinici e in particolare la loro associazione in parti uguali sono, specialmente per quanto riguarda il loro effetto simpaticolitico e vasodilatatore, i più attivi fra i derivati della Segale cornuta usati in terapia, mentre i corrispondenti alcaloidi naturali non sono utilizzabili in considerazione del loro sfavorevole coefficiente terapeutico.
Derivati di semisintesi dell'acido lisergico
Fra i più importanti derivati di semisintesi dell'acido lisergico ottenuti presso i laboratori scientifici della Ditta Sandoz di Basilea, va annoverata la sua dietilamide distinta con la sigla LSD 25 o semplicemente LSD, sull’attività della quale esiste attualmente una vastissima letteratura sia farmacologica che clinica. Noi accenneremo brevemente alla sua azione farmacologica al fine soprattutto di sottolinearne l'importanza che essa ha assunto sia nel campo psicofarmacologico che farmacopsichiatrico.
Questa sostanza fu studiata fin dal 1938 epoca in cui le venne riconosciuta da Rothlin (199) una marcata azione oxitocica, simile a quella dell’ergobasina, sull'utero di coniglio; sia in vitro che in vivo, tale azione, risultò essere inferiore però di una volta e mezza rispetto a quella dell'ergobasina e la sua tossicità più elevata.
L'A. osservò inoltre che l’iniezione endovenosa di 0,1-0,2 mg/kg produceva nei conigli in anestesia, una insolita eccitazione accompagnata da crampi muscolari. Nei gatti e nei cani, l'iniezione sottocutanea di 0,2 mg/kg induce fenomeni motori simili all'atassia, paresi spastica ed un 'alterazione del comportamento di tipo catatonico.
Questi risultati sembrarono all'A. tali da escludere una qualsiasi possibilità di applicazione terapeutica e il suo studio venne abbandonato. Fu soltanto molto più tardi e cioè nel 1943 che Hofmann (200), il quale si occupava, presso i laboratori scientifici della Ditta Sandoz, della preparazione dei derivati dell'acido lisergico, avendo incidentalmente ingerito una piccola quantità di LSD, notò la comparsa di fenomeni psicogeni che si ripeterono costantemente dopo l'assunzione orale di una dose di 250 g. Rothlin ripetè le prove su se stesso, sui suoi collaboratori e colleghi e da queste prime prove risultò che nei soggetti normali la dose attiva della LSD varia da 0,5 a 1 g/kg.
La constatazione di questa inattesa ed elevata attività della LSD, destò un vivo interesse in campo farmacologico e neurologico e le estese indagini che ne seguirono ebbero inizio con quelle fondamentali di Stoll (201) pubblicate nel 1947, svolte nei laboratori stessi della Sandoz e nella clinica psichiatrica dell'Università di Zurigo.
Rothlin riassume nel seguente schema le diverse azioni centrali e periferiche della LSD:

8
Da cui risulta che nell’attività della LSD si possono distinguere due principali azioni: un’azione periferica diretta ed un’azione sul sistema nervoso centrale.
Azione periferica diretta
Abbiamo già accennato all'azione uterotonica della LSD, la quale risulta qualitativamente simile a quella dell'ergotamina. Aggiungeremo ora che essa determina un effetto vasocostrittore sui vasi del rene di ratto (202, 203) e dell’orecchio di coniglio (204) perfusi ed anche nel gatto spinale (202, 203),
Nell’animale intatto si osserva un effetto ipotensore per il predominio dell’azione deprimente sui centri vasomotori.
L’azione adrenosimpaticolitica della LSD in confronto con quella degli alcaloidi naturali e diidrogenati della Segale cornuta, è piuttosto scarsa. L’attività antagonizzante elettiva della LSD sulla serotonina (enteramina di Erspamer) è stata notata da Gaddum (205) sull’utero isolato di ratto e quindi da altri Autori su diversi organi: da Gaddum e Hameed (205) sulla muscolatura liscia dell’intestino di cavia; sulla muscolatura liscia vasale da Ginzel e Kattegoda (206) e da Gaddum e coll. (207); sulla muscolatura liscia dei vasi sanguigni e dei bronchi in vivo, da Herxheimer (208) e da Konzett (209).
La serotonina può, dopo un lungo trattamento, antagonizzare l'azione della LSD sull’espansione dei cromatofori nella femmina del Peocilia reticulatus [Cerletti e Berde (210)].
La LSD determina nel cuore isolato di Venus mercenaria un aumento massimo dell’ampiezza delle pulsazioni, senza alterare la sua sensibilità all'acetilcolina. Tale sua azione è simile a quella prodotta dalla serotonina, per quanto l'effetto di quest’ultima è più facilmente reversibile dopo lavaggio. La stessa azione, ma meno intensa, è posseduta da altri derivati dell’acido lisergico quali (in ordine decrescente), la monoetilamide, la diidroergotamina, gli alcaloidi ergotossinici, l’ergobasina, la metilergobasina e lo stesso acido lisergico (211, 212).
Uno studio comparativo sull'antagonismo fra serotonina, amidoderivati dell’acido lisergico, alcaloidi naturali e di semisintesi della Segale cornuta sull’utero di ratta, è stato eseguito da Cerletti e Doepfner (213). I risultati dimostrarono che dei 20 derivati amidici dell’acido lisergico, più o meno affini alla LSD, che sono stati sperimentati, nessuno raggiungeva il grado di attività e di specificità di quest’ultima.
La sostanza più affine alla LSD, nei riguardi dell'azione antiserotoninica è risultata essere la monoamilamide dell’acido lisergico. Altri stereoisomeri della LSD si dimostrarono praticamente inattivi, mentre la diidro-LSD conserva il 50% dell’attività della LSD non idrogenata.
Gli alcaloidi naturali e i loro derivati idrogenati dimostrarono soltanto una modesta attività antiserotoninica, ad eccezione della metilergobasina dotata di un notevole effetto inibitore specifico.
Sostanze ad attività serotoninoinibitrice superiore alla LSD, furono trovate dagli AA. in un gruppo di derivati della LSD con varie sostituzioni nell'anello dell’acido lisergico. Fra questi, il composto più attivo sotto questo aspetto, è la dietilamide dell’acido 1-metil-2-bromo lisergico.
Scott e Stone (214) hanno studiato tre derivati dell’acido lisergico e precisamente la LSD, la BOL 148 (dietilamide dell’acido d-2-bromolisergico) e la MLD 41 (dietilamide dell’acido d-1-metillisergico) in relazione con la loro azione bloccante la serotonina. Impiegando I131, in ratti trattati con serotonina, gli AA. hanno notato che tutti e tre i composti sono dotati di azione bloccante la serotonina e che, fra essi, la MLD è quello che ha un’azione più prolungata. Tutti e tre i composti manifestano un’attività antitumorale sul sarcoma trasmissibile dei ratti, attività che ha dimostrato un certo parallelismo con l’azione serotoninoinibitrice.
Azione sul sistema nervoso centrale
Gli effetti prodotti dai derivati di semisintesi dell’acido lisergico del tipo della LSD e di questa in particolare, possono essere suddivisi secondo Rothlin (129) in tre gruppi: effetti autonomi, effetti somatomotori ed effetti psichici.
Effetti autonomi, essi possono essere di origine simpatica o parasimpatica e quantitativamente diversi nei vari animali. La midriasi si manifesta nel ratto, nel topo (208) e anche nell’uomo (215, 216). La glicemia viene aumentata dalla LSD e la piloreazione è da essa provocata in diversi animali. Fra i centri più squisitamente sensibili all’azione della LSD, può essere annoverato quello della termoregolazione (217) il quale reagisce provocando nel gatto, nel cane e nel coniglio (218) un aumento di temperatura. Nel ratto invece l’ipertermia è prodotta soltanto da dosi molto elevate di LSD, mentre le dosi deboli possono determinare un effetto ipotermico.
Secondo Supek e Milkovic (219) e contrariamente a quanto precedentemente affermato da altri autori [Woolley e Shaw (220)], l’effetto piretogeno prodotto dalla LSD, sarebbe di origine centrale in quanto non antagonazzato o inibito dalla serotonina.
Tutti questi effetti sono di origine simpatica centrale e vengono inibiti da pretrattamento con gaglioplegici quali l’esametonio e dai simpaticolitici del tipo dell'hydergina (27).
Piccole dosi di LSD non influenzano la pressione arteriosa in maniera significativa. Nei gatti in anestesia, dosi di 50-100 g/kg determinano un effetto ipotensivo dovuto ad un’azione deprimente sul centro vasomotore e, inoltre, un effetto bradicardico per stimolazione vagale centrale. Nel gatto spinale l’effetto bradicardico manca e la pressione subisce un aumento [Rothlin e Cerletti (202, 203)].
L’azione della LSD è stata studiata sulla pressione dell'uomo da Rinkel (215, 221), sulla circolazione cerebrale e sul metabolismo di soggetti normali e schizofrenici da Sokoloff e coll. (216). Si è potuto constatare che la pressione non è influenzata nei soggetti normali, mentre aumenta leggermente negli schizofrenici.
Secondo Sugar e coll. (222) la somministrazione sottocutanea di LSD e di BOL 148 (dietilamide dell’acido 2-bromo-d-lisergico), abbassa notevolmente l'ipertensione renale indotta nei ratti. Una diminuzione di 5-120 mmHg si manifesta entro 48 h dalla somministrazione delle due suddette sostanze. Per 10-14 giorni si mantiene instabile e quindi ritorna ai primitivi elevati livelli. Nei ratti normotesi di controllo le variazioni sono meno ampie e si mantengono entro i normali limiti tensori.
La respirazione può essere influenzata o inibita da dosi di 10-50 g/kg. Dosi maggiori determinano inibizione sino all’arresto per paralisi respiratoria (202, 203, 223, 224).
La LSD produce, tanto nell’uomo quanto nel coniglio fenomeni di tachifilassi, ciò che rende necessario lasciare un intervallo di parecchi giorni fra due serie di esperienze, al fine di poter ottenere effetti riproducibili.
Dhawan e Gupta (225) hanno sperimentato l’azione della LSD e della BOL 148 sull’emesi indotta dall'apomorfina e da altre sostanze (emetina, Hydergina, morfina, ouabaina, protoveratrina) nei cani.
La LSD antagonizza efficacemente l’emesi prodotta da apomorfina sulla quale la BOL 148 non esercita alcun effetto protettore.
La LSD protegge inoltre gli animali dal vomito indotto da morfina e da Hydergina ma non da quello prodotto da emetina, ouabaina e da protoveratrina. Tale attività antiemetica della LSD è stata attribuita dagli Autori ad una depressione selettiva dei chemiocettori emetici midollari.
Gli Effetti somatotropi possono essere di origine piramidale o extrapiramidale e si manifestano nei cani e nei gatti con atassia e paresi spastica. Le dosi necessarie di LSD capaci di produrre questa sintomatologia sono molto più elevate di quelle sufficienti per determinare alterazioni psichiche nell’uomo e alterazioni della termoregolazione nei cani [Rothlin (199)].
Nei cani e nei gatti dopo una fase di eccitazione iniziale essa determina, a dosi sufficienti, uno stato di catatonia transitoria.
Nei topi danzatori, i caratteristici movimenti di maneggio vengono bloccati e sostituiti da uno stato di agitazione disordinata (226).
Azione sulle funzioni psichiche
Le ricerche farmacologiche sull’azione psicotropa della LSD, oltre che sugli animali, furono eseguite molto estesamente sull’uomo e vennero condotte su soggetti psicotici, su soggetti psiconevrotici e su soggetti normali: fra queste ultime sono da annoverare le autoesperienze compiute dagli sperimentatori stessi, al fine di giungere ad una più esatta interpretazione delIa sintomatologia prodotta dalla LSD.
Questa sostanza rientra insieme con altre ad azione simile, in un gruppo di farmaci psicotropi per i quali la denominazione di psicodislettici proposta dal Delay, sembra essere secondo Cerletti (227), più appropriata come designazione generale, di altri termini sino ad ora più frequentemente impiegati (psicotomimetici, allucinogeni, fantastici, edeistici, oniridinici, ecc.) i quali esprimono, più che l’azione generale di questi farmaci, i diversi effetti psicodislettici che essi possono produrre.
I psicodislettici, secondo Cerletti e coll. (227) formano un sottogruppo degli agenti psicotropi, aventi la proprietà di provocare stati passeggeri somiglianti alle psicosi. Pur differendo strutturalmente, esiste fra loro una notevole somiglianza d’azione; ogni gruppo di tali sostanze, provoca tuttavia, effetti psichici caratteristici, ciò che può essere dovuto, sia alla loro diversa struttura chimica che al loro diverso punto di attacco. I psicodislettici non debbono essere classificati, secondo gli AA., nel gruppo degli stupefacenti (oppiacei, cocaina, ecc.) dai quali differiscono fondamentalmente. Essi sono causa di turbe psichiche profonde che non hanno nulla in comune con l’ebbrezza euforica prodotta dagli stupefacenti, essendo la loro azione essenzialmente caratterizzata da un «sentimento di depersonalizzazione e da turbe dello schema corporeo». Questi effetti che si manifestano allo stato di veglia e senza alterazioni della coscienza, potrebbero spiegare, secondo gli AA., l’assenza di quei fenomeni caratteristici alle tossicomanie prodotte dagli stupefacenti i quali, agendo rapidamente sulla vigilanza, sulla coscienza e sulla volontà, provocano uno stato nettamente euforico.
Cerletti e coll. distinguono i psicodislettici derivati dall’indolo da quelli ad azione anticolinergica.
La LSD rientra nel primo gruppo insieme con altre sostanze quali la mescalina, la psilocibina, la bulbocapnina, la bufotonina, l’ibogaina, l'armalina, l’adrenocromo e la serotonina, l’azione delle quali è qualitativamente simile ma quantitativamente molto diversa. Le dosi della LSD capaci di produrre profonde alterazioni del comportamento psichico, sono dell’ordine di quelle relative alle amine biogene: la dose di 20 g è infatti considerata come la minima attiva nell’uomo, mentre effetti psicodislettici massimali possono essere ottenuti con dosi pari a 0,5-1 g/kg.
Con queste dosi si possono ottenere, nell’uomo, profonde alterazioni della percezione, dell’umore, della sensibilità e dell’Io e sebbene con lo stesso dosaggio effetti psicotici possono essere prodotti anche negli animali, non sembra possibile si possa ottenere in questi ultimi un’azione psicomimetica paragonabile a quella che può essere prodotta nell’uomo. Tuttavia, secondo Cerletti e coll., ciò potrebbe essere dovuto anche alle difficoltà che esistono nell’apprezzare le suddette alterazioni negli animali, cui manca la possibilità di manifestare con la parola, o con qualsiasi altro mezzo di espressione le proprie sensazioni psichiche, le stesse difficoltà cioè, che in un certo senso, si potrebbero incontrare, anche ove esperienze simili venissero condotte su soggetti sordomuti e analfabeti. E' quindi opinione degli AA. che tutte le descrizioni di alterazioni psichiche prodotte sugli animali dalla LSD o da sostanze simili e che riferiscono perfino l’insorgere di sintomi schizofrenosimili (ansia, confusione, alterazioni del comportamento, ecc.) debbono essere considerati con notevole scetticismo. La LSD somministrata agli animali a dosi deboli, produce infatti soltanto sintomi a carico del sistema nervoso vegetativo, mentre le dosi elevate sono causa di gravi manifestazioni motorie (atassia, catalessi, ecc.) ma non è mai possibile rilevare direttamente in essi un’azione psicomimetica vera e propria.
Tutte le sostanze psicotizzanti determinano un quadro psicopatologico caratteristico ad ognuna di esse che dal Hellpach e dal Cargnello è stato chiamato «psicoma».
Questi AA. hanno ritenuto utile distinguere con questo termine, quelle psicosi prodotte da intossicazioni esogene, prodotte cioè da sostanze estranee all’organismo, da quelle endogene, dovute ad autointossicazioni prodotte da qualche fattore patogeno umorale o dismetabolita, ad azione schizofrenizzante, di cui si è supposta l’esistenza e che, in via di ipotesi, potrebbe anche essere ricondotto a qualche sconosciuto derivato indolico (227, 228).
Lo psicoma da LSD, ampiamente descritto con ricchezza di particolari da moltissimi Autori e dallo stesso Cargnello è caratterizzato da un quadro sindromico che il Giberti così riassume:
— «Disturbi percettivi (distorsioni percettive, illusioni, fenomeni allucinatori, fenomeni cenestesici, ecc.)
— alterazioni dello schema corporeo e della coscienza dell'Io (depersonalizzazione, ecc.)
— modificazioni ideo-affettive con comparsa di convincimenti e di stati d'animo semideliranti, di ansia, panico, euforia, con o senza corrispondenti rappresentazioni ideatorie e con modificazioni del decorso ideico
— alterazioni comportamentali (riso e pianto immotivati, eccitamento psicomotorio, stati di stupore, ecc.)
— fenomeni neurologici (modesta atassia, Romberg, ecc.) e neurovegetativi (midriasi, arrossamento del volto, modificazioni pressorie e della frequenza cardiaca)».
E' ineressante notare che questo quadro sindromico non si manifesta con le stesse modalità nei diversi soggetti, ma esistono differenze individuali dovute non soltanto alla diversa sensibilità al farmaco e quindi di ordine quantitativo, ma altresì qualitative che si osservano a parità di dose, e che sembrano connesse con le caratteristiche di personalità specifiche individuali. Esisterebbe quindi, sotto questo aspetto, una gerarchia di sintomi che, secondo alcuni autori possono essere così rappresentati:
— «Sintomi primari (costituenti la sindrome di base o comune da LSD).
— Sintomi secondari, costituenti la reazione psicologica individuale agli effetti «primari» del farmaco.
— Sintomi terziari a puro significato «psicologico» (effetto magico secondo Bassi), quali sono quelli riscontrabili con le prove con placebo».
A parte quindi i sintomi primari che si manifestano in tutti i soggetti, in quanto prodotti direttamente dal farmaco per una sua attività farmacologica diretta specifica (sintomi vegetativi , disturbi della percezione, ecc.), sono i sintomi secondari e terziari quelli cui va attribuita la maggior importanza «Quali espressioni individuali di particolari modalità reattive e di singole disposizioni psicologiche o psicopatologiche insite nella struttura di ciascuna personalità e di essa caratteristiche e proprie».
Per cui la LSD può essere considerata, secondo Sloane e Lovett Doust (229), «come un farmaco rivelatore ed evidenziatore di caratteristiche individuali, non solo nel tipo di reattività psicofarmacologica, ma anche negli aspetti più significativi e tipici di date situazioni psicopatologiche attuali o preesistenti».
Uno degli aspetti più interessanti dell'attività di questi farmaci e della LSD in particolare, consiste dunque nell'inibire o nell'abolire la resistenza della barriera psicologica all'affiorare di quei ricordi che agiscono in senso psicotraumatico (momento patogenetico dei diversi complessi), determinando un processo di psicolisi [Leuner (230)] per il quale il ricordo subconscio di avvenimenti precedenti può essere attualizzato e rivissuto sotto l'azione del farmaco. In queste condizioni il trattamento psicoterapeutico è molto facilitato in quanto, secondo Hoch (231), la LSD può evidenziare un «materiale psicodinamico» non altrimenti ottenibile.
Busch e Johison (232) considerano la LSD come un aiuto nella psicoterapia per ottenere un più facile e rapido accesso in pazienti cronicamente isolati e Savage (233) riconosce l'importanza dello studio degli effetti allucinogeni prodotti dalla LSD al fine di un loro possibile impiego per facilitare la «esplorazione della personalità».
Qesto trattamento venne sperimentato per la prima volta in America da Busch e Johnson (234) e successivamente da molti altri [Frederking (235, 236), Leuner (237, 238), Sandison e coll. (239-243), Savage (244), Abramson e coll. (245, 246), Eisner e Cohen (247, 248) e altri].
Le principali indicazioni cliniche del trattamenro lisergico e quelle nelle quali si ottengono i migliori risultati, sono le psiconevrosi e in particolare quelle forme di tipo fobico-ossessivo. Buoni risultati sono stati ottenuti anche in tutti i casi di nevrosi ansiose e in quelle accompagnate da disturbi sessuali (impotenza, frigidità, ecc.); anche le personalità psicotiche e alcuni tipi di alcolisti possono rispondere favorevolmente al trattamento lisergico.
Le controindicazioni alla terapia lisergica sono rappresentate da alcune gravi malattie organiche quali le cardiopatie scompensate, l'ipertensione grave, alcune epatopatie ed anche l'età (al di sotto dei 18 anni, al di sopra dei 65) può sconsigliare, sebbene non sempre, la somministrazione di LSD.
Ugualmente sconsigliato è l'impiego della LSD in alcune malattie psichiatriche, in considerazione del fatto che essa potrebbe provocare gravi crisi ansiose, attualizzare psicosi latenti o accentuare la disposizione a stati depressivi od anche al suicidio ove ne esista già la tendenza. Una terapia abbinata a base di neurolettici (cloropromazina) o di barbiturici, può evitare questi pericoli o diminuirne la frequenza.
Inoltre, secondo Giberti (228), un basso livello intellettuale, una scarsa collaborazione o atteggiamenti diffidenti e ostili, rappresentano altrettanti fattori negativi che possono ostacolare il buon esito del trattamento lisergico.
La LSD è generalmente ben tollerata; qualche eventuale reazione spiacevole che potrebbe manifestarsi nel corso del trattamento, può essere comunque rapidamente stroncata mediante un'iniezione di cloropromazina o con la somministrazione di una dose di Melleril Cerletti e coll. (227).
La LSD, oltre che a scopo terapeutico vero e proprio, può essere utilmente impiegata come mezzo diagnostico ed anche per produrre stati di psicosi artificiali o esogene («psicomi» di Hellpach-Cargnello o «psicosi modello» di Beringer).
L’impiego a scopo diagnostico della LSD deriva dalle sue proprietà psicotossiche per le quali sintomi ignorati, incerti o non ben rilevabili, caratteristici di determinate situazioni psicopatologiche quali alcune psicosi endogene (schizofrenia e psicosi maniaco-depressive in particolare) vengono da essa evidenziati o accentuati, in maniera da rendere più facile la valutazione ai fini diagnostici o diagnostico-differenziali.
La nozione di «psicosi modello» trae origine dal fatto che alcune sostanze, quali quelle ad azione psicodislettica, possono riprodurre quadri psicopatologici più o meno parzialmente comparabili con le psicosi endogene che si osservano clinicamente.
Questa constatazione ha permesso di formulare l'ipotesi che quei fattori patogeni umorali ad azione schizofrenizzante, tuttora sconosciuti, di cui si è supposta l’esistenza e di cui si è già accennato, presentino qualche analogia chimica, biochimica o farmacologica con le sostanze ad azione psicodislettica capaci di produrre una psicosi esogena (o psicoma), confrontabile con le psicosi endogene clinicamente osservabili.
In realtà gli psicomi prodotti dai psicodislettici più comunemente usati in farmacopsichiatria, quali la mescalina, la LSD, la psilocibina, l’adrenocromo, si assomigliano fra loro, secondo Giberti (228), molto piu di quanto possono assomigliare ad una qualsiasi altra psicosi della clinica.
Tuttavia, se è vero che il quadro delle psicosi modello non e confrontabile nel suo insieme, con quello caratteristico delle psicosi cliniche, «Somiglianze che talora sconfinano con l'identificazione si possono talora rilevare — secondo Giberti (228) — tra singoli sintomi o sindromi delle psicosi modello e singoli sintomi o sindromi delle psicosi cliniche». Ed è stata appunto la constatazione di questa, sia pur parziale, somiglianza fra le psicosi cliniche e le psicosi modello, a giustificare il grande interesse che queste ultime hanno suscitato in campo psichiatrico, per la ricerca di quegli sconosciuti fattori patogeni schizofrenizzanti di cui si è detto, e quindi per lo studio della patogenesi delle psicosi endogene.
Esiste su questo argomento una letteratura vastissima, ma non e nostro compito approfondire ulteriormente un argomento così specializzato, che noi abbiamo creduto utile trattare soltanto riassuntivamente ed a grandi linee, concernendo esso l'attività di derivati artificiali di sostanze naturali e che, come tali, esorbitano dai limiti impostici in questa nostra opera. D'altra parte, sostanze interessanti come hanno dimostrato d’essere i derivati di semisintesi degli alcaloidi naturali della Segale cornuta, o quelli di altre droghe di cui ci siamo già occupati, non potevano da noi essere completamente trascurate e per ciò, piuttosto di una vasta trattazione, abbiamo creduto opportuno riferire le notizie essenziali, al fine di offrire allo studioso che intendesse approfondire l’argomento, la possibilita di ricostruire più facilmente la catena bibliografica attraverso i riferimenti contenuti nei lavori citati.
Aggiungeremo soltanto che altri derivati dell'acido lisergico, quali la dietilamide dell'acido 2-bromo lisergico (BOL 148), la pirrolidide dell’acido lisergico (LPD 824) e la monoetilamide dell’acido lisergico (LAE 32), hanno un interesse più teorico che pratico e sono, almeno per ora, utilizzati più a scopi sperimentali che terapeutici.
La BOL 148 è un sedativo leggero, privo di effetti psicotizzanti, la cui attività si manifesta soltanto con un potenziamento dell’azione dei normali sedativi. In comune con la LSD ha soltanto la sua azione fortemente antagonizzante quella della serotonina.
Anche la LPD 824 è priva degli effetti psicotizzanti della LSD ed ha una debole azione antagonizzante quella della serotonina. Ricompare invece in essa l’effetto uterotonico ed una prolungata azione ipotensiva di probabile origine centrale. Essa è praticamente priva di proprietà adrenolitiche.
La LAE 32 ha un'attività psicotonizzante qualitativamente comparabile con quella della LSD, sebbene da essa differisca in alcuni particolari [Callieri (228), Callieri e Rovetta (249)]. Sui soggetti sani la sua azione si manifesta con dosi 10 volte superiori a quelle della LSD, mentre sui malati può esercitare un effetto sedativo simile, ma più debole, di quello prodotto della cloropromazina [Holms (250, 251)].
Rothlin e Fanchamps (179) hanno riassunto, comparativamente, nel seguente quadro, le caratteristiche farmacologiche e tossicologiche dei suddetti derivati dell'acido lisergico.

9
Applicazioni terapeutiche degli alcaloidi naturali della Segale cornuta e dei loro derivati idrogenati
a) Alcaloidi naturali: l’ergotamina, sotto forma di tartrato (Gynergen), l'ergobasina (ergonovina o ergometrina) e la metilergobasina, della quale parleremo in questo paragrafo anche se non è un prodotto naturale ma un derivato di semisintesi, trovano vasto impiego in ostetricia e in ginecologia per le loro proprietà uterotoniche. Di tale loro attività si è già detto nel paragrafo riguardante la loro azione farmacologica, aggiungeremo ora che l'effetto uterotonico dell'ergotamina iniettata intramuscolo, si manifesta dopo un periodo di latenza di 15-20' e si protrae per 12-24 h.
L’ergobasina agisce invece più rapidamente ma la sua azione è di più breve durata: 2-4 h.
L'azione uterotonica della metilergobasina è più energica di quella della ergometrina e della ergobasina, più rapida e di durata intermedia: 2-8 h. Essa, a differenza dell'ergobasina e dell’ergotamina, non determina ipertensione che molto raramente ed è meglio tollerata degli altri due alcaloidi.
L'ergobasina e la metilergobasina per iniezione endovenosa (0,2 mg o 0,2-0,4 rispettivamente), sono indicate nella terza fase del parto, dopo l’espulsione della testa del feto o subito dopo la nascita. E' possibile abbreviare con ciò il periodo placentare e di ridurre la perdita di sangue del 50%.
Altri impieghi ostetrico-ginecologici di questi tre alcaloidi sono i seguenti: per risolvere le atonie dell'utero e per accelerare la sua involuzione dopo il parto; nel taglio cesareo, dopo l'estrazione del feto, la metilergobasina è impiegata per iniezioni endomuscolari, endovenose o anche direttamente nel muscolo uterino; come uterotonici dopo un raschiamento o un aborto incompleto e, infine, per combattere le metro- e le menorragie dovute alle più varie cause.
Come antiemicranico e vasocostrittore, l'ergotamina, analogamente al suo derivato idrogenato, di cui sarà detto in seguito, è impiegata per interrompere le crisi emicraniche o altre cefalee di origine vascolare. La dose di 0,25-0,50 mg intramuscolo, riesce efficace nel 90% di questi casi [Moor (252), Sullivan (253), Wollf (254, 255)].
Somministrata per os il suo effetto è piuttosto scarso; in associazione con la caffeina essa risulta invece molto più attiva [Wolff (255), Frledmann e Brenner (256)].
Come farmaco simpaticolitico l'ergotamina è meno attivo della diidroergotamina e dei derivati idrogenati degli alcaloidi ergotossinici (diidroergocornina, diidroergocristina, diidroergocriptina) la cui attività è superiore, sotto questo aspetto a quella di tutti gli altri. L’impiego dell’ergotamina può essere comunque preferito nei casi in cui, più che un effetto simpaticolitico, si desideri ottenere un’azione tonica sulla muscolatura liscia, come nell'atonia gastrointestinale, nel megacolon, nell’atonia vescicale (257) o una vasocostrizione (268), oppure un forte effetto bradicardico nei casi di tachicardie nervose e nelle tireotossicosi (259, 260, 261).
In associazione con un parasimpaticolitico (Belladonna o suoi alcaloidi) e con un barbiturico, l'ergotamina è vantaggiosamente impiegata come equilibratore del sistema nervoso autonomo, nella terapia delle distonie neurovegetative (262, 263).
b) Derivati diidrogenati
I derivati diidrogenati degli alcaloidi naturali della Segale cornuta hanno un impiego terapeutico assai più vasto di questi ultimi, interessando essi vari campi della terapia.
Nel campo ostetrico ginecologico la diidroergotamina è stata raccomandata per primo dal Sauter (264) per risolvere gli spasmi del collo dell'utero intra partum, caso nel quale, secondo Spanio (265) essa, abbassando il tono delIa muscolatura uterina, aumenta l'ampiezza delle contrazioni, dilata i vasi e diminuisce gli spasmi del segmento inferiore dell’utero senza bloccarne l'automatismo funzionale. La risoluzione dello spasmo cervicale, accompagnata dall'abbassamento del tono di riposo e dell'aumento deIl'ampiezza delle contrazioni, determina una più rapida progressione della dilatazione e quindi del parto.
La dose della diidroergotamina impiegata in questi casi dal Sauter (264, 266) era di 0,25 mg per via intramuscolare, ma da altri Autori [Reist (267) ed altri] sono raccomandate dosi inferiori e cioè di 0,1-0,2 mg per via intramuscolare o sottocutanea. Le osservazioni cliniche di questi Autori vennero in seguito confermate da molti altri [Baskin e Crealok (268), Ferraz (269), Gill (270), Gill e Farrar (271), Jelinek (272) e da altri]. Analoga azione è stata constatata dal Wilhelm (273) sperimentando su 100 primipare, un’associazione degli alcaloidi ergotossinici (Hydergina).
La diidroergotamina o, meglio, la suddetta associazione in quanto meglio tollerata, provocando essa molto più raramente della prima sintomi secondari di nausea e di vomito, è stata impiegata dal Seibert (274) nell’isterosalpingografia al fine di risolvere lo spasmo riflesso che non raramente si osserva a livello dell’istmo tubarico e di facilitare così il passaggio del mezzo di contrasto. Allorchè lo spasmo non si risolve spontaneamente dopo pochi minuti, la sua persistenza e la conseguente mancata penetrazione del mezzo di contrasto, potrebbe altrimenti simulare un’occlusione tubarica dovuta ad altre cause e condurre quindi ad una errata diagnosi.
Come antiemicranici i derivati diidrogenati agiscono in maniera simile all'ergotamina. La diidroergotamina ne differisce perchè i suoi effetti secondari di nausea e di vomito sono più deboli e perchè in essa manca praticamente l'effetto uterotonico, ciò che ne permette l’impiego anche durante la gravidanza e durante il periodo mestruale [Horton e coll. (275)].
I risultati migliori si ottengono con la diidroergotamina per somministrazione parenterale e precoce e praticando una posologia superiore a quella indicata per l’ergotamina (1-3 iniezioni di una fiala di diidroergotamina alla distanza di un'ora o, per ottenere un effetto più rapido e più intenso, 0,5 mg endovena).
Secondo Pasteur Vallery-Radot (276) un certo numero di emicranici reagiscono meglio all'ergotamina che alla diidroergotamina.
L’ergotamina, la diidroergotamina e i derivati idrogenati degli alcaloidi ergotossinici, in associazione con la caffeina, indicati per la terapia di attacco e, la diidroergotamina, l'associazione degli alcaloidi diidrogenati del gruppo dell'ergotossina e l'ergotamina, associata con gli alcaloidi della belladonna e un barbiturico, impiegati per la profilassi delle emicranie, sono ugualmente indicati nella terapia delle varie forme di cefalee (vasomotorie, da tensione nervosa e delle cefalee istaminiche).
In altre forme di cefalee, come quelle post-traumatiche, da abuso di tabacco o conseguenti a puntura lombare, può essere sufficiente, secondo Hofmann (277), il trattametno orale con diidroergotamina, con i diidroalcaloidi ergotossinici o con l’associazione ergotamina-caffeina.
Nelle affezioni in cui esiste o prevale una componente simpaticotonica, l’ergotamina, la diidroergotamina e gli alcaloidi ergotossinici diidrogenati sono stati preconizzati da molti Autori.
Così nel morbo di Flajani-Basedow e nelle sindromi distiroidee essi sono consigliati da Adlersberg e Porges (278), da Sangiorgi (279), da Pennetti (280), da Pariscenti (281), da Melandri e Inglese-Gonora (282), da Rabboni (283).
Nelle tachicardie postoperatorie, il pretrattamento ergotaminico è stato impiegato con buoni risultati da Rabboni (283), da Brace e Reid (284), da Hinton (285) e nelle tachicardie parossistiche dopo strumectomia, da Forster (286).
Nelle affezioni del tubo digerente, come in certe forme di ulcera gastrica
o duodenale e di dispepsie ipercloridriche su base neurogena, nelle quali si supponga l’esistenza di una componente simpaticotonica [Edlen (287), Scaffidi (288)], la diidroergotamina, come l’ergotamina, è stata consigliata e vantaggiosamente impiegata da diversi autori [Spuhler (289), Pokorny (290), Prusik (291)].
Ua rapida remissione della sintomatologia dolorosa da ulcera, resistente all'usuale trattamento con sedativi e con antivagali, è stata ottenuta in alcuni casi da Spuhler con la somministrazione orale di diidroergotamina e Pariscenti (281) ottenne, in qualche particolare caso, la rapida cicatrizzazione della lesione ulcerativa.
Chiray e Chéne (292) sperimentarono l'ergotamina in alcune discinesie del tubo digerente, trovando che essa determina un forte aumento della contrattilità dello stomaco, il cui vuotamento viene per conseguenza accelerato. Essa può essere quindi indicata, secondo gli AA. nel trattamento dell'atonia gastrica, con o senza ptosi, ciò che venne in seguito confermato anche da altri AA. i quali impiegarono l'ergotamina e il suo derivato idrogenato nell'atonia gastrica semplice o complicata da ulcera duodenale [Vaz Serra (293), Baronio (294)].
La diidroergotamina è stata inoltre impiegata per risolvere lo spasmo del cardias, da Himfeld (295), da Pokorny (290); nelle sindromi gastroenteriche riflesse prodotte da colecistite cronica, da appendicite cronica, da colite ulcerosa segmentaria ecc. da Pariscenti (281); per stimolare la motilità nell'atonia intestinale postoperatoria e in alcune forme congenite di discinesia (Megacolon, doligocolon) da Berger (296); da Loddi (297), da Cave Bondi (298) e da Levrat (299) nelle forme di atonia colecistica.
L'associazione degli alcaloidi ergotossinici, è stata impiegata da Rossano e Legera (299a) nel trattamento delle gravi emorragie del tubo digerente.
Nelle forme erpetiche Friis e Moller (300) avendo intravisto l'esistenza di alcune analogie fra la cefalea emicranica e le algie erpetiche, impiegò con successo l’ergotamina nel trattament
L’osteocondrosi cervicale nella cui patogenesi è stata accertata una indubbia partecipazione del simpatico, è favorevolmente influenzata, secondo alcuni autori [Benthe e Schmid (303), Benthe (304), Sàker (305 )], dagli alcaloidi ergotossinici diidrogenati, somministrati per os, per via sublinguale o sottocutanea.
L'ipertensione arteriosa rappresenta com’è noto, una delle principali indicazioni dei derivati diidrogenati degli alcaloidi della Segale cornuta ad azione simpaticolitica e, in particolare, di quelli ergotossinici, la cui associazione costituirebbe secondo Corsi (306), «Il mezzo più efficace, più sicuro e più maneggevole a disposizione del medico, per dominare validamente, quella componente neurotonica, individuabile nell’ipertono simpatico, che incide in maniera fondamentale sul determinismo dell’ipertensione essenziale». La sperimentazione clinica ha dimostrato che i casi di ipertensione che meglio e più elettivamente rispondono a questa terapia, sono quelli con equilibrio neurovegetativo instabile [Odenthal (307)], le ipertensioni neurogene [Corsi (306)], l’ipertensione climaterica [Von Heubner e Wohlrab (308)], l'ipertensione labile con oscillazioni pressorie [Lasch (309) ], Anche la maggior parte delle forme di ipertensione su base arteriosclerotica rispondono favorevolmente a questo trattamento, fatta eccezione di quei casi in cui esistano complicazioni renali [Wilbrandt (310)].
L’ipertensione da tossicosi gravidica, nel cui meccanismo patogenetico è stato riconosciuto uno spasmo vascolare generalizzato, risponde anch’essa in maniera favorevole e pronta agli alcaloidi ergotossinici diidrogenati [Rupp (311), De Bellis (312), Colucci (313), Boveri e Giuliani (314)].
Tutte le affezioni vascolari periferiche, siano esse organiche o funzionali, arteriose o venose, traggono evidenti vantaggi, nella maggior parte dei casi, dal trattamento con la suddetta associazione la quale, risolvendo gli spasmi vascolari o favorendo, nel caso di arteriti obliteranti, lo stabilirsi del circolo collaterale, migliora notevolmente l’irrorazione sanguigna periferica. Moltissimi sono gli autori che hanno riferito sull’argomento [Puglionisi e Eppinger (315), Winsor (316), Vogler (317),Popkin (318). Roberts e Coll. (319), Pisani e Micheli-Pellegrini (320), Kappert (321-322) ed altri], portando il contributo di un’estesa casistica.
Nell’insufficienza coronarica gli alcaloidi ergotossinici diidrogenati, pur non possedendo proprietà coronarodilatatrici comparabili con altri farmaci più specifici e quindi più indicati nel trattamento d’urgenza delle crisi anginose, sono stati trovati utili nel trattamento di base, nella terapia dell'angina di petto con eretismo cardiaco [Schimert e Zickgraf (323)] e nei casi di insufficenza coronarica di varia natura come nell’angina da sforzo in normo e ipertesi, nell’angor notturno, nei postumi da infarto, nell’aortite luetica. In questi casi, dopo un trattamento opportunamente prolungato, Kutz Echave (324) ha potuto constatare la scomparsa o l’attenuazione dei disturbi precordiali.
Nei disturbi circolatori cerebrali l’utilità dell’associazione degli alcaloidi ergotossinici diidrogenati è stata provata sperimentalmente da diversi autori [Rothlin e Taescher (325), Schneider e Wiemers (326), Jotten (327), Hafkenschiel e Coll. (328)] ed i risultati clinici ottenuti da altri [Lasch (329), Schoeber (330), Strauss (331)], hanno confermato la loro attività nel trattamento di vari disturbi circolatori cerebrali, quali il Buerger cerebrale, l’arteriosclerosi o l’angiosi diabetica con localizzazione cerebrale, gli stati postapoplettici recenti e vecchi e, secondo Hadorn e Stucki (332), la loro somministrazione per via intramuscolare sarebbe indicata anche nelI’ictus.
Nelle sindromi otorinolaringoiatriche l’ergotamina e l’associazione degli alcaloidi ergotossinici diidrogenati, sono risultati efficaci in alcune sindromi correlate con stati di ipertono simpatico e squilibrio vasomotorio.
Essi furono impiegati da Vyslonzil (333), da Bachi (334) e da Jacob
(335) nei processi atrofici della mucosa nasale; da Anderson e Rubin (336) nell’epistassi di origine ipertensiva; da Weruly (337) e da Lavino e Lecco (338) nella sindrome di Menière.
Nei disturbi circolatori oculari infine, quali le occlusioni arteriose della retina, i disturbi circolatori retinici della coroidea e del nervo ottico, specialmente se secondari ad altre affezioni (ipertensione, arteriosclerosi, tromboangioite obliterante, ambliopia nicotinica) la suddetta associazione ergotossinica, può migliorare anche durevolmente, secondo Hager (339) e Simkova e Zahn (340), l’irrorazione sanguigna e il metabolismo retinico.
Nel glaucoma acuto e subacuto, tanto la diidroergotamina (341) quanto gli alcaloidi ergotossinici diidrogenati (342), possono determinare un rapido abbassamento della pressione endoculare e la sedazione del dolore.
Tossicologia. Gli alcaloidi naturali della Segale cornuta, per somministrazione prolungata, ad eccezione dell’ergobasina, possono provocare vasocostrizione arteriolare, con conseguenze gravi che talora possono giungere sino alla comparsa di manifestazioni cangrenose delle estremità.
I derivati diidrogenati sono meno tossici e sono esenti da quest’azione. Essi possono determinare qualche azione secondaria, particolarmente in soggetti che presentano una spiccata sensibilità verso queste sostanze (ipertesi per es.), con sintomi di nausea, di vomito, di rossore, di mal di capo, di debolezza e di incontinenza urinaria.
L’avvelenamento acuto è piuttosto raro. Esso può tuttavia verificarsi per ingestione di forti dosi di Segale cornuta o dei suoi preparati galenici a scopo abortivo, oppure con gli alcaloidi naturali quando vengano somministrati a dosi troppo elevate.
L'avvelenamento cronico (ergotismo) dovuto a farine provenienti da cereali infestati dallo sclerozio di Claviceps purpurea sono attualmente molto rari e si potrebbe dire eccezionali.
Anche l’intossicazione che si verificò recentemente in Francia, a Pont Saint Esprit nell’agosto 1951 e che venne inizialmente attribuita a Segale cornuta, si potè invece stabilire in seguito, che responsabile di quella intossicazione collettiva, fu invece un prodotto mercuriale impiegato per la conservazione dei semi [Rothlin e Fanchamps (179)].
Abbiamo già accennato alle intossicazioni collettive da Segale cornuta che si verificarono principalmente in Francia e nel Nord-Europa durante il Medio Evo, aggiungeremo ora che queste intossicazioni si presentavano sotto due forme: convulsiva e cangrenosa.
Queste due forme di intossicazione cronica o di ergotismo, non sempre sono nettamente distinguibili al loro inizio e ciò sia perchè esistono forme intermedie, sia perchè inizialmente le due forme presentano una sintomatologia comune: stanchezza, depressione, dolori lombari e alle estremità, specialmente al polpaccio, nausea, a volte vomito, spesso indebolimento delle facoltà mentali, formicolio della pelle.
Dopo un periodo variabile da pochi giorni ad alcune settimane, l’ergotismo cangrenoso si manifesta con gonfiore e infiammazione delle estremità, più frequentemente alle inferiori; dolori fortissimi e senso di bruciore intenso «come se un ferro rovente attraversasse le membra colpite» da cui le varie denominazioni con le quali durante il Medio Evo era nota questa forma di ergotismo: fuoco di San Antonio o di San Marziale, mal des ardents, ignis sacer o fuoco sacro ecc.
A questi primi sintomi seguono i tipici fenomeni cangrenosi. La cute delle parti colpite si arrossa, poi assume un colore azzurro-nerastro, l’epidermide si stacca dalle regioni cangrenose e attraverso varie fasi, con caratteristiche variabili, si può giungere alla cangrena secca delle dita o del piede e, nei casi più gravi, degli arti. Più raramente vengono colpite le parti del viso (naso, orecchie). Il processo cangrenoso si svolge inizialmente con dolori acutissimi cui segue una fase di completa anestesia. La parte cangrenosa si raggrinza e si dissecca; a volte si notano fatti di putrefazione (cangrena umida).
Il processo cangrenoso può estendersi dalle prime falangi alle dita ed all’intero arto, sino alla perdita spontanea o per amputazione chirurgica delle parti colpite.
Le parti più frequentemente colpite sono gli arti inferiori, con perdita delle dita o del piede e più raramente dell'arto. Meno frequente è la perdita della mano. Il malato può migliorare dopo aver subito queste amputazioni ed anche guarire senza altre conseguenze.
Le prime descrizioni dell’ergotismo cangrenoso risalgono al X secolo, mentre quelle della forma convulsiva si ebbero soltanto nel secolo XVI.
L’ergotismo convulsivo che si osservava con maggior frequenza nei Paesi ad Ovest del Reno, si manifesta con sintomi di formicolio alle estremità, convulsioni, forti dolori, nausea, vomito, cecità, sordità, vertigini, mal di capo, oppressione, diarrea, senso di fame (da ipoglicemia), anestesia cutanea, paralisi, convulsioni epilettiformi, delirio, indebolimento delle facoltà mentali, afasia; sintomi oculari quali midriasi, ambliopia, diplopia, rigidità del cristallino, glaucoma, degenerazione del nervo ottico, nistagmo.
L’esito letale può avvenire entro tre giorni oppure può seguire la guarigione dopo molto lunga convalescenza e con postumi di emiplegia, paraplegia o epilessia.
La presenza di turbe psichiche o sensoriali che compaiono nel quadro della forma convulsiva dell’ergotismo, denoterebbe secondo alcuni (179) che responsabile di questa intossicazione non siano soltanto gli alcaloidi specifici contenuti nella droga, ma anche altre sostanze quali le amine biogene e anche un concomitante stato carenziale di vitamina A [Mellamby (343)].
Casi di intossicazione acuta dovuta a preparati di Segale cornuta o a suoi alcaloidi furono riferiti da diversi autori. Ricorderemo fra i tanti, i seguenti: Babierre (344) che descrisse un’intossicazione acuta di tipo convulsivo, avvenuta in una donna che aveva ingerito una dose di 5-6 g di Ergotina Bonjean per combattere una menorragia.
Un caso letale per ingestione di dosi ripetute di estratto e di polvere di Segale cornuta a scopo abortivo, fu descritto da Davidson (345) e un altro da Rosenbloom e Schildecker e riferito da Barger (346).
Un caso di intossicazione acuta non letale a scopo suicida fu riferito da Nielsen (347). Un altro da Yater e Cahill (348), pure non letale, da iperdosaggio (0,5 mg di ergotamina 3 volte al giorno, endovena per il periodo di una settimana), con una dettagliata descrizione delle lesioni patologiche vasali che ne conseguirono.
Chassar Moir (349) ha riferito tre casi di intossicazione acuta avvenuta in donne cui venne somministrata ergobasina per via intramuscolare alla dose di 0,5 mg. In considerazione del fatto che tale dose non supera i limiti di quella considerata terapeutica, l’intossicazione venne attribuita dall’A. ad un fenomeno di idiosincrasia.
Lo Storck (350) ha trovato che su 42 casi di accidenti tossici provocati dall'ergotamina, 23 si sono verificati in campo ostetrico ed 11 in pazienti ipertiroidei. La cangrena si è verificata in 21 pazienti e si ebbero a lamentare 8 decessi. Secondo l'A. gli accidenti tossici si verificherebbero soltanto nello 0,01 % dei casi trattati con ergotamina.
Durante le epidemie di ergotismo si manifestarono con grande frequenza aborti e parti prematuri e già fin dal secolo XVII si tentò di utilizzare la Segale cornuta come rimedio espulsivo facilitante il parto. Ma l'impiego della droga, senza una sufficiente conoscenza del suo meccanismo d'azione e delle sue caratteristiche di tossicità, condusse a gravi inconvenienti, cosicché il suo uso venne combattuto e quindi abbandonato sino alla fine del secolo XVIII e fu soltanto al principio del secolo scorso che questa droga venne restituita alla terapia.
Controindicazioni. L’uso della Segale cornuta e dei suoi alcaloidi naturali, è controindicato nel corso di infezioni, in quanto l'esistenza di fatti settici può facilitare la comparsa di fenomeni cangrenosi. Altre controindicazioni sono rappresentate dai disturbi vascolari, quali l’arteriosclerosi grave, le arteriti, i disturbi coronarici, la tromboflebite, il morbo di Reynaud ed il morbo di Burger, le lesioni epatiche e renali, il prurito, specialmente se di origine epatica e, infine, la gravidanza.
Crispolti (351) fa rilevare come l’impiego dell'associazione degli alcaloidi ergotossinici diidrogenati nel trattamento dell’ipertensione arteriosa, debba essere condotto con la massima prudenza. Negli ipertesi con funzione renale integra, ma con ipertrofia ventricolare sinistra e deficiente irrorazione coronarica, la suddetta associazione usata anche a dosi modeste, con o senza preparazione miocardiotonica, può essere causa, secondo l’A., di edema polmonare improvviso ed imponente. Egli consiglia pertanto di non usare il preparato risultante dalla suddetta associazione, che nei casi di ipertensione essenziale con miocardio integro e senza deficit coronarico.
Metabolismo ed eliminazione. Non sono ben note le trasformazioni che subiscono gli alcaloidi della Segale cornuta nell’organismo. Negli organi parenchimatosi ed in particolare nel fegato, si è trovata una concentrazione dell’alcaloide somministrato, maggiore che nel sangue.
Indubbiamente gli alcaloidi della Segale cornuta vengono, almeno in gran parte, distrutti dal fegato, e ciò sarebbe provato dal fatto che il loro dosaggio eseguito 5' dopo la somministrazione endovena di una determinata dose di ergotamina, rivela la presenza in quest’organo, di non più dello 0,5% della dose iniettata, ma la velocità con cui si compie tale distruzione, risulta notevolmente ridotta allorché nel fegato siano state prodotte lesioni degenerative dovute ad intossicazione da cloroformio o da fosforo.
I risultati di ricerche eseguite con una reazione cromatica specifica per l’anello indolico integro, hanno fatto ritenere ad alcuni autori [Kobert e Dille (352), Rothlin (353)] che il nucleo dell’acido lisergico viene rapidamente degradato nell’organismo.
L’escrezione urinaria dei suddetti alcaloidi è insignificante e sembra che anche la nefrectomia bilaterale non abbia sulla loro eliminazione un effetto apprezzabile.
Titolazione dei preparati di Segale cornuta
Sebbene l’impiego in terapia della Segale cornuta e dei suoi preparati galenici, sia attualmente molto diminuito, in quanto sempre più va diffondendosi la tendenza a sostituirli con gli alcaloidi puri, il problema della titolazione presenta tuttavia un interesse non trascurabile.
E’ noto come il contenuto del fitocomplesso attivo e quindi l'attività della droga e dei suoi preparati galenici subisca notevoli variazioni, in rapporto specialmente con il luogo di provenienza della droga stessa e con i metodi usati per ottenere le sue preparazioni più comunemente impiegate in terapia, e è anche noto come ciò abbia fatto da tempo riconoscere la necessità di ottenere preparati ad attività costante.
Come al solito, si è tentato di raggiungere questo scopo, mediante la normalizzazione dei metodi di preparazione, completata dalla titolazione chimica o biologica dei principi attivi.
Per quanto riguarda la titolazione chimica, occorre dire che l'attendibilità dei vari metodi proposti, fra i quali ricorderemo quelli di Keller (354), di Wood e Hofer (355), di Goris e Liot (356), di Smith (357), di Kussner e Wolff (358) e molti altri che risultano da modificazioni apportate a questi metodi da diversi autori, è molto relativa. Essi non permettono infatti di valutare le variazioni del rapporto esistente fra i vari alcaloidi, il che può notevolmente influire quantitativamente sulla reazione biologica, nel senso che due preparati per i quali si sono ottenuti gli stessi valori per il contenuto alcaloideo totale, possono esplicare una attività biologica diversa. Inoltre, perchè quasi tutti i metodi chimici presentano l'inconveniente dovuto al fatto, che insieme con gli alcaloidi si dosano anche altre sostanze basiche inattive ma estraibili con i comuni solventi impiegati. Fa eccezione, sotto questo aspetto il metodo di Smith il quale essendo basato sulla reazione di Wasicky (359), molto specifica, permette di dosare soltanto gli alcaloidi. Ciò nonostante, la titolazione di vari estratti da noi eseguita impiegando questo metodo, pur tenendo conto delle modificazioni ad esso apportate da Noel, Allport e Cocking (360), hanno provato che anche quelle preparazioni per le quali si ottennero risultati del tutto negativi, alla prova biologica eseguita direttamente su segmenti isolati di utero, comparativamente con una soluzione di tartrato di ergotamina allo 0,05% dimostrarono una notevole attività uterotonica (361).

0
Con i metodi biologici si ottengono indubbiamente risultati migliori, anche se anch'essi non sono esenti da critiche e se i loro risultati non sempre sono proporzionali all’attività terapeutica.
Essi si basano su vari tests: il più antico ed oggi abbandonato, è quello che si basa sulla cianosi della cresta di gallo, una descrizione del quale è stata data anche da Edmond e Hale (362).
Rothlin (363) ha indicato un metodo basato sull’attività che esplicano i preparati di Segale cornuta sull’utero e sulla vagina in situ di coniglia in anestesia, comparativamente con una sostanza campione; un altro metodo su cui hanno riferito Foster e Stewart (364) e Vos (365), considera il tempo di latenza, del tempo cioè che intercorre fra il momento dell’applicazione del preparato e il momento in cui compare la reazione, sempre in confronto con una sostanza campione.
Molti sono i metodi che si basano sull’annullamento o sull’inversione dell'effetto adrenalinico prodotto dalla Segale cornuta, il più noto e usato dei quali è quello di Broom e Clark (366). Da questo metodo, che viene eseguito su segmenti isolati di utero, derivano tutti gli altri che si valgono di altri reattivi biologici. Ricorderemo fra questi quello proposto da Raymond-Hamet (367) che considera l’annullamento dell'azione vasocostrittrice renale nel cane, di una determinata dose di adrenalina; quello di Masuda e Coll. (368) che considera lo stesso effetto vasocostrittore sulla rana preparata secondo Trendelenburg; quello di Planelles e Coll. (369) che per la valutazione dell’effetto adrenolitico si vale di segmenti isolati di intestino di coniglio e quello di Caffier (370) e di Brugger (371) con il quale viene invece impiegata a tal fine, la vescicola seminale di cavia.
I rilievi che possono essere fatti sull'attendibilità di questi metodi, sono molteplici e riguardano soprattutto la loro idoneità a valutare, almeno con una certa approssimazione, l’attività terapeutica dei vari preparati di Segale cornuta.
Come abbiamo già veduto, essi si basano, per lo più, non sulla loro attività totale ma su alcuni particolari aspetti di essa: o sulla vasocostrizione periferica (cianosi della cresta di gallo), o sul periodo di latenza, o sull’effetto adrenolitico.
II metodo della cianosi della cresta di gallo, a parte il fatto che è quasi impossibile ripetere le prove sullo stesso animale, specialmente allorchè vi siano segni di necrosi, la vasocostrizione pur essendo determinata dalla azione contratturante sui muscoli lisci vasali, non corrisponde all’attività uterotonica: l’ergobasina e l’ergotamina, la cui azione uterotonica è quantitativamente simile, posseggono un’azione vasocostrittrice molto diversa, e cioè debole l’ergobasina e piuttosto energica l’ergotamina.
Gli alcaloidi ergotossinici, dotati di una debole attività uterotonica, sono invece molto attivi come vasocostrittori. Inoltre, la presenza di amine biogene (acetilcolina, istamina e tiramina) può, in maniera non trascurabile, influire sui risultati.
Il metodo che considera il tempo di latenza si basa su di un particolare dell’azione di alcuni alcaloidi naturali, particolare cui non si può certamente attribuire un’importanza preminente agli effetti dell’attività terapeutica. Questo saggio può comunque indicare soltanto la prevalenza nel preparato in esame, dell’ergobasina ad azione più pronta o dell’ergotamina ad azione più ritardata e, a prescindere dal fatto che i dati che si ottengono con questo metodo esigono un’attenta elaborazione statistica, non si può escludere che anche in questo caso la presenza delle amine biogene non possa, più o meno attivamente, influire sui risultati finali.
Per quanto riguarda i metodi che si basano sull'azione adrenosimpaticolitica ed in particolare quello di Broom e Clark, che è tuttora fra i più comunemente usati, avemmo già occasione di osservare (361) che essi, fra gli alcaloidi contenuti nella droga e nei suoi derivati galenici, considerano soltanto quelli dotati di azione adrenosimpaticolitica, quali l'ergotamina e gli alcaloidi ergotossinici. L’ergobasina invece, la cui azione uterotonica è quantitativamente simile a quella dell’ergotamina e molto più elevata di quella degli alcaloidi ergotossinici, essendo totalmente priva di azione adrenosimpaticolitica, viene completamente trascurata. Il metodo di Broom e Clark (366) fu studiato infatti prima dell'isolamento dell'ergobasina.
Ciò posto, ci si potrebbe chiedere se la semplice prova biologica diretta, sull'utero isolato o in situ, eseguita comparativamente con una sostanza campione (ergotamina, ergobasina o metilergobasina), non rappresenti ancora il metodo di titolazione migliore, più semplice e più rispondente ai fini pratici, al fine di ottenere la misura più approssimata dell’attività oxitocica della Segale cornuta e dei suoi preparati galenici.
Estratti e preparati vari
a) Estratto fluido F.U. (g 1 = XXXVI gtt).
Dosi: XV-XXX gtt pro dose, al massimo CX gtt pro die.
b) Estratto fluido per uso ipodermico (ergotina liquida) (g 1 = XXXVI gtt).
Dosi: cc 1-2 per iniezione ipodermica.
c) Estratto molle depurato F.U. (ergotina Bonjean) (1 p. = 6,5 p. circa di droga).
Dosi: (secondo la F.U.) g 0,5 in 1 cc per via ipodermica.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido segale cornuta F.U. g 10
Alcool di 25°……. g 90
(g 2,5-5 pro dose).
Sciroppo
Estratto fluido segale cornuta F.U. g 2
Sciroppo semplice F.U………………….. g 98
(a cucchiai).
Pozione (nell’atonia uterina, nelle metrorragie, ecc.)
Estratto fluido segale cornuta F.U. g 2
Estratto fluido arancio alcool-idrosolubile g 3
Sciroppo F.U……………………………… g 30
Acqua q. b. a………………………………. g 100
(a cucchiai).
Pillole utero-toniche
Estratto molle segale cornuta F.U………………………. g 0,1
Solfato di chinina……………………………………………… g 0,25
Solfato di stricnina…………………………………………. g 0,001
(per una pillola).
(2-3 al giorno).
Pillole antiemorragiche
Estratto molle segale cornuta F.U……………………. g 0,1
Estratto molle idroalcoolico giusquiamo………… g 0,01
Chinina solfato………………………………………………… g 0,1
Eccipiente q. b. per 1 pillola.
(4-8 pro die).
BIBLIOGRAFIA
(1) WENZELL, Am. J. Pharm., 36, 193, 1864; Chem. Zb!., 351, 1865; GANSER J. B., Arch. Pharm., 194, 195, 1870 – (2) KOBERT R., Arch. exp. Path. u. Pharmakoì., 18, 316, 1884; Chem. Zbì., 66, 1885 – (3) TANRET C., Compt. rend., 81, 896, 1875 – (4) TANRET C., Ann. chim., 17, 493, 1879 – (5) TANRET C., Compt. rend., 86, 888, 1878 • (6) DRAGENDORFF e PODWISSOTSKI V., Arch. exp. Path. u. Pharmakoì., 6, 153, 1877 • (7) PODWISSOTSKI V., Pharm. Z. Russland, 22, 393, 1883; Chem. Zbl., 644, 1883 – (8) JACOBY C., Arch. exp. Path. u. Pharmakoì., 39, 104, 1897; Chem. Zbl., I, 1059, 1897 –
(9) BARGER G. e CARR F. H., I. Chem. Soc., 91, 337, 1907 – (IO) BARGER G. e CARR F. H., Chem. News, 94, 89, 1906; Brit. Med. /., 1792, 1906 – (Il) KRAFT F., Arch. Pharm., 244, 336, 1906 – (12) SMITH S. e TIMMIS G. M., I. Chem. Soc., 1390, 1930 – (13) SMITH S. TIMMIS G. M., ibidem, 1888, 1931 – (14) STOLL A., Brev. Suisse, 79, 879, 1918; Schw. Med. Woch., 51, 525, 1921; U.S. Pat. t.394.233, 1919; Chem. Zbl., II, 230, 1922 – (15) SPIRO K. e STOLL A., Verhandl. Schweiz. Naturjorsch. Ges. Basel, 1920; Chem. Abs., 16, 2961, 1922 – (16) STOLL A., Schweiz. Ap. Zig., 60, 341, 358, 374, 1922; Chem. Zbl., III, 1007, 1922 – (17) STOLL A., Schewiz. med. Woch., 65, 1077, 1935 – (18) «CHl- NOIN» S. S. e WOLF E., Dem. brevet. C. 45.550; KL 12, p. Il, 12 maggio 1932 • (i9) KUESSNER W., Arch. Pharm., 272, 503, 1934 – (20) SMITH S. e TIMMIS G. M., I. Chem. Soc., 396, 1937- (21) KUESSNER W., Z. angew. Chem., 50, 34, 1937 – (22) MOIR J. C., Brit. Med. /., I, 1119, 1932 – (23) DUDLEY H. W. e MOIR J. C., Brit. Med. I., I, 520, 1935; Science, 81, 559, 1935 – (24) DUDLEY H. W., Brit. Med. J., r, 798, 1935; J. Am. Chem. Soc., 57, 2009, 1935; Proc. Roy. Soc. London, BH8, 478, 1935; Pharm. I., IV,
80, 709, 1935 • (25) STOLL A. e BURCKHARDT E., Compt. rend., 200, 1680, 1935 – (26) STOLL A. e BURCKHARDT E., Bull. sci. pharm., 42, 257, 1935 – (27) STOLL A., Science, 82, 415, 1935 – (28) KHARASCH M. S. e LEGAULT R. R., I. Am. Chem. Soc., 57, 956, 1935;; ibid., 57, 1140, 1935; Science,
81, 614, 1935; ibid., 81, 388, 1935 • (29) DAVIS M. E., ADAIR F. L., ROGERS G., KHARASCH M.
S. e LEGAULT R. R., Am. J. Obstet. Gynecol., 29, 155, 1935; Chem. Ahs., 29, 4456, 1935 • (30)
KHARASCH M. S., KING H., STOLL A. e THOMPSON M. R., Nature, 137, 403, 1936 – (31)
THOMPSON M. R., l.A.Ph.A,, 24, 24, 185, 1935; ibid., 24, 748, 1935; Science, 81, 636, 1935; ibid., 82, 62, 1935 – (32) DUDLEY H., Proceedings of the Royal Society (London), H8, 478, 1935 – (33) SMITH S. e TIMMIS G. M., Nature, 136, 259, 1935 – (34) STOLL A. e BURCKHARDT E., Z. physiol. Chem., 250, I, 1937 . (35) STOLL A. e BURCKHARDT E., ibidem, 251, 287, 1938 • (36) STOLL A. e HOFMANN A., Helv. Chim. Acta, 26, 1570, 1943 – (37) confr. STOLL A., Exposés Annuels de Biochimie Médicale, 7, 7, 1947; Progress in Allergielehre, 3, 388, ed. Basilea, 1952; Oesterreich Chem. Ztg,, 53, 73, 1952 – (38a) ABE M., YAMANO T., YAMATODANI S., KOZU Y., KUSUMOTO M., KOMATSU H. e YAMADA S., Bull. Agr. Chem. Soc. lapan, 23, 246, 1959 – (38b) VOIGT R., Naturwiss., 46, 77, 1959 – (38 e) MCEK K., SEMONSKY M., VANECEK S. e CERNY A., ibidem, 42, 647, 1955 – (39) BARGER
G. e EWINS A. J., I. Chem. Soc., 97, 284, 19!0 – (40) SMIfH S. e TIMMIS G. M., ibidem, 763 e 1543,
1932 • (41) SMITH S. e TIMMIS G. M., ibidem, 674, 1934 – (42) JACOBS H. e CRAIG L. – I. Biol.
Chem., 104, 547, 1934 • (43) JACOBS W. e CRAIG L., ibidem, 106, 393, 1934 – (44) JACOBS W. e CRAJG L., ibidem, 110, 521. 1935 – (45) JACOBS W. e CRAIG L., Am. Chem. Soc., 57, 383, 1935; I. Biol. Chem., 108, 595, 1935 – (46) JACOBS W. e TIMMIS G. M., J. Am. Chem. Soc., 57, 960, 1935 – {47) STOLL A. e HOFMANN A.. Z. phy.dot. Chem., 250, 7, 1937; 251, 155, 1938 – (48) STOLL A., HOFMANN A. e BECKER B., Helr. Chim. Acta, 26. 1602, 1943 – (49) STOLL A., HOFMANN A. e TROXLER F., ibidem, 32, 506, 1949 – (50) STOLL A .. PETRZILKA T. e BECKER B., ibidem, 33, 57, 1950 – (51) STOLL A., HOFMANN A., JUCKER E.. PETRZILKA T., RUTSCHMANN J. e TROXLER F., Helv. Chim. Acta, 33, 108, 1950 • (52) A. e HOFMANN A,, ibidem, 33, 1705, 1950 –
(53) STOLL A., HOFMANN A. e PETRZILKA T., ibidem, 34, 1544, 1951 – (54) STOLL A. e PETRZILKA
T. , ibidem, 36, 1125 e H37, 1953 – (55) STOLL A. e RUTSCHMANN J., ibidem, 36, 1512, 1953; 37, 814, 1954 – (56) STOLL A. e RUEGGER A., ibidem, 37, 1725, 1954 • (57) STOLL A., PETRZILKA T., RUTSCHMANN J., HOFMANN A. e GUENTHARD H. H., ibidem, 37, 2039, 1954 – (58) STOLL A. e HOFMANN A., ibidem, 38, 421, 1955 – (59) STOLL A., HOFMANN A., LEEMANN H. G., OIT H. e SCHENK H. R., ibidem, 39, 1165, 1956 – {60) JACOBS W. e CRAIG L., J. Blol. Chem., ]]], 455, 1935 – (61) CRAIG L., SHEDLOVSKY G., GOULD R. G. e JACOBS W., 1. Blol. Chem., 125, 289, 1938 – (62) JACOBS W. e CRAIG L., J. Am. Chem. Soc., 60, 1701, 1938 – (63) JACOBS W. e GOULD R. G., J. Biol. Chem., 120, 141, 1937 – (64) KORNFELD E. C., FORNEFELD E. J., BRUCE KLINE G.. MANN M. J., JONES R. G. e WOODWARD R. B., J. Am. Chem. Soc .. 76, 5256, 1954 – (65a) STOLL A. e HOFMANN A., Helv. Chim. Acta, 26, 2070, 1943 – (65b) STOLL A. e HOFMANN A., ibidem, 26, 944, 1943; 38. 421, 1955 – (65c) LEEMAN H. G. e FABBRI S., Ibidem, 42, 2696, 1959 – (66) KUESSNER W. e WOLFF P., Pharm. Ztg., 77, 342, 1932 – (67) STIVIC J., Diss. Leipzig, 1940 – (68) BEKESY v. M., Math. naiurw. Anz. Ungar. Akad. Wiss., 58, 722, 1939; Chem. Abs.. 34, 4525, 1940 – (69) HECHT M. e RUMPEL W., Sci. pharm., 23, 73, 1955 – (70) GROVE D. C. e VOS jr. B. J., J.A.Ph.A., 34, 255, 1945 – (71) BACHBAUER A., Gebwrtshil/e u. PraMenklinik, 6, 278, 1944 – (72) British Pharmaceutical Codex, ed. 1959, p. 281 – (73) United States National FormuJary, 1960, p. 125 – (74) Pharmacopoea Internationalis,
I ed., voi. I, pp, 209 e 211 – (75) STOLL A., Altes und Neues iiber Mutterkorn, Bern, 1943 – (76) SILBER A., Pharmazie, 7, 854, 1952 – (77) SCHULZE T., ibidem, 8, 412, 1953 – (78) FREUDENBERG-ROSEN- DAHL G. e MARKUS CH., ibidem, 8, 531, 1953 – (79) Deutsche Arzneibuch, VI ed., p. 611 – (80) ATAL C. K. e SCHWARTING A. E., l.A.Ph.A., ed. sci., 46, 451, 1957 – (81) KOVACIC K., BOZIN Z. e LADANJI N., Farm. Glas., 12, 419, 1956 – (82) KOVACIC K., BOZIN Z. e HADZIRA- SIDAGIC F., ibidem, 14, 267, 1958 – (83) KOLSEK J., KORNHAUSER A. e PERPAR M., Pharmazie, 12, 101, 1957 – (83 a) TROPP M. Y. e SINILOVA N. G., Med . .Prom. S.S.S.R., 15, 8, 10, 1961; Chem. Abs., 56, 3565, 1962 – (84) BEKESY E., KISERLET KOZLEM, 41, 21, 1938; Ber. ges. Physiol., 116, 156, 1940; Ber. Ung. pharm. Ges., 19, 470, 1943; Pharm. Zewtrulh., 86, 121, 1947; Biochem. Ztschr., 303, 368, 1940 – (85) CARLESS J. E., /. Pharm. Pharmacol., 5, 883, 1953 – {86) MOSQUEIRA A., Parmacognosia, 19, 213, 1959 – (87) SVOBODA G. H., SHAHOVSKOY G., OLIVER A. T., DILLER E., BARTON F., e BARNES A. J., J.A.Ph.A., 43, 257, 1954 – (88) TSCHERMACK E.. Miiieil. der Deutsch. Landw. Geseiisch., 36. 184, 1921 – (89) HECKE L., Schweiz. Ap. Ztg., 59, 277, 1921; 60, 45, 1922 – (90) FALCK R., Pharm. Ztg., 67, 777, 1922 – (91) BEKESY v. N., Zbl. Bakieriol. ParaJitenkunde, 11, 99, 1938; Tarsasag Ertesitòji, 1943 – (92) STOLL A. e BRACK A., Pharm. Acta Helv., 19, 118, 1944 – (93) HECHT W., ibidem, 19, 112, 1944; Pharmazie, 6, 291, 1951 – (94) ROCHELMEYER H., Pharmazie, 4, 326, 1949; Siidd. Apoth. Ztg., 90, 39, 1950 – (95) DIM-ZAJEC V. e MASTNAK A., Pharm. Glasnik, 7, l, 1951 – (96) FREUNDENBERG-ROSENDHAL G., Pharmazie, 6, 536, 1951 – (97) GONZALEZ GOMEZ C., DIAZ CELAYETA F. e VOCHTING A., Parmacognosia, 14, 13, 1954 – (98) GLAZ E. T., Magyar Tudomanyos Akad., Kém. Tudomanyok Oszta/yanak, Kiizleményei, 6, 65, 1955; Chem. Abs., 52, 15650 a, 1958 – {99) confr. HOFMANN A., Pianta Med., 6, 381, 1958 – (100} SCHLEMMER F., WIRTH P. e PETERS
H., Arch. Pharm., 274, 16, 1936 – (101) SILBER A. e BISCHOFF W., Pharmazie, 9, 46, 1954 – (102) BLAZEK Z. e coli., Ceskoslov-. farm., 2, 231, 1953 – (103) BOJOR O. e MANUCHIAN-DRAGOMIRESCU M.,Lucrarile prezeniaie conf. nati. farm. Bucarest, 385, 1958 – (104) BLAZEK Z., BOSWART J., HORAK
P. e KYBAL J., Pharmazie, 8, 592, 1953 – (105) BOSWART J., Relaz. alla Deutsche Akad. Wissensch. Berlin, 8-12 ottobre 1956; reJaz. in Pharmazie, 12, 175, 1957 – (106) WOOD e HOFER, Arch. int. med., 6, 388, 1910 – (107) ROWE, J.A.Ph.A., 26, 312, 1937 – (108) CHRISTENSEN E REESE, Ibidem, 28, 343, 939 – (109) HEINANEN P., OJALA I. S. e RUHIMAKI J., Parm. Aikakauslehti, 69, 275, 1960 – (110) HUBIK J., Casopls Ceskeho Lekarnictva, ed. sci., 63, 89, 1950 – (111) TRZEBINSKI J. e WICHLINSKI L., Acta Po/on Pharm., 16, 259, 1959; Chem. Abs., 54, 1804 h, 1%0 – (112) STOLL A. e SCHLIENTZ W., He/v. Chim. Acta, 38, 585, 1955 – (113) HELLBERG H., Acta Chem. Scand., 11, 218, 1957; Chem. Abs., 52, 14632 b, 1958 – (114) HORAK P., Ceskos/ov. farm., 4, 191, 1955 – (115) SPEICHERT H., Blu/. Znst. Roslin Leczniczych, 5, 211, 1959 – (116} HEINANEN P., JARVI M. e LAHTEENMAKI M., Parm. Aikakauslehti, 68, 155, 1959; Chem. Abs., 53, 14422 b, 1959 – (117) Farmacopea finlandese, ed. VII- (118) BLAZEK Z. e col!., Ceskoslov, farm., 2, 233, 1953 – (119) KACZMAREK F. e SPEICHERT H., Biul. Znst. Roslin LecZ1iczych, 6, 147, 1960 – (120) BARGER G. e DALE H. H., Biochem. J., 2, 240, 1907 – (121) GROGER D. e MOTHES U., Pharmazie, 1i, 323, 1956 – (122) FRAENKEL S. e RAINER J., Biochem. Zeitschr., 74, 167, 1916 – (123) EWINS A. J., Biochem. J., 8, 44 e 366, 1914 – (124) STEINER M., STEIN v. KAMIENSKI E., Naturwiss., 42, 345, 1955 – (125) BARGER G., DALE H. H., Arch. exp. Path. u. Pharmakol., 61, 113, 1909: Chem. Zbl., II, 1761, 1909 – (126) BARGER G., I. Chem. Soc., 95, 1123, 1909 – (127) RIELAENDER A., Sitzber. Magdeburg. Naturf. Ges., 7, 1908 – (128) KUTSCHER F.. Zentr. Physiol., 24, 163, 1910 – (129) ACKERMANN D. e KUTSCHER F., Ztschr. Biol., 54, 387, 1910 – (130) BARGER G. e DALE H. H., J. Chem. Soc.. 97, 2592, 1910 – (131) ENGELAND R. e KUTSCHER F., Zentr. Physiol., 24, 289 e 479, 1910 – (132) STEJNER M. e STEIN v. KAMIENSKI E., Flora, 146, 472, 1958 – (133) SCHULZE E. e BOSSHARD E., Z. physio/. Chem., 10, 80, 1886 – (134) SCHULZE E. e TRIER G., ibidem, 70, 143, 1910 – (135) TANRET C., J. Pharm. Chim., 30, 145, 1909; Chem. Zbl., II, 1474, 1909 – (136) BERGMANN W., Ber., 65, 1489, 1932 – (137) BARGER G., Ergot and Ergotism, London 1931, p. 140 – (138) DRAGENDORFF G. e PODWYSSOTZKY V., Arch. exp. Path. u. Pharmakol., 6, 172, 1877 – (139) JACOBY C., Arch. exp. Path. u. Pharmakol., 39, 85, 1897 – (140) KRAFr
Arch. Pharm., 244, 336 e 344, 1906 – (141) BERGMANN W., Ber., 65, 1486, 1932 – (142) FREEBORN A.,
Pharm. J., 34, 568, 1912 – (143) FRANCK B. e RESCHKE T., Angew. Chem., 71, 407, J959; Ber., 93, 347, 1960; FRANCK B., Pianta Med., 8, 420, 1960; FRANCK B., THIELE O. W. e RESCHKE T., Angew. Chem., 73, 494, 1961; Ber., 95, 1328, 1962; Chem. Abs., 57, 8532, 1962 – (144)STOLL A., RENZ J. e BRACK A., Helv. Chim. Acta, 35, 2022, 1952 – (145) ASAHINA Y. e FUZIKAWA F., Ber., 68, 1558, 1935 – (146) FRANCK B., Pianta Med., 8, 420, 1960 – (147) WJGGERS H. A. L., Lleb. Ann., J, 129, 173, 1832 – (148) MITSCHERLICH E., ibidem, 106, 15, 1858 – (149) BERTHELOT M., ibidem, 108, 117, 1858; 109, 34, 1859 – (150) VOSWINKEL, Pharm. Zentralh., 12, 531, 1891 – (151) HUDSON C. S.,
I. Am. Chem. Soc., 38, 1566, 1916; 51, 1707, 1709, 1930 – (152) BREDERECK H., Ber., 63, 959, 1930 –
(153) BREDERECK H., HOESCHELE G. e RUCK K., ibid., 86, 1277, 1953 – (154) LEMIEUX R. U. e BAUER H. F., Can. l. Chem., 32, 340, 1954; Chem. Abs., 49, 3026 i, 1955 – (155) ZEMPLEN G., Chem. Zbl., I, 898, 1938 – (156) MELLANBY E., SURIE E. e HARRISON D. C., Biochem. J., 23, 710, 1929 –
(157) SANTOS RUIZ, Trab. Inst. Ca/al. Znvest. Biol., 32, 251, 1940; Ber. Ges. Physiol., 129, 147, 1942 –
(158) WIELAND H. e COUTELLE G., Lieb. Ann.. 548, 270, 1941 – (159) MARINO-ZUCCO F. e PASQUERO V., Gau. Chim. Ital., 41, 368, 1911; Chem. Zbl., I, 832, 1912 – (160) LUDWIG cit. da SANTI U., Quaderni di Fitoterapia n. 2, Ed. Inverni & Della Beffa, 1940, p. 34 – (161) KARRER W., Konstitution und Vorkommen der organischen Pflanzenstoffe, 1958, p. 319 – (162) WAHLEN E., Arch. exp. Path. u. Pharmakol., 60, 42, 1908; Chem. Zbl., I, 556, 1909 – (163) VANDERMEULEN, l. Pharm. Belg., 21, 195, 213, 237, 1939 – (164) HART M. e EMERSON H., J. Am. Chem. Soc., 54, 1077, 1932 – (165) TANRET C., 1. pharm. chim., 19, 225, 1889; Compt. rend., 108, 98, 1889; 147, 75, 1908; 149, 222, 1909 – (166) RUPPOL E., l. Pharm. Be/g., 4, 55, 1949 – (167) HERMANN, Vierteiiiarschr. f. prakt. Pharm., 18, 481, 1869 – (168) GAITY KOSTYAL e TESARZ, Wladom. Parmac., 3, 1934 – (169) SMID M. e SEMONSKY M., Ceskos/ov, farm., 7, 388, 1958 – (170) HRANICKA J., Pharmazie, JO, 331, 1955 – (171) KORNHAUSER A. e PERPAR M., Naturwiss., 43, 400, 1956 – (172) DIETRICH, cit. da SANTI U., Quaderni di Fitoterapia, Ed. Inverni & Della Beffa, 1940, p. 32 – (173) SCHINDELMEISER
J. , Apoth. Z., 24, 837, 1909 – (174) ROSEN'THALER L., ibidem., 25, 5, 1910 – (175) AMOS 4-9, Deuteronomio 27-28 – (176) LONICERUS A., Krliuterbuch cp. CCCLXX, p. 285, Francoforte 1582 – (177) STERNS, Med. Reposit. New York, 5, 308, 1808 – (178) GOODMAN e GILMAN, The pharmacological basis of therapeutics, II“ ed., New York 1955 – (179) ROTHLIN E. e FANCHAMPS A., Rev. Path. Gen. et Comp., n. 673, 1427, 1955 – (180) ROTHLIN E. e SCHEGG K. E., Wien. Med. Woch., 75, 2018-2109, 1925 – (181) STOLL A. e ROTHLIN E., Schweiz. Med. Woch., 57, 106, 1927 – (182) LANGECKER, Arch. Exp. Path. u. Pharmakol., 165, 291, 1932 – (183) ROTHLIN E., Arch. lnt. Pharmacodyn. Thérap., 27, 459, 1913 –
(154) ROTHLIN E., Kiin. Woch., 4, 1437, 1925 – (185) ROTHLIN E., Bui/. Gén. Thérap., 176, 416, 1925 – (186) ROTHLIN E., l.A.Ph.A., 36, 6, 57, 1929 – (187) ROTHLIN E., Bul/. Gén. Thérap., 176, 416, 1925 – (188) ROTHLIN E., Arch. Gyni'ikol., 166, 89, 1937 – (189) ROTHLIN E., Bull. Acad. Suisse Sci. Méd., 2, 249, 1946-47 – (190) GROSVENOR C. E., Am. J. Physiol., 186, 211, 1956 – (191) CHANDHURY R. R. e DIKSHIT M. B., Nature, 186, 722, 1960 – (192) STOLL A. e HOFMANN A., He/v. Chim. Acta, 26, 2070, 1943 – (193) KONZETT H. e ROTHLIN E., Arch. lnt. Pharmacodyn. Thér., 85, 381, 1951 – (194) ROTHLIN E. e CERLETTI A., Ztschr. Exp. Med.. 122, 335, 1953 – (195) BIRCHER R. e CER- LF'O'I a., Introduzione farmacologica allo studio dell’azione dei nuovi diidroalcaloidi della Segale cornuta sui disturbi circolatori periferici e dell’ipertonia, di KAPPER A. e Coli., estratto dal XXII suppl. del- l’Helv. Med. Acta, 1949 – (196) ROTHLIN E., Buli. Schweiz. Akad. Med. Wiss., 2, 249, 1947 _ (197) ROTHLIN E., Schwe/z. Med. Woch., 64, 188, 1934 – (198) CERLETTI A. e KALLENBERGER A., Helv. Physio/. Acta, 6, 795, 1948 – (199) ROTHLIN E., J. Pharm. Pharmacol., 9, 569, 1957 – (200) HOFMANN A., cit. da STOLL A. (201)- (201) STOLL A., Schweiz. Arch. Neuro!. Psychiat., 60, 279, 1947- (202) ROTHLIN E. e CERLETTI A., Vedi CHOLDEN: Lysergic add diethylamide and mescaline in experimental psychiatry – Grune and Stratton N.Y., 1956, p. 1 – (203) ROTHLIN E. e CERLEITI A., Ann. N.Y. Acad. Sci., 66, 668, 1957 – (204) SAVINI, Brit. J. Pharmaco/., 11, 313, 1956 – (205) GADDUM J. H. e HAMEED
K. A., ibid., 9, 240, 1954 – (206) GINZEL e KATTEGODA, Quart. 1. Exp. Physiol., 38, 225, 1953 – (207) GADDUM, HEBB, SILVER e SWAN, ibid., 38, 225, 1953 – (208) HERXHEIMER, J. Physiol., 128, 312, 1955 – (209) KONZETT, Brit. J. Pharmaco/., 11, 289, 1956- (210) CERLETTI A. e BERDE, Experientla, 11, 312, 1955 – (211) WELSH J. H., Ann. N.Y. Acad. Sci,, 66, 618, 1957 – (212)McCAY WRIGHT A., MOORHEAD M. e WELSH J. H., Brit. J, Pharmaco/., 18, 440, 1962 – (213) CERLEITI A. e DOEPFNER W., J. Pharmacol. Expt/. Ther., 122, 124, 1958 – (214) SCOTT K. G. e STONE R. S., Cancer Research, 19, 783, 1959 – (215) RINKEL, Am. 1. Psychiat., 108, 572, 1952 – (216) SOKOLOFF, PERLIN, KORNETSKY e KETY, Ann. N.Y. Acad. Sci., 66, 537, 1957 – (217) ROTHLIN E., CERLETTI A., KONZETI, SCHALCH e TAESCHLER, Experientia, 12, 154, 1956 – (218) HORITA e DILLE, Science, 120, 1100,
1954 – (219) SUPEK Z. e MILKOVIC S., Lancet, n. 6889, 562, 1955 – (220) WOOLLEY D. W. e SHAW E., Brit. Med. 1. ii, 122, 1954, cit. da SUPEK e Coll. I.c. – (221) RINKEL, Am. J. Psychiat., 111, 881,
1955 – (222) SUGAR S., FRIED H., KALBER J. e ANTOPOLI W., Am. J. Physiol., 201, 1131, 1961, riass. in Circulatlon 27, 153, 1963 – (223) GRAHAM e KHALIDI, J. Fac. Med. Iraq, 18, 1, 1954 – (224) KATSENELBOGEN e FANO, Dis. Nerv. Sysl., 14, 85, 1964 – (225) DHAWAN B. N. e GUPTA G. P,, J. Phannacol. ExpH. Ther., 133, 137, 1961 – (226) ROTHLIN E. e CERLETTI A., Helv. Chim. Meta, 10. 319, 1952 – (227) CERLETTI A., SCHLAGER E„ SPITZER F. e TAESCHLER M., SehweU- Apoth. Zig.,
101, 210, 1963 – (228) DE GIACOMO U., MORSELLI G. E, CARGNELLO D.. CALLIERI B..
GIBERTI F. e TONINI G., Le psicosi sperimentali, Feltrinelli ed., Milano, 1962, p. XXIV – (229) SLOANE e LOWETT DOUST. citati da GIBERTI, ibid., p. 201 – (230) LEUNER H„ cit. da CERLEITI e Coll, l.c. (227) – (231) HOCH, cit. da GIBERTI l.c. (228) p. 201 – (232) BUSCH e JOHNSON, cit. da
GIBERTI, ibid. (233) SAVAGE C.. cit. da GIBERTI, ibid. – (234) BUSCH A. K. e JOHNSON W. C„
Dis. Nen. Syst., 11, 241, 1950 – (235) FREDERKING W„ Psyche, 7, 342, 1953-1954 – (236) FREDERKING W„ J. Nerv. Meni, Dis., 121. 262, 1955 – (237) LEUNER H., H'Ien. Med. Mach., lOS, 1091, 1958 • (238) LEUNER H. e HOLFELD H„ Psychiat. et Nerv., 143. 379, 1962 – (239) SANDISON R. A., J. Meni. Sci., 100, 508, 1954 – (240) SANDISON R. A.. The use o( LSD in psychotherapy «transact of a Coni, on LSD*, Princeton, aprile 1959, Josiah Macy N.Y. 1960, pp. 81, 149, 1960 – (241) SANDISON R. A., In neuropsychopharmacology proc. Ist. Intern. Congr. Neuropsychopharmacology, Roma 1958, Elsevier, Amsterdam, London, N.Y., Princeton 1959, pp. 176-182 – (242) SANDISON R. A„ SPENSER A. M. e WHITELAW J, D, A„ 1. Meni. Sci., 100. 491, 1954 – (243) SANDISON R, A, e WHITELAW J. D. A„ ibid. 103, 332, 19 5 7 – (244) SAVAGE C„ 1. Nerv. Meni. Dis., 12S, 434, 1957 – (245) ABRAMSON H. A.. HEWIIT M. P., LENNARD H., TURNER W. J„ O’NEIL F. J, e MERLIS S„ J. Psychol., 45, 57, 1958 – (246) ABRAMSON H. A., ibid., 41, 199, 1956 – (247) COHEN S. e EISNER B. S.. Arch. Neurol.
Psychiat. (Chicago), 81, 615, 1959 – (248) EISNER B, G. e COHEN S„ J. Nerv. Mental Dis., 127, 528,
1958 – (249) CALLIERI B. e ROVETTA M„ Arch. Psicol. Neuroi. Psichiatr.. 17, n. 1, 1956, cit, da CALLIERI (228) p. 140 – (250) HOLMS H„ Schweit. Med. Woch., 83, 356, 1953 – (251) HOLMS H„ Med. Hyg., 12, 51, 1954 – (252) MOOR M. T., Amer. J. Surg., 72, 883, 1946 – (253) O’SULLIVAN M. E„ J.A.M.A., 107, 1208, 1936 – (254) WOLFF H. G., Intern. Arch. Aiiergy Appi. Immunoi., 7. 210, 1955 –
(255) WOLFF H, G, e Coll., Headache and other head pain «Oxford Univ. Press,, N.Y. 1948» – (256)
FRIEDMAN A. P. e BRENNER C„ Amer. Proci., 2, 467, 1948 – (257) CHIRAY, Chine, Arch. Malad. App. Digest. (Fr.) 21. 590, 1931 – (258) STEIMANN B„ LUDI H. e BARDEN H. P„ Helv. Med. Acta, 15, 76, 1948 – (259) ADLERSBERG D. e PORGES O., Med. Kiin., 26, 142, 1930 – (260) BOUCKAERT J,, Rei. Méd. Louvain, n. 12, 1926 – (261) BECKER A. M., ÌFien. Ztschr. Mervenhk., 2, 402, 1949 – (262) BIECKEL G„ Schweiz. Med. Woch., 64. 186, 1934 – (263) ROTHLIN E., ibid., 64, 188. 1934 – (264) SAUTER H„ ibid., 78, 475, 1948 – (265) SPANIO P.. Riv. di Ostetr. e Ginecoi. Prat., 33, 65, 1951 – (266) SAUTER H., Ginecologia, 126, 123, 1948 – (267) REIST A., Schweiz. Med, Jahrbuch, Benno Schwabe e Co., Base! 1949 – (268) BASKIN M, D. e CREALOK F. W,, West. 1. Surg. Obsiet. Gynecol. (Am.) 58, 302, 1950 – (269) FERRAZ P. T„ Arch. Brasii. Med., 41, 189, 1951 – (270) GILL R. C„ Med. 1. Austr., 38. 373, 1951 – (271) GILL R. C. e FARRAR J. M., J. Ohsieir., 58. 79. 1951 – (272) JELINEK E., Praxis, 41, 720, 1952 • (273) WILHELM F., Kiin. Med,, 6, 414, 1951 – (274) SEIBERT E„ Gynaecologia, 135, 172, 1953 – (275) HORTON B. T,, PETERS A. e BLUMENTHAL L. S„ Proc. Stag. Meet. Maya Clinic, 20, 241, 1945 – (276) PASTEUR VALLERY-RADOT, Intern. Arch. Allergy, 7, 323, 1955 – (277) HOFMANN P„ Schtveìz. Med. Woch.. 80, 28, 1950 – (278) ADLESBERG D. e PORGES 0„ Med. Klin., 26, 1442, 1930 – (279) SANGIORGl P.. Policlinico, 135, 396, 1953 – (280) PENNETTI G., Ri/orma Medica, 45, 1235, 1929 – (281) PARISCENTI P., Set! Med., 37, 403, 1949 – (282) MELANDRI R. C. e INGLESE- GONORA G. L„ ibid., 42, 667, 1954 – (283) RABBONÌ F„ Policlinico, 59, 1277, 1952 – (284) BRACE E, D. e REID L. C„ Surg. din. N. Amer., p. 567, 1940 – (285) HINNTON J. W. Surgery, 35, 491, 1954 – (286) FORSTER R., SchtveiZ. Med. Woch., 78, 294, 1948 – (287) EDLEN, Acta Med. Scanditi., 1947 (supplementum) – (288) SCAFFIDI V„ Riv. Gasiro-Enierol., 3, 1, 1951 – (289) SPUHLER 0„ Schweiz- Med. Woch„ 76. 1259, 1946 – (290) POKORNY J., Praxis, 37, 957, 1948 – (291) PRUSIK R., Rev. Méd. de Liège, 3, 677, 1948 – (292) CHIRAY e CHENE, Arch. Mal. App. Dig., 21, 590, 1931 – (293) VAZ SERRA A., Coimhra Medica, 1. 22, 1934 – (294) BARONIO G. F., Atti 54" Congr. Soc. It. Med. Interna, Roma 12-14 ottobre 1953, p. 176 – (295) HIMFELD J. P, Schweii. Med. Woch., 76, 1263, 1964 – (296) BERGER H., Ann. Paed., 178, 187, 1952 – (297) LODO! L„ Seti. Med., 40. 414, 1952 – (298) CAVE SONDI G. e GRASSELLINI A., ihid„ 40. 401, 1952 – (299) LEVRAT, Riv. Lyon. Med.. 2. 203, 1953 – (299 a) ROSSAKO C e LEGERA G„ Min. Med,, 48, 3983, 1957 – (300) FRIIS MOLLER V.. Vgeskr. Laeg.. 102. 1119. 1940 – (301) CROSS G., Klin. Mbl. Augenkh.. 121, 15, 1952 – (302) SIMKOVA M„ Ophtaimol.. 119, 381. 1950 – (303) BENTHE D. e SCHMID E. E., Medizinisclie, p. 818, 1952 – (304) BENTHE D„ Monatschr / Psych. u. Neuroi., 125, 141, 1953 – (305) SAEKER G., Nervartz. 23, 333, 1952 – (306) CORSI V.. Min Med.. 42. 435, 1951 – (307) ODENTHAL F.. Deut. Med. Woch., 76. 1907, 1951 – (308) VON HEUBNER E. F. e WOHLRAB K., MOnch. Med. Woch., 93, 2157. 1951 – (309) LASCH F„ ihid., 94, 1325, 1952 – (310) WILBRANDT R„ Helv. Med. Acta, 18, 553, 1951 – (311) RUPP F„ Gynaecologia, 135, 396, 1953 – (312) DE BELLIS L., Giorn. Ostetr. Ginecoi., 19, 105, 1955 – (313) COLUCCI G., Riv. Oster. Ginecoi. Prat., 36, 237, 1954 – (314) BOVERI R. e GIULIANI D., Min. Ginecoi., 8, 17, 1956 – (315) PUGLIONISI A. e EPPINGER S„ Min. Chir.. 8, 761, 1953 – (316) WINSOR
T., Am. J. Med. Sci., 224, 42, 1952 – (317) VOGLER E., Fortschr. Rdntgenstr., 78, 322, 1953 – (318) POPKIN R. J., Caliiornia Med., 77, 108, 1950 – (319) ROBERTS J. E., ANDERSON L. L. c PERRY T. M.. Am. J. Med. Sci., 224, 431, 1952 – (320) PISANI D. e MICHELI-PELLEGRINI G„ Seti. Med., 38, 454, 1950 – (321) KAPPERT A. c Coll., Nelv. Med. Acta, 16. suppi. 22, 1940 – (322) KAPPERT A. c HADORN W., Angiology, 1, 520, 1950 – (323) SCHIMERT G. e 2ICKGRAF H., Klin. Woch., 27, 59, 1949 – (324) KUTZ ECHAVE R., Cardiologia. 20, 129. 1952 – (325) ROTHLIN E, e TAESCHLER M., Helv. Fhysiol. Acta. 9. C 37, 1951 – (326) SCHNEIDER M. e WIEMERS K., Klin. Woch., 29, 580, 1951 – (327) JOETTEN J., Medizinische. p. 691, 1952 – (328) HOFKENSCHIEL J. H. e Coli., J. PharmacoL (Am.) 98, 144, 1950 – (329) LASCH F., Miknch. Med. Woch., 94, 1325, 1952 – (330) SCHOBER W., Wien. Med. Woch., 100, 814, 1950 – (331) SRAUSS H. L„ Med. Welt., 20. 113, 1951 – (332) HADORN W. c STUCKI P., Praxis, 41. 498, 1952 – (333) VYSLONZIL E., Mschr. 1. Ohrenk., 85, 90, 1951 – (334) BACHI S., Min. Med., .17, 553, 1946 – (335) JACOB O., Z. Laryng. Rhin. Otol., 30, 116, 1951 – (336) ANDERSON J. c RUBIN W., Laringoscope, 63, 31, 1953 – (337) WERULY W., Schweiz. Med. Woch., 78, 694, 1948 – (338) LOVINO M. c LECCO V., Boll. Soc. Med. Modena, 47, 1947 – (339) HAGER H., Klin. Mfi. Augenheilk., 120, 510, 1952 – (340) SIMKOVA M. c ZAHN K„ Ophtaimol, 124, 39, 1952 ^ (341) PERSI- CHETTI C., Boll. OcuL, 29. 234, 1949 – (342)POSNER A., Amer. J. Ophtaimol.. 33, 1551, 1950 – (343) MELLAMBY, Brit. Med. J., 1, 679, 1930 – (344) BABIERRE, Bull Thir., 106, 50, 1884 – (345) DAVIDSON, Lancet, 106. 50, 1884 – (346) BARGER G„ Ergot and ergolism – (347) NIELSEN, Miinch. Med. Woch., 75, 736, 1928 – (348) YATER c CAHILL, J.A.M.A., 106, 1625, 1936 – (349) CHASSAR MOIR, Brit. Med. 3.. 2, 1028, 1936 – (350) STORCK, cit, da GOODMAN L. S. c GILMAN A. in The pharma- cological basis of iherapculics, MacMillan Comp. N.Y. 1955, p. 895 – (351) CRISPOLTI G„ Min. Med., 43, 184, 1952 – (352) KOBERT J. C. c DILLE J. M., J.A.Ph.A. (Seleni Ed.), 31, 109, 1942 – (353) ROTHLIN E. cit. da GOODMANN L. S. e GILMAN A. l.c. (350), p. 582 – (354) KELLER, Schweiz. Woch. Chem. Pharm.. 32, 121, 1894 – (355) WOOD c HOFER, Arch. Ini Med., 6, 388, 1910 – (356) GORIS A. e LIOT A., Bull. Sci. Pharm., 31, 379, 1924 – (357) SMITH M. J,, V.S. Public Health Reports, 45, 1466, 1930 – (358) KUSSNER W. c WOLFF P., Pharm. Ztg. BerL 77, 342, 1932 – (359) WASICKY R., Ztg. /. Analit. Chem., 54, 393, 1915 – (360) NOEL, ALLPORT e COCKING, Quari. J. Pharm. PharmacoL, 5. 341, 1932 – (361) BENIGNI R.. La Fitoterapia, n. 5. 1935 – (362) EDMUND e HALE, Bull. 76. Hyg. Lab, U,S. Public Health and Marine Hospital Service, Washington 1911 – (363) ROTHLIN E., Schweiz. Med. Woch., 68. 971, 1938 – (364) FORSTER c STEWART, Pharmac. J.. 161, 158, 1948 – (365) VOS, J.A-Ph.A., (Sci. Ed.). 32. 138, 1943 – (366) BROOM c CLARK, /. PharmacoL Exp. Therapeul, 22, 59, 1923 • (367) RAYMOND-HAMET, Bull. Acad. Med. Paris. 94. 90, 1926 – (368) MASUDA, EDMUND e HALE. cit. da BUCCIARDI G., in Valutazione biologica dei Medicamenti, Sansoni ed., Firenze 1938, p. 406 – (369) PLANELLES, ISEKUTZ c LEINZINGER, Dansk. Tits. Pharm.. 12, pp. 257, 272 e 277, 1938, p. 406 – (370) CAFFIER, Zbl. GynaecoL, 34, 3659, 1927 – (371) BRUGGER, Helv. Physiol. Phar- macol. Acta, 3, 117, 1945.


