Dimenticata per anni o relegata a semplice ipotesi radiologica, l’osteoporosi ha attraversato varie fasi di notorietà legate indissolubilmente ed essenzialmente alla pressione del marketing farmaceutico: dapprima calcitonina ed ipriflavone fino ai vari bisfosfonati, stronzio ranelato, denosumab e teriparatide passando attraverso le esperienze di fluoruri ed estrogeni.
Si è passati dall’approssimazione della radiologia convenzionale e dall’erronea identificazione del problema, col sintomo dolore, a metodiche strumentali (densitometria) per individuare le persone a rischio – quindi non ammalate – alle quali proporre un trattamento preventivo (1).
Tutto risale al lontano 1994 quando un gruppo di esperti associato all’O.M.S. e finanziato dall’industria farmaceutica definì l’osteoporosi una condizione con densità ossea (BMD) di 2,5 deviazioni standard al di sotto del picco di massa ossea della donna giovane; gli stessi autori ammisero che questi erano limiti arbitrari, identificati per finalità epidemiologiche e non certo quella discriminante diagnostica che sarebbe invece poi entrata nell’uso clinico comune ed abbracciata dalle principali società scientifiche.
Da più di vent’anni assistiamo ad un artificio dove un fattore di rischio viene trasformato in malattia grazie all’azione capillare del disease mongering e dell’utilizzo del relativo linguaggio, infatti sono comuni frasi del tipo patologia silenziosa-sottotrattata-insiodiosa-invalidante-ladra di ossa etc frasi purtroppo e troppo spesso pronunciante da eminenti clinici dove la convergenza d’interessi appare un aspetto di sovente sfumato.
Occorre sgombrare il campo da un equivoco di fondo….il trattamento dell’osteoporosi ha come obiettivo la riduzione delle fratture (soprattutto di femore)…ma va sicuramente sottolineato che chi si frattura non sono solo i pazienti osteoporotici; anzi cinque ampi studi epidemiologici hanno indicato coerentemente e in modo incontrovertibile che la maggior parte delle fratture da trauma si verifica a seguito di cadute in persone non osteoporotiche alla densitometria (vedi tabella).
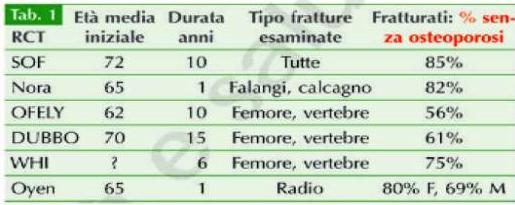
Evidente è il ruolo limitato che ha la BMD – soprattutto in prevenzione primaria – rispetto alla prevenzione delle cadute e delle relative fratture, in più occorre considerare che esistono caratteristiche qualitative dell’osso (microarchitettura) che ne determinano la fragilità indipendentemente dalla mineralizzazione. Quindi volendo riassumere per fratturarsi è quasi sempre necessario cadere!
Fatta questo lungo e doveroso preambolo arriviamo alla nuova edizione delle nota AIFA 79 (2) che se da un lato ha semplificato, tramite l’adozione di diagrammi di flusso, l’atto prescrittivo a carico del SSN dei farmaci antiosteoporotici, ha nuovamente perso un occasione/i che visti i tempi che corrono definire irrinunciabile non deve apparire peregrino.
Si premette che le note AIFA codificano quella che è la rimborsabilità di un trattamento a carico del SSN e non la sua prescrivibilità, ma d’altro canto la nuova nota 79 si propone di ottemperare a logiche di Evidence-based medicine (EBM).
Approfondendo la lettura del background e seguendo i diagrammi di flusso emergono alcuni punti di discontinuità- con la presunta ottica EBM- quali: prevenzione tramite stili di vita, rimborsabilità dell’associazione precostituita alendronato+vit.D, ruolo delle fratture vertebrali, durata massima della terapia con bifosfonati, rimborsabilità del ranelato di stronzio, espansione del ruolo della teriparatide.
Osteoporosi: Prevenzione e Stili di vita
Già nel lontano 1973 il Prof. Charles E. Dent affermava “senile osteoporosis is a pediatric disease”(3) e le evidenze successive non hanno potuto fare altro che confermare questo assunto.
È noto che il picco di massa ossea venga raggiunto intorno ai 30-35 anni di età e quindi la salute delle ossa si costruisce da giovani tramite alcuni semplici provvedimenti quali: esercizio fisico, adeguato apporto alimentare di calcio e vitamina D, evitando l’abuso d’alcol (ok fino ad i bicchiere di vino al giorno), astenensione dal fumo.
Una revisione sistematica (4) condotta su 19 studi prospettici ha dimostrato come l’attività fisica sia importante per la massa ossea in tutti i periodi della vita, ma soprattutto durante la crescita e nel periodo prepuberale.
Una metanalisi (5), che ha incluso 25 studi prospettici, ha indagato gli effetti di programmi di esercizio in donne pre e post menopausa. La metanalisi in questione ha concluso che i programmi di esercizio hanno impedito o invertito quasi dell’1% la perdita ossea annua sia a livello femorale che a livello spinale.
Un recente trial controllato (6) ha seguito per 16 anni due gruppi di donne post-menopausa, un gruppo d’intervento con esercizi ed un altro di controllo. La BMD è diminuita in ambo i gruppi ma la riduzione è risultata più pronunciata nel gruppo di controllo, anche il rischio di fratture è risultato a favore del gruppo esercizi, anche se tale differenza è risultata non statisticamente significativa (Risk ratio 0.51 (95%CI)0.23 to 0.97, p=.046).
Per quanto riguarda il fumo di sigaretta una metanalisi (7) ha analizzato 86 studi per oltre 40 mila partecipanti.
Gli autori concludono come il fumo riduca significativamente la massa ossea dei fumatori rispetto ai non fumatori, inoltre individuano nel fumo un fattore di rischio indipendente, dose dipendente, per la perdita di massa ossea in più si riscontrava un aumentato rischio di fratture nei soggetti fumatori.
Relativamente all’assunzione di alcol uno studio (8) ha analizzato 3 coorti prospettiche per un totale di 5,939 uomini e 11,032 donne.
Gli autori concludevano come l’assunzione di alcol fosse associata ad un aumento significativo dell’osteoporosi e del rischio di fratture anche se l’effetto risultava non essere lineare per le dosi assunte infatti gli effetti sopraenunciati si osservavano per quantità di tre unita di alcol/die ed oltre.
Il modo ottimale per garantire un adeguato apporto di calcio e vitamina D è quello di assumerlo con gli alimenti. Tuttavia, poiché non sempre è facile/possibile raggiungere i livelli suggeriti dalle principali società scientifiche con la sola dieta, si deve ricorrere agli integratori.
Le associazione di calcio (1.000-1.200 mg/die in due dosi frazionate) alla vitamina D (800 UI/die), hanno dimostrato la loro efficacia nella riduzione delle fratture in prevenzione primaria, negli anziani istituzionalizzati e in prevenzione secondaria, nelle donne in post-menopausa con pregressa frattura in trattamento con bifosfonati.
Limitarsi ad un semplice richiamo, come hanno fatto gli estensori della nota, senza quantificare od almeno elencare le evidenze e senza porre il giusto accento su interventi con rischi e danni per i pazienti inesistenti sembra più un proforma….non puntare su provvedimenti validati scientificamente su cui è doveroso investire risorse sia economiche che professionali appare la prima occasione persa.
E’ vero si dirà che AIFA si occupa di farmaci, ma un richiamo più esteso e corposo avrebbe almeno reso le idee più nitide e chiare sulla realtà delle cose.
Associazione precostituita Alendronato+vit. D
L’alendronato è disponibile in Nota 79 anche in associazione con vitamina D, tuttavia l’unico studio comparativo condotto con questa associazione non ha dimostrato alcun vantaggio rispetto alla formulazione standard (senza vitamina D) (9).
Inoltre, va considerato che ai fini di un assorbimento ottimale, alendronato va assunto almeno 30 minuti prima della colazione, mentre il colecalciferolo a stomaco pieno.
La associazione precostituita non consente tale modalità di somministrazione differenziata dei principi attivi.
Desta forti dubbi la reale utilità in terapia dell’associazione ed inoltre i vantaggi per i pazienti non sono dimostrati, sembrerebbe una seconda occasione persa…
Ruolo delle fratture vertebrali
La nuova nota AIFA 79 prevede la rimborsabilità dei trattamenti, a prescindere dai valori di BMD, in caso di fratture vertebrali individuate radiologicamente basandosi sul criterio di Genant, cioè con la riduzione di un’altezza vertebrale di almeno il 20%.
Una riduzione di almeno del 20% dell’altezza vertebrale non indica necessariamente una frattura ma anche una semplice deformazione, bisogna altresì considerare che solo il 30% delle fratture vertebrali morfometriche è clinicamente evidente.
Questo ampliamento delle condizioni di rimborsabilità sembra essere poco aderente alle evidenze ed alla pratica clinica (valutazione globale del paziente e delle sue comorbilità); sarebbe più opportuno ed auspicabile concentrarsi sulle ben più temibili fratture di femore! Sembrerebbe una terza occasione persa…
Durata massima della terapia con bifosfonati
Se da un lato la nota AIFA prende in considerazione la problematica della durata massima della terapia con bifosfonati dall’altro canto non prende posizione sulla rimborsabilità nel tempo di tali trattamenti a fronte di un bilancio beneficio/danni che non può non considerare le fratture femorali atipiche o diafisarie.
La soppressione a lungo termine del turnover osseo sembra infatti indebolire anziché rafforzare l’osso.
In uno studio caso controllo (10) effettuato su oltre 205.000 donne di età superiore ai 68 anni, il trattamento con bifosfonati per un periodo superiore ai 5 anni è stato associato ad una incidenza significativamente più elevata di fratture femorali subtrocanteriche o diafisarie; ulteriori studi osservazionali sono giunti alle medesime conclusioni.
In più si deve considerare che dopo 5 anni di trattamento con bifosfonati non si è osservato nessun beneficio in termini di riduzione di fratture, come dimostrano i risultati dello studio FLEX (11).
Si tratta quindi di decidere in quali pazienti il vantaggio terapeutico dei bifosfonati può controbilanciare il rischio di una frattura atipica e su questa valutazione di efficacia prevederne la rimborsabilità.
Sulla base dei limitati dati a disposizione, si può ragionevolmente ritenere che a beneficiare di un trattamento oltre i 5 anni siano i pazienti con pregresse fratture o con densità minerale ossea molto bassa (T score femorale inferiore a -4). Sembrerebbe una quarta occasione persa…
Rimborsabilità del Ranelato di Stronzio
Sin dalla commercializzazione nel 2005, numerose erano le incognite sul versante della sicurezza a lungo termine del Ranelato di Stronzio ed a fronte di un efficacia modesta, si tracciava un rapporto beneficio/rischio meno favorevole rispetto ai bifosfonati.
Nonostante le perplessità esistessero la pressione del marketing farmaceutico era forte e spesso ben accolta anche da talune Società Scientifiche…


Nel corso degli anni si sono svelate – quelle informazioni celate più o meno ad arte – sulla safety dello Stronzio Ranelato il che ha portato il susseguirsi nel tempo di numerose restrizioni prescrittive e controindicazioni sino a che giunti agli inizi del 2014 il Comitato di valutazione dei Rischi per la Farmacovigilanza (PRAC) dell’Agenzia Europea dei Medicinali (EMA) ha raccomandato che le specialità medicinali a base di Ranelato di Stronzio, non dovessero più essere usate per il trattamento dell’osteoporosi.
Il Comitato, dopo un attenta revisione di tutti dati disponibili, rilevava che per ogni 1000 pazienti trattati per 1 anno vi fossero 4 casi di problemi cardiaci gravi (di cui 2 infarti miocardici) e 4 casi di eventi tromboembolici in più con lo Stronzio Ranelato rispetto al placebo.
Inoltre all’assunzione di Stronzio Ranelato venivano associati una serie di altri rischi, come gravi reazioni cutanee quali sindrome di Lyell e sindrome di Dress, alterazioni della coscienza, convulsioni, epatite e citopenia (12).
Sul versante dei benefici il PRAC sottolineava la loro modestia, infatti il Ranelato previene circa 5 fratture non vertebrali, 15 nuove fratture vertebrali e 0,4 fratture dell’anca per ogni 1.000 anni paziente.
Nonostante le evidenze facessero propendere per un bilancio benefici/rischi tutto a favore dei rischi il Comitato per i Medicinali ad Uso Umano (CHMP) di EMA deputato alla decisione finale, nel medesimo anno, continuava a sostenere che il profilo beneficio/rischio fosse a favore del beneficio attuando ulteriori restrizioni come l’utilizzo in osteoporosi gravi ed in pazienti ben selezionati, cioè senza precedenti eventi cardiovascolari e tromboembolici, controindicando l’uso in pazienti in condizioni di immobilizzazione temporanea o permanente o dopo attenta valutazione clinica in pazienti ad alto rischio cardiovascolare.
Attualmente in Italia i medicinali a base di Stronzio Ranelato sono classificati ai fini della fornitura con RR (ricetta ripetibile) e sono prescrivibili a carico del SSN, nel rispetto delle condizioni previste dalla Nota AIFA 79, dai seguenti specialisti internista, reumatologo, geriatra, endocrinologo sulla base di diagnosi e piano terapeutico AIFA della durata massima di 12 mesi (13).
La nuova nota 79 prevede ancora la rimborsabilità del Ranelato di Stronzio – seppure in terza linea- ma non si è colta l’occasione (…e sono cinque) di escludere dalla rimborsabilità un farmaco che possiede insufficienti benefici a fronte di numerosi danni.
Sintetizzando e per dirla come la Revue Prescire le agenzie del farmaco – nazionali ed europee – hanno deciso in favore delle aziende farmaceutiche rispetto alla salute dei pazienti (14).
Espansione del ruolo della teriparatide
Il farmaco Teriparatide è costituito da un segmento ricombinante dell’ormone paratiroideo umano (i primi 34 aminoacidi) che ne rappresenta la regione biologicamente attiva.
L’ormone paratiroideo regola l’omeostasi calcica e la formazione e il riassorbimento osseo, a seconda delle modalità di somministrazione.
Somministrato continuativamente ha un effetto catabolico, ma, se somministrato una volta al giorno, agisce prevalentemente stimolando la formazione di osso.
Teriparatide viene somministrato sottocute una volta al giorno e raggiunge la concentrazione plasmatica massima dopo circa 30’; viene metabolizzato quasi totalmente per via renale con un t1/2 di 1 ora (somministrazione sc) e i livelli plasmatici non sono più dosabili dopo 3-4 ore.
I due studi principali (15-16) di confronto vs placebo e vs alendronato si sono conclusi prematuramente, per l’aumentata incidenza di osteosarcoma nei ratti riportata dopo 2 anni di trattamento.
Il rischio di osteosarcoma nei pazienti non è stata confermato dagli studi clinici, ma il periodo di trattamento è comunque limitato a 18 mesi e non si può escludere un periodo di latenza maggiore.
Lo studio più numeroso, che ne ha dimostrato l’efficacia vs placebo non riportava, peraltro, il calcolo della potenza statistica dello studio.
L’unico studio di confronto vs alendronato ha dimostrato una maggior efficacia della teriparatide relativamente, però ad un end-point surrogato come la densità minerale ossea.
La nota AIFA 79 prevede la rimborsabilità della Teriparatide in prevenzione secondaria nelle seguenti condizioni:
– soggetti con ≥ 3 fratture
– soggeti con ≥ 1 frattura + T-score colonna o femore ≤ -4
– soggetto con ≥ 1 frattura + trattamento > 12 mesi con prednisone o equivalenti ≥ 5 mg/die
– Nuova frattura vertebrale o femorale nonostante trattamento in nota 79 da almeno 1 anno
In virtù dell’evidenze sopracitate ci si interroga sull’ampio ruolo in terapia che la nota riserva alla Teriparatide, inoltre se si considera che i bifosfonati sono i farmaci più studiati – anche in prevenzione secondaria – e che posseggono consistenti dati di efficacia su esiti quali le fratture e non sulla densità minerale ossea (vedi teriparatide).
Il quesito iniziale resta insoluto….anzi sembrerebbe l’ennesima occasione persa!
Conclusioni
Concludendo non si può non riaffermare che le note AIFA delineano quella che è la rimborsabilità di un trattamento a carico SSN, cosa ben diversa da quella che è la prescrivibilià!
Ma altrettanto forte va riaffermato il concetto che la concedibilità di un trattamento a carico del SSN dovrebbe fondarsi sulle più solide basi scientifiche possibli ed essere guidato dagli interessi dei pazienti, in quanto persone anche facendo delle scelte drastiche o quantomeno impopolari…per alcuni stakeholder.
Il punto non è risparmiare nell’assistenza sanitaria ma assicurarsi che il trattamento sia efficace e con rischi contenuti per i pazienti!
BIBLIOGRAFIA
1.Maestri E et al. Vecchi e nuovi bisfosfonati nella prevenzione delle fratture da osteoporosi. IsF 2008
2.https://www.agenziafarmaco.gov.it/sites/default/files/Determinazione_n._589-2015-Modifiche_alla_Nota_79.pdf
3.Dent CE. Keynote address: Problems in metabolic bone disease. Proceedings of the International Symposium on Clinical Aspects of Metabolic Bone Disease 1973; 17
4.Bielemann RM et al. Physical activity during life course and bone mass:a systematic review of methods and findings from cohortstudies with young adults BMC Musculoskelet Disord. 2013 Mar 4;14:77
5. Wolff I et al. The effect of exercise training programs on bone mass: a meta analysis of published controlled trials in pre- andpostmenopausal women Osteoporos Int. 1999;9(1):1-12.
6. W. Kemmler et al. Exercise and fractures in postmenopausal women. Final results of the controlled Erlangen Fitness and Osteoporosis Prevention Study (EFOPS) Osteoporos Int (2015) 26:2491–2499
7. Kenneth D. Ward, Robert C. Klesges A Meta-Analysis of the Effects of Cigarette Smoking on Bone Mineral Density Calcif Tissue Int (2001) 68:259-270
8. J. A. Kani et al. Alcohol intake as a risk factor for fracture Osteoporos Int (2005) 16: 737–742
9.https://salute.regione.emilia-romagna.it/documentazione/ptr/ptr/archivio/determina-n-10044-del-6-agosto-2015-201caggiornamento-luglio-2015-del-prontuario-terapeutico-regionale-adottato-con-dgr-28
2015201d/view
10. Park-Wyllie et al. Bisphosphonate use and the risk of subtrochanteric or femoral shaft fractures in older women JAMA. 2011 Feb 23;305(8):783-9
11. Black DM. et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial JAMA. 2006 Dec 27;296(24):2927-38.
12.https://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/Protelos_and_Osseor/Opinion_provided_by_Committee_for_Medicinal_Products_for_Human_Use/WC500162132.pdf
13.Determina 11 maggio 2015, pubblicata sulla G.U. n. 115 del 20.05.2015 https://www.gazzettaufficiale.it/atto/serie_generale/caricaDettaglioAtto/originario;jsessionid=0tx67ptNq5NTu0OBOzguJg__.ntc-as5-guri2a?atto.dataPubblicazioneGazzetta=2015-05-20&atto.codiceRedazionale=15A03761&elenco30giorni=false
14. Prescrire International 2015 ;24 (156): 15 https://english.prescrire.org/en/81/168/49795/0/2015/ArchiveNewsDetails.aspx?page=2
15. Neer RM, et al. Effect of Parathyroid Hormone (1-34) on Fractures and Bone Mineral Density in Postmenopausal Women with Osteoporosis N Engl J Med 2001; 344: 1434-41
16. Body JJ, et al. A randomized double-blind trial to compare the efficacy of teriparatide [recombinant human parathyroid hormone (1-34)] with alendronate in postmenopausal women with osteoporosis. J Clin Endocrinol Metab 2002; 87(10):4528-453