Podofillo
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Podophyllum peltatum L. – Fam. Berberidee)
(Sin. – Podophyllum montanum Refin. – Anapodophyllum peltatum Moench. – Anapodophyllum canadense Catesb.)
Podofillo- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Podophyllum, dal greco pous – podos = piede e fullon = foglia, per le foglie a forma di piede (zampa d'anatra).
peltatum – dal greco pelth = pelta (piccolo scudo rotondo, leggero, di vimini o di pelle, che portavano i soldati di fanteria della milizia greca; i peltasti, allusione al picciolo che si inserisce nel mezzo del lembo fatto a forma di scudo).
montanum = montano.
Anapodophyllum, dal greco ana = sopra = che ha superiormente le foglie a forma di piede.
canadense – del Canada.
Nomi volgari – Pomme de mai (fr.), common podophyllum, may apple, mandrake’s rott (ingl).
Habitat – Canada (est. – Quebec, Ontario), dalla baia di Hudson alla Florida; U.S.A., Kentucky, Virginia, Carolina, Tennessee.
Pianta erbacea perenne.
Nota – Specie affine è il Podophyllum Emodi Wall, dell’India, Tibet e Afghanistan che dà una droga differente nell’aspetto (frammenti tortuosi, verrucosi, con internodi brevissimi, cicatrici fogliari vicine l’una all’altra, più grossi). Odore e sapore simili a quelli del P. peltatum.
Parti usate – Il rizoma.
Componenti principali
Resina (podofillina), miscela complessa, il cui principale componente, la podofillotossina, è stato estratto sin dal 1880 da Podwyssotzki (1). Mediante procedimenti cromatografici in questi ultimi anni è stato possibile separare dalla resina del Podofillo una serie di nuove sostanze, qui elencate nella tabella 1, aventi composizione simile a quella della podofillotossina. Si tratta di corpi con struttura riferibile ai lignani, prodotti resinosi naturali derivanti dall’alcool coniferilico.
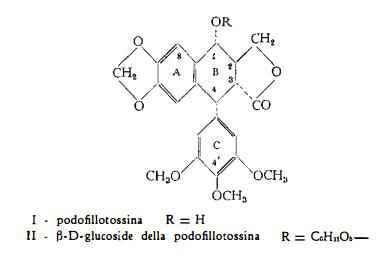
Podofillotossina, C22H22O8 fu estratta sin dal 1881 dai rizomi del Podophyllum peltatum L. e dalla resina dei rizomi di diverse specie di Podophyllum, specialmente del P. peltatum e del P. Emodi (1). L’esatta formula grezza è stata stabilita da Borsche e Niemann (2). Il problema
Fig 1
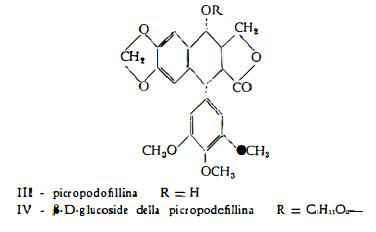
della formula strutturale della podofillotossina è stato oggetto delle ricerche di Borsche e coll. (3), di Spath e coll. (4) (5) e di Hartwell e Schrecker (6). Questi ultimi (6) hanno infine dimostrato che la podofillotossina e la picropodofillina (formule I e IIl rispettivamente) sono stereoisomeri.
b-D-glucoside della podofillotossina, C28H32O13, è il glucoside con formula II, separato dapprima dal Podophyllum Emodi Wall. nelle proporzioni dello 0,5-1% da Stoll, Renz e von Wartburg (8). E’ stato in seguito isolato anche dai rizomi del Podophyllum peltatum L. da von Wartburg, Angliker e Renz (7). Il b-D-glucoside della podofillotossina
si scinde facilmente, mediante b-glucosidasi, per formare D-glucosio e l’aglucone (7).
Picropodofillina, C22H22O8, identificata come stereoisomero della podofillotossina (6), è stata ottenuta per la prima volta da quest'ultima sostanza da Podwyssotzki (1). Pur essendo stata separata, sia dalla resina del P. Emodi Wall. nella quantità dello 0,33% (10), sia dalla resina del P. peltatum L. (9), tuttavia non è ritenuta quale componente originale di queste resine, poiché sembra si formi dalla podofillotossina durante i procedimenti di estrazione.
b-D-glucoside della picroprodofillina, C28H32O13, è stato estratto, nella proporzione dell’1,8%, dal Podophyllum Emodi Wall., da Hartwell e coll. (11) (12).
4’-Demetil-podofillotossina, C21H20O8, è la sostanza, separata dalla resina del Podophyllum Emodi Wall, nella quantità dell’1,7% da Nadkarni, Maury e Hartwell (11). Gli stessi AA. con Leiter (12) ne hanno definita la formula di struttura
b-D-glucoside della 4’-demetil-podofillotossina, C27H30O13, (VI) è stato estratto nella quantità dello 0,2-0,5% dai rizomi del Podophyllum
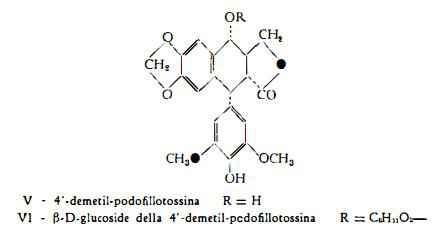
Emodi Wall. da Stoll, von Wartburg, Angliker e Renz (13). E’ stato identificato anche nella resina del P. peltatum L. da von Wartburg, Angliker e Renz (7), i quali per scissione idrolitica del glucoside con b-glucosidasi hanno ottenuto D-glucosio e l'aglucone.
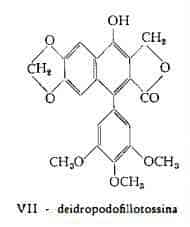
Deidropodofillotossina, C22H18O8, è stata isolata in piccole quantità da Kofod e Jòrgensen (14) dal Podophyllum peltatum L. Nella resina del P. emodi Autheroff e May (15) ne hanno rilevato un contenuto pari al 2-3%. La probabile formula di struttura della deidropodofillotossina, secondo Kofod e Jòrgensen (14), è la VII.
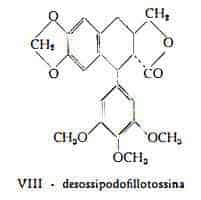
Desossipodofillotossina (antricina, ernandione, silicicolina), C22H22O7, è stata isolata nella quantità di circa 0,1% dalla podofillina del Podophyllum peltatum L. da Kofod e Jòrgensen (16). E’ la sostanza con formula Vlll che Hartwell e Schrecker (17) hanno identificata alla antricina, all’ernandione ed alla silicicolina, estratte precedentemente dall’Anthriscus silvestris (23), dalla Hernandia ovigera L. (24) e dallo Juniperus silicicola rispettivamente (25).
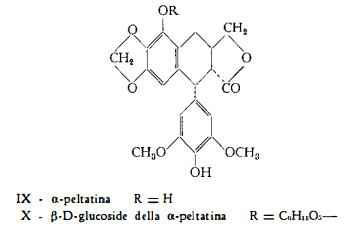
a-Peltatina, C21H20O8, è stata separata dai rizomi del Podophyllum peltatum L. ed identificata alla 4’-demetil-b-peltatina (IX) per opera-di Hartwell e coll. (18-20). Per trattamento con basi è trasformabile in picro-a-peltatina.
b-D-glucoside della a-peltatina, C27H30O13, è stato isolato dai rizomi del Podophyllum peltatum L. ed identificato da Stoll, Von Wartburg e Renz (21). Von Wartburg, Angliker e Renz (7) hanno messo in evidenza che per scissione idrolitica con b-glucosidasi lo zucchero che si libera è il D-glucosio.
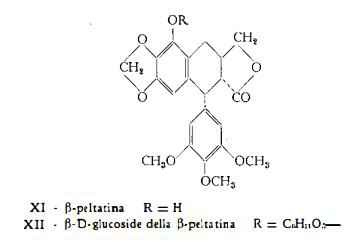
b-Peltatina, C22H22O8, isolata dalle radici del Podophyllum peltatum L. da Hartwell e Detty (19), è stata riconosciuta identica al lignano di formula XI da Hartwell, Schrecker e Greenberg (20).
b-D-glucoside della b-peltatina, C28H32O13, è stato trovato nel Podophyllum peltatum L. da Stoll, von Wartburg, Angliker e Renz (22), che ne hanno pure definita la composizione (XII) (7) (22).
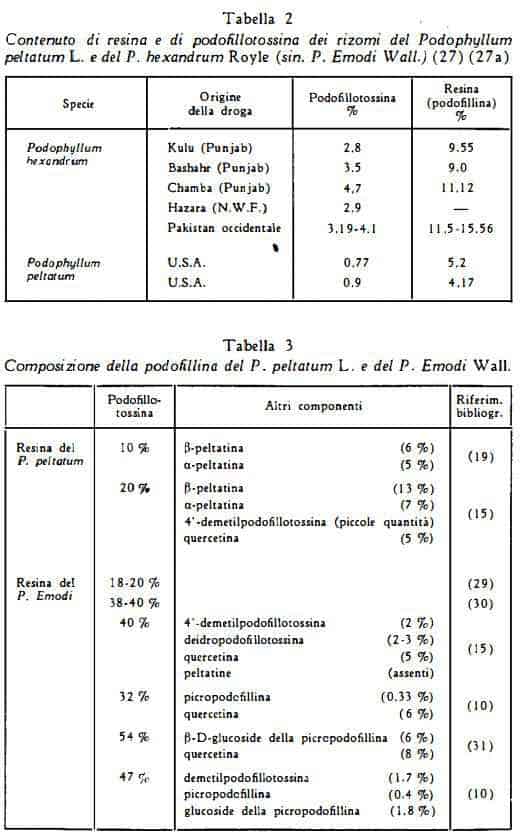
Il contenuto di resina del Podophyllum peltatum L. è generalmente pari al 4-5% in media (26) (27), nettamente inferiore quindi al contenuto del P. Emodi Wall., che si ritiene variabile per lo più dall’8 al 13% (27) (28) (tabella 2).
Dalla resina del P. peltatum L., è stata estratta quercetina ed una miscela di fitosteroli (9).
Nella frazione flavonolica della resina del Podophyllum Emodi Wall., sono stati trovati 7-80% di quercetina e 13-20% di canferolo (32).
Nella resina del P. Emodi sono stati determinati 3,68% di olio essenziale, responsabile dell’odore della podofillina (10) e 8,6% di cera (31).
Ceneri 1,6% (33), anche 2,6% (34) nel Podophyllum peltatum L.
Proprietà farmacologiche ed impiego terapeutico
Il Podofillo era noto nella America del Nord fin dall'epoca precolombiana e sembra fosse impiegato dalle popolazioni dei paesi di origine, come emetico.
Le sue proprietà catartiche vennero segnalate da Barton nel 1798 e nel 1820 la droga venne inserita nella Farmacopea degli Stati Uniti d’America.
In Europa il Podofillo ebbe il suo riconoscimento ufficiale nel 1864 con l’inserzione nella Farmacopea inglese (35).
Oltre le ben note attività catartica e colagoga, alla resina di Podofillo o podofillina, sono state attribuite altre interessanti proprietà, quali quella antimitotica, antimicotica e antieczematosa, in base alle quali essa ha trovato utile impiego nella terapia dei condilomi acuminati, in alcuni tumori cutanei, nel granuloma inguinale, nella Tinea capitis e in alcune forme eczematose.
Azione catartica e colagoga – Somministrata a piccole dosi la podofillina determina azione lassativa e colagoga, mentre alla somministrazione di dosi elevate può seguire un’azione drastica. Con dosi da 1 a 6 cg, si ottiene un aumento della peristalsi che interessa specialmente l’intestino crasso, un aumento delle secrezioni intestinale e biliare, accompagnate talvolta da leggere coliche.
La podofillina è largamente usata, sola o associata a droghe ad azione simile (droghe antraceniche in particolare) nella terapia della stitichezza cronica e della insufficienza epatica. Non dà luogo a fenomeni di assuefazione, anche prolungandone l’uso.
Hazleton (36) sperimentando su cani operati di fistola biliare, trovò che l’iniezione di mg 2-5/kg di podofillina, aumenta il flusso biliare del 77%.
Tale azione comparirebbe molto rapidamente ma è di breve durata, L’A. fa notare che è necessario che la pressione arteriosa del cane non scenda al di sotto dei 60 mmHg, perchè il flusso epatico possa essere mantenuto.
Valette e coll. (37), con una prima serie di esperienze eseguite con lo scopo di studiare l’azione della podofillotossina sull’intestino isolato e in situ, hanno dimostrato che l’effetto peristaltogeno di questa sostanza si manifesta tanto sull’intestino tenue che sul colon in situ. La podofillotossina deprime l’attività motoria del duodeno isolato di ratto mentre determina la contrazione del colon isolato di ratto e dell’ileo isolato di cavia.
L’azione dell’acetilcolina sul duodeno isolato di ratto è antagonizzata, mentre l’azione dell’istamina sull’ileo di cavia è rinforzata dalla podofillotossina. Qusta, come alcune altre sostanze ad azione purgativa, si, combinerebbe secondo gli AA. con la sieroalbumina.
Più recentemente Valette e Criou (38), continuando le ricerche precedentemente citate, hanno studiato sull’intestino isolato di cavia l'azione della podofillotossina, dell'a e della b-peltatina e della picro-a-peltatina. Essi notarono che il colon discendente di cavia presenta la massima sensibilità all'azione di queste sostanze e che perciò, meglio di ogni altro organo, ha permesso di analizzare il loro meccanismo d’azione.
Gli AA. hanno inoltre dimostrato ch nessuna azione di potenziamento si manifesta associando fra loro le suddette sostanze e che la risposta dell'intestino isolato alla loro azione, è modificata per aggiunta di atropina, di mepiramina o di esametonio, mentre viene antagonizzata dall’azione ddla papaverina, il che ha permesso agli AA. di attribuire ai principi attivi contenuti nella resina di Podofillo, un’azione eccitante sulla fibra muscolare liscia.
Azione citotossica e antimitotica – La conoscenza di questa proprietà deriva dall’attività terapeutica che manifesta la podofillina nella terapia dei condilomi accuminati.
Le prime osservazioni cliniche in proposito, si debbono a Kaplan (39) il quale trattò una ventina di pazienti con esito favorevolissimo. La podofillina veniva applicata dall'A. sotto forma di sospensione in olio di vaselina, al 25 % o di una pasta ottenuta con podofillina polverizzata e stemperata in acqua.
Detersa la parte, la sospensione o la pasta, veniva applicata sulla parte e, per quanto possibile, limitatamente al campo delle lesioni. Al fine di evitare eventuali fenomeni irritativi che potrebbero verificarsi sulle parti sane, è opportuno proteggere queste, con uno strato di vaselina o di una pomata con ossido di zinco. Dopo 6 ore la medicazione viene rimossa e la parte lavata con acqua tiepida e sapone.
Le vegetazioni assumono un colore biancastro, si disseccano e dopo due o tre giorni inizia una desquamazione che conduce alla completa eliminazione dei condilomi.
Dopo una settimana scompare, di solito, ogni traccia dei condilomi e della eventuale reazione irritativa.
Nella grande maggioranza dei casi, è sufficiente una sola applicazione e soltanto nel 6-10% dei casi, è necessario ripetere il trattamento.
Le applicazioni non sono dolorose e le reazioni piuttosto limitate. Soltanto il giorno seguente l’applicazione, si nota frequentemente un eritema più o meno intenso, con sensazioni di calore e di prurito che di solito, sono ben tollerate dal malato.
Al fine di evitare anche questi fenomeni rettivi Haber (40) consiglia di impiegare sospensioni di podofillina al 5 % anzichè al 25 %. In questo caso la medicazione viene rimossa dopo 8 h e il trattamento deve essere ripetuto due o più volte.
I risultati ottenuti da Kaplan furono in seguito confermati da lui stesso in collaborazione con Culp (41), con Culp e Magid (42) e da numerosi altri AA. (MacGregor (43), Beheran e coll. (44), Serrano Camargo (45), Michel (46), Monzo e coll. (47), Cohen (48), Blaich ( 49), Reich (50), Wurm (51), Martini (52), Daud e Rubin (53), Jensen (54), Touraine (55), Jofrida (56), Ayala (57), Rizzi (58), Buccellano (59) e molti altri).
L’azione della podofillina è molto attiva sulle cellule dei condilomi non cheratinizzati, le quali sono spesso distrutte dopo una sola applicazione. Più resistenti sono invece le cellule dei condilomi di vecchia data e parzialmente cheratinizzati, per distruggere le quali occorrono ripetuti trattamenti.
Oltre che in sospensione in oli minerali o in pomata, la podofillina viene impiegata anche sotto altre forme e con altri eccipienti. Sullivan e King (60) preferiscono l’impiego della podofillina in soluzione alcoolica al 20 % perchè sensibilmente meno irritante per le mucose normali che circondano le lesioni.
Hall (61) impiega una miscela di alcool e di acetone in parti uguali e Garb (62) unguenti al 2,5, 5 e 7,5 % di resina in una base così composta: olio di ricino, aquator (base risultante da ossicolesterolo e vaselina), vaselina bianca ana p. 4,5, oppure in soluzione con alcool di 70° o in tintura composta di Benzoino, per uso dermatologico (neurodermatiti, lichene semplice, psoriasi).
Nel trattamento dei papillomi dei genitali femminili, la Podofillina è stata impiegata da Michel (63) e da Reich (50). In questi casi essa veniva usata in soluzione al 25 % in olio di vaselina e applicata per mezzo di batuffoli di cotone. La medicazione era poi tolta dopo 3 ore o al massimo, dopo 6 ore mediante lavaggio con soluzione saponosa tiepida.
Nella miggior parte dei casi può essere sufficiente una sola medicazione, mentre in altri, essa deve essere ripetuta una o due volte.
Semple (64) usò la podofillina nel trattamento dei papillomi vescicali con buoni risultati. La sostanza veniva applicata cistoscopicamente, tramite un catetere uretrale, in soluzione in olio di vaselina e a concentrazioni scalari dallo 0,5 all’1, sino all’8%, in quantità che non superavano complessivamente i 3 cc.
Con questo trattamento l'A. ha potuto notare la regressione più o meno rapida o completa dei papillomi, rendendo così superflua la cistotomia.
Tsung-Ming-Chaig (65) ha sperimentato l’azione inibente della podofillina su colture in vitro di cellule di papillomi tirotdei. L A. ha osservato che rnentre la coltura di controllo non tratata dimostrava un accrescimento lineare nello spazio di 9 giorni, tutte le altre colture trattate con podofillina a diverse concentrazioni presentavano un arresto dell’accrescimento che appariva proporzionale dla concentrazione della podofillina stessa nel liquido di coltura. Le cellule diventavano irregolari e infine picnotiche. Un simile arresto di accrescimento venne riscontrato anche in un papilloma delle cellule basali dell’orecchio medio, mentre l’accrescimento della mucosa normale tiroidea e un cilindroma nasale, non venne influenzato. L'A. ritiene che l’effetto negativo che si ottiene spesso con le applicazioni cliniche della podofilina, sia dovuto molto verosimilmente alla sua scarsa concentrazione e alla scarsa durata della sua azione.
Le verruche volgari sono molto più resistenti all’azione della podofillina. Insuccessi parziali o totali sono stati ottenuti in questi casi da Touraine (66), da Frank e Cohen (67), da Conejo Mir (68) e da Sullivan e King (69) i quali su 100 casi trattati, hanno ottenuto 15 guarigioni dopo 3-4 applicazioni di una soluzione alcoolica di resina, mentre altri 15 non hanno dimostrato alcuna sensibilità al farmaco, nonostante le numerose modificazioni apportate all’eccipiente per renderlo più penetrante.
Wyss-Chodat (70) ha curato con successo tre casi, ma applicando la podofillina soltanto dopo aver asportato per raschiamento la cheratosi superficiale delle verruche o una parte di esse, sino a lasciare soltanto un tessuto molle e permeabile.
Ayres (71) ha invece fatto precedere l’applicazione della podofillina, da un pretrattamento con acido monocloroacetico, al fine di distruggere lo strato superficiale.
Andrews (72) ha invece ottenuto la guarigione in due settimane in due casi di verruche della faccia, con la semplice applicazione di una pomata al 2 % di podofillina.
Jensen (54) ha impiegato la podofillina sotto forma di pomata al 25 % in lanolina nelle verruche planae faciei. Sulle parti colpite la pomata veniva applicata mediante un cerotto che era poi tolto dopo 24 ore e il trattamento veniva ripetuto sulle verruche non ancora scomparse.
Le verruche plantari vengono trattate come le verruche volgari e cioè con applicazione di podofillina, dopo asportazione delle parti superficiali cheratinizzate, con vari metodi [Wyss-Chodat (70), Kurtin e Yontef (73), Andrews (72) ecc.].
Azione della podofillina sulla mitosi cellulare
L'azione che esplica la podofillina sui condilomi acuminati e sulle verruche, fece pensare ad un'azione inibente la moltiplicazione cellulare, simile a quella già nota di cui è dotata la colchicina. Tale somiglianza fra gli effetti prodotti dalle due sostanze venne notata da Slaughter e Limaci (74) e da Lutford (75) al quale non sfuggì la possibilità di impiegare la podofillina per gli stessi scopi per i quali viene impiegata la colchicina ed è appunto sotto questo aspetto, che essa venne estesamente studiata da Sullivan e dai suo collaboratori [Wechsler (76), King (60), Blancard (77) ] e in seguito da moltissimi altri ricercatori, tanto che esiste oggi sull’argomento, una vastissima letteratura.
La podofillina posta a contatto coi tessuti provoca in essi lesioni tossiche aspecifiche e specifiche di diverso grado, in relazione con la concentrazione, la durata delle applicazioni o la frequenza con la quale esse vengono ripetute.
Le lesioni specifiche di grado più elevato consistono in una necrosi più o meno estesa al centro dell’applicazione, cui conseguono ulcerazioni che mettono a nudo il derma e che facilmente si infettano.
Allorché le applicazioni di podofillina sono meno frequenti (due volte la settimana per esempio), le lesioni che compaiono due o tre giorni dopo l’ultima applicazione, sono meno gravi e determinano una reazione di difesa [«acantosi», secondo King e Cauldwell (82)] nello strato superficiale e medio della cute che si manifesta con un leggero ispessimento della epidermide, con aumento della cheratina di superficie, abbondanti granulazioni cheratojaline nelle cellule dello strato granuloso, mentre il reticolo di Malpighi e lo strato basale appaiono inalterati.
Allorché l'azione è più intensa, a questa «acantosi» si associano diverse altre lesioni che gli stessi King e Cauldwell hanno descritte.
Le lesioni specifiche con la comparsa delle «podophyllin cells» possono essere prodotte soltanto dalla podofillina, dalla azotoiprite e dalla colchicina e non si riscontrano che nelle cellule dello strato basale e negli strati più profondi del reticolo di Malpighi.
La podofillina e la podofillotossina, come altre sostanze contenute nella resina di Podofillo o da esse derivate e delle quali sarà detto in seguito, turbano profondamente il processo di mitosi cellulare determinando un arresto nella metafase. Questo processo di inibizione elettiva che si osserva tanto sulle cellule dei tessuti normali, quanto su quelle dei tessuti patologici, sembra manifestarsi soltanto sulle cellule a proliferazione attiva e non ancora definitivamente differenziate, quali per es. quelle dello strato basale della pelle e degli strati immediatamente vicini e non sembra avere alcuna azione sulle cellule già differenziate e che hanno già raggiunto lo stadio adulto o di senescenza, quali per es. quelle degli strati superiori del reticolo di Malpighi e degli strati superficiali della pelle. Di uguale effetto statmocinetico sono dotate anche le peltatine e Belkin (83) dimostrò che tanto la podofillina quanto le peltatine, iniettate sotto cute, esplicano una marcata azione inibente sui tumori da innesto dei topi e che la podofillotossina agisce come un veleno cellulare diretto, inibendo la mitosi.
Esperienze eseguite su diversi tipi di tumori, hanno dimostrato che la moltiplicazione delle cellule neoplastiche è notevolmente inibita da queste sostanze, anche se non sempre è possibile ottenere una inibizione totale.
Depongono in tal senso i risultati ottenuti da numerosi AA., fra i quali Hartwell e Shear (84), Ormsbee e coll. (85), Leiter e coll. (86) (87), Greenspan e coll. (88), Loran e Guth (89) i quali ultimi usarono una frazione da essi isolata dalla resina di Podofillo; Leighton e coll. (90), che studiarono l’attività di un derivato della podofillina su colture di tessuti cancerosi; Cedetti e coll. (91) i quali studiarono, oltre la podofillotossina, l'a-peltatina, la b-peltatina, la picropodofillina e i loro b-glicosidi: Maturova e coll. (92) i quali determinarono l’indice di tossicità statmocinetica della podofillotossina e di alcuni suoi derivati di sintesi: Emmenegger e coll. (93) i quali studiarono 4 glicosidi da essi isolati dal Podophyllum peltatum e dal P. Emodi.
Santavy e coll. (94) i quali più recentemente sperimentarono l'azione della podofillotossina e di alcuni suoi derivati sulla mitosi cellulare dei ratti parzialmente epatoectomizzati 27 ore prima della somministrazione delle suddette sostanze, venivano uccisi dopo 18 ore e il fegato veniva esaminato istologicamente.
I risultati ottenuti sono riassunti nella seguente tabella:

0
La dose capace di produrre mitosi pari a 200 mg/kg corrisponde alla DL50 per l’epipodofillotossina, l'epipicropodofillina, la 4’-demetil-picropodofillina, il podofillotossone, la desossipodofillotossina e per la desossipicropodofillina. Per la picropodofillina, per l'acetato di picropodofillina, per la b-peltatina B, per l’acetato della b-peltatina B, per l’a-peltatina B, e per il suo diacetato, la DL50 e la dose mitotica corrispondono rispettivamente a 500 e a 200 mg/kg.
L’indice tossico-statmocinetico dei derivati della podofillina è stato trovato pari a 1,5-2,7 mentre i valori corrispondenti alla colchicina e alla demecolcina, corrispondono rispettivamente a 2,5 e 7.
Per quanto riguarda i rapporti esistenti fra azione farmacologica e composizione chimica, sembra che la presenza di un gruppo ossidrilico libero nei composti della podofillina, sia necessario perchè si manifesti la loro azione biologica. L’acetilazione dei gruppi ossidrilici nelle posizioni 1 e 8, diminuisce notevolmente l'attività farmacologica e la sostituzione con radicali alchilici ne causa la completa scomparsa e così pure la sostituzione del gruppo ossidrilico in C-8 con un gruppo carbossilico o l'eliminazione del gruppo ossidrilico stesso. Altre variazioni strutturali apportate ai composti della podofillina possono aumentare o diminuire la loro attività.
All'attività statmocinetica della podofillina è da attribuire anche l'azione anticoncezionale di questa sostanza. Wiesner e Yudkin (95) hanno infatti osservato che la podofillotossina iniettata nei topi alla dose di 0,25 mg, interrompe la gravidanza, sembra per un'azione diretta sull’ovulo.
Cullis (96) ha descritto un caso di deformità multiple congenite in una bambina nata da una donna di 24 anni, la quale per 3 settimane, dalla 5° alla 9° settimana di gravidanza, aveva assunto un preparato lassativo in tavolette, contenente 30 mg di podofillina, alla dose di 2 tavolette 3 volte al giorno. L’ A. afferma che il Podofillo, analogamente alla talidomide può provocare polineurite.
Wilson (97), in base a quanto è possibile dedurre dall’uso più che cinquantennale di preparati contenenti Podofillo, somministrati anche durante il periodo di gravidanza, nega che essi possano provocare malformazioni del tipo di quelle descritte dal Cullis.
L'impiego clinico di queste sostanze nella terapia dei tumori ha condotto a risultati certamente incoraggianti anche se non definitivi. Sulla loro attività e sul successo del trattamento, sembra influire, oltre il tipo della lesione tumorale, anche il metodo seguito per il trattamento.
Wyss-Chodat (98) ottenne un insuccesso in un caso di epitelioma spinocellulare sviluppatosi su di un lupus, mentre ottenne la guarigione in 4-6 settimane di 9 epiteliomi basocellulari, trattati con tre applicazioni settimanali di una pomata al 25 % di podofillina e con una soluzione di nitrato d'argento al 5 % negli intervalli.
Sullivan (99) trattò con applicazioni di podofillina (da 10 a 20 in media, in tre settimane), 25 cancri cutanei di cui 12 basocellulari, 7 intraepidermici e uno spinocellulare, ottenendo un solo insuccesso, mentre la guarigione degli altri avvenne entro un periodo di tempo variante da 10 giorni a 3 mesi.
Interessante la tecnica seguita da Smith e Garrett (100) per condurre l'azione della podofillina sino agli strati profondi del neoplasma. Essi trattavano la lesione cancerosa con una pomata al 30 in olio minerale o con una emulsione al 20 % in benzolo e dopo aver protetto i tessuti limitrofi con una pomata inerte, ricoprivano la parte con una medicazione occlusiva che era mantenuta per 1-3 giorni, al fine di provocare la macerazione delle lesioni. Lo strato necrotico formatosi alla superficie veniva quindi eliminato e il trattamento ripetuto sino alla guarigione completa. La reazione infiammatoria che si produceva intorno alla lesione, era curata coi metodi ordinari.
Seguendo questa tecnica, gli AA. hanno ottenuto la guarigione clinica, stabile in 2 casi di epiteliomatosi multipla superficiale in 10 giorni: in 11 casi di epiteliomi basocellulari poco infiltrati in 7 giorni; in due casi di epiteliomi basocellulari nettamente infiltrati in 14 giorni, senza registrare alcun insuccesso.
Buoni risultati furono ottenuti anche da Garb (101) in un paziente portatore di tre epiteliomi basocellulari del diametro di 1,5-7 cm, dopo 3 mesi di trattamento.
Bucalossi e Di Pietro (102) trattarono con podofillina 20 casi di carcinoma cutaneo, di cui 4 spinocellulari, 3 carcinomi della mucosa vulvo-vaginale, orale e labiale e una verruca papillomatosa del pene, con risultati che gli AA. definirono, in complesso, soddisfacenti e, in base al risultato degli esami istologici e citologici eseguiti, essi concludono affermando che una nuova sostanza è entrata nella chemioterapia anticancerosa, sulle cui possibilità è ancora prematuro esprimersi: ma l’esistenza di un buon intervallo terapeutico fra dose minima efficace e dose minima tossica, accertato da Leiter e coll. (103) per la podofillina e soprattutto per la podofillotossina e per l'a e b-peltatina, nel ratto, giustifica le speranze che si fondano su tali ricerche.
Chatard (105) riferì il caso di un paziente di 79 anni, affetto da un epitelioma basocellulare della regione temporale, estendentesi alla gota sino al padiglione auricolare, per il quale non si potè ricorrere nè alla roentgen-terapia nè alla diatermocoagulazione. Esso venne quindi curato col metodo di Sullivan, impiegando podofillina in soluzione oleosa al 20 o al 25 % in olio di vaselina. Dopo un mese e mezzo, l’A, constatò la scomparsa totale dell’epitelioma e l’eliminazione elettiva del tessuto neoplastico, senza lesione dei tessuti sani e con un’ottima cicatrizzazione.
Lo stesso Chatard (106) riferì successivamente il caso di un malato affetto da una reticolosi istiocitaria localizzata in una narice, nel quale il trattamento con una soluzione alcoolica di podofillina al 20 % applicata quotidianamente per una quindicina di giorni, produsse una lisi estremamente rapida della lesione,
Varga e Belloni (107) hanno condotto uno studio comparativo sull’azione statmocinetica della colchicina e della podofillina, valendosi di un metodo personale consistente nella inoculazione simultanea o intervallata delle due sostanze, in embrioni di pollo. Dalle variazioni così indotte sull’attività proliferativa dei megaloblasti circolanti, oltre che da alcuni aspetti morfologici della mitosi, gli AA. precisano il tipo dell’azione antimitotica delle due sostanze concludendo che la podofillina è dotata di un effetto statmocinetico più puro.
Secondo Ballarati (108) il trattamento podofillinico può dar buoni risultati mediante applicazioni locali nelle forme neoplastiche cutanee superficiali, circoscritte e non infiltrate: risultati non soddisfacenti si otterrebbero invece nelle forme cutanee estese o infiltrate, nelle forme interessanti le mucose e nel trattamento generale. L'azione della resina sarebbe secondo l’A. semplicemente di contatto, manifestandosi in superficie e non in profondità. La podofillinoterapia pertanto, potrebbe essere impiegata, secondo Ballarati, con una certa utilità, nella terapia delle piccole lesioni epiteliomatose e segnatamente in quei malati che per ragioni diverse non possono ricorrere alla radioterapia: in questi casi, a parità di effetti, l’A. trova che il metodo offrirebbe il vantaggio di essere alla portata di tutti i medici e di una estrema semplicità di impiego. Un certo valore palliativo è riconosciuto a questo metodo anche nel trattamento di qualche neoplasia ulcerata che non si presti ad altri trattamenti e qualche utilità potrebbe anche essere riconosciuta all’impiego della podofillina, se fosse dimostrato che questa possa indurre una maggior sensibilizzazione alla roentgenterapia, ciò che del resto era già stato ritenuto probabile dal Sulzberger (109).
In considerazione di tutto ciò, l’A. ritiene piuttosto ristretto il campo della podofillinoterapia e non condivide le opinioni ottimistiche di altri AA. i cui successi terapeutici deriverebbero dal fatto che essi si sono limitati a sottoporre al trattamento podofillinico le forme neoplastiche meno
Si potrebbe osservare a questo proposito che, come già fu detto, sull’esito del trattamento può influire in misura non trascurabile il metodo con cui la podofillina viene impiegata. Con opportuni accorgimenti infatti, come già venne riferito da Smith e Garret (100) e da altri, possono essere aggredite con esito favorevole, anche forme neoplastiche cutanee notevolmente estese ed infiltrate.
Altri AA. [Sampey (110, Greenspan e coll. (111-112)] hanno riferito di aver ottenuto temporanee regressioni nel morbo di Hodgkin con a-peltatina.
L’adeno-carcinoma mammario di Caspari non è inibito, secondo Neukomm e Trey (113), nè dalla podofillina, nè dalla podofillotossina, nè dalle a-b-peltatine, nè dall’a-picropeltatina.
Esperienze eseguite da Kocsis e coll. (114) con podofillina marcata con C14 hanno dimostrato che nei topi portatori di sarcoma 170, l’escrezione di radioattività con le urine, nelle 4 ore successive alla somministrazione, è superiore a quella che si osserva negli animali normali. Al contrario, nei topi e nei criceti portatori di carcinoma ascitico di Ehrlich, l’escrezione della radioattività è notevolmente diminuita e in alcuni casi ridotta alla metà.
Azione batteriostatica e antimicotica – Schnell e Thayer (115) trovarono che estratti acquosi di foglie di Podofillo inibiscono la crescita dello Staph. aureus in vitro. Gli estratti eterei delle foglie e delle radici risulterebbero, al contrario, inattivi.
La podofillina, secondo Reiss e Winston (116), sarebbe dotata di attività antimicotica. Il Microsporum audouini, il M. fulvum, il M. lanosum, il Trichophyton gipseum e il T. purpureum. vengono inibiti dalla podofillina alla diluizione di 1:10000, il M. audouini e il M. lanosum sono uccisi alla diluizione di 1:1000, mentre il M. fulvum e il T. purpureum, sono uccisi alla diluizione di 1:200.
Da tale attività derivano le applicazioni terapeutiche nel trattamento della Tinea capitis con risultati in complesso buoni.
Reiss (116) basandosi su risultati di ricerche in vitro, trattò 10 bambini di età compresa fra i 3 e i 10 anni, affetti da Tinea capitis, con podofillina all’1% in carbowax. In tutti i casi era stata accertata la presenza del M. audouini e del M. lanosum. La zona florescente scomparve completamente nello spazio di una settimana e solo in due casi si rese necessario prolungare il trattamento per due settimane.
Analogamente Young (117), il quale trattò diversi casi di Tinea capitis da M. audouini, con una soluzione al 3,3% in alcool di 64°, di podofillotossina, riferì di aver ottenuto risultati superiori che impiegando altri antimicotici (salicilamide, acidi undecilico e propionico).
Risultati incoraggianti ma non ugualmente buoni, furono ottenuti da Schwebel e coll. (118), i quali impiegarono però la podofillina in concentrazione forse insufficiente (0,2% in carbowax). Nel granuloma inguinale la podofillina venne sperimentata con successo da Tomskey e coll. (119), da Culp e coll. (42) e da Smith (120).
Vilanova e coll. (121) avendo sperimentato la podofillina nel trattamento dell’eczema, trovarono che la sua attività non è costante in questi casi. Gli AA. hanno isolato dalla resina di Podofillo 7 frazioni e notarono che la podofillotossina cristallizzata è il principio più attivo contenuto nella suddetta resina.
Gli AA. sperimentarono questa sostanza su 116 soggetti comprendenti due categorie di malati:
a) dermatiti di contatto (dermatiti eczematose allergiche del tipo di contatto, dermatite venenata);
b) eczemi neurodermici comprendenti la neurodermatite essudativa nella sua fase essudativa (prurigo, eczema costituzionale, eczematoide essudativa di Rost) e l’eczema nummulare.
Questi malati furono trattati con podofillina all’1 % sola o associata con catrame di carbon fossile al 5 % o con podofillotossina cristallizzata all’1:5000 sola o associata come sopra.
Secondo gli AA. la podofillina costituisce un buon rimedio sintomatico dell’eczema ma, in quanto tale, non può evitare le recidive ed è quindi opportuno associare in questi casi, un appropriato trattamento generale. Gli AA. fanno inoltre notare che la podofillina è il primo rimedio che, in modo razionale e sino ad un certo punto specifico, agisce nelle lesioni sintomatiche principali dell’eczema e cioè sulla spongiosi e sulla vescicolazione che ne conseguono.
Michel (122) ottenne risultati soddisfacenti impiegando la podofillina sotto forma di pomata al 10 % nel trattamento della psoriasi e così pure Puersali e Roveri (123) i quali usarono invece la podofillina in soluzione di alcool e glicerina.
Prove sull’attività antiflogistica della podofillina, comparativamente con la demecolcina, furono eseguite da Lenfeld e coll. (124) i quali sperimentarono queste due sostanze sull’infiammazione acuta e subacuta, prodotta sperimentalmente nei ratti, iniettando cc 0,2 di una soluzione al 2% di formaldeide sotto l’aponeurosi plantare della zampa posteriore. Gli AA. trovarono che la demecolcina inibisce principalmente l’infiammazione acuta, mentre la podofillina inibisce quella subacuta.
Tale attività delle due sostanze appare però limitata dal valore relativamente elevato della loro tossicità.
Tossicità – Somministrata per os alla dose media di 3-6 cg la podofillina determina, come già fu detto, un’azione purgativa e colagoga. A dosi più elevate e superiori ai 25 cg può determinare avvelenamenti gravi e spesso mortali. Compaiono in questi casi sintomi di nausea, vomito, dolori addominali violenti accompagnati da frequenti scariche diarroiche caratterizzate da evacuazioni acquose e spesso contenenti sangue; segue uno stato di profonda depressione che si può concludere col coma e la morte.
Prove sperimentali di tossicità sulla podofillina e sulla podofillotossina, vennero eseguite da Sullivan e coll. (125). Queste sostanze somministrate ai topi parenteralmente, dimostrarono di essere dotate di una tossicità pari, rispettivamente, a 1/15 di quella relativa alla colchicina.
Dosi tossiche di podofillina determinano la morte, di solito, in 15-18 h. Nelle prime 8 h dopo la somministrazione, si osserva diarrea, respirazione rapida e faticosa, disturbi della deambulazione. Dopo 9 h subentra un periodo di eccitazione che si manifesta con convulsioni spastiche. A questa fase ne consegue un’altra caratterizzata da astenia, da andatura strisciante, da respirazione lenta, superficiale e faticosa. L’esame microscopico svela un’enterite acuta con aumento del numero dei leucociti polimorfonucleati nella sottomucosa intestinale e una sorprendente rottura dei loro nuclei. Molto evidente appariva anche la necrosi del tessuto linfoide sottomucoso.
Nell’epitelio della lingua, l’attività mitotica appariva aumentata e la mitosi delle cellule cutanee non era arrestata.
Tanto la podofillina quanto la podofillotossina, sono meglio tollerate dai ratti adulti che dai giovani sui quali le due sostanze manifestano una più elevata tossicità.
Un effetto tossico cumulativo è stato determinato nei ratti somministrando le due sostanze, ripetutamente durante il giorno a dosi inferiori da 1/6 a 1/5 della DL50.
Riassumendo possiamo dunque dire che alla resina di Podofillo e ai suoi componenti attivi (podofillotossina, peltatine ed alcuni loro derivati di sintesi) possono essere attribuite, oltre alla nota azione catartica e colagoga, anche le seguenti altre attività:
a) azione citotossica e antimitotica per le quali le suddette sostanze hanno trovato utile impiego nella terapia dei condilomi acuminati, delle verruche, dei papillomi e di alcune forme tumorali cutanee;
b) azione antimicotica, per la quale la podofillina e la podofillotossina sono state impiegate nella terapia della Tinea capitis;
c) azione antiflogistica e antieczematosa per le quali le suddette sostanze sono state impiegate nella terapia di alcune forme eczematose e di alcune dermatiti.
Estratti e preparati vari
Estratto fluido (g 1 = LV gtt)
Dosi: g 0,5-1 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido podofillo…………………………………………………. g 20
Alcool di 60°…………………………………………………………………. g 80
(g 2,5-5 pro dose).
Pozione lassativa e colagoga
Estratto fluido podofillo………………………………………………. g 5
Estratto fluido carciofo ………………………………………………… g 10
Estratto fluido curcuma ……………………………………………….. g 10
Sciroppo di lamponi……………………………………………………… g 60
Alcool di 60°…………………………………………………………………. g 40
(1-2 cucchiaini la sera).
BIBLIOGRAFIA
(1) PODWYSSOTZKI V., Ardì. exp. Path. u. Pharmukol., 13, 29, 1880 – (2) BORSCHE W. e NIEMANN
J., Lieb. Ann., 494, 126, 1932 – (3) BORSCHE W. e NIEMANN J., ibid., 499, 59, 1932 – (4) SPAETH E., WESSELY F. e KORNFELD L., Ber, 65, 1536, 1932 • (5) SPAETH E., WESSELY F. e NADLER E., ibid., 65. 1773, 1932; 66, 125, 1933 – (6) HARTWELL J. L. e SCHRECKER A. W., J. Am. Chem. Soc., 72. 3320, 1950; 73. 2909, 1951; 75, 5916, 1953 – (7) VON WARTBURG A., ANGLIKER E. e RENZ J., He/v. Chim. Acta, 40, 1331, 1957 – (8) STOLL A., RENZ J. e VON WARTBURG A., J. Am. Chem. Soc.. 76, 3103, 1954; Heiv. Chim. Acta, 37, 1747, 1954 – (9) BARTEK J., POTESILOVA H., MASINOVA V. e SANTAVY F., Chem. Listy, 49, 1550, 1955; Chem. Abs., 50, 4913 a, 1956 – (10) CHAKRAVARTI S. C. e CHAKRABORTY D. P., J.A.Ph.A., Sci. ed., 43, 614, 1954 â– (H) NADKARNI M. V., MAURY P. B. e HARTWELL J. L., J. Am. Chem. Soc., 74, 280, 1952 • (12) NADKARNI M. V., HARTWELL J. L., MAURY P. B. e LEITER J., ibid., 75, 1308, 1953 – (13) STOLL A., VON WARTBURG A., ANGLIKER E. e RENZ J., ibid., 76, 5004, 1954 – (14) KOFOD H. e JORGENSEN C., Acta Chem. Scand., 8, 1296, 1954 – (15) AUTERHOFF H. e MAY O., Pianta Med., 6, 240, 1958 – (16) KOFOD H. e JORGENSEN
C. , Acta Chem. Scand., 9, 346, 1955 • (17) HARTWELL J. L. e SCHRECKER A. W., J. Am. Chem. Soc., 76. 4034, 1954 • (18) HARTWELL J. L., ibid., 69. 2918, 1947 – (19) HARTWELL J. L. e DETTY W. E., ibid., 70, 2833, 1948; 72, 246, 1950 – (20) HARTWELL J. L., SCHRECKER A. W. e GREENBERG
G. Y., ibid.. 74, 6285, 1952 – (21) STOLL A., VON WARTBURG A. e RENZ J., ibid., 77. 1710, 1955 •
(22) STOLL A., VON WARTBURG A., ANGLIKER E. e RENZ J., ibid., 76, 6413, 1954; Chem. Abs.,
51, 2736, 1957 – (23) NOGUCHI K., KAWANAMI M., Chem. Abs., 47, 6386, 1953 – (24) HATA C.,
Chem. Abs., 41, 2917, 1947; 47, 10872, 1953 • (25) HARTWELL J. L., JOHNSON J. M., FITZGERALD
D. B. e BELKIN M., J. Am. Chem. Soc, 74, 4470, 1952 • (26) WEHMER C., Die Pflanzenstoffe, II ed., p. 329 – (27) Chopra’s Indigenous Drugs of India, ed. 1958, p. 227 – (27a) WAHID M. A. e SAMIULLAH, Pakistan S. Sci. ìnd. Res., 3, 228, 1960; Chem. Abs., 58, 1301, 1963 • (28) HUSSAIN A., CHAUDHRI I. I., FATEH MUHAMMAD e WAHHAB A., J. Pharm. Pharmacol., 6, 62, 1954 – (29) FERRARI G., ì Farmaco. 7. 472, 1952 – (30) DE AMBROSI L., II Farmaco, ed. prat., 9, 265, 1954 – (31) JARQUE R. Q. e DE IRAZAZABAL NERPELL A., Anal. reai. soc. espan. jù. y quim., 50B, 779, 1954; Chem. Abs., 49, 9106 d, 1955 • (32) PANKAJAMANI K. S. e SESHADRI T. R., Proc. Indian Acad. Sci., 36A. 157. 1952; Chem. Abs.. 48, 2702 d, 1954 . (33) COWIE W. B. e DICKSON W., Pharm. J., 220, 1906 – (34) MORAN
J. I., Merck’s Report, 218, 1903; Pharm. Ztg., 60, 1904 • (35) DEZANI S., Trattato di Farmacognosia UTET, Torino 1920, p. 174 – (36) HAZLETON L. W., J.A.Ph.A., 31, 53, 1942 – {37) VALEITE M. G., HUREAU M. L. e CARIOU M. J., Ann. pharm. franQ., 16. 169, 1958 – (38) VALETTE M. G. e CARIOU M. J., ibid.. 19, 428, 1961 â– (39) KAPLAN J. W., New Orieans Med. Surg. J., 94, 388, J942 – (40) HABER
H. , Brit. I. Ven. Dis.. 21, 63, 1945 – (41) CULP O. S. e KAPLAN J. W., Ann. Surgery, 120, 125, 1944 –
(42) CULP O. S., MAGIO M. A. e KAPLAN J. W., J. Uro/ogy, 51, 655, 1944 – (43) MACGREGOR J.
W., Brit. Med. J, 1, 593, 1945 • (44) BEHERAN H. R. e KRAVES J. J., D'ta Med.. 17, 1137, 1945 • (45) SERRANO CAMARGO M., Med. y Cir. Bogotà, 9, 188, 1945 – (46) MICHEL P. J., Presse Méd.. n. 51, 712, 1946 – (47) MONZO O. R., KANTT J. e COURERAT M. F., Semana Méd., 1, 298, 1946 – (48) COHEN E. L., PracUoner, 156. 133, 1946 – (49) BLAICH W., Med. Kiinik, n. 15, 325, 1946 – (50) REICH W. J. e coll., Am. J. Obstetr. Gynecol, 53. 658, 1947 – (51) VURM K., Dermat. Woch., n. 8, 178, 1950 • (52) MARTIN! G., Zbl. Gynàkol.. n. 18a, 1283, 1950 – (53) DAUD J. e RUBIN A., ibid., n. 20, p. 1440 – (54) JENSEN T., Dermatol. Woch., n. 17, 405, 1950 – (55) TOURAINE, Presse Méd., n. 35, 470, 1945 – (56) JOFRIDA V., Giorn. di Med. Miiit., 93, 239, 1946 – (57) AYALA, Anìì. ital. Derm. Sifiiogr.. n. 4, 335, 1947 – (58) RIZZI V., Dermosifilografo. n. 1-2, 26, 1947 – (59) BUCCELLANO, Ann. itai. Derm. Sifiiogr., n. 1, 539, 1947 – (60) SULLIVAN M. e KING L., Arch. Dermat. Syph., 56. 30, 1947 – (61) HALL A. F., ibid., 62, 362, 1950 – (62) GARB J., ibid., 61, 520, 1950; 61, 690, 1950; 62, 598, 1950; 63. 740, 1951 • (63) MICHEL P. J., PrNse Méd.. n. 51, 712, 1946 • (64) SEMPLE J. E., Dtsch. Woch., n. 8, 254, 1949 – (65) TSUNG-MING CHANG, Arch. Ohr. Nas. u. Kaeihk-Heilk.. 179, 498, 1962, in Dtsch. med. Woch., 87. 2395, 1962 – (66) TOURAINE A., Thérapie. 5, 178, 1950 – (67) FRANK S. e COHEN W., Arch. Derm., 56, 109, 1947 – (68) CONEJO MIR J., Hispanis Medica (Siviglia), 5, 515, 1948 – (69) SULLIVAN M. e KING L.. cit. da TOURAINE l.c. (66) • (70) WYSS-CHODAT F., Dermatologica, 97, l, 1948 – (71) AYRES JNN. S., cit. da TOURAINE l.c. (66) – (72) ANDREWS G., Arch. Dermat. Syph., 56, 47, 1947 – (73) KURTIN A. e YONTEF R., ibid., 57. 395, 1948 – (74) SLAUGHTER D. P. e LIMACI L. R.. Surgery, 7, 696, 1940 – (75) LUTFORD R. J., J. Nat. Cancer Inst.. 6, R9, 1945 • (76) SULLIVAN M. e WECHSLER H., Science. 105, 433, 1947 . (77) SULLIVAN M. e BLANCHARD
K. , Buit. Joìjm^ Hopkins Hosp., 81, 65, 1947 – (78) ZANNICK R., Pharmazie, 4, 35, 1949 – (79) KELLY M. G. e HARTWELL J. L.. J. Nat. Ctmner In.st., 14, 967, 1954 . (80) PEROTTI G., Farmaci e Farmacie, 8, n. 11-12, 1958 – (8!) Res. Div. S. Penick e Co. New-York 1953 – (82) KING L. e CAULDWELL E., J. Nat. Cancer Inst.. 10, 131, 1949 – (83) BELKIN M., J. Pharmacol. exp. Thér., 93, 18, 1948 – (84) HARTWELL J. L. e SHEAR M. J., Cancer Res. J., 7, 716, 1947 – (85) ORMSBEE R. A., CORNMANN J. e BERGER R. E., Proc. Soc. Exptl. Biol. Med., 16. 586, 1947 • (86) LEITER J., DOWNING V., HARTWELL J. L. e SHEAR M. J., Cancer Res. J., 9, 597, 1949 – (87) LEITER J. e HARTWELL
J. L., ibid., 9, 625, 1949 – (88) GREENSPAN E. M., LEITER J. e SHEAR M. J., J. Nat. Cancer ìnst.. 10, 1295, 1950 – (89) LORAN M. R. e GUTH E. P., J.A.Ph.A., 49, 254, 1951 – (90) LEIGHTON J., KLINE J., BELKIN M. e ORR E. C., Cancer Res., I., 17, 336, 1957 • (91) CERLETII A., EMMENEGGER H. e STAHELIN H., Actuaiilé Pharmacol., 12, 103, 1959 – (92) MATUROVA M., MALINSKY J. e SANTAVY F., J. Nati. Cane. Jnst., 22, 297, 1959; Chem. Abs.. 53. 10556g, 1959 – (93) EMMENEGGER H., STAHELIN H., RUTSCHMANN J., RENZ J. e VON WARTBURG A., Arzneim.-Forsch.. 11, 327 e 459, 19t:1 • (94) SANTAVY F., MATUROVA M., MALINSKI J. e SEIDLOVA-MASINOVA, Acta Univ. Palackianae Olomucensis. 2, n. 14, 105, 1958; Chem. Abs., 53, 22517, 1959 – (95) WIESNER B. P. e YUDKIN J., Nature. 176, 249, 1955 • (96) CULLIS J. E., Lancet. n. 7254, 5ll, 1962 . (97) WILSON F., ibid., n. 7257, 663, 1962 – (98) WYSS-CHODAT F., eit. da TOURAINE I.c. (66) – (99) SULLIVAN M., ibid. – (100) SMITH L. M. e GARRETI H., ibid. • ( 101) GARE J., Arch. Dermat. Syph., 60. 806, 1949 – (102) BUCALOSSI P. e DI PIETRO S., Min. Med., 43, 523, 1952 – (103) LEITER J., DOWNING V., HARTWELL J. L. e SHEAR M. J., Nat. Cane. Inst., 10, 1273, 1950 – (104) VERONESI U., Fitoterapia, 24, 3, 401, 1953 – (105) CHATARD M. H., Comunicai. alla Soc. Franf. de Derm. e Syph., Lione 2 maggio 1957, in Presse Méd., 65. 1262, 1952 – (106) CHATARD M. H., Comunicai. alla Soc. Franf. de Derm. e Syph., Lione 25 giugno 1959; in Presse Méd.. 67. 1994, 1959 – (107) VARGA L. e BELLONI F., II Farmaco, ed. sci., 14, 795, 1959 – (108) BALLARATI U., Min. Med., 43, 822, 1952 – (109) SULZ- BERGER M., Arch. Dermat. Syph., 60, 13, 1949 – (110) SAMPEY J. R., Am. I. Pharm., 128, 271, 1956 –
(111) GREENSPAN E. M. e coll., Cancer Res. J., 12, 266, 1952 • (112) GREENSPAN E. M. e coll., J. Nati. Cane. Inst., 14, 1257, 1954 . (113) NEUKOMM S. e TREY M., Oncologia. 14, 219, 1961; Chem. Abs., 56. 889 i, 1962 – (114) KOCSIS J. J., WALASZEK E. J. e GEILING E. M. K., Arch. interri pharmacod. et de thér., 111, 134, 1957 – (115) SCHNELL L. O. e THAYER J. D., cit. da PAECH K. e TRACEY M. V. in «Moderne Methoden der Pfianzenanalyse» Springer, ed. Berlin-Gottingen 1955, vol. III, p. 700 – (116) REIS F. e WINSTON D. R., Exp. Med. Surg., 7, 229, 1949 – (117) YOUNG C. J., Arch. Dermat. Syph., 64, 607, 1951 – (118) SCHWEBEL S., SNYDER W. e SLINGER W. N., J.A.M.A., 149, 261, 1952 • (119) TOMSKEY G. C., VIEKERY G. W. e GETZOFF V. L., J. Vroiogy. 48, 401. 1942 â– (120) SMITH D., Arch. Dermat. Syph.. 56. 47, 1947 – (121) VILANOVA, CARDENAL C. e POU A., Ann. Dermat. et Syph.. n. 4, luglio-agosto 1950 – (122) MICHEL P. J., J. Méd. Lyon. 27, 567, 1946 – (123) PUERSALI A. e DOVERI R., Min. Med., n. 7, 192, 1947 – (124) LENFELD J., KROUTJL M. e ZEMANECK J., Arch. intem. pharmacod. et de thér.. 125, 137. 1960; Chem. Abs., 54, 23070!, 1960 – (125) SULLIVAN M., FOLLIS R. H. e HILGARTNER M., Proc. Soc. Exp. Bioi. N.Y., 77, 269, 1951.


