Scilla
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Scilla maritima L. – Fam. Liliacee/Scillee)
(Sin. – Urginea maritima Bak. – Urginea Scilla Steinh. – Ornithogalum
maritimum Lamk. – Ornithogalum Squilla Gawl. – Stellaris Scilla Moench.)
Scilla- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Scilla, dal greco skullw = strazio, tormento, allusione alla proprietà venefiche del bulbo. E da Skulla = Scilla, mostro marino. Questo nome si ricollega al mito di Scilla, la bellissima ninfa che, innamoratasi di Glauco, pregò la maga Circe di renderglielo favorevole; ma Circe, che amava Glauco, avvelenò la fonte nella quale Scilla soleva bagnarsi ed il veleno mutò la ninfa in un orrendo mostro. La ninfa ebbe tanto orrore di se stessa che si gettò nel mare di Sicilia, dove fu mutata in uno scoglio tutto caverne mugghianti, divoratrici di marinai, di fronte ad un'altra rupe orrida, abitata dal mostro Cariddi. Un tempo il passaggio tra Scilla e Cariddi era ritenuto pericoloso.
Secondo altri da skellw = inaridisco, dissecco, perchè la pianta nasce nei luoghi aridi, arenosi, secchi; oppure da skullw = strazio, tormento, molestus sum, perchè questa cipolla punge ed irrita con l’asprezza quando si applica. Si pretende anche che, se si taglia con un coltello, questo resterà avvelenato. Perciò, nelle preparazioni della Scilla, si usavano coltelli di avorio e di legno (Lemery).
Urginea – L'etimo da urgere =premere, schiacciare, per i semi depressi, è errato.
Il nome deriva dalla località di Ben Urgin, presso Bona in Algeria, dove fu raccolta e studiata per la prima volta. Dice Steiheil (1834): «Urginea, du nom d'une tribu arabe des environs de Bone – Ben Urgin, dans le territoire de la quelle nous avon récolté, pour la première fois, une espèce de ce genre».
maritima – delle zone marittime.
Ornithogalum, dal greco ornis, orniqos = uccello e gala = latte, da cui orniqogalon; allusione al color latteo dei fiori simile al colore bianco delle penne di certi uccelli.
Stellaris, per i fiori a forma stellata.
Nomi volgari – Numerosi. Giacinto selvatico, cipolla marina, ornitogalo marino, epimenidio (tosc.), seulla marina (lig.), cipolla canina, cipudrazzu (pugl.), cipollazza (calab.), cipuddazza marina (sic.), abridda, aspidda, zeodda marina (sard.).
Meerzwiebel (ted.), oignon marin (fr.), escila, cebolla albarrana, ceborrincha (spagn.), alvarra, cebola alvarra (port.), tengeri hagyma (ungh ), sea onion (ingl.), 'unsal, bes'al Faraoun (cipolla del Faraone), bes'al-far (cipolla del topo) (arabo marocch.), agufal (berb.), ansil, fahon o far'on, ichquil (arab. tripol.).
Habitat – Regione mediterranea, Asia Minore, Marmarica, Cirenaica, Tripolitania, Algeria, Marocco, Canarie, Africa or., Capo di B. S.
Esistono due varietà:
var. alba o scilla femmina – Asia Minore, Grecia, Malta. In Italia, nelle arene e sulIe rupi marine. Rara sul litorale veneto, non molto frequente lungo le coste liguri e toscane, Lazio, abbondantissima nelle provincie meridionali (Calabria, Sicilia), Sardegna, isole.
var. rubra o scilla maschio – Spagna; in Italia, nelle provincie meridionali (Calabria, Sicilia).
Parti usate – I bulbi, raccolti in agosto (prima della fioritura) (Scillae bulbus F.U.).
Componenti principali
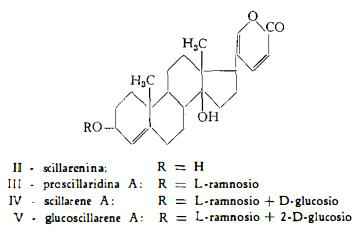
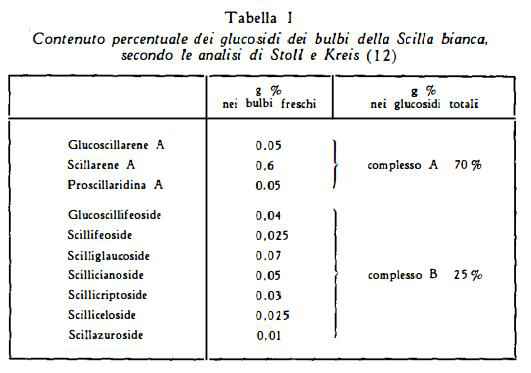
Sostanze glucosidiche non definite chimicamente — scillaina, scillipicrina, scillitossina, scillina, scillenina, scillitina, scillidiuretina, xantoscillite — sono state riportate in letteratura (1). L'isolamento dei glucosidi sterolici, componenti della Scilla maritima L., si deve ai lavori di Stoll e collaboratori (3-14), la cui pubblicazione prese inizio nel 1933 con la segnalazione dell'estrazione dello scillarene A.
Componenti dei bulbi di Scilla maritima var. alba
Scillarene A, C36H52O13, fu descritto nel 1933 da Stoll, Suter, Kreis, Bussemaker e Hofmann (2), che l'hanno estratto dai bulbi della Scilla maritima L. e ne hanno identificati i prodotti della scissione ottenuta con
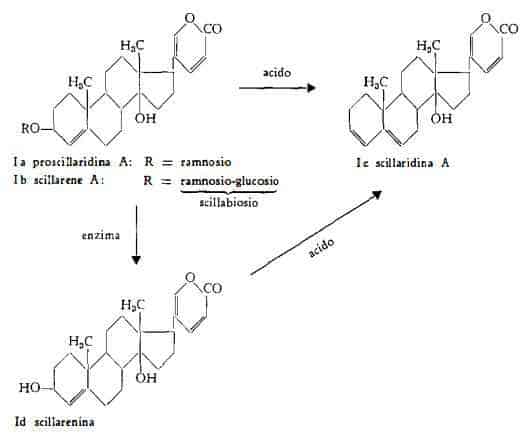
acidi e cioè lo zucchero scillabiosio (ramnosio + glucosio) e scillaridina A, (anidro-scillarenina), C24H30O3, forma anidra dell’aglucone naturale, che è la scillarenina, C24H32O4.
Mediante scissione con l'enzima scillarenasi (3) o con altri adatti enzimi (4) Stoll. e coll. (3) (4) hanno ottenuto la degradazione dello scillarene con formazione di glucosio e di proscillaridina A, C30H42O8, scindibile a propria volta per azione enzimatica nell'aglucone scillarenina e L-ramnosio.
La determinazione della struttura chimica dello scillarene A si deve agli studi di Stoll e coll. (5-11), che hanno condotto alla formula di costituzione IV.
Glucoscillarene A, C42H62O18, è il glucoside primario più ricco di zuccheri, estratto da Stoll e Kreis (12) dalla Scilla bianca. Esso contiene una molecola di glucosio in più rispetto allo scillarene A e per scissione idrolitica con b-glucosidasi (emulsina) si scinde con formazione di scillarene A e di glucosio.
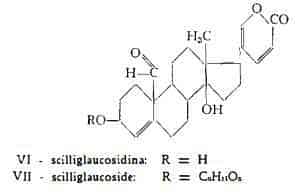
Scilliglaucoside, C30H40O10, è stato isolato dalla Scilla bianca da Stoll e Kreis (12). Per idrolisi si scinde con liberazione di una molecola di glucosio e dell’aglucone scilliglaucosidina, C24H30O5, (4), per la quale è stata stabilita da Stoll, von Wartburg e Renz (13) la formula strutturale VI:
Altri glucosidi — scillicianoside, glucoscillifeoside, scillifeoside, scilliceloside, scillazuroside e scillicriptoside — sono stati separati da Stoll e Kreis (12), in piccole quantità, per via cromatografica, dalle soluzioni madri derivanti dall'estrazione dello scillarene A. La struttura chimica di queste sostanze non è stata sinora definita.
Nei bulbi della Scilla bianca è stato trovato il fruttosano sinistrina, secondo analisi di vecchia data (1); più recentemente è stato estratto l’1,2% (dai bulbi secchi) di glucosinistrina, poliosio che per idrolisi acida produce D-fruttosio e D-glucosio nel rapporto approssimativo di 4:1 (15). E' stata inoltre segnalata la presenza di acido chelidonico (16) (17), colina, sitosterina, di uno sterolo (scillisterina) (18), che è probabilmente identificabile con la stigmasterina (19) e di olio grasso con gli acidi palmitico, oleico, propionico e acetico (18); ceneri 4-5% (1).
Componenti dei bulbi della Scilla maritima var. rubra
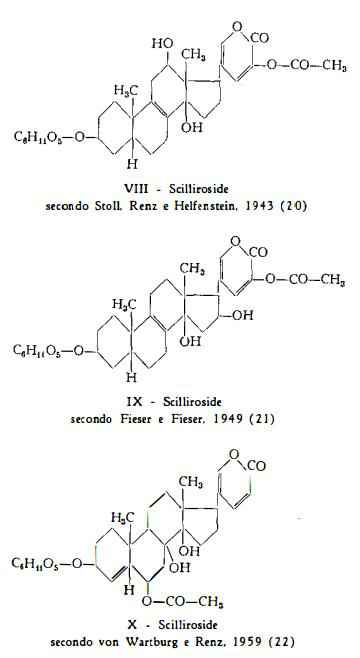
Dalla Scilla maritima L. var. rubra Stoll e Renz (14) hanno estratto scilliroside, il principale componente di questa varietà di Scilla, ed inoltre piccole quantità di scillarene A e di «scillarene F» (scilliglaucoside). Per lo scilliroside Stoll, Renz e Helfenstein (20) hanno proposto la formula VIlI, che è stata poi modificata da Fieser e Fieser nella IX (21) e successivamente da von Watburg e Renz (22) nella X.
Per scissione enzimatica dello scilliroside, C32H44O12, si ottiene una molecola di glucosio e scillirosidina, C26H34O7 (23).
Dai bulbi freschi di Scilla rossa è stato ottenuto lo 0,035 % di scilliroside (24). Kg 650 di bulbi freschi di Scilla rossa della Sardegna hanno
dato una resa di 44 g di scilliroside, 1,6 g di scillarene A e di 7,2 g di scillarene F (14).
Il contenuto di scilliroside nei bulbi della Scilla rossa subisce variazioni specialmente in rapporto al periodo di raccolta ed al luogo di provenienza. Il maggiore titolo di scilliroside è stato rilevato nei bulbi raccolti in agosto ed in settembre (14) (25).
In bulbi freschi di Algeria in aprile, durante la crescita delle foglie, si sono trovati da tracce a mg 70 di scilliroside per kg di bulbi, mentre nello stadio di fioritura della pianta, cioè in agosto ed in settembre, da 170 a 370 mg/kg e dopo la fioritura 60 mg di scilliroside per kg di bulbi (14).
Altri componenti della Scilla rossa: un pigmento fiavonolico, identificato con l’isoramnetina (4'-metiletere della quercetina o 3,5,7,4'-tetraossi-3-metossi-flavone), C16H12O7 (26). Un poliosio, precedentemente considerato come levulosano, è stato riconosciuto quale composto di glucosio e di levulosio (27).
L’elevata azione rattotossica, propria della Scilla rossa, ha indotto alla ricerca del principio responsabile di questa proprietà. A diverse sostanze — composti floroglucinici (28), cromogeni (29) — è stata attribuita l’attività ratticida, sinché molto tossico per i ratti si è rivelato lo scilliroside, la cui DL 50 per somministrazione orale nei ratti albini è risultata di mg 0,7/kg nei maschi e di mg 43/kg nelle femmine (14) (30).
Proprietà farmacologiche ed impiego terapeutico
La Scilla può essere annoverata fra i rimedi di uso più antico fra le popolazioni abitanti il bacino del Mediterraneo. Essa è ricordata da Teofrasto, da Plinio, da Dioscoride, al quale fra l’altro, si deve la preparazione del vino scillitico il cui uso, come quello del miele scillitico, introdotto più tardi dagli arabi, non è ancora completamente dimenticato.
A Dioscoride erano già note le proprietà diuretiche di questa droga e ne indicava l’impiego contro l’idropisia; essa era usata inoltre contro la tosse, contro l’asma e, più o meno razionalmente, nel trattamento di numerose altre malattie.
Nel Medioevo, secondo Alberto Magno, la Scilla era usata, oltre che nell’idropisia, anche per provocare il flusso mestruale e vedremo in seguito come anche quest’ultima indicazione non fosse del tutto ingiustificata.
Sembra che la più importante azione di cui è dotata questa liliacea, l’azione cardiotonica, sia stata osservata per la prima volta da Home nel 1780 (31) e studiata sperimentalmente in seguito da Fagge e Stevenson nel 1866 (32), da Kónig nel 1875 (33) e da Husemann nel 1876 (34).
La sua azione farmacologica è dovuta ai glicosidi cardioattivi che entrano nella sua composizione e la cui struttura chimica è simile a quella dei glicosidi contenuti nella Digitalis purpurea e nelle altre droghe cosiddette digitaliche, quali lo Strofanto, la Digitale lanata, l’Adonide, la Convallaria, l’Oleandro, il meccanismo d’azione dei quali è fondamentalmente lo stesso di quello già descritto per i glicosidi cardioattivi contenuti nella Digitalis purpurea, dai quali differiscono tuttavia per alcuni particolari che saranno succintamente illustrati.
Potremo intanto distinguere i glicosidi digitalici in due categorie: glicosidi digitalici di I ordine e glicosidi digitalici di II ordine o digitaloidi.
Appartengono alla I categoria i glicosidi cardioattivi contenuti nella Digitalis purpurea e alla II quelli contenuti nelle droghe digitaliche.
Questi ultimi si distinguono da quelli di I ordine, come fu già detto a proposito della Convallaria, principalmente per essere più facilmente saponificabili, per essere dotati di un’azione più pronta e più transitoria e quindi più facilmente reversibile, in relazione al loro minor potere di ancoramento sul muscolo cardiaco ed alla loro più rapida degradazione ed eliminazione. Essi sono quindi esenti da quell’azione cumulativa dalla quale sono caratterizzati invece i glicosidi digitalici di I ordine.
I glicosidi cardioattivi della Scilla, come tutti quelli di II ordine contenuti nelle altre droghe digitaliche, risultano più attivi di quelli di I ordine in unità biologiche (unità rana, unità gatto ecc.) (ved. Convallaria), ma date le loro caratteristiche di assorbimento, di eliminazione, di accumulo ecc. non esiste un parallelismo fra la loro attività espressa in unità biologiche e la loro attività clinica, la quale risulta in ogni caso inferiore a quella dei glicosidi di I ordine.
La Scilla, come le altre droghe digitaliche, è di solito considerata come un succedaneo, della Digitale, ma secondo alcuni Autori [Farenkamp (35)], non sarebbe esatto l'attribuire alla Scilla il semplice ruolo di succedaneo, poiché se è vero che la sua azione tonicardica è inferiore a quella della Digitale, è anche vero che la sua azione vagale è più intensa e tale da agire in maniera più efficace in certi casi di tachicardia sui quali la Digitale o non agisce o agisce soltanto incompletamente.
Secondo Straub (36) l’azione dei glicosidi della Scilla occuperebbe un posto intermedio fra quella dei glicosidi della Digitale e quelli dello Strofanto, in confronto ai quali ultimi i glicosidi della Scilla sarebbero dotati di un’azione terapeutica meno immediata, più blanda e più costante, ciò che praticamente renderebbe più facile la regolazione del dosaggio.
Ove se ne riconosca la necessità si può sostituire lo scillarene con la strofantina o con la Digitale e viceversa. I glicosidi della Scilla differirebbero dagli altri, secondo l’A. per la loro marcata azione diuretica ed azoturica, la quale sarebbe indipendente dal loro effetto sulla circolazione generale. Essi eserciterebbero, secondo questo A., un’azione specifica sul parenchima renale, soprattutto quando esistano lesioni degenerative dei reni. Tale effetto sarebbe conseguente alle modificate condizioni circolatorie locali dovute alla vasodilatazione renale e all’aumento di filtrazione che ne deriva.
Per quanto riguarda il posto che può essere assegnato ai glicosidi della Scilla fra quelli della Digitale e delle altre droghe digitaliche, specialmente per ciò che concerne il loro potere di fissazione sul muscolo cardiaco, i glicosidi della Scilla dovrebbero essere posti, anzichè fra quelli della Digitale e quelli dello Strofanto, fra quelli della Digitale lanata e quelli dello Strofanto.
Rothlin (37) indica la seguente successione, in ordine decrescente, dei diversi glicosidi digitalici relativamente al loro potere di fissazione: digitossina (digitalina cristallizzata), lanatoside C, lanatoside A e purpureaglicoside A, lanatoside B e purpureaglicoside B, scillarene A, ouabaina e k-strofantoside, gitossina, gitalina, agliconi (i quali rispetto ai glicosidi avrebbero un minimo potere di fissazione).
Per quanto riguarda l'azione diuretica della Digitale e delle droghe digitaliche, è noto che mentre alla Digitale, alla Digitale lanata, allo Strofanto, viene attribuita un'azione diuretica indiretta, conseguente cioè alle modificate condizioni cardiocircolatorie generali e renali, alle altre droghe digitaliche viene in generale attribuita, sebbene non concordemente, anche un’azione diuretica diretta esplicantesi cioè a livello degli elementi specifici renali.
White e coll. (38) ritengono che l'azione della Scilla sulla diuresi, raramente può essere posta in evidenza. Kaheen (39) e Stoll (8), al contrario, trovano che la Scilla è un diuretico più attivo della Digitale e Seel (40) ritiene che le proprietà più importanti della Scilla siano quelle extracardiache, quelle cioè che essa esplica sui vasi renali, determinando una vasodilatazione ed eccitando direttamente il parenchima renale, con conseguente aumento della diuresi e della eliminazione dell’azoto.
Buch e coll. (41) hanno studiato le modificazioni della funzione renale determinate in 6 pazienti con valvulopatie reumatiche, dalla somministrazione endovenosa di una dose unica di Scillarene B, eseguendo contemporaneamente ricerche emodinamiche mediante cateterismo cardiaco.
Da tali ricerche risulterebbe che lo Scillarene è un farmaco cardiotonico ad azione rapida, specialmente in pazienti con fibrillazione atriale.
L’affermazione che lo Scillarene, oltre ai suoi effetti di tipo digitalico sul cuore, abbia anche un effetto diuretico, non è stata confermata dai risultati dello studio della funzione renale. L'aumento della diuresi che si può verificare in soggetti scompensati e trattati con questo glicoside, dovrebbe essere considerato, secondo gli AA., secondario agli effetti esercitati sul cuore.
Più recentemente Wogel e Kluge (42), che hanno studiato l'azione diuretica della convallatossina, della cimarina, della g-strofantina, della digossina, del lanatoside C, della digitossina, della digitossigenina e dello scillarene A, somministrati per via endovenosa, hanno trovato che tutti questi glicosidi, esclusa la digitossigenina che si è dimostrata inattiva sotto questo aspetto, svolgono, qualitativamente, la stessa azione.
Questi AA. trovarono che non sempre l'aumento dell'eliminazione del sodio e l'aumento dell’eliminazione d’acqua sono paralleli. La convallatossina si è dimostrata fortemente diuretica e molto attiva sull'eliminazione del potassio.>
I suddetti AA. spiegano l'effetto, diuretico dei glicosidi cardioattivi secondo due meccanismi; inibizione del riassorbimento del sodio da parte dei tubuli ed eliminazione del sodio per mobilizzazione extrarenale del potassio intracellulare.
Più recentemente, Grollman e coll. (43) hanno studiato comparativamente l’azione diuretica di alcuni glicosidi digitalici e dai risultati da essi ottenuti, risulta che quantunque le varie sostanze digitaliche manifestino la stessa azione qualitativa nell’indurre diuresi e natriuresi, se iniettate nell’arteria renale, esse differiscono quantitativamente nella loro azione.
Lo scillarene ha un’azione diuretica e natriuretica maggiore di quella della digossina, forse per la presenza di due doppi legami nell’anello lattonico. La presenza di una molecola di glucosio in più nel desacetil-lanatoside C, rispetto alla digossina, riduce ulteriormente la sua azione diuretica. Modificazioni in entrambi gli agliconi e nella parte glucidica della molecola sembrerebbero condizionare l'azione inibitoria di questi steroidi nel trasporto del sodio.
L’azione diuretica di queste sostanze, non è una conseguenza di variazioni emodinamiche renali, ma dell’inibizione del riassorbimento del sodio nelle anse prossimali e distali dei tubuli renali.
Lo scillarene, glicoside simile a quelli contenuti nella Digitale, esercita secondo gli AA. un’azione diretta sul rene, ma è più potente come diuretico e natridiuretico dei glicosidi digitalici e ciò in accordo con le conclusioni cui giunsero Strickler e Kessler (44).
Un'altra azione interessante che viene attribuita ai glicosidi digitalici e in particolare a quelli contenuti nella Scilla, è quella estrogena, azione che si ricollega con la loro natura steroidica e quindi fondamentalmente simile a quella degli ormoni steroidi (sessuali e corticosurrenali).
Fornero (45) afferma che i preparati di Scilla, sia sperimentalmente sui topi, che clinicamente, manifestano un'azione prevalentemente estrogena. Negli strisci vaginali delle topine trattate con dosi piuttosto elevate di Scilla, si osserverebbero infatti le tipiche cellule dell'estro, quasi come unico reperto del campo microscopico.
A carico della mucosa dell'utero, l’A. ha notato una iperplasia ghiandolare e pluristratificazione dell'epitelio di rivestimento, con cellule cilindriche vacuolizzate, come sintomo della loro intensa funzionalità.
Nell'ovaio è stata notata l’esistenza di una certa spinta alla maturazione dei corpi lutei.
Meno chiaro sarebbe invece il quadro che si riscontra nell’anteipofisi, mentre nessuna reazione sarebbe stata notata nel surrene.
Più marcati sarebbero stati invece i reperti impiegando i glicosidi digitalici i quali, somministrati a dosi opportune, oltre a determinare uno spiccato estro, hanno prodotto reazioni specifiche in tutti gli organi endocrini e in particolare nell'anteipofisi, nella milza, nell'utero e nell’ovaio.
Giacolone (46) riferì su di un’altra applicazione ginecologica dei glicosidi della Scilla. Questo A., dopo aver ricordato le caratteristiche sintomatiche dell'eclampsia tossigravidica e quelle farmacologiche dello Scillarene, sottolinea le notevoli proprietà di questo glicoside nel ricondurre alla norma la diuresi, nel determinare la scomparsa degli edemi e la disintossicazione dell’organismo nei casi di eclampsia, dopo espletato il parto e dopo aver praticato le abituali cure sedative e disintossicanti. Lo Scillarene veniva somministrato in questi casi, per iniezione endovenosa alla dose di 0,5 mg quotidianamente per 4 o 5 giorni.
Estratti e preparati vari
a) Estratto fluido titolato biologicamente Titolo: g 1 =4 U.I. del Campione Internazionale di Digitale. (g 1 = XLVI gtt).
Dosi: V-XV gtt pro dose.
b) Estratto fluido acetico per ossimiele (g 1 = XXVI gtt).
Serve per la preparazione dell'ossimiele scillitico.
c) Tintura F.U. al 20 % di droga.
Dosi: XXV- LXX gtt pro dose.
d) Glucosidi titolati biologicamente
Dosi: mg 1,6 tre-quattro volte al giorno (dose d’attacco); mg 0,8 una-quattro volte al giorno (dose di mantenimento).
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido scilla……………………………………………….. g 20
Alcool di 70° g 80
(XXV-LXX gtt pro dose due-tre volte pro die).
Sciroppo
Tintura scilla F.U…………………………………………………….. g 5
Sciroppo semplice F.U………………………………………….. g 95
(2-3 cucchiaini pro die, fino a g 20-25).
Ossimiele
Estratto fluido acetico scilla ……………………………………. g 5
Miele depurato………………………………………………………. g 95
(20-30 g pro die).
Aceto scillitico F.U.
Estratto fluido acetico scilla…………………………………… g 10
Acqua……………………………………………………………………. g 80
Alcool di 90° g 10
(0,6-2 cc pro dose).
Pozione cardiotonica e diuretica
Tintura scilla F. U.
Tintura digitale………………………………………………….. ana gtt X
Sciroppo radici aperitive ………………………………………. g 15
Acqua……………………………………………………………………. g 60
(a cucchiai durante la giornata).
Sciroppo di scilla composto (U.S. Pharm. IX).
Estratto fluido scilla
Estratto fluido poligala………………………………………….. ana g 30
Tartaro emetico……………………………………………………….. g 2
Acqua distillata……………………………………………………… g 10
Sciroppo semplice F.U. q. b. a…………………………… g 1000
(a cucchiaini).
Vino di scilla composto
Estratto fluido scilla……………………………………………….. g 30
Estratto fluido arancio amaro…………………………………. g 12
Estratto fluido china solubile…………………………………. g 12
Estratto fluido ginepro……………………………………………… g 8
Estratto fluido angelica……………………………………………. g 4
Estratto fluido assenzio…………………………………………… g 4
Vino bianco q. b. a…………………………………………….. g 1500
(2-3 cucchiai pro die).
BIBLIOGRAFIA
(1) WEHMER C., Die Pflanzenslotle; II ed., p. 154 • (2) STOLL A., SUTER E., KREIS W., BUSSE- MAKER B. B. e HOFMANN A., Helv. Chim. Acta, 16, 703, 1933 – (3) STOLL A., KREIS W, e HOFMANN, Z. physiol. Chem., 222, 24, 1933 – (4) STOLL A., KREIS W. e VON WARTBURG A., Helv. Chim. Acta, 35, 2495, 1952 – (5) STOLL A., HOFMANN A. e HELFENSTEIN A., ibidem, 17, 641, 1934 – (6) STOLL A., HOFMANN A., KREIS W., ibidem. 17, 1334, 1934 – (7) STOLL A. e HOFMANN A., ibidem, 18, 82 e 401, 1935 – (8) STOLL A., HOFMANN A. e HELFENSTEIN A., ibidem. 18, 64, 1935 – (9) STOLL A., HOFMANN A. e P!!YER J., ibidem, 18, 1247, 1935 – (10) STOLL A. e RENZ J.,
ibidem, 24. 1380, 1941 – (11) STOLL A., RENZ J. e BRACK A., ibidem, 35, 1934, 1952 – (12)' STOLL A. e KREIS W., ibidem, 34. 1431, 1951 – (13) STOLL A., VON WARTBURG A. e RENZ J., ìbidem, 36, 1531, 1953 – (14) STOLL A. e RENZ J., BuH. sci. pharm., 47, 65, 1940; Helv. Chim. Acia, 24. 1380, 1941; 25, 43 e 377, 1942; 33, 286, 1950 – (15) GOERLICH B., Lieb. Ann., 634, 192, 1960 – (16) RAMSTAD E., Pharm. Acta Heiv., 28, 45, 1953 – (17) SCHINDLER H., Inhaltstoffe und Priìfungsmethoden homò- pathisch verwendeter Pflanzen, 1955, p. 177 – (18) BUSCHMANN E., Arch. Pharm., 257, 79, 1919 – (19) GEORG A.^ Arch. sci., 7, 52. 1954 – (20) STOLL A., RENZ J. e HELFENSTEIN A., Helv. Chim. Acta, 26, 648, 1943 – (21) FIESER L. F. e FIESER M., Naturai Products Re!ated to Phenanthrene, III ed., 1949, p. 558 – (22) VON WARTBURG A. e RENZ J., Helv. Chim. Acta, 42, 1620, 1959 – (23) STOLL A. e RENZ J., ibidem, 33, 286, 1950 -(24) STOLL A. e RENZ J., Compt. rend., 210, 508, 1940-(25) O’CONNOR M. G., BUCK R. E. e FELLERS C. R., ind. Eng. Chem., 27, 1377, 1935 – (26) VITTE G. e BOUSSE- MART E., BuU. soc. pharm. Bordeaux, 90, 177, 1952 – (27) BOUSSEMART E., BuH. soc. pharm. Mar- seiiie, n. 3, 47, 1952 • (28) ROQUES, Compt. rend., 139, 726, 1945 – (29) GIULIANO O., Boli. soc. it. bioi. sper., 23, n. 12, 1, 1947 – (30) ROTHLIN E. e SCHALCH W. R., Helv. Physiol. Pharmacoi. Acta, 10, 427, 1952 – (31) HOME, Chem. exp. Histories a. dirrection, Edinburg, p. 357, 1780, cit. da MADAUS in Lehrbuch der Biologischen Heilmittel, G. Thieme, Lipsia 1938, voi. IH, p. 2479 – (32) FAGGE e STEVENSON, Pharm. J., 7, 421, 1866, cit. da MADAUS I.c. (31) – (33) KOENIG, Dissert. Gottinga 1875, eit. da MADAUS I.c. (31) – (34) HUSEMANN, Arch. exp. Path. u. Pharmakol., 5, 254, 1876, eit. da MADAUS I.c. (31) – (35) FAHRENKAMP, Dtsch. Arch. Kiin. Med., 145, 109, 1924 – (36) STRAUB W., Ther. Gegenw., 98, 1959; J.A.M.A., 172. 164/184, 1960 • (37) ROTHLIN E., J. Suisse Méd., 70, 577 1940 – (38) WHITE e coll., J.A.M.A.. 75, 974, 1920 – (39) KAHEEN, Dtsch. med. Woch., 65, 1667, 1939 – (40) SEEL H., Pharmazie, 14, 301, 1959 • (41) BUCH H., ELIASCH H., THOMASSON B. e WERKO L., Am. Hearr. J., 54, 376. 1957 – (42) WOGEL G. e KLUGE E., Arzneim.-Forsch.. 11, 848, 1961 – (43) GROLLMAN A., SUKI W. e GAVAMIAN M., Arch. intern. pharmacod. et de thér., 140, 55, 1962 – (44) STRICKLER J. C. e KESSLER R. ., J. CHn. invest., 40. 311, 1961 • (45) FORNERO A., Progressi di Terap., 36, 13, 1951 – (46) GIACOLONE T., Riv. di Ostet. Ginecol., 7, 263, 1952.


