Digitale
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Digitalis purpurea L. – Fam. Scrofulariacee/Rinantoidee/Digitalee)
Digitale- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Digitalis, dal latino digitus = dito, da cui ditale: allusione alla forma della corolla.
purpurea, per i fiori color porpora, dal latino purpura, color porpora.
Nome volgare – Ditale della Madonna, erba aralda, cornucopia, erba di San Leonardo, ecc.
Habitat – Terreni silicei delle regioni montagnose dell'Europa centrale e occidentale. In Italia, indicata come avventizia nelle regioni settentrionali (Val d 'Aosta, Val d’Ossola) e centrali, presente nel Comasco, Carnia. Toscana.
Coltivata come ornamentale. Esistono parecchie varietà a fiori rosei, bianchi, ecc. e parecchi ibridi.
Spontanea in Sardegna è la Digitalis purpurea L. var. tomentosa Hoff. et Link. (Limbara e Gennargentu) (da non confondersi con la Digitalis lanata Ehrh.). Questa specie corrisponde alla Digitalis Thapsi L. della Spagna.
Parti usate – Le foglie (Digitalis folia F. U.).
Componenti principali
Numerosi glicosidi con struttura sterolica, che si possono classificare in due gruppi fondamentali:
A: Glicosidi cardioattivi, le cui genine hanno come nucleo basilare il cardenolide con 23 atomi di carbonio.
B: Glicosidi non cardioattivi:
1 ) glicosidi del gruppo del digitanolo con genine che hanno come scheletro un nucleo sterolico con 21 atomi di carbonio;
2) glicosidi saponinici con genine, che hanno per scheletro Io spirostano con 27 atomi di carbonio.
Le ricerche chimiche sui principi attivi della Digitalis purpurea fu iniziata da AA. francesi (1) (2) (3) sin dai primi decenni del secolo scorso. Verso il 1869 Nativelle (4) riuscì per primo a preparare la “digitalina cristallizzata”, che è stata successivamente denominata digitossina da Schmiedeberg (5). Indagini successive furono condotte alla fine del XIX ed all'inizio del XX secolo da Kiliani (6), da Cloetta (7) e specialmente da Windaus (8). Sono stati messi così in evidenza i prodotti idrolitici della digitossina, cioe l'aglicone digitossigenina e tre molecole di uno zucchero caratteristico, il digitossosio.
In seguito agli studi di Kiliani (9), di Kraft (10) e di Windaus (8), agli inizi del secolo scorso, è stato isolato un nuovo glicoside cristallizzato la gitossina, costituita dall’aglicone gitossigenina e da tre molecole di digitossosio.
Un terzo glicoside attivo, il digitalinum verum, già isolato dai semi della Digitalis purpurea da Schmiedeberg nel 1875 (5), fu studiato molto più tardi da Kiliani (11) e da Windaus (8).
Le indagini sulla composizione chimica dei glicosidi cardioattivi furono approfondite specialmente da Windaus e coll. (8), i quali con una serie di importanti lavori, iniziati nel 1922, giunsero a definire la costituzione e la configurazione degli agliconi.
Stoll e Kreis (12) nel 1935 riferirono che una grande parte dei glicosidi digitalici non preesiste nella droga come tale, ma deriva dalla scissione idrolitica di glicosidi primari. Questi AA. operando su droga, in cui era stata bloccata l’azione degli enzimi, riuscirono ad isolare una serie di nuovi composti, cioè i purpureaglicosidi A e B.
La presenza di un nuovo glicoside la “digicorina”, segnalata in un primo tempo (13), è stata negata successivamente da Ishidate e coll, (14) ( 15).
L'introduzione di moderni metodi di separazione, quali la cromatografia su carta e su colonna e la ripartizione tra solventi non miscibili, ha reso possibili l’identificazione e l'isolamento di numerose altre sostanze presenti in minime quantità nella Digitalis purpurea. Ulrix (16) sin dal 1946 per via cromatografica dimostrò che certe sostanze ritenute pure erano miscele; segnalò inoltre la presenza di principi glicosidici non ancora conosciuti e mise invece in dubbio l'esistenza, come sostanze singole, sia della gitalina, già contestata da Kiliani sin dal 1914 (9), sia del “purpureaglicoside C” da cui si faceva derivare la gitalina stessa. Le ricerche cromatografiche di Haack, Kaiser, Gube e Spingler (17- 20) dovevano in seguito confermare l'inesistenza della “gitalina” come sostanza unica. Nella frazione “gitalina” questi AA. stabilirono infatti la presenza di parecchie sostanze, tra cui digitossina, gitossina, strospeside e due nuovi composti, la gitalossina e la verodossina.
Nel 1953 Ishidate e Okada (21-23) isolavano dalle foglie della Digitalis purpurea la gitorina, che Tschesche, Grimmer e Neuwald (24) avevano già estratta dalle foglie della Digitalis lanata. Nello stesso anno Sato, Yoshida, Ishii e Nishimura (25) segnalavano la presenza nelle foglie della Digitalis purpurea dello strospeside, così denominato da Reichstein e coll. che l'avevano precedentemente isolato dallo Strophanthus speciosus Reb. (26-28). Frattanto Stoll, Kreis e von Wartburg nel 1954 (29) riuscivano ad ottenere in forma cristallizzata i purpureaglicosidi A e B, noti sino a quel momento solo in forma amorfa. ll digitalinum verum, che prima si riteneva presente solo nei semi della Digitalis purpurea, nel 1953 è stato messo in evidenza anche nelle foglie da Ishidate, Okada e Sasakawa (30). Nel 1955 anche il già noto odoroside H è stato trovato nelle foglie della Digitalis purpurea da Sato, Ishii e Oyama (31) e da Haack, Kaiser e Spingler (32).
Nuovi glicosidi cardioattivi sono stati inoltre segnalati in questi ultimi anni nella D. purpurea: il digiproside, isolato dalle foglie nel 1955 da Sato, Ishii. Oyama, Wada e Okumura (33) (34); la gitalossina (16-formil-gitossina), il primo dei glicosidi formilici molto attivi trovati nella Digitale e precisamente nella frazione “gitalina”, è stato estratto dalle foglie da Haack, Kaiser e Spingler nel 1955 (17) (19): la verodossina e la glucoverodossina, due altri glicosidi formilici, sono stati ottenuti dalle foglie dagli stessi AA. nel 1956 (20); la presenza di diversi bis- e mono-digitossosidi della digitossigenina, della gitossigenina e della gitalossigenina è stata inoltre rilevata nel 1956 da Sato e coll. (35) (36) e nel 1957 da Kaiser, Haack e Spingler (37) e da Murphy (38): Miyatake, Okano, Hoji e Miki nel 1957 (39) hanno isolato la gitostina e nel 1958 (40) la neogitostina, due nuovi glicosidi della gitossigenina; nel 1958 Haack, Kaiser e Spingler (41) hanno aggiunto una nuova sostanza alla serie dei glicosidi della gitalossigenina, la glucogitalossina (16-formil-purpureaglicoside B), trovata nelle foglie e nei semi della D. purpurea.
Altri glicosidi, apparentemente nuovi, sono stati estratti mediante metodi cromatografici, da parecchi AA.. Jensen (42 ), in un estratto acquoso della D. purpurea, ha riconosciuto la presenza di nuove sostanze, cinque della serie A e nove della serie B. Sasakawa (43) nelle foglie della D. purpurea ha messo in evidenza 6 nuove sostanze che presentano la fluorescenza dei glicosidi della serie B.
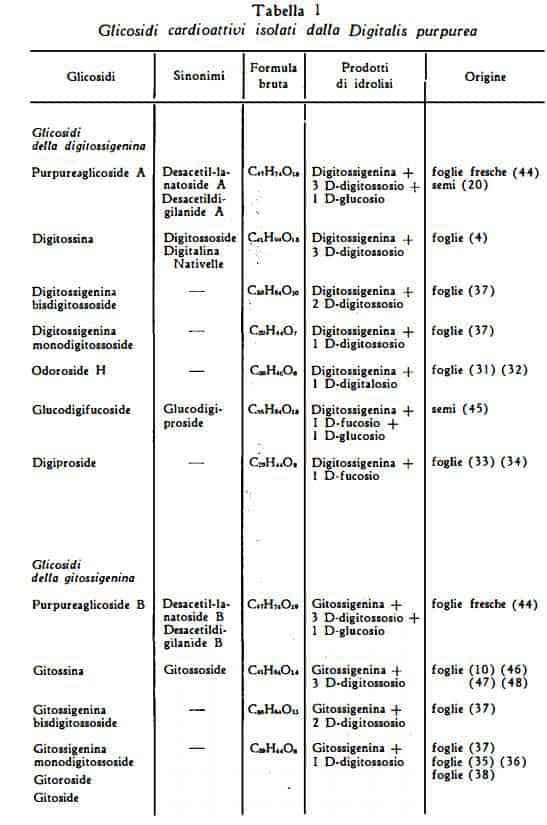
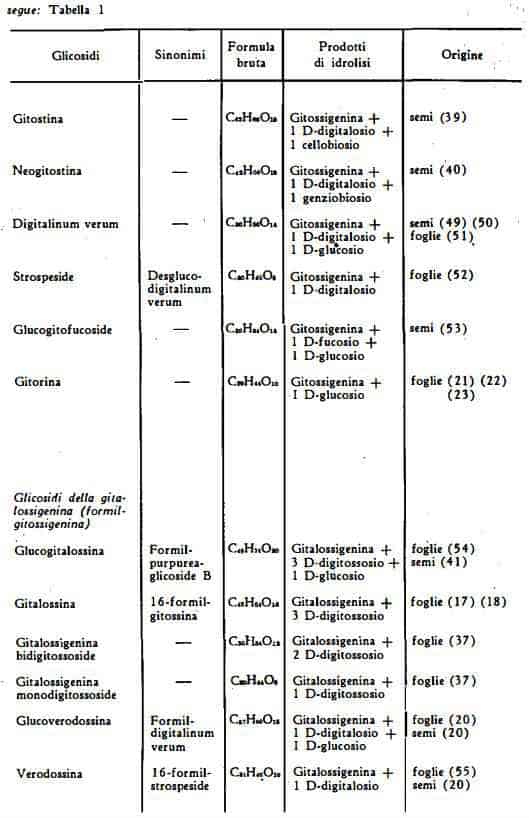
Glicosidi cardioattivi
- – Glicosidi della digitossigenina
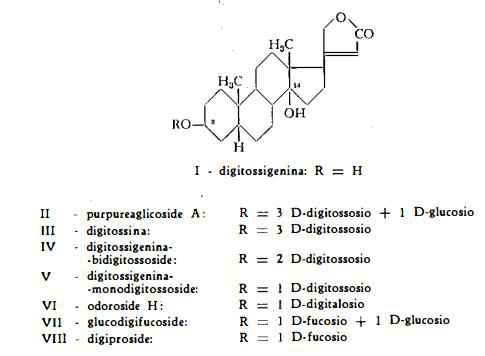
Il purpureaglicoside A, C47H74O18 (formula di struttura II), identificato al desacetil-lanatoside A o desacetil-digilanide A, è stato isolato dalle foglie fresche della Digitalis purpurea da Stoll e Kreis (12). Gli stessi AA. con Wartburg (29) l'hanno più tardi ottenuto in forma cristallina. Haack, Kaiser, Cube e Spingler (20) l’hanno trovato anche nei semi della stessa droga. E’ composto dell'aglicone digitossigenina C23H34O4, di 3 molecole di D-digitossosio e di 1 molecola di D-glucosio. Per idrolisi enzimatica perde facilmente la molecola di glucosio per dare digitossina.
La digitossina (digitossoside, digitalina Nativelle), C41H64O13, (formula III) è stato il primo glicoside estratto in forma purificata dalle foglie della Digitalis purpurea per opera di Nativelle (4), che gli assegnò il nome di digitalina. Essa fu in seguito isolata da parecchie altre specie di Digitalis, La denominazione digitossina si deve a Schmiedeberg (5) e la identificazione della digitalina Nativelle alla digitossina si deve ad Hasenfratz (56). L’esatta formula grezza, C41H64O13, è stata definita da Windaus (57). Per scissione idrolitica con acidi la digitossina produce digitossigenina e digitossosio (58), precisamente 3 molecole di D-digitossosio, C6H12O4 (59). E’ stata ottenuta per scissione idrolitica del purpureaglicoside A e del digilanide A da Stoll e Kreis nel 1933 (12).
L'aglicone della digitossina, la digitossigenina (formula I), ha assunto altre denominazioni — tevetigenina, cerberigenina, evonogenina, echujetina —, secondo i nomi degli altri glicosidi, dalla cui idrolisi essa è stata ottenuta. La formula grezza, C28H34O4, è stata stabilita da Windaus (60) e la formula di struttura (I) è stata fissata in seguito agli studi sulla configurazione chimica, compiuti da Jacobs e Gustus (61), da Windaus e Stein (62), da Tschesche (63), da Jacobs e Elderfeld (64), da Hunziker e Reichstein (65) e da Meyer (66).
Un bidigitossoside della digitossigenina, C35H54O10, (formula IV) è stato isolato dalle foglie della Digitalis purpurea da Kaiser, Haack e Spingler (37).
Un monodigitossoside della digitossigenina, C29H44O7, (formula V), è stato pure estratto dalle foglie dagli stessi AA. sopracitati (37).
L’odoroside H, C30H46O8, (formula VI) (digitossigenina + 1 mol. D-digitalosio), già isolato dalla corteccia del Nerium Odorum Sol. (67), dalla pianta dello Strophanthus gracilis K. Schum. et Pax. (68) (69), dalle radici della Carissa ovata (R. Br.) var. stolonifera F. M. Bailey, dalla C. lanceolata R. Br. (70) e dai semi dello Strophanthus vanderijstii (71), è stato trovato anche nelle foglie della Digitalis purpurea da Sato e coll. (31) e da Haack, Kaiser e Spingler (32).
Il glucodigifucoside o glucodigiproside, C35H54O13 (formula VII) (digitossigenina + 1 mol. D-fucosio + 1 mol. D-glucosio) è’stato trovato nelle foglie da Okano (45).
Il digiproside, C29H44O8 • ½ H20, (formula VIlI), (digitossigenina + 1 mol. D-fucosio) è stato ottenuto dalle foglie della Digitalis purpurea da Sato, Ishii, Oyama, Wada e Okumura (33) (34), i quali hanno dimostrato che si tratta di un mono-D-fucoside della digitossigenina.
- – Glicosidi della gitossigenina
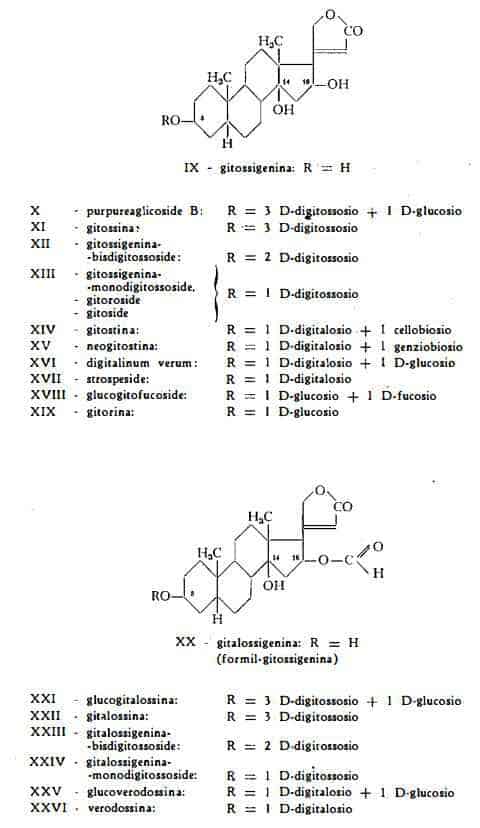
Il purpureaglicoside B, C47H74O10, (formula X), identificato con il desacetil-lanatoside B o desacetildigilanide B, è stato isolato da Stoll e Kreis nel 1935 (44) in forma amorfa dalle foglie fresche della Digitalis purpurea. Gli stessi AA. con Von Wartburg nel 1954 (29) l'hanno ottenuto in forma cristallizzata. Haack, Kaiser, Gube e Spingler (20) l'hanno trovato anche nei semi della stessa droga. Il purpureaglicoside B è composto dell'aglicone gitossigenina, C23H34O5, di 3 mol. di D-digitossosio e di 1 mol. di D-glucosio. Per idrolisi enzimatica perde facilmente la molecola di glucosio per dare gitossina.
La gitossina (gitossoside), C41H64O14, (formula XI), identificata da Windaus e Schwarte (47) con l'anidrogitalina di Kraft (10) e da Windaus, Westphal e Stein (48) con il bigitalinum di Cloetta (46), è stata estratta dalle foglie della Digitalis purpurea in forma pura da Windaus e coll. (48) che ne hanno determinata la formula centesimale. Essa produce per idrolisi gitossigenina, C23H34O5 e 3 mol. di D-digitossosio (47).
L'aglicone della gitossina, la gitossigenina, C23H34O5, (formula IX), è stata ottenuta per la prima volta per idrolisi dell'anidrogitalina (= gitossina) da Kraft (72), che le diede la denominazione «anidrogitaligenina». Windaus e Schwarte (47) le assegnarono il nome gitossigenina. Windaus, Westphal e Stein (48), che l'hanno identificata alla bigitaligenina di Cloetta (46), ne hanno stabilita la formula grezza, C23H34O5, ed hanno iniziati gli studi sulla struttura chimica, continuati poi da Jacobs e Gustus (73), da Jacobs e Elderfeld (74), da Tschesche (63), da Moore (75) e da Cardwell e Smith (76). Attualmente la formula di struttura della gitossigenina si rappresenta secondo lo schema IX.
Un bidigitossoside della gitossigenina, C35H54O11, (formula XII), è stato isolato dalle foglie della D. purpurea da Kaiser, Haack e Spingler (37).
Anche un monodigitossoside della gitossigenina, C29H44O8, (formula XIII), è stato estratto dalle foglie dagli stessi AA. sopracitati (37), ed inoltre da Sato e coll. (35) (36) con il nome di gitoroside e da Murphy (38) con il nome di gitoside.
La gitostina, (formula XIV), un triglicoside della gitossigenina, è stato estratto dai semi della D. purpurea da Miyatake, Okano, Hoji e Miki (39) ed identificato con un gitossigenin-b-cellobiosido-b-D-digitaloside (40). Per idrolisi enzimatica parziale la gitostina dà 1 mol. di glucosio e digi-talinum verum, C36H56O14 oppure 2 mol. di glucosio e strospeside, C30H46O9.
La neogitostina, (formula XV), glicoside cardiotonico trovato nei semi della Digitalis purpurea, è stata identificata con un gitossigenin-b-genziobiosido-b-D-digitaloside (40).
Il digitalinum verum, C36H56O14, (formula XVI), è stato isolato anche dalle foglie della D. purpurea da Ishidate, Okada e Sasakawa (51), dopo d'essere stato estratto per la prima volta da Kiliani (49) e poi da Windaus, Bohne e Schwieger (50) dai semi della stessa droga. La formula grezza è stata fissata definitivamente a C36H56O14 da Windaus e Haack (77) Il digitalinum verum, che è difficilmente idrolizzabile produce, per energica scissione idrolitica con acidi, 1 mol. di D-digitalosio, 1 mol. di D-glucosio e l'aglicone dianidrogitossigenina (digitaligenina), C23H30O3, che non è la genina originale, essendo questa propriamente la gitossigenina (47).
Lo strospeside (desgluco – digitalinum verum) C30H46O9, (formula XVII), (gitossigenina + 1 mol. D-digitalosio) fu così denominato da Reichstein e coll. (78), che lo isolarono dapprima dai semi dello Strophanthus speciosus Ward et Harv. e dello S. Bovini Baill.. E' stato trovato nel 1953 da Sato, Yoshida, Jshii e Nishimura (52) nelle foglie della Digitalis purpurea e nel 1955 da Tschesche e Grimmer (79) nelle foglie della Digitalis lanata.
Il glucogitofucoside (gitossigenina + 1 mol. D-fucosio + 1 mol. D-glucosio), (formula XVIII), precedentemente isolato in forma di eptaacetato, C35H54O14 (C2H2O)7, dalle foglie della Digitalis lanata da Tschesche e Grimmer (79), è stato successivamente trovato in piccole quantità anche nei semi della Digitalis purpurea da Miyatake, Okano, Hoji e Miki (53). Il glucogitofucoside per scissione idrolitica produce l'aglicone dianidrogitossigenina, 1 mol. di D-glucosio ed 1 mol. di D-fucosio.
La gitorina, C20H44O10, (formula XIX), (gitossigenina + 1 mol. di D-glucosio) è stata in un primo tempo estratta dalle foglie della Digitalis lanata da Tschesche, Grimmer e Neuwald (80) e poi anche dalle foglie della D. purpurea da Ishidate e Okada (21) (22) (23 .
- – Glicosidi della gitalossigenina ( 16-formil-gitossigenina)
La glucogitalossina (16-formil-purpureaglicoside B), C48H74O20, (formula XXI), è stata isolata per cromatografia su carta dalle foglie della Digitalis purpurea da Wichtl (54), che l'ha segnalata come nuova sostanza diversa dalla gitalossina ed analoga ai purpureaglicosidi A e B. Haack, Kaiser, Spingler e Gube (41) l'hanno isolata, oltre che dalle foglie, anche dai semi della Digitalis purpurea. La glucogitalossina è composta dell'aglicone gitalossigenina, C24H34O6, di 3 mol. di digitossosio e di 1 mol. di glucosio. Per idrolisi enzimatica perde facilmente la molecola di glucosio per dare gitalossina.
La gitalossina (16-formil-gitossina), C42H64O15, (formula XXII), è costituita dall'aglicone gitalossigenina e da 3 molecole di D-digitossosio. E' stata estratta dalle foglie della Digitalis purpurea in quantità paragonabili a quelle della digitossina e della gitossina da Haack, Kaiser e Spingler (17) (18), che l’hanno così denominata e ne hanno determinata la costituzione chimica (19). La gitalossina differisce dalla gitossina per la presenza di un radicale formilico in posizione 16. La presenza di questo radicale sembra perciò conferire alla gitalossina la particolare attività farmacologica, di cui essa è dotata, notevolmente superiore a quella della gitossina.
Un bidigitossoside della gitalossigenina, C36H54O12, (formula XXIII), è stato trovato da Kaiser, Haack e Spingler (37) nelle foglie della D. purpurea.
Un monodigitossoside della gitalossigenina, C30H44O9, (formula XXIV), gli stessi AA. sopracitati (37) hanno pure estratto dalle foglie della D. purpurea.
La glucoverodossina (formildigitalinum verum), C37H56O15, (formula XXV), (verodossina + 1 mol. D-glucosio) è stata trovata, come la glucogitalossina, sia nelle foglie che nei semi della D. purpurea (20).
La verodossina (16-formil-strospeside), C31H46O10, (formula XXVI), (gitalossigenina + 1 mol. D-digitalosio) è stata estratta dalle foglie della D. purpurea da Haack, Kaiser e Spingler (55), che ne hanno determinata la composizione chimica. E' stata trovata anche nei semi della stessa droga (20).
La presenza di genine libere (digitossigenina, gitossigenina) nelle foglie della D. purpurea è stata riconosciuta da alcuni AA. (16) (81) e negata da altri (82).
Composizione chimica dei glicosidi cardioattivi
La struttura chimica dei glicosidi cardioattivi è stata chiarita specialmente per opera di Windaus e coll. (8), i quali riuscirono a stabilire il rapporto esistente tra la configurazione chimica delle genine digitaliche e quella di steroli di composizione nota. La caratteristica generale dei glicosidi cardioattivi della Digitale e di altre droghe cardiotoniche, quali l’Adonide, la Convallaria e lo Strofanto, è infatti quella di avere come scheletro il nucleo «cardenolide», derivato dal metil-ciclopeptenofenantrene, di avere cioè una struttura steroide ed un caratteristico gruppo lattonico insaturo pentatomico, che è di importanza fondamentale per l'azione cardiotonica. L'anello lattonico è fissato al nucleo sterolico nell'atomo di carbonio C17. Inoltre tutti i glicosidi hanno due gruppi —CH3 nelle posizioni C10 e C13, un gruppo —OH in C14 ed un altro in C3, al quale ultimo si attacca il radicale zuccherino. Lo zucchero può essere un mono-, di-, tri- ed anche un tetraoso. Nei glicosidi cardiotonici della Digitalis purpurea sono stati sinora identificati i seguenti zuccheri; D-digitossosio, D-digitalosio, D-fucosio
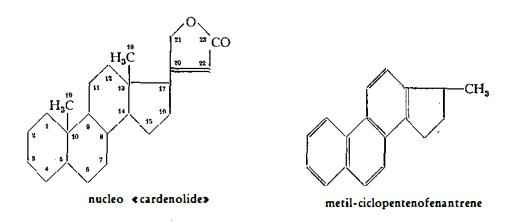
e D-glucosio. Il D-digitalosio ed il D-digitossosio hanno una struttura caratteristica e sono stati trovati solo nei glicosidi digitalici.
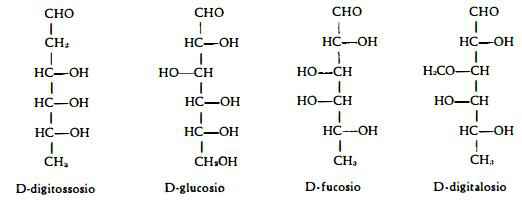
Dal punto di vista della composizione chimica i glicosidi cardioattivi della Digitalis purpurea si possono dividere in tre gruppi principali, ai quali si possono riferire rispettivamente i glicosidi delle genine digitossigenina, gitossigenina e gitalossigenina. Poiché la gitalossigenina è la 16-formilgitossigenina, i tre agliconi sono riducibili praticamente a due forme fondamentali, cioè alla digitossigenina ed alla gitossigenina, che differiscono soltanto nel numero e nella posizione dei gruppi ossidrilici e precisamente:
digitossigenina: due OH in posizione 3 e 14 rispettivamente
gitossigenina: tre OH in posizione 3, 14 e 16 rispettivamente
La maggiore differenza tra i diversi glicosidi digitalici consiste quindi nella struttura della catena zuccherina.
Nelle foglie fresche della Digitalis purpurea, dopo i lavori di Stoll e coll. (12), si è ammessa la presenza di due glicosidi iniziali (glicosidi primari), cioè i purpureaglicosidi A e B, suscettibili di scissione ad opera degli enzimi delle foglie (digipurpidasi) per dare i corrispondenti desglucosidi (glicosidi secondari) digitossina e gitossina. Ai purpureaglicosidi si è poi aggiunto un terzo glicoside primario, la glucogitalossina, isolata ed identificata da Haack e coll. (18), la quale, come i purpureaglicosidi A e B. perde facilmente un glucosio per idrolisi enzimatica, dando la gitalossina. Questa a propria volta subisce una lenta degradazione in presenza della umidità delle foglie per il distacco del radicale formilico, trasformandosi in gitossina.

I glicosidi primari contengono tutti tre molecole di digitossosio ed una molecola di glucosio, delle quali solo quella del glucosio, che è legata al terzo digitossosio, si elimina per azione enzimatica. Infatti il distacco del digitossosio richiede una idrolisi più spinta (idrolisi acida). Pertanto i bis- e monodigitossosidi, che sono stati trovati nella digitale, non sono da considerarsi quali prodotti della scissione idrolitica dei glicosidi più complessi. Si potrebbe invece avanzare l’ipotesi che questi mono- e digitossosidi siano elementi intermedi della biosintesi dei glicosidi primari.
Comunque altri ancora sono i componenti glicosidici della Digitale, che non derivano certamente dai glicosidi iniziali di Stoll, come la gitorina che ha una molecola di glucosio direttamente legata alla genina o come l'odoroside, il digitalinum verum e gli altri, che contengono zuccheri diversi da quelli dei glicosidi primari.
Contenuto di glicosidi cardioattivi
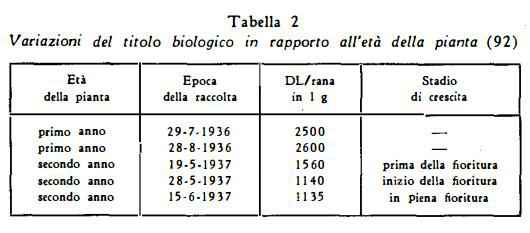
II contenuto di glicosidi cardioattivi della Digitale dipende da molti fattori che influenzano la formazione dei glicosidi nella pianta. Tra i più importanti sembra siano da annoverarsi la stagione della raccolta (83-86), i mutamenti di temperatura, l'esposizione alla luce (87-89) e specialmente l’età della pianta (84) (88) (90-92). Sono state osservate variazioni della percentuale di glicosidi nelle varie ore del giorno (92a – 92d), con valori massimi verso mezzogiorno e minimi nella notte (92b).
Nello studio del contenuto di glicosidi totali e di digitossina nel corso del ciclo vegetativo della Digitale, si fa distinzione fra i due periodi di crescita della pianta. La crescita infatti avviene in due periodi: nel primo anno si forma una rosetta basale e solitamente nella primavera del secondo anno (ma talvolta non prima del terzo e del quarto anno) si sviluppa l’alto stelo fiorifero. Dopo la fruttificazione la pianta muore. Sharp e Lancaster (93) hanno riferito che le piante di Digitale cresciute in Inghilterra hanno avuto un titolo massimo nella raccolta del giugno e del luglio. Nelle foglie pienamente cresciute del primo anno Tattje (83) ha notato un più elevato contenuto di glicosidi totali all’inizio di luglio ed un secondo aumento, meno elevato del precedente, in ottobre. La stagione migliore per la raccolta delle foglie delle piante del secondo anno è verso il periodo della fioritura (84) (85). Durante il secondo anno di crescita anche Tattje (84) ha trovato un massimo titolo all’inizio dell’epoca della fioritura.
Kelpsaite (85) per le foglie delle piante del primo anno ha rilevato un titolo massimo in settembre. Per le piante bisannuali e pluriannuali l’A. ha notato un tenore di glicosidi cardioattivi più elevato nelle foglie raccolte prima della fioritura dalla fine di maggio all'inizio di luglio. Yamamoto (86) ha ottenuto titoli massimi in agosto con regressione successiva fino ad un secondo aumento nel maggio dell’anno seguente.
E’ stato osservato che sia nelle piante del primo che del secondo anno le foglie possono avere basso o nullo contenuto di principi attivi (94) (95) ed inoltre il titolo di glicosidi cardioattivi, secondo le esperienze di parecchi AA., (84) (88) (90-92), è risultato spesso superiore nelle foglie del primo anno rispetto a quello delle foglie del secondo anno.
La composizione quali-quantitativa delle foglie della D. purpurea varia molto secondo la provenienza della droga. Il rapporto tra il titolo di purpureaglicoside A e di purpureaglicoside B è variabile entro larghi termini. Gli studi sperimentali di Van Os e coll. (97-99) su piante di Digitalis purpurea di origine geografica diversa hanno contribuito a spiegare le cause delle elevate differenze di attività farmacologica, più volte notate per droghe di diversa provenienza, aventi il medesimo titolo di glicosidi totali. Gli AA. hanno infatti dimostrato l’esistenza di popolazioni naturali (dette anche «razze chimiche») di Digitalis purpurea di diversa origine, in cui le proporzioni tra i diversi glicosidi, più o meno attivi, sono caratteristiche costanti. Essi descrivono tre tipi con diversa composizione: il primo più attivo, con glicosidi prevalentemente del gruppo A (tipo a digitossina), il secondo con glicosidi del gruppo B (tipo a strospeside) ed il terzo, il meno attivo, con glicosidi del digitanolo (tipo a digipurpurina). Il primo tipo, che si distingue per il tenore elevato di digitossina, è quello della Digitale raccolta nei Vosgi. della quale sono notoriamente molto quotate l’attività farmacologica e l'elevato rendimento di digitossina. Le piante dei Vosgi
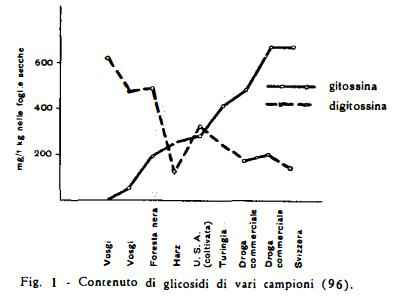
contengono infatti in prevalenza glicosidi della serie A (digitossina) e solamente il 20-25% di glicosidi della serie B (gitossina). La Digitale delle Ardenne belghe è del secondo tipo con titolo predominante di glicosidi della serie B, contenendone circa 40-50%. Con scarso contenuto di digitossina è il terzo tipo, in cui sono presenti quantità notevoli di digipurpurina, glicoside del digitanolo, che è praticamente inattivo sul cuore. Gli stessi AA. (97-99) hanno espresso l’opinione che a determinare le costanti differenze nelle rispettive proporzioni dei glicosidi della Digitale non siano le diverse condizioni ambientali, bensì i caratteri ereditari.
Le ricerche sulla biologia delle Digitali si sono orientate anche verso lo studio della influenza, che può esercitare la natura del terreno sulla crescita della pianta e sulla produzione dei glicosidi attivi. Queste indagini hanno avuto soprattutto lo scopo pratico di giungere alla coltivazione della pianta anche in zone lontane ed in terreni diversi da quelli acidi, silicei, su cui la Digitalis purpurea cresce spontanea (100-102). Duquénois (101) e successivamente Rowson (102) anche da terreni calcarei hanno ottenuto raccolti con rese soddisfacenti e con attività farmacologica globale comparabile con quella delle foglie spontanee dei Vosgi.
Un’altra questione, interessante la cultura della Digitale, è la funzione, che sulla crescita della pianta e sulla produzione dei glicosidi può esercitare la presenza del manganese nel terreno. I risultati delle analisi del Burmann (103) avevano messo in rilievo elevate quantità di manganese nelle foglie della Digitalis purpurea. Dafert e Lòwy (104) hanno in seguito constatato che l'aggiunta di manganese al terreno aumenta il rendimento quantitativo del raccolto a detrimento dell’attività della droga. Le esperienze di Duquénois e Schaerer (103) hanno infine provato che la presenza del manganese nel terreno è necessaria, ma non in alte dosi, poiché le elevate quantità di manganese trovate nelle foglie (da 38 a 255 mg% nella droga secca) sono da attribuirsi solo alla facile assimilabilità del manganese nella forma solubile, in cui si trova nei terreni acidi, su cui la Digitalis purpurea cresce spontanea. Infatti le piante cresciute in terreni non acidi, in cui il manganese è in forma insolubile, contengono quantità dell'elemento molto inferiori (perfino 10 volte inferiori) rispetto alle piante dei terreni acidi.
La stabilizzazione, l’essiccazione e la conservazione delle foglie della Digitalis purpurea hanno pure grande influenza sul contenuto dei glicosidi cardioattivi e sono state perciò oggetto di lungo studio specialmente per quanto riguarda i numerosi problemi creati dalla complessa composizione chimica della Digitale. Tra i fattori, che maggiormente contribuiscono a rendere difficoltosa la conservazione dell'attività originale della droga, è la facile trasformabilità dei glicosidi, gli uni negli altri, considerata l’elevata differenza d’azione farmacologica esistente tra questi. Già Hamilton nel 1919 (106) aveva dimostrato che le foglie secche della Digitalis purpurea avevano attività meno elevata rispetto alle foglie fresche. Wijngaarden (107) attribuì ad azione enzimatica la causa della minore attività delle foglie secche di Digitale, L'azione idrolizzante degli enzimi è stata poi messa chiaramente in evidenza da Stoll e Kreis (12) i quali hanno rilevato che la digitossina e la gitossina derivano per scissione fermentativa da glicosidi iniziali più ricchi di radicali zuccherini.
Un'altra causa, stabilita recentemente (18), della diminuzione di attività della droga è la facile perdita del radicale formilico in posizione 16 dei glicosidi della serie della gitalossigenina. In tal modo dalla gitalossina molto attiva, si ferma la gitossina, molto meno attiva. Questa degradazione avviene rapidamente in mezzo acido o alcalino e più lentamente in presenza dell'umidità naturale delle foglie; ciò è quindi di grande importanza per la conservazione dell'attività della droga.
Altri processi di trasformazione più o meno noti si possono verificare, come ad esempio per l’azione dei batteri durante la macerazione della droga in acqua.
In letteratura si trovano indicati diversi procedimenti di stabilizzazione e di essiccazione, studiati allo scopo di evitare la degradazione dei glicosidi cardiotonici (108-121).
Allo scopo di chiarire in quali costituenti dei tessuti fogliari siano localizzati i glicosidi, Del Rio Ibanez (122), sottoponendo foglie fresche di Digitalis purpurea e di D. lanata alla pressione frazionata con il metodo di Mascherpa (123), ha rilevato che i glicosidi cardioattivi sono presenti soprattutto nei liquidi intercellulari e tra i componenti citoplasmatici, mentre risultano in quantità minore tra i componenti nucleari e stromali.
Le sostanze cardioattive sembra inoltre si trovino specialmente nelle foglie della parte superiore della pianta, essendo queste risultate più attive di quelle della base (124) (125).
Nella tabella 3 sono indicati i dati analitici dei componenti cardioattivi della Digitalis purpurea, secondo le referenze reperibili in letteratura, referenze frammentarie ed incomplete per le difficoltà che si incontrano nel dosare con sufficiente precisione le singole sostanze.
Nella tabella 4 sono elencati i titoli di digitossina di campioni di Digitalis purpurea di differente origine, secondo i risultati delle analisi di Stoll (135a).
Nelle tabelle 5 e 6 sono riuniti i titoli di tre dei più importanti glicosidi digitalici, la digitossina, la gitalossina e la gitossina, titoli che Haack, Kaiser, Cube e Spingler (18) hanno dedotto dall'esame di campioni di foglie di differente provenienza (tabella 5) e di campioni della frazione «gitalina», estratta da droghe di diversa origine (tabella 6). Nella tabella 6 il confronto dei dati analitici chimici e di quelli biologici dell'ultima colonna (dose letale in mg/kg) dimostra la maggior attività del materiale avente il più elevato contenuto di gitalossina.

0

1

2
Glicosidi non cardioattivi
- Gruppo del digitanolo
I glicosidi non cardioattivi del gruppo del digitanolo hanno come scheletro fondamentale un nucleo sterolico con 21 atomi di carbonio. Gli zuccheri, che sono collegati in C3 al nucleo sterolico, sono metilpentosi (diginosio, digitalosio, oleandrosio, digitossosio).

3
La denominazione glicosidi del digitanolo è stata data ai componenti di questo gruppo da Tschesche e Buschauer (136). Qui di seguito sono riportate le formule, proposte dagli stessi AA., per la diginina, la digifoleina e per la lanafoleina e quella assegnata alla digitalonina da Sato, Wada, Ishii, Oyama e Okumura (137).

4
La diginina. C28H40O7, (diginigenina, C21H28O4, + 1 mol. di D-diginosio) è stata estratta dalle foglie della Digitalis purpurea da Karrer nel 1936 (138) e nel 1955 da Sato, Ishii e Oyama (139). Tschesche e Buschauer (136) ne hanno proposta la formula di struttura XXVII.
La digitalonina, C28H40O8, trovata da Sato, Ishii, Oyama, Wada e Okumura (34) nelle foglie della Digitalis purpurea, è stata successivamente identificata dagli stessi AA. (137) ad un diginigenin-mono-D-digitaloside (formula XXVIII).
Una ossidiginina, la digifoleina, C28H40O8, è stata isolata dalle foglie della Digitalis purpurea e della Digitalis lanata da Tschesche e Grimmer (140). Tschesche e Buschauer (136) ne hanno formulato lo schema strutturale XXIX. L’aglicone digifologenina, C21H28O5, che insieme con 1 mol. di D-diginosio costituisce la digifoleina, differisce dall’aglicone della diginina, diginigenina, per la presenza di un —OH in C2.
La lanafoleina, C28H40O8, (formula XXX), estratta da Tschesche e Buschauer (136) (141) dalle foglie della Digitalis purpurea e della Digitalis lanata, produce per idrolisi l’aglicone, digifologenina, C21H28O5, (142) ed 1 mol. di D-oleandrosio. La digifologenina, che in precedenza era stata denominata lanafologenina (136), è quindi identica all’aglicone della digifoleina.
La digipurpurina, C39H64O14, trovata nella Digitalis purpurea da Tschesche e Grimmer (140), dà per idrolisi acida 3 mol. di D-digitossosio ed una anidrogenina, C21H32O4, che deriva dall’aglicone originale digipurpurogenina, C21H34O5.
La digipronina, C28H40O9 (143) (144), è stata estratta dalle foglie della Digitalis purpurea e della D. lanata da Sato, Ishii, Oyama e Okumura (143) e da Tschesche, Lipp e Grimmer (145), i quali ultimi ne hanno ottenuto per idrolisi l'aglicone, digiprogenina di formula grezza C21H28O5 e digitalosio. Sato (144) dall'idrolisi della digipronina ha ricavato tre genine: a-genina, C21H28O5, b-genina, C21H26O4, e g-genina, C21H28O5.
La purpnina, trovata nelle foglie della Digitalis purpurea e della D. lanata (143) (145), darebbe per idrolisi un aglicone di formula grezza C21H32O4 (143).
La digacetinina, C43H64O16, è stata isolata con processo cromatografico dalle foglie della Digitalis purpurea portoghese da Tschesche, Hammerschmidt e Grimmer (146). La digacetinina è composta dell’aglicone desacetil-digacetigenina, C21H30O5, 3 mol. di D-digitossosio e di 2 mol. di acido acetico. Per scissione idrolitica acida sono stati ottenuti l’aglicone digacetigenina, C28H32O6, 3 mol. di D-digitossosio e 1 mol. di acido acetico. Per trattamento con KHCO3 si stacca un'altra mol. di acido acetico e si ottiene la desacetil-digacetigenina C21H30O5.

5
Dei glicosidi del digitanolo la digipurpurina è in quantità preponderante, costituendo, secondo Grimmer ( 147), il 14% circa dei glicosidi totali, mentre la digifoleina ne costituisce il 3 % e la diginina il 2 % ca. Nelle foglie è stato rilevato un contenuto di mg 5-10% di diginina (138) e di mg 0,1 % di digipronina (145). La digacetinina è stata trovata nella frazione «gitalina» delle foglie della Digitalis purpurea nella quantità del 6-10 % (146).

6
2) Glicosidi saponinici
I glicosidi non cardioattivi con 27 atomi di carbonio sono saponine steroidiche, che si differenziano dalle semplici sterine per la particolare formazione della catena laterale fissata all'anello D. Il nucleo fondamentale è lo spirostano.
A questo gruppo appartengono la digitonina, la gitonina e la tigonina.
La digitonina, C56H92O20. (digitogenina + 2 mol. glucosio + 2 mol. galattosio + 1 mol. xilosio) è stata isolata per la prima volta da Schmiedeberg (5) dalla digitalina commerciale, preparata dai semi della Digitalis purpurea. Più tardi fu ottenuta anche dalle foglie della D. purpurea da Keller ( 148). Manns (149) invece ne ha esclusa la presenza nelle foglie; secondo questo A., le saponine delle foglie si distinguono da quelle dei semi, i quali ultimi soltanto conterrebbero digitonina. Kiliani preparò la digitonina in forma pura (150) e ne studiò i prodotti, derivanti dalla scissione idrolitica, identificandovi l'aglicone digitogenina e gli zuccheri glucosio, galattosio (151) e xilosio (152). La formula grezza della digitogenina, C27H44O5, è stata stabilita da Jacobs e Simpson nel 1935 (153). In seguito alle ricerche condotte specialmente da Windaus e coll. (154)
(155), da Tschesche e Hagedorn (156), da Marker e coll. (157) (158), da Klass, Fieser e Fieser (159), da Djerassi e col!. (160) (161) e da Warren e Canham (162) alla digitogenina è stata attribuita la formula di struttura XXXI.

7
La gitonina, C50H82O23, (gitogenina + 3 mol. galattosio + 1 mol. di un pentosio), estratta dalle foglie della Digitalis purpurea e dalla digitonina grezza da Kraft (163), è stata così denominata da Windaus e Schneckenburger (165). Per scissione idrolitica dalla gitonina sono stati ottenuti l'aglicone gitogenina (165), 3 mol. di un esosio [= galattosio (164)] e 1 mol. di un pentosio (166). Per la gitogenina, identificata da Windaus e Brunken (167) alla «digina», estratta dalle foglie della Digitalis purpurea da Tambach (168), è stata determinata la formula grezza C27H44O4 per opera di Simpson e Jacobs (169). La formula di struttura (XXXII) è stata stabilita in seguito agli studi di Jacobs e Simpson (170), di Tschesche e Hagedorn (171), di Marker e Rohrmann (172), di Djerassi e coll. (173) e di Herran, Rosenkranz e Sondheimer (174).

8
Dalle foglie della D. purpurea, per idrolisi acida di un estratto, Jacobs e Fleck (175) hanno ottenuto la tigogenina, C27H44O3, l'aglicone della saponina tigonina C56H92O27, che doveva essere successivamente isolato dalle foglie della D. lanata da Tschesche (176). La formula grezza della tigogenina, C27H44O3, è stata stabilita da Jacobs e Simpson (169). La formula di struttura, dopo gli studi di Tschesche (176), Jacobs e Simpson (169), Tschesche e Hagedorn (177) e di Marker e coll. (178) (179), è stata fissata secondo lo schema XXXIII.

9
La presenza di una nuova saponina nelle foglie della Digitalis purpurea è stata segnalata da Marquina e Villa (180). I prodotti di idrolisi di questo glicoside saponinico, denominato digonina, sono, secondo gli stessi AA., glucosio, xilosio ed una prosapogenina, la quale a propria volta per idrolisi acida dà origine a zuccheri riducenti e ad una sapogenina. Contrariamente alla digitonina ed alla gitonina, la digonina non forma colesteridi; essa non contiene nè gruppi acidi, nè gruppi lattonici.
Le foglie della Digitalis purpurea, secondo Weiss e Manns (181), contengono l'1% di saponine, producenti tigogenina e gitogenina per microsublimazione. La tigogenina è il principale componente saponinico delle foglie, mentre i semi contengono una rilevante quantità di digitonina. Nei semi sono stati trovati 1,16% di digitonina (182) e lo 0,006% di digitogenina (130).
Altri componenti
Fra gli altri componenti della Digitalis purpurea, gli acidi antirrinico e digitalico, segnalati da Morin (183), sono stati identificati il primo all'acido succinico, il secondo ad una miscela degli acidi isovalerianico, butirrico, propionico, acetico e formico (184). L'esistenza, nelle foglie della Digitale, degli acidi ferulico e caffeico, notata dal Fourton (184), è stata poi confermata dall'Hermann (185), che vi ha trovato inoltre anche piccole quantità di acido p-cumarico. Secondo Fourton (184), è da escludersi la presenza di tannino.

0
Dalle foglie sono stati isolati inoltre anche gli acidi citrico (186) ed isocitrico (187).
L'acido ascorbico, analizzato da Gunther, Heeger e Rosenthal (188) nelle foglie, nel corso della vegetazione della pianta dal giugno all'ottobre, risulta presente in quantità variabili da mg 63 a mg 114% nella droga fresca, da mg 273 % a mg 734 % nella droga secca. Il contenuto è massimo in giugno e diminuisce gradatamente con titolo minimo in ottobre.
Nelle foglie Paris (189) ha trovato la digitoluteina, C16H12O4, che era già stata isolata dalle foglie della D. lutea da Adrian e Trillat (190) e che Janot, Chabasse-Massonneau, De Graeve e Goutarel (191) hanno identificato all' 1-metossi-2-ossi-3-metil-antrachinone o etere metilico della b-metilalizarina:

1
Due pigmenti flavonici sono stati separati dalle foglie: la luteolina e il luteolin-7-glucoside. La luteolina, C15H10O6, isolata con il nome di digitoflavone dalle foglie della D. purpurea da Fleischer (192), è stata poi identificata da Kiliani e Mayer (193) alla luteolina, estratta dalla Reseda luteola L. Il luteolin-7-glucoside, C21H20O11, è stato estratto nella quantità dello 0,3% dalle foglie della D. purpurea e definito chimicamente da Nakamura, Ohta e Hukuti (194).

2
Acetilcolina e colina sono state pure determinate nelle foglie in proporzioni pari allo 0,001 % e 0,1 % rispettivamente (195).
Attivi enzimi (idrolasi) sono stati messi in evidenza, con il nome digipurpidasi, da Stoll e Kreis (12) nelle foglie, nelle quali esplicano azione idrolitica sui glicosidi primari cardioattivi.
Ceneri: 6,6-14,4 % nelle foglie secondo Newcomb e Haynes (196), 7,1-9 % secondo Winkler (197) con elevate quantità di manganese segnalate per la prima volta dal Burmann (198).
Manganese: 0,035-0,254 % nelle foglie di piante cresciute in terreni acidi, ma non superiore a 0,005-0,006 % nei terreni calcarei, secondo Duquénois e Schaerer (105); 0,049-0,055 % (nelle foglie secche), secondo Knutsen (199), 0,0834-0,366 % (nelle foglie secche), secondo Freund (200).
Proprietà farmacologiche ed impiego terapeutico
Dopo che il Wittehering (201) nel 1875 riconobbe nella Digitale un medicamento diuretico e cardiotonico, l'azione farmacologica e terapeutica di questa importantissima droga venne studiata in tutti i suoi particolari, tanto che oggi esiste sull'argomento una letteratura così vasta da giustificarne la raccolta in un volume dedicato esclusivamente alla Digitale.
E’ quindi da escludere che essa possa essere anche parzialmente riassunta nel capitolo di un'opera che, come abbiamo premesso e spesso ripetuto, si propone soltanto il modesto compito di completare (e non di sostituire), in quella parte che riguarda lo studio delle piante medicinali, i trattati italiani e stranieri di cui oggi la letteratura farmacologica dispone. Nella maggior parte di questi, la farmacologia e la terapia della Digitale vi si trovano così diffusamente e magistralmente trattate che a noi non resta che farne un breve cenno e di aggiungere quanto è stato più recentemente acquisito intorno all'intimo meccanismo d'azione dei suoi principi attivi.
Ricorderemo intanto che l'azione dei glicosidi digitalici viene oggi interpretata secondo un concetto unitario, come dovuta cioè alla loro azione fondamentale che consiste nell'aumentare l'energia della contrazione cardiaca. Da essa deriverebbe e sarebbe condizionato il manifestarsi di tutti gli altri effetti caratteristici alla loro azione: l'aumento della gettata cardiaca, la diminuzione della dilatazione diastolica, l'abbassamento della pressione venosa, la diminuzione del numero delle pulsazioni, specialmente evidente questa, in determinate condizioni e l'aumento della diuresi, non sarebbero infatti, secondo questo concento, che la diretta conseguenza della aumentata forza di contrazione sistolica.
L'intimo meccanismo di questa azione che si manifesta con particolare evidenza e benefìci effetti terapeutici, specialmente nelle insufficienze cardiache di tipo congestizio, è stato profondamente indagato nei suoi vari aspetti da moltissimi ricercatori, ma non si può ancora dire che le conclusioni che si possono trarre dai risultati sino ad ora conseguiti, siano definitive. Trattasi per lo più di teorie che, pur offrendo una soddisfacente interpretazione biochimica della maggior parte dei fenomeni connessi con l'azione digitalica, attendono tuttavia di essere confermate dall'apporto di ulteriori dati sperimentali e clinici.
Noi cercheremo di riassumere il più brevemente e il più chiaramente che ci sarà possibile, quanto oggi è noto sul come i principi attivi digitalici possano interferire sui meccanismi fisiologici che condizionano l’attività cardiaca e sulla loro attitudine a modificarne le eventuali alterazioni patologiche.
Allorché un muscolo è stimolato alla contrazione, avvengono alcuni fenomeni che possono essere teoricamente così schematizzati: allungamento e accorciamento della proteina contrattile e idrolisi e reisintesi dell'acido adenosintrifosforico (ATP). Dalla trasformazione dell'ATP in ADP (acido adenosindifosforico) per opera della ATPasi, si libererebbe l'energia chimica (calcolata in 11000 calorie) necessaria al muscolo per compiere il suo lavoro, la cui entità è in relazione ad un insieme di fattori atti a condizionare la capacità della proteina contrattile ad utilizzare l'energia disponibile.
Il Wollenberger (202) definisce come energia di liberazione quella che viene liberata dal ciclo dell'ATP e come energia di utilizzazione quella che viene trasferita alla proteina contrattile e da essa camunque utilizzata. Una maggiore o minore capacità da parte della proteina contrattile di trasformare l'energia di liberazione in energia di utilizzazione, si rifletterà dunque sulla produzione di lavoro utile, e quindi sull'efficienza meccanica del muscolo.
Secondo alcuni AA. [Fleckenstein e coll. (203-207), Mommaerts (208, 209)] non è certissimo o comunque non ancora definitivamente provato, che l’ATP o il CP (fosfato di creatina) rappresentino le immediate fonti di energia per il muscolo cardiaco, ma secondo Hajdu e Léonard (210), che citano i suddetti AA. «sembrerebbe abbastanza sicuro che qualche elevata energia collegata al fosfato, sia l'immediata fonte di energia per il ciclo di contrazione».
Secondo lo schema suesposto quindi, la causa dell'insufficienza miocardica, la causa cioè della diminuzione dell'efficienza meccanica del miocardio, potrebbe essere ricercata o in un difetto nel ciclo dell’ATP, con conseguente diminuzione di energia di liberazione o in una diminuita attitudine da parte della fibra miocardica a trasformare l'energia di liberazione in energia di utilizzazione.
Sull'eventualità che si verifichi l'una piuttosto che l'altra causa, fu molto discusso, ma dai risultati di numerose ricerche eseguite sia in vitro che in vivo da diversi Autori, sembra che si possa concludere che questa causa debba essere ricercata a livello dell'energia di utilizzazione [Bing e coll. (211), Wollenberger (212)] ed è a questo livello, più che a quello della energia di liberazione, che si manifesterebbe appunto l'azione dei glucosidi digitatici. La quale azione, in definitiva, consisterebbe nel determinare un aumento della capacità da parte della proteina contrattile di convertire l’energia chimica disponibile, in lavoro meccanico.
Sul meccanismo secondo il quale i glicosidi digitalici esplicherebbero quest'azione, sono state formulate due ipotesi: 1a che i suddetti glicosidi agiscano interferendo sull'equilibrio jonico intracellulare: 2a che essi agiscano direttamente sulla proteina del muscolo. Mentre non sembra poter essere ancora precisata la possibilità che si verifichi la seconda ipotesi, appare ampiamente provato il fatto che i glicosidi digitalici, nelle concentrazioni terapeutiche o tossiche, determinino una perdita di potassio da parte del muscolo cardiaco e i già citati Hajdu e Leonard (210), autori di una completa monografia su «The cellular basis of cardiac glycoside action» (alla quale rimandiamo il lettore che desiderasse documentarsi più ampiamente sull'argomento), ritengono che questa perdita di potassio possa essere ragionevolmente collegata con un aumento della contrattilità, dal momento che effetti inotropi positivi, possono essere indotti da una diminuzione del potassio intracellulare comunque ottenuta.
Di analoga azione sarebbe dotato il sodio, il che fa ritenere agli AA. che la contrattilità della proteina muscolare venga condizionata dalla somma dei due cationi monovalenti in rapporto alla quantità della proteina stessa.
Data la grande importanza del calcio-jone sulla contrattilità normale del miocardio, l'effetto dei glicosidi digitalici su questo jone bivalente è stato molto indagato, ma dai risultati sino ad ora raggiunti, non sembra sia possibile dedurre resistenza di un rapporto diretto fra l'azione cardiotonica dei suddetti glicosidi e il calcio-jone.
Così schematizzato il meccanismo d'azione dei glicosidi digitalici, cercheremo ora di riassumere brevemente le modificazioni funzionali che essi inducono sul cuore insufficiente e gli effetti terapeutici che ne derivano.
Abbiamo già detto che l'azione farmacologica fondamentale dei glicosidi digitalici consiste in un aumento dell'energia di contrazione sistolica, specialmente in fase di scompenso congestizio. Ciò conduce ad un più rapido e completo vuotamento durante la sistole, ad un miglior riempimento e ad una riduzione del volume diastolico, ad una diminuzione della pressione venosa, ad un aumento dell'efficienza meccanica del miocardio, il che permette al cuore di compiere il suo lavoro con un minor consumo di ossigeno e, infine, ad un aumento della secrezione urinaria.
Il rallentamento delle pulsazioni cardiache, che si manifesta in maniera pressocchè insignificante nel cuore normale e anche nel cuore in scompenso ma con ritmo normale, è invece molto evidente allorché lo scompenso è associato a tachicardia e particolarmente nella fibrillazione atriale.
Un tempo si attribuiva alla bradicardia indotta dai glicosidi digitalici, un valore terapeutico determinante e veniva considerata come la loro più importante attività. Ma se è vero che un'azione cronotropa negativa in fase tachicardica, può contribuire a migliorare l'attività cardiaca, è anche vero che il miglioramento di uno stato di scompenso può avvenire anche prima che si manifesti l'azione bradicardizzante o indipendentemente da essa.
Il rallentamento del ritmo cardiaco prodotto dalla Digitale deriverebbe da un complesso ed ancora non completamente noto meccanismo, determinato da un'azione vagale e da un'azione extravagale. L'azione vagale, secondo Heymans e coll. (213) non sembrerebbe essere dovuta ad una eccitazione diretta dei centri vagali ma piuttosto ad una eccitazione indotta dai, glicosidi digitalici a livello delle zone vasosensibili cardioaortiche e seno-carotidee, eccitazione questa, capace di determinare un riflesso vagale e un conseguente effetto cronotropo negativo.
L'attività extravagale si manifesta invece a livello del sistema di conduzione atrio-ventricolare ed è dovuta ad un'azione diretta dei glicosidi digitalici sul fascio di His di cui viene aumentato il periodo di refrattarietà e diminuita la velocità di conduzione. Ne risulta anche in questo caso, un effetto cronotropo negativo che si riflette sull'ECG con aumento dell'intervallo PR, effetto che per dosi tossiche di Digitale, può tradursi in un blocco cardiaco parziale o in una completa dissociazione atrio-ventricolare. Dosi terapeutiche invece, pur non influenzando sensibilmente la frequenza di un cuore che pulsa con ritmo normale del seno, possono agire efficacemente sulla fibrillazione auricolare e sui disturbi del ritmo e della frequenza che ne conseguono. In questi casi, in cui un maggior numero di impulsi atriali raggiungono il ventricolo, la Digitale agendo sul sistema di conduzione nella maniera anzidetta, ostacola il passaggio degli impulsi dall'atrio al ventricolo e può ricondurre ad un livello normale il ritmo e la frequenza delle pulsazioni ventricolari.
L'azione diuretica rappresenta una delle più appariscenti attività dei glicosidi digitalici ed è quella che più colpì l'attenzione del Wittehering durante i suoi primi studi sulla Digitale.
Trattasi di un'azione indiretta che non si manifesta allorchè la diuresi è normale o nelle oligurie che non siano correlate con uno stato d'insufficienza cardiocircolatoria. I glicosidi digitalici non agiscono dunque a livello degli elementi secernenti renali ma aumentano notevolmente la secrezione urinaria nei casi in cui la sua diminuzione è dovuta ad alterate condizioni circolatorie locali e generali. In questi casi la Digitale normalizzando l'attività cardiaca, determina la riduzione delle stasi periferiche, riconduce alla norma la pressione arteriosa e diminuisce quella venosa, aumenta la velocità di circolo e migliora le condizioni di irrorazione renale, tutti fattori questi che insieme con l'aumento dello stato idremico che viene a determinarsi per il riassorbimento degli edemi, contribuiscono a ristabilire la diminuita funzionalità renale.
Sotto l'azione della Digitale la quantità delle urine può aumentare nelle 24 h. fino a 10-15 volte e la loro composizione subisce alcune modificazioni caratterizzate da una diminuzione del peso specifico, da un aumento della concentrazione degli elettroliti e da una diminuzione dell'albumina.
Assorbimento ed eliminazione – L’assorbimento dei preparati digitalici somministrati per os, avviene per la maggior parte nell’intestino e in particolare nell’ultimo tratto del colon, con velocità che varia per i diversi preparati: la tintura è assorbita più rapidamente dell’infuso e anche più rapidamente e più completamente è assorbito l’estratto cloroformico. Piccole quantità di glicosidi vengono distrutte dal succo gastrico ed anche nell’intestino crasso.
Si considera che l’assorbimento intestinale avvenga nello spazio di 24 h circa e in quantità diversa per i diversi preparati e glicosidi (il 20 % per la polvere e per la tintura, il 100 % per la digitossina).
Più incostante è l’assorbimento per le vie sottocutanea e intramuscolare, vie di somministrazione queste che sono sconsigliabili del resto per tutti i glicosidi cardioattivi, anche per l’azione irritante di cui essi sono più o meno dotati e per la facilità con cui possono dar luogo ad ascessi.
Contrariamente a quanto si riteneva, non sembra che al miocardio si possa attribuire un potere di fissazione dei glicosidi digitalici, superiore a quello di altri tessuti. Ricerche eseguite con digitossina marcata con C14, hanno però dimostrato che il cuore umano può trattenere in misura superiore agli altri tessuti, i prodotti idrosolubili di degradazione (i metaboliti cioè) della digitossina, la cui attività farmacologica, per quanto ancora non nota, non può essere esclusa.
Come la velocità di assorbimento, anche la velocità di eliminazione dei glicosidi digitalici è diversa. L’eliminazione è lenta per i glicosidi della Digitale, più rapida per quelli dello strofanto e intermedia fra questi estremi, quella dei glicosidi delle altre droghe digitaliche.
L’azione cumulativa cui danno luogo quelli contenuti nella Digitale, è dovuta appunto al fatto che essi vengono eliminati, o metabolizzati, molto più lentamente di quanto non vengano assorbiti.
La maggior parte della quantità eliminata dopo una singola dose di Digitale, compare nelle urine dopo 24-48 h. ma l’eliminazione di piccole quantità continua ancora per alcune settimane [Goodman e Gilman (214)].
La rapidità di assorbimento dei glicosidi digitalici è proporzionale alla dose somministrata. Dosi elevate vengono assorbite più rapidamente ed anche il loro effetto è relativamente più pronto.
L’azione della Digitale, specialmente se somministrata per os, a piccole dosi, si manifesta dopo un certo periodo di latenza. Il suo pieno effetto terapeutico cardiocircolatorio compare di solito 24-36 h dopo la somministrazione, mentre sulla diuresi può manifestarsi anche alla distanza di 72 h. Il periodo di latenza è abbreviato con l’impiego delle dosi più elevate. In questo caso l'azione piena può comparire dopo 6-10 h.
Per quanto riguarda la persistenza dell’azione, si considera che l’effetto di una dose piena di Digitale o di digitossina, può persistere per 1-3 settimane, secondo la dose somministrata.
Principali indicazioni e controindicazioni
Come già fu detto, la terapia digitalica dà i suoi risultati migliori nella insufficienza congestizia e specialmente nei casi in cui coesiste fibrillazione atriale. Ottimi risultati si ottengono anche nel flutter auricolare, nello scompenso con ritmo sinusale normale e nello scompenso cardiaco da ipertensione o da arteriosclerosi. Allorché la causa dello scompenso è secondaria, in quanto conseguente ad altri stati patologici, la risposta alla Digitale è trascurabile o può mancare del tutto (miocardite reumatica, shock, disturbi da compressione come nei versamenti pericardici, nelle aderenze, ecc.).
La terapia digitalica è inefficace o addirittura controindicata, allorché la causa dello scompenso non risiede nel miocardio ma é secondaria a fatti miocarditici di origine infettiva o tossica (difterite o altre malattie infettive, tireotossicosi, ecc.). E' inoltre controindicata nella tachicardia ventricolare e allorché esistano fatti degenerativi miocardici. Ugualmente controindicata é nella trombosi coronarica e nell'angina pectoris, quando non siano associate ad uno stato di scompenso e così pure nei casi di polmonite in cui la sintomatologia cardiorespiratoria é sostenuta da uno stato di tossiemia generale e da ipossiemia e non dall'eventuale esistenza di uno scompenso congestizio in atto. In questi casi la Digitale può aumentare la percentuale della mortalità (214).
Tossicologia – L'intossicazione da Digitale consegue di solito, al suo impiego secondo un dosaggio irrazionale. Essa è in rapporto alle caratteristiche di assorbimento e di eliminazione, per le quali può determinarsi l'accumulo nell'organismo dei suoi principi attivi in una concentrazione superiore a quella considerata terapeutica. Allorché ciò si verifica, ne conseguono disturbi gastroenterici, cardiaci, visivi, nervosi ed anche cutanei, con la comparsa di esantemi.
I disturbi gastro-enterici si manifestano con anoressia, nausea, vomito e diarrea. Quando la nausea e il vomito non sono dovuti ad un effetto locale sulla mucosa gastrica, effetto che in soggetti particolarmente sensibili può seguire anche alla somministrazione di una singola dose e quindi indipendentemente da ogni azione di accumulo, essi si manifesta
Gli effetti cardiaci si riflettono soprattutto sulla frequenza e sul ritmo: diminuzione della frequenza al di sotto delle 60 pulsazioni al minuto, comparsa di frequenti extrasistoli ectopiche, tendenza al blocco parziale del cuore, aritmia fasica o bigeminismo che si manifestano col succedersi di extrasistoli dopo ciascuna contrazione normale. Sull'ECG si può notare un aumento dell’intervallo PR, slivellamento rettilineo del tratto ST ed inversione della T.
Gli effetti nervosi si manifestano con cefalgia, astenia, sonnolenza e malessere generale. Nei casi gravi, delirio, stato confusionale, afasia, allucinazioni e, più raramente, fatti convulsivi.
I disturbi visivi si manifestano con imperfetta nitidezza di visione degli oggetti che appaiono circondati da aloni o da bordi bianchi: con ambliopia, diplopia, cromatopsie varie e specialmente xantopsia, fenomeni questi che si ritiene siano dovuti ad una parziale e temporanea cecità corticale (214).
Meno frequente é la comparsa di eruzioni cutanee orticario o scarlattinosimili, le quali sono di solito sensibili all’azione degli antistaminici.
Allorché la suddetta sintomatologia é dovuta ad iperdosaggio e quindi allo stabilirsi di un'azione cumulativa, la si può facilmente dominare e determinarne la remissione in un periodo più o meno lungo, sospendendo per qualche giorno la somministrazione del preparato digitalico che l'ha provocata, oppure riducendo opportunamente la dose di mantenimento che, a seconda dei casi, potrà essere somministrata anche in maniera discontinua.
Vie di somministrazione, preparati e dosi
Per i preparati digitalici e per i glicosidi puri la via di somministrazione più opportuna, ove sia possibile, è la via orale. L'assorbimento nell'intestino può essere completo dopo 2 h e i primi effetti possono manifestarsi dopo 6 h, mentre l'effetto pieno, per dosi sufficienti, si ottiene di solito dopo 10 h. Ove non sia possibile la somministrazione orale (coma, vomito ed altre cause), si può ricorrere alla somministrazione parenterale.
La via intramuscolare, per quanto presenti non pochi inconvenienti e in primo luogo quello dovuto all'effetto irritante locale, oggi è piuttosto largamente praticata specialmente, come vedremo, per gli strofantinici, ma anche i glicosidi della Digitale e i suoi preparati totali, opportunamente purificati, per quanto meno impiegati di quelli dello Strofanto per questa via, trovano anch'essi non poche indicazioni. In particolari casi d'urgenza si può ricorrere anche alla via endovenosa; occorre tener presente però che questa via di somministrazione non è scevra di pericoli e che l'iniezione può riuscire rapidamente mortale ove la dose non sia stata attentamente stabilita caso per caso e iniettata con le dovute precauzioni e con la dovuta diluizione e lentezza.
La via rettale attualmente impiegata per la somministrazione dei più diversi farmaci, appare particolarmente adatta anche per la somministrazione dei preparati digitalici, permettendo essa di evitare gli inconvenienti relativi alla somministrazione orale e parenterale di cui si è detto. D'altro lato la via rettale, sommando le caratteristiche delle vie orale e parenterale, per quanto riguarda le modalità e la rapidità con cui avviene l'assorbimento, potrebbe essere, in un certo senso, definita come una via entero-parenterale. Come sede anatomica infatti e per quella parte delle sostanze introdotte nel retto, che viene assorbita attraverso la emorroidaria superiore e che passando nella mesenterica inferiore, raggiunge il circolo portale e quindi la cava inferiore dopo aver attraversato il fegato, questa via di somministrazione deve essere considerata enterale. Ma per quella parte che viene assorbita attraverso le emorroidarie media e inferiore, tributarie della cava inferiore (tramite, rispettivamente, l'ipogastrica e le pudende interne) e giunge al cuore evitando il circolo portale e il fegato, l'assorbimento avviene come se la sostanza fosse somministrata per via parenterale. L'assorbimento rettale sarebbe dunque, almeno per una parte delle sostanze introdotte nel retto, molto più rapido che per via orale: il Sauter (215) trovò infatti che l'assorbimento del calcio per via rettale è altrettanto rapido che per via intramuscolare o allorché venga iniettato lentamente endovena.
Per quanto riguarda la Digitale e i suoi glicosidi, la dose per via rettale, le modalità di somministrazione e il periodo di latenza corrispondono a quelli noti per la somministrazione orale.
A proposito dei preparati digitalici diremo, in generale, che sono da preferirsi quelli stabilizzati (se si tratta di preparati totali) e titolati biologicamente. I preparati in compresse con rivestimento gastroresistente, offrono il vantaggio di evitare i fenomeni di nausea e di vomito conseguenti alla congestione venosa della mucosa gastrica non raramnete determinata dall’azione locale dei preparati digitalici, siano essi preparati totali o glicosidi puri. Altro loro notevole vantaggio è quello che manifestandosi sintomi di nausea e di vomito, essi possono essere in questo caso attribuiti con certezza ad ipersdosaggio e non ad azione locale. Distinzione questa particolarmente necessaria allorché la terapia digitalica non venga praticata sotto la diretta sorveglianza medica, ma ambulatoriamente o a domicilio. In questi casi il paziente stesso, opportunamente avvertito, può sospendere spontaneamente la somministrazione o ridurre il dosaggio, alla prima comparsa della suddetta sintomatologia.
La posologia ha nella terapia digitalica una grande importanza e ciò sia per quanto riguarda la possibilità di ottenere l'optimum dell’azione terapeutica, sia per evitare l'insorgere di eventuali fenomeni di intossicazione acuta o da accumulo.
E’ noto che l'optimum dell'azione terapeutica lo si ottiene dopo che al paziente é stata somministrata la massima dose tollerata, dopo cioè che é stato raggiunto il livello di saturazione digitalica. La dose massima che con sicurezza può essere somministrata all’uomo nelle 24 h, è stata calcolata in una U.I. per ogni 5 kg di peso corporeo, per cui ad un uomo del peso di 70 kg possono essere somministrate 14 U.I.. Nel caso che il peso non sia noto con esattezza, si consiglia di attenersi ad una dose che corrisponda ai ¾ circa della dose massima e che può essere praticamente considerata del valore medio, per l'adulto, di 10-12 U.I. divise in 4 dosi da somministrarsi ogni 6 ore.
Questo metodo che prevede la somministrazione della dose iniziale di saturazione in 24 h, viene seguito in generale, nei casi più gravi di scompenso, cardiaco, con lo scopo di ottenere un risultato terapeutico entro il più breve tempo consentito dalla somministrazione orale. Allorché non esistano particolari condizioni di gravità che consiglino di seguire questo metodo cosiddetto «rapido», la digitalizzazione iniziale viene di solito praticata seguendo il metodo normale che prevede il raggiungimento della saturazione somministrando la suddetta dose in 2-4 giorni.
Raggiunta questa dose di saturazione, si può sospendere per un giorno la somministrazione e riprenderla con una dose giornaliera variabile da ½ a 2 U.I. come dose di mantenimento e che, tenendo conto delle inevitabili variazioni individuali, corrisponde alla quantità che viene giornalmente eliminata o metabolizzata dall'organismo.
Il dosaggio basato sul titolo biologico offre quindi indiscutibili vantaggi di fronte a quello ponderale, purché il medico possa disporre di preparati digitalici ben titolati in U.I., costanti nell'azione e sicuri nell'effetto. Il loro uso offre la possibilità di raggiungere con maggior sicurezza il massimo effetto terapeutico e più facilmente permette di evitare quei fenomeni di intossicazione e di accumulo cui spesso dà luogo l'impiego di preparati mal titolati o addirittura a titolo ignoto.
Estratti e preparati vari
a) Estratto fluido F U. (Titolo chimico 0,2% digitossina) (g 1 = LII gtt).
Dosi: g 0,2-1 pro die.
b) Tintura F.U. (Titolo chimico 0,02% digitossina).
Dosi: g 2-10 pro die.
c) Tintura a titolo costante (Titolo biologico 6 u.e.p. in un g).
Dosi: g 1-5 pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido digitale purpurea F.U. g 10
Alcool di 70°………………………. g 90
(g 2-10 pro die)
Sciroppo
Tintura digitale F.U. g 5
Sciroppo semplice F.U. g 95
(g 10-20 pro die)
Mistura diuretica di Halle
Tintura digitale F.U. g 18
Vino di colchico g 6
Potassio joduro……….. g 10
Sciroppo salsapariglia composto g 50
Acqua distillata ….. g 75
(a cucchiaini nelle cardio- e nefropatie)
Ossimiele diuretico di Gluber
Tintura digitale F.U.
Estratto fluido segale cornuta ana g 20
Acido gallico g 10
Potassio bromuro g 30
Acqua di lauroceraso g 5
Sciroppo lampone g 400
Ossimiele scillitico g 520
(a cucchiaini, come sopra)
Vino cardiotonico diuretico
Estratto fluido digitale g 5
Estratto fluido scilla
Estratto fluido ginepro g 8
Alcool di 60° g 100
Sciroppo semplice F.U. g 100
Vino Marsala g 800
(a bicchierini)
BIBLIOGRAFIA
(1) HOMOLLE, >. de Pharm.. 7, S7, 184S – (2) HOMOLLE e QUEVENNE, Mém. sur la Digitaline, 1854 – (3) WALZ, ìahrb. Pharm., 9, 302, 18S8; IO, 319, 1858 – (4) NATIVELLE C., J. Pharm. Chlm., 9, 245, 1869; 16, 430, 1872; 20, 81, 1874 – (5) SCHMIEDEBERG, Arch. exp. Paih. n. Pharmakoì., 3, 16, 74, 1875; 16, 162, 1883 – (6) KILIANI H„ Arch. Pharm., 234, 277, 1896 – (7) CLOETrA, Arch. exp. Palh. u. Pharmakoì., 41, 421, 1898; 45, 435, 1901 – (8) WINDAUS A. e WEIL, Z. Phyaol. Chem., I2I, 62. 1922; WINDAUS A. STEIN, Ber., 61. 2436, 1928; WINDAUS e SCHWARTE, Ber.. SS, 1515, 1925; WINDAUS. WESTPHAL e STEIN, Ber., 61, 1847, 1928; WINDAUS, Arch. exp. Palh. u. Pharmakoì., 135, 256, 1928; WINDAUS e HAACK, Ber., 62, 475, 1929 – (9) KILIANI H„ Arch. Pharm., 252, 13, 1914; Ber., 48, 334, 1915 – (10) KRAFF, Arch. Pharm., 250, 125, 1912 – (11) KILIANI H„ Arch. Pharm., 230, 250, 1892; 233, 299, 1895 – (12) STOLL A. e KREIS W., Helv. Chlm. Acla, 16, 1049, 1933; IS, 120, 1935 – (13) TAMURA K., ISHIDATE M., KOBAYASHI Y. e TOKITA K„ Proc. Imp. Acad., 20, 680, 1944; Chem. Ahi., 48, 4771, 1954 – (14) ISHIDA- TE M„ OKADA M. e SASAKAWA Y'., Pharm. Bull., I, 186, 1953 – (15) ISHIDATE M„ Pharmazie, 9, 589, 1954 – (16) ULRIX F„ 1. Pharm. Bel/., 3, 2, 1948; Thise Dod. Pharm., LItge, 1946 – (17) HAACK E., KAISER F., GUBE M. e SPINGLER H., NaIurwIss., 42, 441, 1955; Chem. Abs., 51, 3636h, 1957 – (18) HAACK E., KAISER F, e SPINGLER H„ Arznelm.-Forsh., 6, 176, 1956 – (19) HAACK E., KAISER F. e SPINGLER H., Ber., 89, 1353, 195$; Chem. Abs., 51, 5781Ì, 1957 – (20) HAACK E., KAISER F., GUBE M. e SPINGLER H., NaIurwIss., 43, 301, 1956 – (21) ISHIDATE M. e OKADA M„ Pharm. Bull., 1, 304, 1953; Chem. Abs., 49, 4945, 1955 – (22) ISHIDATE M„ Pharmazie, 9, 589, 1954 – (23) OKADA M„ 1. Pharm. Soc. Japan, 73, 1118, 1953; Chem. Abs., 48, 12145, 1954- (24) TSCHESCHE R, GRIMMER G. e NEUWALD F.. Ber., SS, 1103, 1952-(25) SATO D., YOSHIDA K.. ISHII H. e NISHIMURA Y.. Pharm. Bull., I, 305, 1953 – (26) REICHSTEIN T. e VON EUW J.. Helv. Chlm. Acla, 33, 666, 1950 – (27) RITTEL W„ HUNGER A. e REICHSTEIN T„ Helv. Chlm. Acla, 35, 434, 1952 – (28) SCHINDLER O. e REICHSTEIN T„ Helv. Chlm. Acla, 35, 442, 1952 – (29) STOLL A.. KREIS W, e VON WARTBURG. Helv. Chlm. Acla, 37, 1134, 1954 – (30) ISHIDATE M„ OKADA M. e SASAKAWA Y„ Pharm. Bull., I, 186, 1953; Chem. Abs., 48, 7851 b, 1954 – (31) SATO D., ISHII H. e OYAMA Y„ J. Pharm. Soc. Japan, 75, 1173, 1955; Chem. Abs., 50, 2922 d, 1956 – (32) HAACK E., KAISER F. e SPINGLER H., NaIurwIss., 42, 442, 1955; CAem. Abs., 51, 3636e, 1957 – (33) SATO D„ ISHII H., OYAMA Y., WADA T. e OKUMURA T„ J. Pharm. Soc. Japan, 75, 1573, 1955; Chem. Abs., 50, 10750 e, 1956 – (34) SATO D„ ISHII H„ OYAMA Y„ WADA T. e OKUMURA T„ Pharm. Bull., .4, 284, 1956; Chem. Abs., 51, 7650d, 1957 (35) SATO D„ WADA T. e OKUMURA T„ J. Pharm. Soc. Japan, 76, 1334, 1956; Chem. Abs., 51, 3089 d, 1957 – (36) SATO D„ WADA T„ ISHII H„ OYAMA Y. e OKUMURA T„ Pharm. Bull. Japan, 5, 253, 1957 – (37) KAISER F,; HAACK R e SPINGLER H., Ueb. Ann., 603, 75, 1957 – (38) MURPHY 3. E.. J.A.Ph.A„ Sci. ed„ 46, l70, :. 1957 – (39) MIYATAKEK., OKANO A.. HOII K. e MIKI T„ Pharm. Bull., 5, 163, 1957; Chem. Abs.,.St,ù 18471 h, 1957 – (40) OKANO A., Chem. Pharm. Bull., 6, 178, 1958 – (41) HAACK E., KAISER F.,!: SPINGLER H. e GUBE M., NalurwUs., 43, 301, 1956; Ber., 91, 1758, 1958; Chem. Abs,, 53, 1160c, 1959;':; (42) 3ENSEN K. B., Acla Pharmacol. Toxicol., 12, 11. 1956 – (43) SASAKAWA Y.. J. Pharm. Soc.
75, 946, 1955; Chem. Abs., 50, 533, 1956 – (44) STOLL A. e KREIS W„ Helv. Chlm. Acla, IS, .120, 1935|:{<:i (45) OKANO A.. Pharm. Bull., 5, 272, 1957; Chem. Abs., 52, 4926g, 1958 • (46) CLOETTA M;,’ AreA;!i ' exp, Palh. u. Pharmakoì., 112, 261, 1926 – (47) WINDAUS A. e SCHWARTE G.,Ber.,5S, 15I5el5I9, f925f,v (48) WINDAUS A„ WESTPHAL K. e STEIN G.. Ber., 61, 1847, 1928 – (49) KILIANI H„ Arch. Pharmur 230, 250, 1892; 237. 446, 1899; 252, 26, 1914 – (50) WINDAUS A., BOHNE A. e SCHWIEGER Jx., Ber„ 57, 1388, 1924 – (51) ISHIDATE M„ OKADA M. e SASAKAWA Y„ Pharm. Bull., I, 186, 1953; Chem,
Abs., 48, 7851 b, 1954 – (52) SATO D„ YOSHIDA K., ISHII H. e NISHI Y„ Pharm. Bull.. I, 396, 1953;
Chem. Abs., 49, 11962 i, 1955 – (53) MIYATAKE K., OKANO A., H03I A. e MIKI T„ Pharm. Bull., 5, 157, 1957; Chem. Abs., 51, 18471 d, 1957 – (54) WICHTL M.. NaIurwIss., 43, 158, 1956 – (55) HAACIK R, KAISER F. e SPINGLER H., Naiu, Iss., 43, 130, 1956 – (56) HASENFRATZ V., Compì, rend.. 192, 366, 1931 – (57) WINDAUS A., Arch. exp. Palh. u. Pharmakoì., 135, 253, 1928 – (58) KILIANI, Arch. Pharm., 233, 299, 311 e 698, 1895; 234, 277, 1896 – (59) WINDAUS A. e FREESE C„ Ber., SS, 2503, 1925 –
(60) WINDAUS A., Chem. Zbl., I, 2912, 1927 – (61) JACOBS W. A. e GUSTUS E. L., J. Blol. Chem.,
78. 573, 1928 – (62) WINDAUS A. e STEIN G., Ber., 61, 2436, 1928 – (63) TSCHESCHE R„ Z. physiol. Chem., 229, 219, 1934 – (64) JACOBS W. A. e ELDERFELD R. C„ Science, 80, 533, 1934; J. Blol. Chem., 108, 497, 1935 – (65) HUNZIKER e REICHSTEIN T„ Helv. Chlm. Acla, 28, 1472, 1945 – (66) MEYER K„ Helv. Chlm. Acla, 30, 1976, 1947 – (67) RITTEL W., HUNGER A. e'REICHSTEIN T.. Helv. Chini. Acla, 36, 434, 1953 – (68) AEBl A. e REICHSTEIN T, Helv. Chlm. Acla, 34. 1277, 1951 • (69) ROSSELEr J. P. e REICHSTEIN T„ Helv. Chlm. Acla, 36, 787, 1953 – (70) MOHR K„ SCHINDLER O. e REICHSTEIN T„ Helv. Chlm. Acla, 37. 462, 1954 – (71) LICHTI H., TAMM C. e REICHSTEIN T„ Helv. Chlm. Acla, 39, 1933, 1956 – (72) KRAFT E, Arch. Pharm., 250, 118, 1912 – (73) JACOBS W. A. e GUSTUS E. L., Science, 70, 639, 1929; Chem. Zbl., I, 2102, 1930 – (74) JACOBS W. A. e ELDERFELD R. C.,
3. Blol. Chem., 92. 313, 1931; 99, 693, 1933; 100, 671, 1933 – (75) MOORE J. A., Helv. Chlm. Acla, 37, 659, 1954 – (76) CARDWELL H. M. E. e SMITH S., 3. Chem. Soc., 2012, 1954 – (77) WINDAUS A. e HAACK E., Ber., 62, 475,1929 – (78) RITTEL W., HUNGER A. e REICHSTEIN T., Helv. Chlm. Acla, 35, 434, 1952; SCHINDLER O. e REICHSTEIN T., Helv. Chim. Mela, 35, 442, 673, 1952 . (79) TSCHESCHE R. e GRIMMER Q„ Ber.. 88, 1569, 1955; Chem. Abs., 50, 11358 f, 1956 – (80) TSCHESCHE R., QRIM- MER Q. e NEUWALD F., Ber., 85, 1103, 1952 – (81) TATTJE D. H, E„ Diss. Qroningen, 1952 – (82) NEUWALD F., Arch. Pharm. Beri, 285, 22. 1952 – (83) TATTJE D. H. E.. Pharm. Weekbl. 91, 541, 1956; Chem. Abs.. 50. 15758c, 1956 – (84) TAITJE D. H. E., Pharm. tVeekbl., 91. 778, 1956 – (85) KELPSAITE L.. Trudy Kalmass.':. Med. Inst., 4, 215, 1957; Chem. Abs., 52, 12322 i, 1958 – (86) lAMA- MOTO S., Ann. Repts SMonoz! Res. Lab., n. 4. 90. 1954; Chem. Abs., 50, 160371, 1956 – (87) BURMANN, Schwelz., Ap. Zti.', 52, 527, 1914 – (88) TSAO D.P.N. e YOUNGKEN H. W,, l.A.Ph.A., 41, 19, 1952 – (89) WASICKY R„ Pharm. Monatsh., 1. 169, 1920 – (90) ROWSON J.. Chem. a. Drugg., 163, 505, 1955 – (91) ONICEV P. J„ Pharmazia, 2, 28, 1947 – (92) MADAUS G. e SCHINDLER H„ Arch. Pharm., 276, 280, 1938 – (92a) DAFERT, Angew. Boi., 3, 23. 1921 – (92 b) DARE J. G. e NELSON G. A., J. Pharm. Pharmacol., 4. 619, 1952 – (92 c) HEGNAUER R„ Pharm. IVeekbl., 88, 69, 1953 – (92 d) TATTJE D. H. E„ Pharm. tyeekbl., 92, 734, 1957 – (93) SHARP J. G. e LANCASTER J., Pharm. !.. 86, 102, 1911 – (94) STRAUB W„ Arch. exp. Palh. u. Pharmakol., 80, 72. 1917; Arch. Pharm., 256, 196, 1918; Schwell. Med. fVoch, li. 888, 1935 – (95) JOACHIMOGLU G.. Arch. Pharm., 258. 33. 1920 – (96) STOLE A, Chem. Ind., 1562, 1959 – (97) VAN OS F. H. L.. OALENKAMP C. H. c KLIPHUIS A. R„ Pharm. Weekbl., 89. 429, 1954; Chem. Abs., 48, 11729 e, 1954 â– (98) VAN OS F. H. L. e STEHOUWER J. H.. Pharm. Weekbl., 91, 942, 1956 – (99) VAN OS F. H. L., Volume commemorativ du Centenaire de L, Braemer, Slrasbour8, 1958 – (100) LEFRANCOIS A., Essala de culture de la Digitale, Thése Pharm., Parla, 1931 – (101) DUQUÈ- NOIS P„ Ann. Pharm. Frane., 10, 177, 1952 – (102) ROWSON J. M., J. Pharm. Pharmacol., 7, 932, 1955 – (103) BURMANN J„ J. suisse Chim. Pharm., 49, 562, 1911; 51, 117, 1913 – (104) DAFERT O. e LÓWY H„ Meli und Oew. Pflanz., 13, 23, 1930; Bull. Sci. Pharm., 38. 542, 1931 – (105) DUQUÈNOIS P. e SCHAERER E., Ann. Pharm. Franf.. 8. 375, 1950 – (106) HAMILTON H.. J. Am. Chem. Soc., 41, 25, 1919 – (107) WIJNGAARDEN D.. Arch. exp. Palh. u. Pharmakol., 113, 59, 1926 – (108) PERROT E., BOUR- CET P. e RAYMOND-HAMET, Bull. Sci. Pharm., 38. 7. 1931 – (109) CALCANO! V. e CIROPOL J., Phar- mazie, 14, 635, 1959 – (110) TATTJE D. H E, Pharm. Tlldschr. Belgici 30, 2L 1953 – (111) RAPP, Pharm. !.. 38, 731, 1914 – (112) British Pharmacofxteia, 1958, p. 216 – (113) The Ptiamnacopoca of Che United States of America, XV ed., 1955, p. 215 – (114) Gosudaistvenala farmacopoea SSSR, vosmoe izdanie Moskva, 1952, p. 216 – (115) Codea medicamentarius gallicus, VII ed., 1949, p, 231 – (116) VAN OS F. H. L„ Pharm. Weekbl., 88, 237, 1953 – (117) GISVOLD O.. J.A.Ph.A., Sci. ed., 47, 600, 1958 – (118) GISVOLD O.. J.A.Ph.A., Sci. ed., 48. 532, 1959 – (119) YOUNGKEN H. W., DJAO E. H. e TSAO D. P. N.,
J. A.Ph.A . Sci. ed., 40, 569, 1951 – (120) COSGROVE F. P. e GUTH E P„ J.A.Ph.A., Sci. ed., 43, 90. 1954 – (121) SABINIEWICKZ S,. Ann. Pharm. Frane., 15, 321, 1957 – (122) DEL RIO IBANEZ J., Arch. Hai. Sci. Farmacol., 1, 292, 1951 – (123) MA^CHERPA P,, Boll. Soc. Hai. Blol. Sper., 23, 242, 1947; Bloch. Appi, 3, 165, 1956 – (124) COULOUMA, Thése Pharm., Montpellier. 1924 – (125) NEUWALD F.. Arch. Pharm., 284, 382, 1951 – (126) VAN OS F. H. L., Volume Commémoralif du Centenaire de L. Braemer, Strasbourg, 1958 – (127) TATTJE D. H, E e VAN OS F. H. I_. Pharm. Tlldschr., 30, 21, 1953; Pharm. Weekbl., 88, 237, 1953; Schwelz. Ap. Zig., 91, 618, 1953 – (128) OKADA M„ YAMADA A. e SAITO
K. , J. Pharm. Soc. Japan, 75, 611, 1955; Chem. Abs., 49, 12778 d, 1955 – (129) MOMOSE T., Japan, 6744,
6 agosto 1959; Chem. Abs., 54, 1812 i, 1960 – (130) SATO D., ISHII H. e OYAMA Y„ Ann. Repl. Shionogl Res. Lab., n. 5, 113, 1955; Chem. Abs., 50, 17331 c, 1956 – (131) MOHR K. e REICHSTEIN T., Pharm.
Acta Helv., 24, 246, 1949; Chem. Abs., 44, 1652, 1950 – (132) SATO D.. ISHII H. e NISHIMURA Y„
J. Pharm. Soc., Japan, 74, 1397, 1954; Chem. Abs., 49, 4940 h, 1955 – (133) SATO D., ISHII H. e NISHIMURA Y.. J. Pharm. Soc. Japan, 74. 474, 1954; Chem. Abs., 48, 10298, 1954 – (134) OKADA M., J. Pharm. Soc. Japan, 73, 1118, 1953; Chem. Abs., 48, 12145 c, 1954 – (135) HAACK H., GUBE M,, KAISER F. e SPINGLER H.. Ber., 91, 1758, 1958 – (135 a) STOLE A., J. Suisse Mid., 70, 594, 1940 – (136) TSCHESCHE R. e BUSCHAUER G,, L!eb. Ann., 603, 59, 1957 – (137) SATO D., WADA T„ ISHII H„ OYAMA Y, e OKUMURA T.. Pharm. Buìi, 5, 253, 1957; Chem. Abs., 52, 63771, 1958 – (138) KARRER W.. Festschrilt E. Bardi, 1936, p. 238; Chem. Zbi, II, 2727, 1936 – (139) SATO D., ISHII H.
e OYAMA Y., J. Pharm. Soc. Japan, 75, 1025 e 1173, 1953; Chem. Abs., 50, 533 d e 2922 d, 1956 .
(140) TSCHESCHE R. e GRIMMER G.. Ber., 88, 1569, 1955; Chem. Abs., 50, 113581, 1956 – (141) TSCHESCHE R,, DIsch. Ap. Zig., 97, 5. 1957 – (142) TSCHESCHE R. e LIPP G.. LIeb. Ann., 615, 210, 1958; Chem. Abs., 53, 20130a, 1959 – (143) SATO D., ISHII H,, OYAMA Y. e OKUMURA T. 1. Pharm. Soc. Japan, 75, 1573, 1955; Chem. Abs., 50, 10750e, 1956 – (144) SATO D.. Yakugaku ZasshI, 79, 1474, 1959; Chem. Abs., 54, 6809 g. 1960 – (145) TSCHESCHE R.. LIPP G. e GRIMMER G., LIeb. Ann., 606, 160, 1957; Chem. Abs., 52, 9176 h, 1958 – (146) TSCHESCHE R, HAMMERSCHMIDT W. e GRIMMER G„ LIeb. Ann., 614, 136, 1958; Chem. Abs,, 53, 4341 1, 1959 – (147) GRIMMER G.. Pianta Med., 4, 136, 1956 – (148) KELLER C.. Chem. Zhl., i, 1211. 1897 – (149) MANNS O., Relaz. alla Pharmazeutische Gesellschaft, Berlino, 27 marzo 1956; DIsch. Apoth. Zig., 96, 381, 1956 – (150) KILIANI H., Ber., 24, 339, 1891 – (151) KILIANI H., Ber, 23, 1555, 1890 – (152) KILIANI H.. Ber., 59. 2462, 1926 – (153) JACOBS W. A. e SIMPSON J. C. E.. J. Btoi Chem., 110, 429, 1935 – (154) WINDAUS A. e WEIL K.. Z. physiol.
1 ¥ • i.. ’ 0-
Chem., ni, 61, 1922 – (155) WINDAUS A. e.SHAH S. V., Z. physiol. Chem., ISI, 86, 1926 – (156)1 iì TSCHESCHE R. e HAGEDORN A„ Ber., 68, 2247, 1935; 69, 797, 1936 – (157) MARKER R. E. e ó- ROHRMANN E„ J. Am. Chem. Soc., 61, 2724, 1939; 62, 647, 1940 – (158) MARKER R. E., TURNER D. L. e ULSHAFER P. R., 1. Am. Chem. Soc., 64, 1843, 1942 – (159) KLASS D. L., FIESER M, e FIESER L. F, 1. Am. Chem. Soc., 77, 3829, 1955 – (160) DJERASSI C. e GROSSNICKLE T. T., Chetts. Ind., 728, 1954; Chem. Abs., 49. 9008, 1955 – (161) DJERASSI C, GROSSNKTCLE T. T. e HIGH L. B„
J. ,4m. Chem. Soc., 78, 3166, 1956 – (162) WARREN F. L. e CANHAM P. A. S., Chem. Ind., 727, 1954; Chem. Abs., 49, 9009 b, 1955 – (163) KRAFT, Chem. Zbl., I, 1698, 1911 – (164) KILIANI H., Ber.,
SI, 1613, 1918 – (165) WINDAUS e SCHNECKENBURGER, Bei-.. 46, 2628, 1913 – (166) WINDAUS A., Chem. Zbl., I. 1814, 1926 – (167) WINDAUS A. e BRUNKEN J., Z. physiol. Chem, 145, 37, 1925 – (168) TAMBACH R., Pharm. Zentralh., 53, 392, 1912; Chem. Zbl., I, 1841, 1912 – (169) JACOBS W. A. e SIMPSON J. C. E, J. Blol. Chem., 109, 573, 1935 – (170) JACOBS W. A. e SIMPSON J. C. E,
J. Blol. Chem., 110, 429, 1935 – (171) TSCHESCHE R. e HAGEDORN A, Ber., 69, 797, 1936 – (172) MARKER R. E. e ROHRMANN E., J. Am. Chem Soc., 61, 2724, 1939; 62, 647, 1940 – (173) PATAKI !.. ' ROSENKRANZ G. e DJERASSI C., J. Am. Chem. Soc., 73, 5375, 1951 – (174) HERRAN, ROSENKRANZ e SONDHEIMER, Chem. Ind., 824, 1953; J, Am. Chem. Soc., 76, 5531, 1954 – (175) JACOBS W. A. e FLECK E. E., J. Blol. Chem., 88, 545, 1930 – (176) TSCHESCHE R., Ber., 68, 1090, 1935 – (177) TSCHESCHE R. e HAGEDORN A„ Ber., 68, 1412, 1935 – (178) MARKER R. E. e ROHRMANN E,
J. ,4m. Chem. Soc., 62, 900, 1940 – (179) MARKER, ROHMANN e JONES, J. ,4m. Chem. Soc., 62, 1162, 1940 – (180) MARQUINA J. M. G. e VILLA M. G„ Farmacognosla, 17, 425, 1957; Chem. Abs., 52, 9, 7518 c, 1958 – (181) WEISS F. e MANNS O., Pharm. Zeniralh., 98, 437. 1959; Chem. Abs., 54, 819 e, 1960 . (182) GISVOLD O., J.A.Ph A., 23, 664. 1934 – (183) MORIN P. L.. J. Pharm Chim., 7, 294, 1845 – (184) FOURTON A., Les acides de la digitale, 1929 – (185) HERMANN K„ Pharmaiie, 13, 266, 1958 – (186) KARRER W., Konstitution und Vorkommen der Organischen Pflanzenstoffe, 1958, p. 351 – (187) KARRER P. e MATTER E., Helv. Chim. Acta, 31, 789, 1948 – (188) GtÌNTHER E., HEEGER E. F. e ROSENTHAL C.. Pharmade, 7, 39, 1952 – (189) PARIS R., Compì, rend., 238, 932, 1954 – (190) ADRIAN e TRILLAT, Compì, rend., 129, 889, 1899; Chem Zbl., I, 207, 1900 – (191) JANOT M, CHABASSE – MASSON- NEAU J-, DE GRAEVE P. e GOUTAREL R.. Bull. Soc. Chim. Blol., 108, 1955 – (192) FLEISCHER F., Ber., 32, 1184, 1899 – (193) KILIANI H. e MAYER O.. Ber., 34, 3577, 1901 – (194) NAKAMURA H., OHTA T. e HUKUTI G„ Chem. Zbl., II. 3801, 1936 – (195) NEUWELD F.. Arch. Pharm., 459, 1952 – (196) NEWCOMB e HAYNES, Amer. 1. Pharm., 87, 113, 1915 – (197) WINKLER L. W„ Pharm Zentralh., 73, 614, 1932 – (198) BURMANN J., J. sidsse Chim Pharm., 49, 562, 1911; 51, 117, 1913 – (199) KNUTSEN J. C.. Norges Apolekerlorening Tldss., 29, 1. 1921 – (200) FREUND, Pharm. Zentralh., 55, 481, 1914 – (201) WITTEHERING, ciL da MADAUS in Lehrbuch der Biologischen Heilmittel, voi. IL p. 1190, Thieme, Lipsia 1938 – (202) WOLLENBERGER A.. Pharmacol. Rev., 1, 311-352, 1949 – (203) FLECKENSTEIN A. e JANKE J„ P/i«g. Arch. ges. Physiol., 258, 177-199, 1953 – (204) FLECKENSTEIN A. e JANKE J., Ibld., 265, 237-263, 1957 – (205) FLECKENSTEIN A.. JANKE J., DAVIES R, E e KREBS H. A., Nature, London, 174, 1081-1083, 1954 – (206) FLECKENSTEIN A., JANKE J.. KRÙSE R. e LECHNER C.. Arch. t. exp. Path. u. Pharmakol., 224, 465-475, 1955 – (207) FLECKESTEIN A., JANKE J„ LECHNER C. e BAUER G.. Pftiig. Arch. ges. Physiol., 259, 246-266, 1954 – (208) MOM- MAERTS W. F. H. M.. Nature, London, 174, 1083-1084, 1954 – (209) MOMMAERTS W. F. k. M„ Am. J. Physiol., 182, 585-593, 1955 – (210) HAJDU S. e LÉONARD E, Pharmacol. Rev., 11, 173-209, 1959 – (211) BINO R, J„ MARAIST F. M,, DAMMANN J. F., DRAPER A., HEIMBECKER R.. DEI.EY R., GERARD R. e CALAZEL P., Circulation Res., 6, 122-128, 1958 – (212) WOLLENBERGER A., [ved, (202)1 – WOLLENBERGER A„ J. Pharmacol., 91, 39-51, 1947 – WOLLENBERGER A„ Am. 1. Physiol., 150, 733-745, 1947 – WOLLENBERGER A.. Experenlla, 10, 311-312, 1954 – (213) HEYMANS C., BOUCKAERT J. J. e REGNIERS P„ C. R. Soc. Blol., 110, 572-574, 1932 – (214) GOODMAN L. S. e GILMAN A„ The Pharmacological basis of Therapeutics., McMillan Comp. New York 1955 – (215) SAUTER, Schiveit, Med. IVoch., n. 17, 1948,


