Passiflora Incarnata L.
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Fam. Passifloracee)
(Sin. – Granadilla incarnata Moench.)
Passiflora Incarnata L.- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Passiflora – fiore della Passione, perchè il cerchio di filamenti fiorali (di vario colore porpora, rosa, violetto) ricorda la corona di spine di Gesù, i tre stili i chiodi, le foglie tricuspidate la lancia e i viticci lo staffile.
Mandata in omaggio a Papa Paolo V (Camillo Borghese, 1605/21), questi la fece coltivare con molta cura a Roma, indicando che la pianta rappresentava una rivelazione divina: la Passione di Cristo.
Granadilla – da granado (port.) – granato, allusione al colore del granato (piròpo e almandino, silicati rossi).
incarnata – per la corona color porpora al centro e violetto pallido alla periferia,
Nomi volgari – Mbrucuyà silvestre, burucuyà (indio), passiflore rouge o purpurine (fr.), passion flower, passion vine (ingl.), passiflora rossa (it.), granadilla (port. spagn).
Habitat – Scoperta nel Perù e descritta per la prima volta da Nic. Monardis (1569). Brasile, Messico, U.S.A. (Nord Carolina, Missouri, Texas, Virginia, Florida), Antille. Vegeta anche nell’Africa del nord, coltivata, e nella regione mediterranea. Coltivata nei giardini in Europa.
Arbusto rampicante.
Parti usate – Rami fogliuti e fioriti, raccolti quando si sviluppano i primi frutti. La droga non deve avere la parte sotterranea dei fusti, nè i rizomi (piante anziché recise alla base, strappate dal terreno).
La pianta non va confusa con la Passiflora rubra L. di S. Domingo (foglie a due lobi, anziché tre). La caratteristica della incarnata è di avere due ghiandole nettarifere alla base del picciolo fogliare: tener presente che anche altre specie (holosericea L. del Messico, hirsuta L. dell’America del sud, glauca H. K. della Guiana, Caienna) hanno i piccioli glandulosi e le foglie trilobe.
Componenti principali
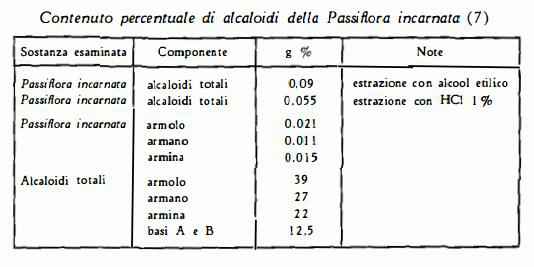
La ricerca della composizione chimica dei principi attivi della Passiflora ha condotto a risultati positivi soltanto in questi ultimi anni. Anteriormente sostanze non bene definite chimicamente, dotate di proprietà farmacologiche, sono state ottenute da De Nito ( 1 ), Fellows e Smith (2), da Ruggy e Smith (3), da Borgatti (4) e da Neugebauer (5), finché gli studi di Neu (6) dal 1954 al 1956 hanno messo in evidenza nella Passiflora la presenza di un alcaloide, passiflorina, identificato poi con una base alcaloidica già nota, l’armano. Successivamente nel 1959, Lutomski (7) ha confermato, quale componente della Passiflora incarnata L., l’armano ed ha inoltre estratto dalla stessa droga quattro altri alcaloidi, e cioè armina, arinolo e due sostanze A e B non identificate. Lo stesso A. con Wrocinski (8) nel 1960 ha riferito di aver ottenuto quattro composti flavonoidi, e di avere constatato che la presenza di queste sostanze nei preparati di Passiflora, insieme con gli alcaloidi, è necessaria per lo svolgersi dell'«optimum» dell’azione sedativa, propria della droga.
Pertanto, allo stato attuale delle conoscenze circa la composizione chimica della Passiflora incarnata L., si ammette la presenza dei seguenti componenti (8a):
A – Alcaloidi
1) Armano, C12H10N2 – E’ stato isolato da Neu (6) in un primo tempo con il nome di passiflorina dalla Passiflora incarnata, P. edulis, P. alba, P. bryonnoides, P. quadrangularis, P. capsularis e P. tuberosa. Lo stesso A. ha identificato la passiflorina con l’armano (9). Questo alcaloide indolico, derivato dalla b-carbolina e noto dapprima solo come prodotto di degradazione dell’armina (9), è stato poi trovato anche in natura, essendo stato riconosciuto identico, sia alla loturina (10), componente della corteccia del Symplocus racemosa Roxb. (11), sia alla aribina (12), isolata dalla corteccia di Arariba rubra Mart. (13).
2) Armina, C13H12ON2 – E’ l’alcaloide indolico, già noto per essere stato isolato da Fritzsche (14) dal Peganum Harmala ed estratto sia dai semi che dalle radici della stessa droga da Rozenfeld (15). E’ stato separato per via cromatografica anche dalla Passiflora incarnata L. da Lutomski (7).
3) Armolo, C12H10ON2, base fenolica, ottenuta dapprima per trattamento della armalina con acido cloridrico a temperatura di ebollizione (16), è stata ora trovata anche in natura come componente della Passiflora incarnata L. (7).
4) Base A e Base B, di composizione non identificata, sono state isolate da Lutomski (7) dalla Passiflora incarnata L. nella quantità del 12,5% del contenuto totale degli alcaloidi.
La conoscenza della composizione chimica degli alcaloidi, armano, armina ed arinolo, si deve specialmente ai lavori di Fischer e coll. (17- 20), di Robinson e coll. (21-27) e di Spàth e coll. (28) (29). Le formule di struttura definite per le tre sostanze sono le I, Ila e Ilb rispettivamente:

B – Altri componenti
Quattro flavonoidi, dotati di azione sedativa sul topo e sui piccoli pesci, sono stati separati mediante procedimento cromatografico (8).
n-Nonacosano nella frazione insaponificabile (6).
Sterine, nell’estratto etereo della pianta, del quale il 13 % è costituito da stigmasterina ed il 10% da altri steroli (6).
Gomma 0,25 % (31).
Un glucoside cianogenetico è stato trovato da Guignard (30) in quantità variabile dallo 0,005% allo 0,05% nelle specie Passiflora coerulea, P. adenopoda, P. racemosa, P. tuberosa, P. actinia, P. quadrifolia, P. maculata, P. foetida, P. laurifolia, P. alata e P. edulis. Un glucoside, producente per scissione acido cianidrico, è stato pure trovato da Greshoff (32) nella Passiflora quadrifolia, P. laurifolia e nella P. princeps. Neugebauer (5) ha riconosciuta la presenza di un glucoside cianogenetico nelle foglie della Passiflora coerulea, P. tuberosa, P. bryonnoides, P. capsularis e della P. digitata; l’esito delle ricerche è stato invece negativo per la Passiflora incarnata, P. edulis, P. gracilis e P. alba.
Con il nome di passiflorina e di maracugina sono state indicate da Peckolt (33) due sostanze amare, non definite chimicamente, che sono state estratte dallo stesso A. da specie sudamericane di Passiflora: P. actinia, P. alata, P. Eichleriana; nella P. edulis è stata trovata soltanto maracugina.
Proprietà farmacologiche ed impiego terapeutico
L’azione sedativa della Passiflora venne segnalata per la prima volta nel 1867 da Phares (34) e confermata in seguito da Ott (35) il quale precisò che la sua azione depressiva si manifesta a livello della zona motrice del midollo spinale e che, inoltre, verrebbe stimolata l’attività respiratoria, mentre l’azione ipotensiva sarebbe molto debole e di breve durata.
Clinicamente l’azione sedativa della Passiflora venne confermata da Stapleton (36) il quale la trovò utile in tutti i casi di insonnia in cui l’ostacolo al sonno era dovuto ad una eccitazione cerebrale.
Renon (37) la impiegò con successo negli stati ansiosi e in particolare, nella cosiddetta angoscia di guerra, durante il primo conflitto mondiale.
Leclerc (38-39) vanta l’efficacia di questa droga per combattere le turbe della menopausa e l’insonnia che frequentemente si manifesta durante la convalescenza di malattie infettive e in particolare della grippe.
Secondo questo A. la Passiflora presenterebbe il grande vantaggio di provocare un sonno simile a quello fisiologico e un risveglio rapido, completo senza conseguenze di depressione o di obnubilamento psichico.
Analogamente, Stauffer (40) e Schirmer (41) riferiscono di aver impiegato la Passiflora nel trattamento dell’insonnia e, inoltre, delle nevralgie.
Ricerche farmacologiche sull’azione della Passiflora, vennero condotte da De Nito (1) secondo cui sarebbero contenute in questa droga, due sostanze alcaloidee, una delle quali sarebbe dotata di una netta azione ipotensiva.
Sperimentando su animali a sangue freddo (rane e rospi) e su mammiferi (cani), egli non sarebbe mai riuscito a determinare in essi nè un’azione sedativa sul sistema nervoso centrale, nè un’azione narcotica o ipnotica o anestetica locale, pur impiegando dosi tossiche di un estratto fluido. A tali dosi la Passiflora determina una diminuita capacità di reagire a tutti gli stimoli e in particolare a quelli dolorifici e, negli animali a sangue freddo, anche una incapacità a compiere i movimenti volontari.
Sul cuore in situ di rana e di rospo, l’estratto fluido determina un effetto bradicardico e un aumento dell’ampiezza delle pulsazioni e ciò sia sugli animali normali che in quelli previamente atropinizzati.
Sul cuore isolato di mammifero lo stesso estratto eccita in primo tempo la fibra miocardica e la deprime in secondo tempo.
Deprime l’attività del nodo di Keit e Flack e determina un’azione dromotropa negativa. Nel cane, l’estratto fluido determina un effetto ipotensivo per vasodilatazione periferica.
Successive ricerche sull’azione spasmolitica della Passiflora vennero eseguite da Borgatti (4) il quale impiegò come reattivo biologico l’intestino isolato di coniglio. Egli trovò che la droga determina un’azione deprimente su quest’organo e che esiste un antagonismo fra Passiflora e pilocarpina, senza però che nessuna delle due sostanze riesca a inibire completamente l’azione dell’altra. L’antagonismo sarebbe invece più completo di fronte al cloruro di bario in quanto, non solo la Passiflora riesce a invertirne l’azione contratturante, ma anche a inibirne l’attività.
L A. avrebbe accertato inoltre l’esistenza di un sinergismo di potenziamento fra Passiflora e papaverina e conclude attribuendo alla Passiflora un’azione depressiva sulle fibre muscolari liscie.
Alla stessa conclusione giungono Ruggy e Smith (3) i quali negano però ai principi attivi della Passiflora ogni attività sedativa, pur ammettendo l'esistenza di un’azione ipotensiva e miolitica sulla fibra muscolare liscia.
La sostanza attiva contenuta nella Passiflora, non ancora ben identificata, potrebbe essere rappresentata, secondo Neugebauer (5) da una sostanza basica, probabilmente identica alla maracugina, mentre Lutomski e Wrocinski (8) attribuiscono l’azione sedativa della droga a due frazioni da essi isolate, una flavonica e una alcaloidica (ved. parte chimica), la cui presenza nei preparati di Passiflora sarebbe necessaria perchè possano esplicare l’optimum dell’azione farmacodinamica.
In considerazione delle relazioni esistenti tra stati emotivi e nutrizione, specialmente durante la prima infanzia. Borsetto (42) ha studiato l’influenza che può esercitare la somministrazione di sedativi vegetali, quali la Passiflora, la Lattuga virosa, il Biancospino, la Valeriana, la Camomilla ecc, su quelle anomalie di crescita che possono derivare dagli stati di irrequietezza nervosa.
Le droghe vennero somministrate sotto forma di estratti fluidi o di infuso (per la Camomilla) a dosi tali da non indurre sonnolenza e la durata del trattamento venne protratta per un periodo variante da una settimana, nei casi in cui la risposta al farmaco impiegato era pronta, sino ad oltre un mese negli altri casi. L’A. osservò che l’azione dei sedativi sui bambini ipercinetici, eretistici, anoressici, può influenzare favorevolmente l’equilibrio psico-fisico e l’incremento ponderale che risultò notevole in tutti i casi.
Ricorderemo infine che, secondo Paris e Quevauviller (43), la Passiflora è dotata di un’azione protettiva di fronte al broncospasmo provocato dall'acetilcolina e che, alle dosi impiegate dagli AA., essa può ritardare, ma non impedire, le crisi asmatiche provocate da questa sostanza.
Per quanto riguarda invece l’effetto antistaminico, l’azione della Passiflora sarebbe meno evidente in quanto essa riesce soltanto a determinare un certo ritardo nella comparsa del broncospasmo ma non un vero effetto protettore e antistaminico.
Estratti e preparati vari
a) Estratto fluido per tintura (g 1 = XLVl gtt).
Dosi: g 0,2-0,6 pro dose.
b) Estratto fluido per sciroppo (g 1 = XXX gtt).
Dosi: g 0,2-0,6 pro dose.
c) Estratto molle acquoso (1 p. = 4 p. circa di droga),
Dosi: g 0,05-0,15 pro dose.
d) Estratto secco acquoso (1 p. = 6 p. circa di droga).
Dosi: g 0,05-0,1 pro dose.
e) Esccatto secco iniettabile.
Dosi: la quantità in peso corrispondente a g 0,05-0,1 di droga pro dose.
Preparazioni usuali e formule galeniche
Tintura
Esccatto fluido passiflora per tintura g 20
Alcool di 50°……………………… g 80
(XL-LX gocce pro dose).
Sciroppo
Estratto fluido passiflora per sciroppo g 5
Sciroppo semplice F.U……… g 95
(a cucchiaini).
Sciroppo sedativo
Estratto fluido passiflora per tintura g 8
Estratto fluido biancospino g 2
Estratto fluido giusquiamo g 0,6
Glicerina…………………………… g 40
Sciroppo di arancio…………… g 180
(a cucchiaini).
Compresse ipotensive
Estratto secco vischio bianco ………………………… g 0,05
Estratto secco passiflora………………………………… g 0,03
Estratto secco frangula …………………………………… g 0,10
Estratto secco biancospino…………………………….. g 0,02
Eccipiente q. b. per 1 compressa
(2-3 compresse pro die).
BIBLIOGRAFIA
(1) DE SITO G., Rass. Terap. e Palol. Clin., 3, 193, 1931 – (2) FELLOWS e SMITH, J.A.Ph.A., 27, 565,
1938 – (3) RUGGY e SMITH, J.A.Ph.A., 29, 207, 245, 1940 – (4) BORGATTI, Arch. II. sci. larm., «, 173,
1939 – (5) NEUGEBAUER H„ Pharmazie, 4. 176, 1949 – (6) NEU R., Arineim.-Forsch., 4. 292 e 601,
1954; 6, 94, 1956; Chem. Abs.. 48, 9018 h, 1954; 49. 2679 e, 1955 . (7) LUTOMSKI J ., Biul. itisi. Rostin Leczniclych, 5, 169 e 182, 1959, 6, 209, 1960, Chem. Abs., 54, 16752 a, I960; 55, 21479 a, 1961 – (8)
LUTOMSKI J. e WROCINSKI T., Bini. Itisi. Roslln Leczniczych, 6, 176, I960; Chem. Abs., 55, 6785 e,
1961 – (8 a) Confr. CAPRA C., Fìiolerapia, 32, n. 3, 2, 1961 – (9) FISCHER O., Festschrìft zum 80. Geburtstag des Prinzregenten Luitpold, Erlangen 1901; Chem. Zbl., l, 957, 1901 – (10) SPAETH E„ Monaish., 41. 401, 1920 – (11) HESSE O., Ber., Il, 1542, 1878 – (12) SPAETH E., Monaish., 40. 35L 1919 – (13) RIETH R., Lieb. Ann.. 120. 247, 1861 – (14) FRITZSCHE J., Lieb. Ann., 64. 365, 1847 – (15) ROZENFELD A. D., Farm. Zhur., 183,1930; Chem. Abs., 25, 2811, 1931 – (16) FISCHER O. e TAEUBER, Ber., 18, 400, 1885 – (17) FISCHER O, Ber,, 30, 2482, 1897 – (18) FISCHER O. e BOESLER W., Ber., 45, 1934, 1912 – (19) FISCHER O., ANGERMANN e DIEPOLDER, Ber., 47, 99, 1914 – (20) FISCHER
0. , Chem. Soc. Absir.. (i), 405, 1901 – (21) PERKIN W. H. e ROBINSON R„ J. Chem. Soc., 101, 1778,
1912 – (22) PERKIN W. H. e ROBINSON R., J. Chem. Soc., 115, 967, 1919 – (23) KERMACK W. 0., PERKIN W. H. e ROBINSON R„ J. Physiol., 29, 45L 1903 – (24) PERKIN W. H. e ROBINSON R, J. Chem. Soc., 115, 933, 1919 – (25) lYER W. W. S. e ROBINSON R., J. Chem. Soc., 1635, 1934 – (26)
BARRETI H. S. B.. PERKIN W. H. e ROBINSON R„ J. Chem. Soc., 2942, 1929 – (27) LAWSON,
PERKIN W. H. e ROBINSON R., 1. Chem. Soc., 125. 625, 1924; ROBINSON R. e THORNLEY, ibid., p. 2169; FREAK e ROBINSON R„ ibid., 2013, 1938 – (28) SPAETH e LEDERER, Ber., 63, 122, 1930 – (29) SPAETH e EITHER, Ber., 73, 719, 1940 – (30) GUIGNARD L„ Bull. sci. pharmacol., 13, 603, 1906 . (31) MITCHELL J. H„ RICE M. A. e RODERICK D. B„ Science, 95, 624, 1942 – (32) GRESHOFF, Arch. Phorm., 344, 399, 1906 – (33) PECKOLT T„ Ber.. 19, 343, 1909 – (34) PHARES, cil. da LECLERC H., in Précis de Phytothér., Masson, Paris 1935, p. 247 – (35) OTT 1., Medicai Bull., dicembre 1904 –
(36) STAPLETON M., Detroit Med. 1., 1904 – (37) RENON L., cit. da LECLERC H. Le. (34) – (38) LECLERC H., Courrler Médical, 1919 – (39) LECLERC H.. Buli. Sci. Pharmacol., 1920 – (40) STAUFFER, Klin. hom. Arzneimlttel, p. 751, cit. da MADAUS G. in Lehrbuch der Biologlschen Heilmittel, G. Thieme ed, Leipzig 1938, 3, p. 2072 – (41) SCHIRMER, Biologischen Heiikunst., p. 764, 1931, cit. da MADAUS
1. c. (40) – (42) SARTORE S„ Ann. Isnardi, 3, 120, 1956 – (43) PARIS R. e QUEVAUVILLER A., Thérapie, 2, 69, 1947.


