Efedra (specie varie)
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
Ephedra distachya L. (sin. E. sinica Stapf. – E. vulgaris (L) – E. flava Porter Smith. – E. Ma-Huang L).
Ephedra monostachya L. – E. nebrodensis Tin. – E. helvetica C. A. Meyer
Ephedra equisetina Bunge. – Ephedra intermedia Schrank var. tibetina‘Stapf.
Efedra (specie varie)- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Ephedra, dal greco ejedros, nome di una pianta somigliante nel portamento agli Equiseti.
Secondo alcuni Autori da epi = sopra e udwr = acqua, cioè pianta che sta vicino all'acqua del mare.
Secondo altri da epi = sopra e edra = seggio (nel senso di stelo), allusione ai fiori posti all'ascella delle guaine.
distachya = a due spighe, da dis = due e stacus = spiga.
monostachya = ad una sola spiga.
nebrodensis = dei monti Nebrodi (Sicilia, Messina),
helvetica = della Svizzera.
equisetina = che ha l'aspetto degli Equiseti.
intermedia = che sta fra le varie specie.
tibetina = del Thibet.
Nome volgare – Uva marina, per i frutti che assomigliano ad acini di uva, di color rosso, con succo acido (Dodoneo, 1600).
Poliganu bacciferu (Sicilia). .
Il nome cinese Ma-Huang = astringente giallo, è riferibile ad un gruppo di varie specie di Ephedra.
La droga principalmente usata in Cina è la Ephedra sinica Stapf. (sin. –
E.flava Porter Smith – Ephedra Ma-Huang L.). In un primo tempo, questa specie è stata confusa con la Ephedra vulgaris Rich. var. helvetica 'Hooker et Thomson (sin. E. helvetica C.A. Meyer).
Il nome è stato anche, occasionalmente, attribuito da Read e Liu, alla Ephedra equisetina Bunge. Fu anche usato per la Ephedra intermedia, Schrank var. tibetina Stapf.
La Ephedra sinica Stapf. si identifica con la Ephedra vulgaris (L) Rich. che a sua volta altro non è che la E. distachya L.
Habitat – Luoghi sabbiosi e marittimi dell'Europa meridionale; Ungheria, Siberia (monostachya). Rupi scoscese e scoperte, arene presso il mare nella Penisola e nelle isole maggiori (distachya).
In Sicilia, sui Monti Nebrodi (Caronie), le Madonie; in Sardegna sul Monte Oliera in luoghi aspri e rocciosi (nebrodensis).
In Svizzera (helvetica).
Le altre specie: Asia (Mongolia merid., Cina sett., Giappone).
Frutici a rami sottili, talora tortuosi e quasi volubili, articolato-nodosi.
Parti usate – La pianta intera.
Componenti principali
L'alcaloide efedrina come sostanza pura è stato isolato per la prima valta dalla droga cinese «Ma Huang» da Nagai nel 1887 (1), il quale diede appunto alI'alcaloide la denominazione efedrina. Successivamente Merck trovò efedrina (2) e y-efedrina (3) nella specie europea Ephedra helvetica C.A. Mey.
Allo studio della composizione chimica dell'efedrina e della y-efedrina hanno contribuito specialmente Nagai ( 4), Miller (5), Schmidt e coll. ( 6), Emde e coll. (7), Fourneau e coll. (8), Rabe (9), Ogata (10), Freudenberg e coll. (11), Leithe (12). Attualmente la struttura chimica della efedrina naturale (l-efedrina) C10H15ON e della y-efedrina naturale (d-y-efedrina) C10H15ON puo essere rappresentata dalle seguenti formule:

L'efedrina e la y-efedrina sono quindi due stereoisomeri con struttura equivalente all' 1-fenil-2-metilaminopropanolo e cioè molto vicina a quella dell'adrenalina, che e il 1-(3,4-diossifenil)-2-metilaminoetanolo:
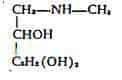
La stereoisomeria dell'efedrina e della y-efedrina è dovuta alla differenza nella configurazione in corrispondenza all'atomo di C in posizione a, mentre l'asimmetria del C in b e identica nei due composti.
L'efedrina può esistere sotto sei forme stereoisomere, due racemiche, due levogire e due destrogire. Lo stesso dicasi per i suoi isomeri. Spath e Gohring
(13) (14) hanno preparato per sintesi tutti i sei isomeri dell'efedrina.
Nella droga cinese “Ma Huang”, oltre a efedrina ed a y-efedrina, sono state trovate parecchie altre basi: N-metilefedrina (15), d-nor-y-efedrina (16). d-N-metil-y-efedrina (17), l-nor-efedrina (18), benzilmetilamina (19), efedina (20).
La I-nor-efedrina, C9H13ON, è stata isolata da Kanao (18) dalla Ma Huang crescente nel Pechili ed è stata trovata da Wolfes (21) in Ephedra europea.
La d-nor-y-efedrina, C9H13ON, è stata ottenuta da Smith (16) dai residui deIIa preparazione dell'efedrina dalla Ma Huang.
La N-metilefedrina (l-N-metilefedrina), C11H17ON, è stata trovata da Smith (15) nella Ma Huang e da Wolfes (21) in Ephedra europea.
La N-metil-y-efedrina (d-N-metil-y-efedrina), C11H17ON, è stata isolata da Nagai e Kanao (17) da Ma Huang crescente nel Pechili.
L efedina, C8H18N2O3, alcaloide di struttura chimica non definita è stata trovata nella Ma Huang da Chou e Chu (20).
La presenza in Ma Huang della benzilmetilamina, C8H11N, è stata stabilita da Chen, Stuart e Chen (19).
Wolfes (21) ha messo in evidenza che le Ephedra europee contengono gli stessi alcaloidi delle specie cinesi.
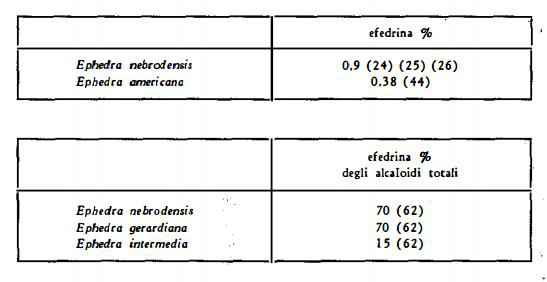
Le specie di Efedra italiane sono state esaminate da La Floresta (22) (23), Carboni (24) (25) (26), Mulas e Salis (27), Alberti (28) e Simon (29) allo scopo di stabilire se le specie indigene della Sardegna e della Sicilia fossero usufruibili per l'estrazione dell'efedrina. E' stato rilevato che l'E. nebrodensis conteneva una notevole quantità di efedrina e di y-efedrina: 0,9 % di efedrina, 0,8 % di pseudoefedrina, secondo Carboni; che l'E. distachya conteneva solo y-efedrina, mentre l'E. fragilis Desf., l'E. altissima Desf. e l'E. procera C.A. Mey avevano un basso contenuto alcaloidico.
Nell'E. gracilis Castoldi (30) ha trovato l'1,2 % di alcaloidi.
Le Ephedra crescenti nell'India del Nord (E. sinica Stapf, E. equisetina Read e Liu, E. intermedia Schrank e C.A. Mey, E. distachya L.) sono state analizzate da Read e Feng (31) e trovate ricche di alcaloidi.
Le Ephedra indiane con particolare riguardo alle variazioni stagionali del contenuto alcaloidico sono state studiate da Chopra, Ghosh e Dutt (32), da Chopra e Dutt (33), da Ghose e Krishna (34), da Chopra, Krishna e Ghose (35) e da Quazilbash (36).
Le Ephedra dell'America sono prive di alcaloidi, secondo le testimonianze di diversi AA. (37-43). Fa eccezione, secondo Chavez (44), l’E. americana Humb. e Bonpl. (E. andina Poepp. e Endl.), in cui è stato trovato lo 0,38 % di efedrina.
In una specie del Nord-Africa, l’Ephedra alata Decnc., si è rilevata la presenza di efedrina e di y-efedrina (45) (46).
Per l'estrazione dell'efedrina in Russia si usano le specie E. equisetina ed E. intermedia (47).
La droga cinese Ma Huang può contenere il 2 % di alcaloidi totali (54), ma le droghe commerciali comunemente ne contengono circa l'1 %.
L'analisi del contenuto di alcaloidi totali e di efedrina in alcune specie di Ephedra ha dato i seguenti risultati:
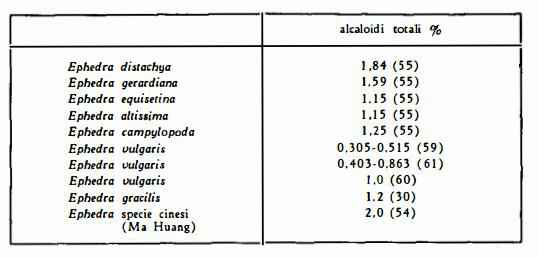
Vi è una notevole variazione, tra le differenti specie di Ephedra, nel contenuto di alcaloidi totali e nel rapporto tra efedrina e y-efedrina. Vi sono pure variazioni stagionali e dipendenti dalle condizioni ambientali (terreno, clima ecc.). Il contenuto di alcaloidi aumenta con il crescere della pianta sino ad un massimo all'epoca della caduta della pianta stessa, per cui le più vecchie sono da considerarsi più ricche di alcaloidi rispetto alle piante giovani (48) (49) (50), Nel corso della fioritura, vi è una maggior quantità di alcaloidi nelle piante maschili rispetto alle femminili (25) (29) (51). L’Ephedra che cresce in luoghi umidi ha un più basso contenuto di alcaloidi (52).
Non sono stati trovati alcaloidi nelle radici, nelle bacche o nei semi dell'Ephedra (51) (53). I nodi contengono solo un terzo del contenuto totale di alcaloidi degli internodi, ma contengono una maggior quantità di y-efedrina rispetto agli internodi (51) (53).
Oltre agli alcaloidi nelle Ephedra sono stati trovati tracce di olio etereo, catechina, tannino, zucchero, mucillaggine, resina, acqua 8,7 %, ceneri 5,1% (in Ephedra vulgaris var. monostachya) (56); mannano (nel legno di Ephedra vulgaris Rich.) (57). Alyukina (58) ha segnalato che l'Efedra può essere considerata quale materiale tannante redditizio, contenendo tannino dall'8,38 al 9,42%.
Proprietà farmacologiche ed impiego terapeutico
L'Efedra è impiegata nella medicina cinese sin dalla più remota antichità, tanto che si fa risalire all'Imperatore Shen Nung (2760 A.C.) il merito di averne sperimentata l'attività e di averla classificata, insieme con altre droghe, fra i rimedi della «Classe media». Sotto il nome di Ma-huang alcune specie di Efedra fra le quali l'Ephedra distachya (o E. sinica Staph. o E. vulgaris L.), la E. equisetina, la E. intermedia Schank var. tibetina o miscugli di esse, si trovano citate in un codice farmaceutico cinese, il Pentsao Kang Mu (1569), attribuito a Shi Cheng Li, in cui il Ma-huang è indicato come droga ad azione antipiretica, diaforetica, stimolante circolatoria e sedativa della tosse (63).
Il nome cinese di Ma-huang significherebbe secondo alcuni, “astringentegiallo”; da altri questa denominazione viene tradotta invece «Canapa gialla» per la somiglianza dei suoi fiori con quelli della Canapa (64)
L'Efedra è tuttora impiegata nella medicina cinese e fa parte della composizione di numerose preparazioni farmaceutiche. Essa venne impiegata in passato anche nella medicina popolare russa, come rimedio delle malattie dell'apparato respiratorio e contro il reumatismo.
Anche gli indiani del Sud-Ovest degli U.S.A. impiegarono empiricamente una specie americana di Efedra nella terapia di alcune malattie veneree (63).
Sull'Efedra come tale, esistono scarse notizie farmacologiche e cliniche, ma vastissima è invece la letteratura sul suo principio attivo principale, la I-efedrina, che viene attualmente estratta dal Ma-huang (miscela di varie specie).
Nel 1927 l'efedrina venne ottenuta per sintesi nei laboratori Merck e messa in commercio col nome di Efetonina (o efedrina racemica).
L'efedrina ha attratto l'attenzione dei farmacologi e dei clinici occidentali dopo che i lavori di Chen e dei suoi coll. [ved. bibliogr. da (65) a (81)] misero in evidenza alcune proprietà che l'efedrina avrebbe in comune con l'adrenalina, dalla quale peraltro, differisce chimicamente soltanto per il fatto che possiede due ossidrili in meno nell'anello benzolico e un gruppo metilico unito al secondo atomo di carbonio della catena laterale. Questa stretta parentela chimica, ha inizialmente avvalorato la ipotesi che all'analogia chimica corrispondesse anche un'analoga azione farmacologica, ma i risultati di successive ricerche dimostrarono che ciò in realtà si verifica soltanto parzialmente.
Nell'efedrina è ancora dimostrabile infatti un'attività simpaticomimetica, ma molto attenuata rispetto a quella caratteristica dell'adrenalina. Evidente è invece nell'efedrina, una marcata attività sulla fibra muscolare liscia che nell'adrenalina manca.
Mentre l'azione dell'adrenalina si svolge dunque specificamente sugli accettori adrenergici, quella dell'efedrina, meno specifica, si manifesta con un punto d'attacco neuro-muscolare.
Oltre questa differenza, che può essere considerata fra le più importanti, altre ne esistono che contribuiscono a differenziare farmacologicamente e clinicamente le due sostanze.
La molecola dell'efedrina è molto più stabile di quella dell'adrenalina; essa non è attaccata dall'aminossidasi, sistema enzimatico che provoca la rapida distruzione dell'adrenalina. La sua azione è quindi più durevole, anche se meno energica, di quella dell'adernalina (fig. 1). Ciò spiegherebbe la ragione per cui l'azione dell'efedrina viene ridotta [(82) (83)], piuttosto che potenziata, dalla cocaina, al contrario di quanto avviene invece per l'adrenalina. In questo caso la cocaina, inattivando l'aminossidasi, sottrae l'adrenalina alla sua azione distruttrice, potenziandone e prolungandone l'azione.
L'efedrina somministrata per os è rapidamente assorbita e, a differenza dell’adrenalina, non subisce alcuna alterazione a contatto dei succhi digerenti.
Somministrata ripetutamente a brevi intervalli, l'efedrina dà luogo a quella speciale forma di resistenza nota col nome di «tachifilassi», che consiste in un progressivo affievolirsi dell’azione, sino alla totale scomparsa o addirittura all'inversione.
Su segmenti isolati di intestino o di utero, l’efedrina agisce anche dopo atropinizzazione e contemporanea ergotaminizzazione, rivelando la natura prevalentemente muscolare della sua azione che si manifesta di solito con un ipo o un ipertono a seconda dello stato di tonalità iniziale del segmento stesso. L'azione ipotonizzante e quella inibente delle contrazioni automatiche determinate dall'adrenalina su segmenti isolati di intestino, sono sempre antagonizzate o invertite dall’efedrina.
Infine, i bloccanti adrenergici antagonizzano l'azione dell'adrenalina ma non quella dell'efedrina.
In considerazione del fatto che l’azione farmacologica e terapeutica dell'efedrina si trova diffusamente trattata in molti testi di Farmacologia, noi cercheremo di riassumere quanto crediamo sia necessario per dare di essa una descrizione più completa e succinta che ci sarà possibile.
Sulla pressione arteriosa l’azione dell'efedrina si manifesta, come già fu detto con un effetto ipertensivo meno intenso ma più durevole di quello determinato dall’adrenalina (fig. 1).
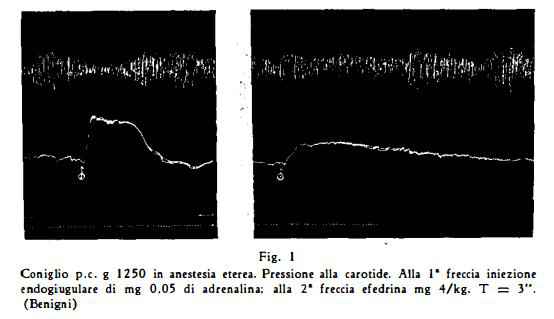
In determinate condizioni e con dosi elevate, alcuni AA. osservarono anche un effetto ipotensivo [Miura (84), Chen e Meek (79), Pennetti (85)] effetto che Chen e Meek ritennero essere dovuto ad una depressione cardiaca. Secondo Chen, Schmidt e Meek (86), per ottenere lo stesso effetto ipertensivo determinato dall’adrenalina, occorre una dose di efedrina 700 volte superiore, ma l'azione di questa sarebbe 7 volte più durevole. Nagel (87) attribuisce invece all’adrenalina un'azione soltanto 100 volte più attiva dell'efedrina, la cui durata sarebbe superiore di 4-5 volte.
L'azione tachifilattica dell'efedrina fu osservata da Chen fin dal 1926 su animali normali (76) e decapitati o decerebrati (88), nei quali notò che piccole dosi ripetute di efedrina (o del prodotto sintetico racemico), non determinano un aumento costante della pressione ma un aumento progressivamente decrescente, sino a produrre addirittura un'ipotensione che aumenta sempre più, via via che si ripetono le dosi.
Da Chen (89) fu posto anche in evidenza il marcato sinergismo di potenziamento esistente fra efedrina e adrenalina, associazione questa, capace di determinare un aumento del 66% sull’elevazione della pressione determinata dalla sola adrenalina ed un aumento del 72 % sulla durata della azione. L'esistenza di tale sinergismo venne in seguito confermata da Launoy e Nicolle (90), da Schumann (91) e da altri.
Più recentemente, con una tecnica di registrazione continua della pressione nel rospo, il Silva (92) ha studiato l’azione di diverse sostanze, fra le quali l’efedrina, confermando la sua azione ipertensiva.
Sul cuore isolato di mammifero l’efedrina alla concentrazione di 1:100000 determina un'azione stimolante con aumento di ampiezza, dovuta specialmente ad una maggior espansione diastolica ed un aumento di frequenza [Chen e Meek (79), Pennetti (85), Benigni (93)] (fig. 2).
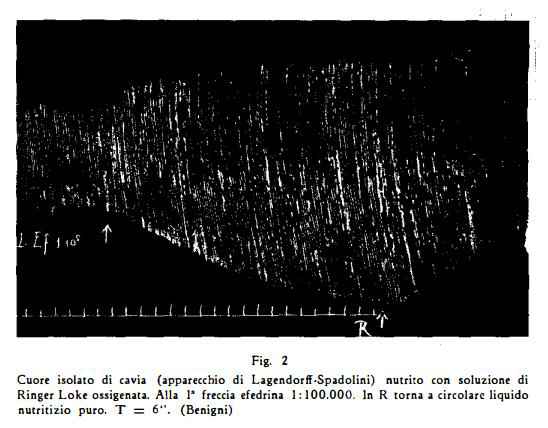
Continuando la perfusione, l'ampiezza diminuisce e si possono osservare anche disturbi del ritmo (fig. 3) (Pennetti, Benigni).

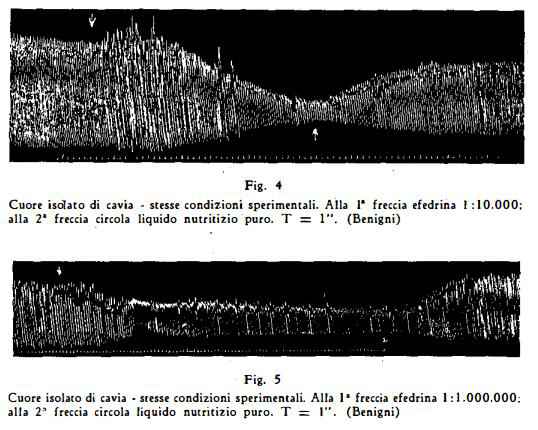
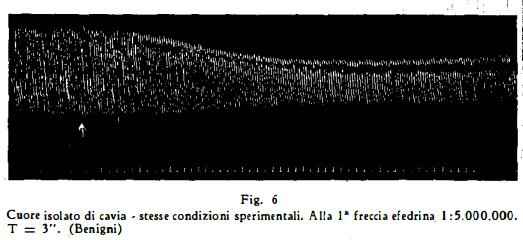
Concentrazioni superiori all'1:100000 riducono invece l'ampiezza e la frequenza, lasciando immodificato il ritmo (fig. 4) (Chen e Meek, Pennetti, Benigni), modificazioni queste, che si possono però osservare anche con cencentrazioni inferiori (1:500000, 1:1000000, 1:5000000, (Benigni) (fig. 5, 6).
Sull'atrio isolato di cavia Pepeu, Masi e Giotti (94), trovarono che l'efedrina manifesta un'azione nicotinosimile.
L'azione vasale periferica dell'efedrina si manifesta con una vasocostrizione e in ciò concordano i risultati delle ricerche di Gilnsburg (95) che sperimentò sui vasi dell'orecchio di coniglio; di Sollmann e Barlow (96), di Gradinesco (97), di Schumann (91), di Benigni (93), che sperimentarono sulla rana preparata secondo Trendelenburg (fig. 7): di Chen,

0
Schmidt e Meek (86), di Fujii (98), di Raymond-Hamet (99), di Gradinesco e Marcu (100) che sperimentarono sui vasi degli organi isolati. Raymond-Hamet inoltre, che studiò l’efedrina sul rene in situ, trovò che la sua azione vasocostrittrice è antagonizzata dalla yoimbina.
L'azione dell'efedrina sui muscoli lisci e in particolare su segmenti isolati o in situ di intestino e di utero è invece meno costante e più complessa.
Su segmenti di intestino isolato alcuni AA. ottennero con l’efedrina a diverse diluizioni, un’azione inibente del tono e delle contrazioni automatiche (Chen e Schmidt (86), Boyer e Levy (ved. 86), Kinnmann e Plant (101) ecc.).
Altri notarono invece un’azione eccitante del tono e delle contrazioni e capace di far riapparire le contrazioni automatiche inibite dall’adrenalina [Nagel (87), Dulière (102), Pollak e Robitscher (103), Benigni (93) ecc.]. Altri ancora constatarono azioni eccitanti o deprimenti secondo le dosi impiegate e, probabilmente in relazione anche allo stato di reattività dell’organo [Kreitmair (104), Marcu e Savulescu (105), Benigni (93)].

1

2
Anche per quanto riguarda il meccanismo d'azione furono formulate ipotesi diverse. Alcuni attribuirono all'efedrina un'azione autonomotropa anfotera [Marcu e Savulescu (105)], altri un'azione simpatico-muscolare [Todashi Okasaki (106), Benigni (93)]; altri ancora, gangliare, senza escludere un'azione parasimpatica [Reintz (107), Mitrofanov (108)].
Anche su segmenti di utero isolato si possono osservare azioni eccitanti o inibenti a seconda dello stato fisiologico dell'animale da cui i segmenti sono stati prelevati. Chen e Schmidt (ved. 86), constatarono un effetto contratturante: analoga azione venne osservata da Kreitmair (109) il quale osservò anche che tale azione non è antagonizzata dall’ergotamina, ciò che venne in seguito confermato da Nagel (87), da De Eds e Butt (110) e da Benigni (93) il quale potè constatare anche che su segmenti di utero gravido di mus Musculus, l'efedrina può dar luogo ad un effetto adrenalinico, non antagonizzato però dall'ergotamina, mentre sull'utero in situ di coniglia talamica, osservò costantemente un’azione contratturante.
Più recentemente Hovig e Naess (111) osservarono che sull'utero isolato di ratta, l'azione contratturante della 5-idrossitriptamina viene antagonizzata dall'efedrina il cui effetto tachifillattico si svilupperebbe in questo caso, molto rapidamente.
Il tono dello sfintere vescicale viene aumentato dall'efedrina e ciò giustifica il suo impiego nella terapia dell'enuresi notturna e della disuria.
L’effetto sulla motilità gastrica fu studiato recentemente anche dal Cirnu
(112) il quale osservò che l'efedrina agisce determinando un'inibizione durante i periodi di contrazione.
Anche la secrezione pancreatica, studiata nell'uomo portatore di fistola pancreatica esterna, verrebbe inibita, secondo Howard, James e Evans
(113), dall’iniezione intramuscolare di efedrina alla dose di 45 mg, nella misura del 15%.
Sul sistema nervoso centrale l’efedrina agisce con un effetto analettico sui centri superiori cerebrali; essa stimola i centri midollari e vasomotori ed anche i riflessi spinali e i centri motori vengono eccitati.
Risultati di ricerche eseguite da Kiessig e Orzechowski (114), dimostrano che l'efedrina, come pure altre amine ad azione simpaticolitica, sono dotate di azione analgesica e che sono capaci di elevare la soglia della sensibilità dolorifica negli animali da esperimento (cani).
Completiamo questo capitolo ricordando le seguenti altre azioni attribuite dai diversi AA. all’efedrina.
Analogamente a quanto fu notato per altre sostanze simpaticomimetiche, quali l'adrenalina e l'anfetamina, anche l'efedrina sarebbe dotata, secondo Szòke (115), di un’azione stimolante la fagocitosi.
L’azione stimolante sul sistema ipofisario-corticosurrenalico di cui risulta dotata l’adrenalina [Long e Fry, Vogt, Speirs e Meyer (116)], può essere ottenuta, secondo Abelson e Moyes (117), anche con efedrina somministrata per os, alla dose di g 0,06.
Ricerche condotte da Drescher e Zetler (118-119) su rospi e topi maschi, dimostrarono che l’efedrina è dotata di un’azione sensibilizzante delle gonadi all’ormone gonadotropo.
Ripetute somministrazioni di efedrina nei cani, determinerebbero, secondo Levshunova (120), un blocco dei riflessi motori condizionati a dosi elevate, oppure un aumento a dosi più deboli.
Laubender e Presser (121) che studiarono sul coniglio l’azione iperglicemizzante dell'adrenalina e di alcune altre sostanze adrenalinosimili, fra le quali l'efedrina, trovarono che anche questa è dotata di una debole azione iperglicemizzante.
Enenkel e Pedal (122) osservarono che animali (conigli) immunizzati contro la difterite e trattati 8 ore dopo l’immunizzazione con tre iniezioni di efedrina, dimostrarono dopo 14-32 giorni dall’immunizzazione un marcato aumento del titolo dell'antitossina in confronto con gli animali non trattati e con differenze statisticamente significative.
Tsukumo Sato (123) osservò che l'iniezione intramuscolare di efedrina nel ratto, alla dose di 2 mg/kg aumenta il consumo di ossigeno e remissione dell'anidride carbonica entro la prima ora, aumento cui segue una diminuzioiie dopo 3 ore. Il quoziente respiratorio prima diminuisce poi aumenta e la temperatura corporea è temporaneamente aumentata.
La sensibilità visiva dopo 15-20' di adattamento all'oscurità sarebbe, secondo Granger (124), migliorata dall’efedrina.
Sul muscolo radiale dell'iride l’efedrina, sia per applicazione locale che per somministrazione orale o parenterale, determina midriasi. La pressione endoculare non viene elevata e tanto i riflessi alla luce quanto l’accomodazione, non vengono alterati e ciò è dovuto al fatto che il muscolo ciliare non viene paralizzato.
Sulla muscolatura scheletrica l’efedrina agisce aumentando il tono di contrazione. Tanto l'efedrina quanto le altre sostanze ad azione simpaticomimetica, migliorano la trasmissione neuromuscolare, anche se depressa dal curaro ed aumentano la risposta alla tensione, sia nei muscoli normali che in quelli affaticati o denervati [Burn (125)].
Sui gangli autonomi l'efedrina determina invece una depressione della trasmissione [Marrazzi (126)].
Assorbimento ed eliminazione
Somministrata per os l'efedrina viene completamente assorbita nel tratto intestinale e passa rapidamente in circolo. Somministrata per via parenterale (sottocutanea, intramuscolare) viene assorbita più rapidamente dell'adrenalina. L'assorbimento rettale è più lento che per via sottocutanea ma l'azione è più prolungata [Giroux (127)].
Essa non subisce alterazioni a contatto dei succhi digestivi, non è alterata dalla aminossidasi e dalla fenolossidasi, nè durante il suo passaggio attraverso il fegato.
Nell'uomo l'efedrina viene eliminata come tale, attraverso l’emuntorio renale, nelle proporzioni del 60-70% entro le prime 12 ore e di circa il 100% dopo 24 ore [Ricther. (128)].
Le indicazioni terapeutiche dell'efedrina sono piuttosto numerose e interessano diversi campi della terapia.
In sostituzione dell'adrenalina l'efedrina viene frequentemente usata per ottenere un'azione più prolungata ed anche perchè può essere utilmente somministrata per os.
Buoni risultati si ottengono negli stati ipotensivi cronici e specialmente nell'ipotensione posturale. Nella debolezza vasomotoria acuta e cronica l'efedrina è stata vantaggiosamente impiegata dal Becker (129) in associazione con teofillina e dietanolamina.
Nell’anestesia spinale l’efedrina può essere impiegata per prevenire una eventuale caduta della pressione arteriosa e per mantenere il suo livello entro i limiti fisiologici.
Buoni risultati si ottengono anche nel blocco cardiaco completo e nella sindrome di Adams-Stokes, con efedrina somministrata alla dose di 15-30 mg al giorno. E' possibile ottenere con ciò un aumento della velocità ventricolare e la prevenzione della bradicardia e dell’asistolia, dovute a temporaneo arresto cardiaco. L’efedrina è però controindicata nei casi in cui l'attacco di sincope è dovuto ad un accesso transitorio di prefibrillazione ventricolare [Goodman e Gilman (130)].
Il Pierron (131) riferì di aver ottenuto la guarigione in due casi di blocco auricolo-ventricolare dopo un trattamento prolungato con efedrina somministrata a dosi elevate.
Vasto impiego trova l'efedrina nel trattamento sintomatico delle malattie allergiche; nell’asma bronchiale [Gerrits (132), Gross (133) ed altri] o nella febbre da fieno, casi nei quali può essere somministrata alla dose di 20-50 mg per os o per via sottocutanea, come rimedio preventivo e curativo, sola od associata ad aminofillina o ad antistaminici.
Alcuni malati possono presentare una certa resistenza all’azione della efedrina; in questi casi la dose può essere aumentata senza danno, secondo Herxheimer (134), da g 0,05-0,06 a 0,13-0,195 e poiché i malati si assuefanno rapidamente all’efedrina, la dose dovrà essere ulteriormente aumentata già dopo pochi giorni, ma dopo breve interruzione si ristabilisce la primitiva sensibilità.
Nella miastenia grave, l’effetto dell’efedrina, pur essendo inferiore a quello della neostigmina, può trovare un utile impiego, sia sola che associata alla neostigmina stessa, alla dose di 10-20 mg, due o tre volte al giorno.
Nella narcolepsi è impiegata con buoni risultati alla dose di 10-15 mg o più, per os 3 volte al giorno.
Nel reumatismo articolare e nell'artrite reumatica, per la sua azione ipofisaria-corticosurrenalica di cui si è già detto, l’efedrina può a volte agire favorevolmente ma, secondo Redmond (135), ciò si verifica soltanto nei casi in cui si può constatare un effetto favorevole entro le prime 24 ore dopo la somministrazione di una dose iniziale di almeno g 0,09.
Secondo Jaquet e coll. (136), l’efedrina somministrata a dosi piuttosto elevate (g 0,02, 4 volte al giorno) e per un periodo sufficientemente lungo, può agire favorevolmente nella pancreatite acuta, non solo diminuendo la sintomatologia dolorosa, ma determinando in alcuni casi, un effetto curativo vero e proprio. Nello stesso senso depongono le osservazioni cliniche di Desjaques (137).
Negli stati dispnoici Binet e Strumza (138) trovano che l'efedrina è più attiva della canfora, della caffeina, della lobelina ed anche della benzedrina.
L'efedrina può essere utilmente impiegata nel «piccolo male» specialmente in quei casi in cui il trattamento con trimetadione è rimasto senza effetto. Buoni risultati si ottengono anche in molti casi di epilessia e il Tripi (139) ne confermò l'attività somministrandola per os alla dose iniziale di g 0,05 al giorno ed aumentando la dose di g 0,05 ogni 4 giorni, sino a raggiungere la dose di g 0,15. Nella prima fase del trattamento l'A. constatò un aumento del numero degli accessi. Dopo 40-60 giorni diminuirono sino alla totale scomparsa, con contemporaneo miglioramento dello stato fisico e psichico dei pazienti. L’uso dei barbiturici durante la prima fase del trattamento influenzerebbe sfavorevolmente, secondo l’A., l'esito della terapia.
Nei casi in cui contemporaneamente all'epilessia esistano altre affezioni (lue, tubercolosi, nefropatie, alterazioni endocrine o cerebrali) l'efedrina può determinare un aumento del numero degli accessi. Anche nei casi di oliguria, il trattamento con efedrina, può risultare più dannoso che utile.
L’efedrina, come altre sostanze simpaticomimetiche, è giudicata un farmaco prezioso per combattere le lesioni tossiche del cuore prodotte da infezione difterica [Schoenemann (140)] e gli effetti depressori dei veleni del sistema nervoso centrale (morf
Nei disturbi della minzione (stranguria, frequenza e urgenza della minzione) e in particolare nell'enuresi notturna, l’efedrina può agire sintomaticamente elevando il tono dello sfintere vescicale. Nell’enuresi notturna essenziale infantile, l'efedrina in associazione con belladonna, alfa-tocoferolo e vitamina B1, è stata impiegata con successo da Sacino (141).
In associazione con codeina, l'efedrina (o l'efetonina) si è dimostrata molto utile come sedativo della tosse tormentosa con scarso espettorato, nel corso di broncopolmoniti [Coglia (142)].
Per applicazione locale l’efedrina trova impiego nella corizza acuta e nella rinite vasomotoria.
Come midriatico l’efedrina è impiegata in soluzione al 3-5% per facilitare l'esame del fondo dell'occhio, sola od associata all'omatropina allo 0,1%. Soluzioni a concentrazioni più elevate di efedrina possono produrre irritazione. Nelle iridi di colore scuro, come pure nei casi di irite o di iridociclite, l'efedrina può essere inattiva sotto questo aspetto.
Tossicologia – La tossicità dell'efedrina non è elevata e non sono noti casi di intossicazione letali dovuti a questa sostanza. Dosi superiori alle terapeutiche o anche dosi normali in soggetti particolarmente sensibili, possono tuttavia determinare una sintomatologia caratterizzata da eccitazione nervosa, insonnia, vertigini, tremori, stato ansioso, tachicardia o aritmie cardiache, sudorazione, anoressia, nausea o vomito, sintomatologia questa, la cui gravità è proporzionale alla dose e alla sensibilità individuale.
Dosi molto elevate, stimolano il centro respiratorio e, negli animali, fenomeni convulsivi che si manifestano anche dopo decerebrazione o cocainizzazione.
Gli effetti dovuti ad eccitazione nervosa sono, di solito, bene antagonizzati dai barbiturici, l'associazione dei quali si è dimostrata utile anche nei casi in cui il trattamento prolungato con dosi terapeutiche, determina nervosismo, insonnia e stato ansioso.
L'impiego dell'efedrina esige una certa cautela nei soggetti affetti da disturbi cardiovascolari e in quelli sottoposti a trattamento digitalico.
Somministrazione e dosi – L'efedrina viene somministrata di preferenza per os a dosi che negli adulti variano da 15 a 50 mg o a queste inferiori nei trattamenti prolungati.
Per via sottocutanea o intramuscolare, si impiegano in generale le stesse dosi. La somministrazione endovenosa è meno seguita e deve essere praticata con le necessarie cautele.
Topicamente, per applicazione sulle mucose (nasali, in particolare) come decongestionante, l'efedrina si usa in soluzione acquosa o oleosa allo 0,5-2 %. Per collirio (per ottenere un'azione midriatica) in soluzione al 3-5%.
Sotto forma di supposte l’efedrina può essere impiegata anche per via rettale, alle stesse dosi che per via orale [Giroux (127)].
Estratti e preparati vari
Estratto fluido (Titolo chimico 0.4% alcaloidi) (g 1 = XL gtt).
Dosi: g 3-5 sino a g 20 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido efedra…………………………………………… g 20
Alcool di 25°………………………………………………… g 80
(a cucchiaini)
Sciroppo
Estratto fluido efedra……………………………………. g 5
Sciroppo semplice F.U. . ……………………………. . g 95
(a cucchiai)
Sciroppo balsamico espettorante
Estratto fluido enula campana …………………….. g 10
Estratto fluido efedra……………………………………. g 5
Estratto fluido balsamo tolù………………………….. g 5
Estratto fluido arancio alcoolidrosolubile……… g 1
Sciroppo semplice e acqua q. b. a……………….. g 100
(a cucchiai)
Pozioni calmanti nell'asma
Estratto fluido lobelia
Estratto fluido giusquiamo
Estratto fluido efedra ana g 10
Potassio bromuro………………………………………… g 5
Sciroppo diacodio …………………………………… g 40
Acqua e sciroppo q. b. a………………………………. g 225
(un cucchiaino ogni 3-4 ore)
Efedrina o efetonina
Codeina fosfato ana g 0,10
Liquore anisato di ammonio……….. g 2
Sciroppo di altea………………………………………. g 30
Sciroppo di poligala g 150
[1 cucchiaio ogni 2 h nella tosse con scarso espettorato e nel corso di broncopolmoniti (Coglia)].
BIBLIOGRAFIA
(1) NAGAI N.. PHarm. Ztg., 32, 700, 1887 – <2) MERCK E., Jahresber., 1. 1888 – <3) MERCK E.. Jahresber^ 13, 1893 – (4) NAGAI N, /. Pharm. Soc. Japan, 120, 109, 1892; I2I, 181, 1892; 127, 832. 1892; 130, 1186, 1892; 239, 901, 1893; 329, 729, 1909; Chem. Ztg., 24, 441, 1900; /. Chem. Soc. Japan, 32, 426, 1911; 34, 437, 1913; J. Pharm. Soc. Japan, 559, 845, 1918; Lleb. Ann., 470, 157, 1929 – <5) MILLER E. R.. Arch. Pharm., 240, 481, 1902 – (6) SCHMIDT e coli„ Arch. Pharm., 243, 73, 1905; 244, 239, 1906; 246, 210, 1908: 247, 141, 1909; Apoth. Z., 25, 677, 1910; Arch. Pharm., 249, 305, 1911; Apoth. Z., 26, 368. 1911; Arch Pharm., 250, 154, 1912; 250, 141, 1912; Apoth. Z., 28, 667, 1913; Arch. Pharm., 251, 320, 1913; 252, 89, 1914; 253, 52, 1915 – <7) EMDE H. e colL Arch. Pharm., 244, 241, 1906; 244, 269, 1906; 245, 662, 1907; 247, 54, 1909; 247, 130, 1909; 249, 37L 1911; Festschr. 'Deut, Apoth. Vereins, Braunschwelg, v. H. Beckurts, 85, 1910; NWv. Chtm. Acta, 12, 365, 1929; 12, 377, 1929; 12, 384, 1929; 12, 399, 1929; 13, 3, 1930; Pharm. Ztg., 74, 1570,1929; Apoth. Z., 44, 1605, 1929; Arch. Pharm., 268, 83, 1930 – (8) FOURNEAU E, e coll., J, pharm. chim., 20, 481, 1904; 25, 593, 1907; Anales soc, cspaH. fis. y quìm., 20, 394, 1922; Buil. soc. chlm., 35, 614, 1924; AnaUs soc. cspah. |lr. y quìin., 23, 450, 1925; Butt. soc. chim., 43, 1232, 1928; Aruitcs soc, espaSx. fis. y quìm., 27, 500, 1929; Buil. joc. chim. Frans., 47, 72. 1930; 47.'894, 1930; 12, 985, 1945 – (9) RABE P., Ber., 44, 824, 1911 – (10) OGATA, J. Pharm. Soc. Japan, 451, 751, 1919 –
(II) FREUDENBERG K. e coti.. Ber., 57, 1547, 1924; J. Am. Chem. Soc., 54, 234, 1932; Btochem. Zettschr.. 245, 238, 1932; Ueb. Ann., 510, 223, 1934 – (12) LEITHE W., Ber., 64, 2827, 1931; 65, 660. 1932; Oesterr. Chem, Ztg., 35, 133, 1932 – (13) SPÀTH E. e GÒHRING R„ Monatsh., 41, 319, 1920 – (14) SPÀTH E., Ber., 58. 197, 1925 – (15) SMITH S., J. Chem. Soc., 2056. 1927 – (16) SMITH S., J. Chem. Soc., 51, 1928 – (17) NAGAI N. e KANAO S., J. Pharm, Soc. Japan, 48, 845, 1928 – (18) KANAO S„ Ber., 63, 95, 1930 – (19) CHEN A. L., STUART E. H. e CHEN K. K.. J.A.Ph.A., 20, 339, 1931 – QO) CHOU T. Q. e CHU J. H., Chinese J. PhysioL, 8, 161, 1934 – (21) WOLFES O., Arch. Pharm., 268, 327, 1930 – (22) LA FLO- RESTA A., Arch, farmacoì. sper., 68, 66, 1939 – (23) LA FLORESTA A., Arch. farmacoL sper., 69, 41, 1940 – (24) CARBONI S., Ricerca Seleni., 11. 754, 1940 – aS) CARBONI S., Ann. Chtm. Appi., 31, 278, 1941; 31, 281, 1941 – (26) CARBONI S., Ann, Chim. Appi.. 31, 457, 1941 – (27) MULAS M. e SALIS E., Arch. Ist. bioch. Ital, 11, 315, 1939 – (28) ALBERTI C.. Boll. chim. farm., 78, 477, 1939 – (29) SIMON I„ Rlv. Ital, ess. prof., 24. 66, 1942 – (30) CASTOLDI, Boll. chim. farm., 91, 431, 1952 – (31) READ B. E. e FENG C. T., J.A.Ph.A,, 17, 1189, 1928 – (32) CHOPRA R. N, GHOSH S. e DUTT A. T., Indlan J. Med. Research., 15. 889, 1928 – (33) CHOPRA R. N. e DUTT T. A., Indian J. Med. Research,, 17, 647, 1930 – (34) OHOSE T. P. e KRISHNA S., Arch. Pharm., 268, 636, 1930; J. Indlan Chem. Soc. Ind. A News Ed., 6, 142, 1943 – (35) CHOPRA R. N., KRISHNA S. e GHOSE T. P, Indlan J. Med. Research., 19, 107, 1931 – (36) QUAZILBASH N. A., Quart. J. Pharm. Pharmacol., 21, 475, 1948 – (37) CLARK G. W. e GROFF
G. W., Proc. Soc. Expll. Blol. Med., 24. 325, 1927 – (38) NIELSEN C„ MeCAUSLAND H. e SPRUTH
H. C., J.A.Ph.A., 16. 288, 1927 – (39) TERRY R. E., J.A.Ph.A., 16, 397, 1927 – (40) GROFF G. W. e CLARK G. W., Vntv. Cali/. (Berkeley) Pubts. Botany, 14, 247, 1928 – (41) READ B. E. e FENG C. T.. Proc. Soc. Exptl. Biol, Med., 24. 819, 1927 – (42) NIELSEN C. e MeCAUSLAND H., J.A.Ph.A.. 17, 427, 1928 – (43) BEASLEY J. L. e HARRIS L. E., J.A.Ph.A., 31. 171, 1942 – (44) CHAVEZ A. S. R., Boi. Soc. Qulm. Perù, 3. 198, 1937 – (45) BLACK O. F. e KELLY J. W., Am. J. Pharm., 99, 748, 1927 – (46) PERON- NET M. e CHATIN J.. J. Pharm. chtm.. 2, 19, 1942 – (47) MASSAGETOV P. S, Farmatslya i FarmakoL, 1938, n. 6, 17 â– (48) READ B- E. e LIU J. C., J.A.Ph.A„ 17, 339, 1928 – (49) CHOPRA R. N. e DUTT A. T., Indlan. J. Med. Research., 17, 647. 1930 – (50) LE BLANC F. e HUME A. N., S. Dakota Agr. Expt. Sta. Ann. Rep„ 1938, 40, 1939 – (51) FENG C. T. e READ B. E, Chlncse J. Phystol., 2, 337, 1928 – (52) GHOSE T. P. e KRISHNA S., Arch. Pharm , 268, 636, 1930 – (53) FENG C. T. e READ B. E., Pharm. J., 119, 356, 1927 – (54) HEYDEN A. A. e JORDAN C. B., J.A.Ph.A., 22, 616, 1933 – (55) TOYO HIKO KAWATANI e coU,, Yàkugaku Zasshl (Giappone), 79, 392, 1959; Chem. Abs., 53, 15480d, 1959 – (56) SPEHR, Dissert. Dorpat. 1890; Pharm. Ztg. Russland. 31, 65, 1892 – (57) BERTRAND, Compì. Rend., 129, 1025, 1899 – (58) ALYUKINA L. S„ izvest. Akad. Nauk Kazakh. S.S.R., Ser. Blol., n. 9, 55-64, 1955; Chem. Abs., 49. 1572Ih, 1955 – (59) MASUCCI e SOTA, J.A.PhA.. 15, 748, 1926 – (60) WILLIAMS, J.A.Ph.A., 17, 430, 1928 – (61) SCHOETZOW e NEEDHAM, J.APh.A., 15, 1070, 1926 – (62) CHOPRA R. N.. KRISHNA S. e GHOSE T. P., Indlan. J. Med. Research. 10, 177, 1931 – (63) GOODMAN L. S. e GILMAN A, The Pharmacological Basls of Therapeutlcs li ed. Macmillan Comp. New York 1955, p. 505 – (64) OSOL A., FARRAR G. E. e coli., The Dispensatory o( (he U.S.A. 25* ed„ Llpplncot Comp. Phlladelfia>Montreal 1955, p. 500 – (65) CHEN, Proc. Soc. Exptl. Biol. Med., 22, 203, 1924 – (66) CHEN e . SCHMIDT. /. Pharmacol. Exp. Ther., 23, 1924 – (67) CHEN e SCHMIDT. tbid., 24, 339-357, 1924 – (68) CHEN e SCHMIDT, Proc. Soc. Exptl. Biol. Med., 21, 351. 1924 – (69) CHEN. Ibtd., 22, 570, 1925 – (70) CHEN, ibtd., 22, 568, 1925 – (71) CHEN, ibld., 22, 404, 1925 – (72) CHEN. J.A.Ph.A., n. 3. 1925 – (73) CHEN. J. Pharmacol. Exp. Ther., 28, 83, 1925 – (74) CHEN. Sclen. News Lettres. 8, n. 253, 1926 – ^ (75) CHEN. J. Pharmacol. Exp. Ther., 27, 87, 1926 – (76) CHEN. ibtd., 27, 77-86. 1926 – (77) CHEN. tbld., 27, 61, 1926 – (78) CHEN, ibid., 27, L 1926 – (79) CHEN e MEEK, Ibid., 28, 31. 1926 – (80) CHEN e MEEK, Ibtd., 28, 59, 1926 – (81) CHEN, CHANG-KEN WU e HENRIKSEN, ibid., 27, 61. 1926 – (82) HAMMOND PK J.A.Ph.A., sci. ed.. 47. 67, 1958 – (83) HAMMOND Ph.. V„ ibtd.. 48, 10, 602-605.
1959 – (84) MIURA, Kiìtt. Woch^ BtrUn. 24, 707. 1887 – (85) PENNETTI G., Riforma Mtd., 187, 1928 – (86) CHEN, SCHMIDT c MEEK, cit. da BOYER c LEVY in fluii, sci. pharm.. 35. 421, 1928 – (87) NAGEL A, Arch. exp. Fath, u. Pharmakoì., 110, 129, 1925 – (88) CHEN, J. Fharmacol. E^,p. Ther., 28, 219, 1928 – (89) CHEN, cit. da BOYER e LEVY 1 c. (86) – W LAUNOY e NICOLLE, C. R. Soc. Btot., 99. 198, 1928 – (91) SCHUMANN, Arch. exp. Parli, u, Pharmakoì., 138, 208, 1928 – (92) SILVA V., Rev. Soc. Argentina, 29. 277, 1953 – (93) BENIGNI R., Arch. Fisiologia, 29, 3, 326-355, 1930 – (94) PEPEU O., MASI R. e GIOITI A., Arch. Interri, pharmacodyn. et de thèr., 21. 2, 302, 1960 – (95) OUNSBURO. ÌVirchow Arch. Paih. Anat. u. Physiol., 124, 1891 (96) SOLLMANN e BARLOW, J. Pharmacol. Exp. Ther., so. 21, 1928 – (97) GRADINESCO, C. R. Soc. BioL, 96, 1027, 1927 – (98) FUJII, cit. da BOYER e LEVY
I. c. (86). – (99) RAYMOND-HAMET, C. R. Sac. Bioi, 97, 618, 1927 – (100) GRADINESCO c MARCU, ibid., 96. 27, 1927 – (101) KINNMANN c PLANT, J. Pharmacol. exp. Ther.. 31, 212, 1927 . (102) DULIÉRE, C, R. Soc. Biol., 97. 405, 1927 – (103) POLLAR c ROBITSCHER, cit. da BOYER e LEVY (86) – (104) KREITMAIR, Arch. exp. Patk u. Pharmakoì.. 120, 189, 1927 – (105) MARCU e SAVULESCU, C. R. Soc. Blol., 18, 243, 1928 – (106) TODASHI OKASAKI, Japan J. Med. Sclen. IV Pharm., 2. 9, 1930 ^ (107) REINTZ, C. R, Soc. Blol,, 98, 809. 1928 – (108) MITROFANOV A. J., Pharmakoì. I Toxtcat., 21. 24.28, 1958; Chem. Abs.. 52, 12236 a, 1958 – (109) KREITMAIR, Mùnch. Med. fVoch., n. 5. 190, 1927 – (110) DE EDS e BUIT, Proc. Soc. exptl. Biol. Med., 24, 800, 1927 – (111) HOVIG T, e NAESS K., Acta Pharmacol Toxicol, lì, 336-342, 1955 . (112) CIRNU V., 3. P. Paylov Cercetàrl NeuroU, 4, 251-265, 1959; Chem. Abs., 54, 1734 b, 1960 – (113) HOWARD J. M-, JAMES Ch. L. e EVANS Sh. S., Surg. Forum. Proc. 37 Th. Congr. Ann. Coll. Surgeons, 577-582, 1951; Chem. Abs., 50, 8(K)9 b, 1956 – (114) KIESSIG H. J. e HORZECHOWSKI G., Arch. exp. Path. u. Pharmakoì., 197, 391404, 1941 – 015) SZÒKE A. e coll., fVien. Klln. Woch., 42. 793. 1950 – (116) LONG c FRY, WOGT, SPEIRS e MEYER, cit da ABELSON e MOYES in (117) – (H?) ABELSON D. c MOYES E. N., Lancet. II, 50. 1950 – (118) DRESCHER J. e ZETLER G., Acta Endocrlnol., 18. 305-311, 1955 – (119) ZETLER G. e DRESCHER
J. , Arch. exp. Paih. u. Pharmakoì. 225. 116-117, 1955 – (120) LEVSHUNOVA N. A., Phlslol. Zhw. S.S.S.R., 40. 339-395, 1951; Chem. Abs., 49, 1964 c, 1955 – (121) LAUBENDER W. e PRESSER C.. Arznelm.-Forsch., 7, 298-330, 195 7- (122) ENENKEL H. J. c PEDAL H. W.. Arch. exp. Path. u. Pharmakoì., 226, 69-77. 1955 –
(123) TSUKUMO SATO, Nlppon Yakurlgaku Zasshl, 52. 22-40, 1956; Chem Abs., 51, 11568 f. 1957 –
(124) GRANGER G. W„ Nature, 174, 653, 1954 – (125) BURN J. H., Brlth. Med. J.. 1, 547-550. 1939 – (126) MARRAZZI A. S., J. Pharmacol. Exp. Ther., 67, 321-329, 1939 – (127) GIROUX c coU., Sckwelz. Ap. Ztg., n. 4, 672, 1949 – (128) RICHTER D-, Blochem. J., 32, 1763-1769, 1938 – (129) BECKER V.. Med. Monatschr., n. 11, 842, 1949 – (130) GOODMAN S. S. e GILMAN A., I. c., p. 514 – (131) PIERRON J., Presse Méd., n. 39. 719, 1950 – (132) GERRITS J. G„ Schweli. Med. Woch., n. 39. 948. 1949 – (133) GROSS R., N Med. Welt., n. 45. 1480, 1950 – (T34) HERXHEIMER H., Klln. Woch., n. 37-38, 600, 1947 – (135) REDMOND W-, Lancet, II, 6618, 34. 1950 – (136) JAQUET P. c coIU Presse Méd., n. lOO-lOl, 1041, 1940 – (137) DESJAQUES R., Ibld., n. 106-107, 1320, 1941 – (138) BINET E. c STRUMZA V., Wlen. Med. Woch, n. 15, 267, 1942 – (139) TRIPI G., Zbl. Neurol. u. Psychiatr., 100, 676, 1941 – (140) SCHOENE- MANN H., Mlinch. Med. Woch., n, 13. 289, 1942 – (141) SACINO G., Gatz. Med. U., aprile 1957 – (142) GOGLIA G., Rinasc, Med., 19. 1, 13, 1942.


