Enula Campana
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Inula Helenium L. – Fam. Composite) (Sin. – Corvisartia Helenium Mérat.)
Enula Campana- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Inula, nome dato dai Latini derivato forse dal greco inew o inaw = purgare, per allusione alle sue proprietà depurative.
Helenium, dal greco elenion = l’Alnus (che pare derivi dal celtico aln = vicino ai corsi d'acqua). L’Ontano alligna nei luoghi freschi e fra le canne, dove si trova l'Inula.
Secondo altri Autori da Elenh perchè la pianta, come dalla leggenda, sarebbe nata dalle lacrime di Elena (?).
Anche dal greco elenh = piccolo corbello, per la forma dell’involucro.
Corvisartia – Dedicata da F. V, Mérat a Corvisart (1775-1821) medico di Napoleone I.
Nome volgare – Erba dei dolori, Antiveleno, Leila (Tosc.).
Habitat – Europa meridionale-orientale, Balcani, Asia (introdotta nell'America settentrionale). In Italia si trova nei luoghi erbosi umidi, in tutta la Penisola sino alla Basilicata. Isola del Giglio, Sardegna. Spontanea nel Meridionale, per lo più avventizia negli altri luoghi. Coltivata.
Pianta erbacea perenne.
Parti usate – Rizomi e radici, raccolte in autunno da piante di 2-3 anni.
Componenti principali
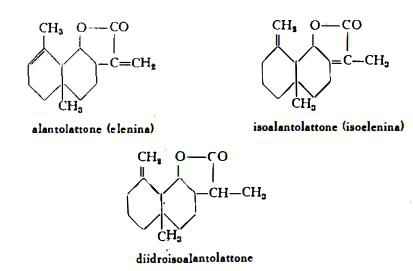
Sostanze volatili; piccole quantità di olio etereo, (alantolo) e 1-3% (1) di una sostanza cristallina (essenza di inula), costituita principalmente dai derivati sesquiterpenici alantolattone C15H20O2 (denominato elenina) (2) (3) (4) (5), isoalantolattone (isoelenina) C15H20O2 (5) (6) e diidroisoalantolattone C15H22O2 (4), i quali hanno struttura vicina a quella della santonina (4) (5) (7) (8).
Con la denominazione «elenina» (alantocanfora) è stato designato sia l’alantolattone, sia anche la miscela dei lattoni sopraindicati.
Gli studi di Hansen (4) e di Ruzicka e coll. (5) hanno messo in evidenza che gli alantolattoni isomeri hanno le formule sottosegnate.
Separando l’alantolattone dall’olio di Enula campana, Ruzicka e coll. (5) hanno notato nell’olio la presenza di un sesquiterpene monociclico, che per idrogenazione con selenio produce eudalene. Un composto liquido con fromula grezza, identica a quella dell’alantolattone e dell'isoalantolattone C15H20O2, è stato pure isolato dall’olio. Nelle frazioni ad alto punto di ebollizione dell’olio è stato trovato un composto azulenico non identificato.
Nelle radici di Enula campana si trova dal 19 % al 44 % di inulina (sinonimi: alantina, dalina, sinanterina) (C6H10O5)n (9-14).

L’inulina è un levulosano, cioè un polimero del levulosio, ad alto peso molecolare (da 3000 a 5000), nel quale il levulosio si trova nella forma furanica (9 – 14a).
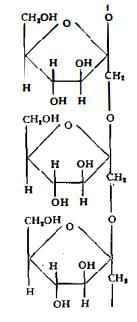
Per idrolisi con acqua a 165° l’inulina fornisce prodotti idrolitici intermedi, levogiri, analoghi alle destrine e designati con i nomi di piroinulina, levulina, metinulina. Per idrolisi spinta con acidi, si giunge rapidamente al levulosio puro. Tra i fermenti, il solo veramente attivo per idrolizzare l’inulina è l’inulasi, che si trova in certi funghi.
I poliosi indicati in letteratura con i nomi di pseudoinulina, inulenina, eliantenina e sinantrina, secondo Pringsheim e coll. (10) (13) (16), sono da considerarsi prodotti di decomposizione fermentativa dell’inulina.
Nella frazione volatile delle radici di Inula Helenium è stata rilevata la presenza di sostanze antibatteriche («fitoncidi»), di cui non è stata chiarita la natura chimica (18a).
Nelle foglie di Enula campana è stato trovato un principio amaro, alantopicrina, di formula grezza C17H23O3OH, dotato di proprietà antielmintiche (15) e vitamina C da mg 28 a mg 37% nella droga fresca, pari a mg 103-229 % nella droga secca (18b).
Proprietà farmacologiche ed impiego terapeutico
L'Enula campana era nota a Ippocrate e a Dioscoride dai quali era impiegata come emmenagogo, come bechico e come diuretico. In seguito furono attribuite a questa droga molte altre proprietà terapeutiche che non vennero però confermate dalle successive ricerche farmacologiche e cliniche, in base alle quali oggi possono essere riconosciute all’Enula campana le seguenti azioni; bechica e modificatrice della secrezione bronchiale, colagoga e coleretica, diuretica, batteriostatica, antifermentativa e antielmintica.
a) L'azione bechica e modificatrice della secrezione bronchiale come le altre suddette azioni, sembra essere dovuta all'alantolattone o elenina, alla quale il Korab (19) attribuì, non solo una notevole azione calmante della tosse, ma anche una spiccata attività contro il B. di Rock, utile nel trattamento della tubercolosi. Tale attività venne in seguito negata dall’Audignon (20), ma secondo il Renon (21), anche indipendentemente dall’esistenza o meno, di una tale azione specifica, l’elenina può essere ugualmente utile in questi malati come ottimo calmante della tosse e come, modificatore della secrezione bronchiale, ove la si somministri alla dose di g 0,05-0,10 e senza oltrepassare i g 0,20.
La droga può essere utilmente impiegata, secondo Leclerc (22), in infusione al 5 %, sotto forma di estratto fluido o di tintura, nei casi di bronchite catarrale con tosse ed abbondante espettorazione.
b) L'azione coleretica e colagoga fu studiata dal Malecek (23) il quale considera la radice di Enula campana come un ottimo medicamento coleretico e colagogo. Secondo questo A., dopo 15’ dalla somministrazione della polvere di questa droga, si manifesta una forte secrezione biliare che perdura senza interruzione per un periodo di 4 ore, Chabrol, Charonnat, Maximin e Waitz (24) e, successivamente Chevalier (25), dimostrarono che tale azione è dovuta all’elenina. Quest’ultimo A., ripetendo le esperienze di Chabrol e coll., potè constatare come la secrezione biliare può più che raddoppiare durante le tre ore successive all’iniezione endovenosa di g 0,05/Kg di elenina.
Chabrol attribuisce l’azione colagoga dell’elenina soprattutto al nucleo naftilico, ma secondo Chevalier, anche la funzione betonica dovrebbe avere una non trascurabile importanza. Questo A. trova interessante raffrontare l'azione dell'elenina a quella della santonina che presenta una costituzione chimica simile e che agisce ugualmente sull’attività renale, epatica e come antielmintico, ma in maniera diversa sul sistema nervoso.
c) Azione diuretica – Chevalier (25) ha studiato l’azione dell’elenina sulla secrezione urinaria del coniglio e del cane e trovò che essa è dotata di un’attività che si manifesta aumentando l’escrezione sia dell’acqua che dei cloruri e dell’urea.
L’iniezione intraperitoneale di una soluzione oleosa di elenina alla dose di g 0,05/Kg nel coniglio adulto, ha determinato un aumento dell’80 % del volume delle urine, nei tre giorni successivi all’iniezione, nelle quali l’urea era aumentata del 40 % e i cloruri del 30 % circa.
Analogamente, nel cane, l’elenina iniettata lentamente endovena, alla dose di g 0,10/Kg, non provoca fenomeni tossici persistenti e determina un aumento della diuresi del 60 %, dell’urea del 32 % e dei cloruri del 43 %.
Le urine secrete sotto l’azione dell’elenina possono essere conservate senza l'aggiunta di antisettici; in esse l’elenina è contenuta immodilicata e può essere estratta con cloroformio in mezzo acido. Secondo l’opinione di alcuni AA. francesi citati da Chevalier (Gilbert, Carnot, ,Huchard, Linossier, Robin) in molti artritici, gottosi e uremici, l’insuflicienza renale sarebbe spesso accompagnata da un certo grado di insufficienza epatica ed è anche in considerazione di ciò che Chevalier attribuisce molta importanza alla doppia azione coleretica e diuretica, dell’Enula campana che egli annovera fra le droghe ad azione epato-renale.
Richard, Westfalle e Bott.(26), Shammon e Smith (27) ed altri, osservarono che l’inulina, altra sostanza contenuta nell’Enula campana e in percentuale piuttosto elevata, somministrata parenteralmente, viene escreta esclusivamente e totalmente, dai glomeruli renali.
Questa osservazione condusse allo studio di un «inulin-clearance-test» che venne impiegato per lo studio della funzionalità glomerulare nel rene sano e malato e per lo studio del meccanismo d’azione di diverse droghe diuretiche.
Hueper (28) trovò che l’iniezione endovena di forti dosi di inulina in soluzione fisiologica nel cane, determinano uno stato idremico che perdura per 20 ore dopo l’iniezione e che può divenire permanente ove le iniezioni vengano praticate quotidianamente per un periodo superiore ai due mesi. L’A. notò che solo in uno dei 4 cani in esperimento, i tubuli renali mostrarono residui di inulina che provocarono una reazione da sostanza estranea.
Nel sangue degli animali trattati non erano evidenti risposte collododasiche o fenomeni da accumulo nelle pareti vascolari e negli organi interni di nessuno dei cani trattati.
Le iniezioni endovenose di inulina in soluzione sterile e priva di pirogeni, ripetute quotidianamente e protratte per un periodo superiore ai due mesi, non determinarono inconvenienti gravi nel sangue e negli organi interni degli animali trattati.
d) L'azione batteriostatica dell’elenina venne confermata da Korab (19) che la trovò attiva come batteriostatico e battericida alla diluizione di 1:10000. ObioI (29) ne constatò l'attività contro il bacillo della difterite e Bokenham (30) contro il B. di Kock alla diluizione di 1:10000.
Sembra che l'elenina impiegata da questi AA. fosse costituita da una miscela di sostanze e non da un prodotto puro, tanto che il Bokenham avendo constatato una certa variabilità di azione, tentò di purificarla e ottenne così una sostanza che chiamò elenina senza darne però le caratteristiche chimiche.
Più recentemente Io studio dell’elenina fu ripreso sotto questo aspetto, dal Mose (31) il quale confermò che essa è dotata di una notevole attività antibiotica, capace di completare e rinforzare quella relativa all’olio etereo contenuto nell’EnuIa campana stessa.
e) L'azione antielmintica dell’elenina e dei suoi isomeri è stata studiata da diversi Autori giapponesi [Babasaki (32), Kariyone e Ohkura (33), Saku Ozeki, Munio Kotake e Kio Hayashi (34), Tinsyo Go (35)] i quali sono concordi nell’ammettere che le suddette sostanze sono dotate di un’attività antielmintica che, per intensità, può essere comparata con quella della santonina, della quale tuttavia, sarebbero meno tossiche. Saku Ozeki e coll, somministrarono elenina a bambini da 7 a 14 anni a dosi variabili da 9 a 200 mg con buoni risultati. A queste dosi l’elenina si sarebbe dimostrata ugualmente attiva e meno tossica della santonina e dell’ascaridolo.
Tinsyo Go ha potuto constatare che la droga coreana contiene gli stessi principi attivi di quella europea e precisamente, alantolattone, isoalantolattone e diidroisoalantolattone. L’alantolattone sarebbe, secondo l’A., il principio più attivo. Dosi tossiche di queste sostanze provocano nel coniglio e nel topo, dispnea e paralisi.
Soluzioni diluite di diidroisoalantolattone, ma non di isoalantolattone, manifestano azione inotropa positiva sul cuore isolato di rana; a concentrazioni elevate, tutte e tre le sostanze esercitano azione depressiva. Tutte inibiscono i movimenti dell’intestino isolato di coniglio e tutte aumentano l’attività motoria del muscolo di lombrico. L’alantolattone e l’isoalantolattone eccitano dapprima i movimenti della tenia del cane, poi la paralizzano e l’uccidono.
Tutte e tre le sostanze sono dotate di proprietà antielmintiche nel gatto, allorché vengano somministrate a dosi superiori ai 5 mg/Kg.
f) Assorbimento ed eliminazione – L’elenina è facilmente assorbita, relativamente alla sua scarsa solubilità e viene di solito somministrata in cachets, pillole, compresse ecc. La sua eliminazione avviene in piccola parte attraverso la mucosa polmonare e per la maggior parte con la bile e con le urine nelle quali la si può ritrovare in parte inalterata e in parte sotto forma di alantato di sodio. Secondo Chevalier è appunto a questa eliminazione che si deve attribuire l’azione terapeutica delle preparazioni di Enula campana nelle diverse forme di cistiti, per le quali tali preparazioni venivano in passato prescritte.
g) Tossicologia – Sperimentata sugli animali da laboratorio l’elenina dimostra di essere dotata di una tossicità relativamente bassa che si manifesta determinando un’azione paralizzante bulbo-midollare dopo un breve periodo iniziale di eccitazione.
L’iniezione endoperitoneale, di una soluzione oleosa di elenina, alla dose di g 0,12/Kg determina nella cavia, dopo qualche minuto, agitazione, dispnea, salivazione, poi sonnolenza con respirazione irregolare, paralisi e morte per asfissia.
Nel coniglio e nel cane le dosi di g 0,27-0,75/Kg di elenina per via endovenosa, provocano immediatamente fenomeni di shock, dispnea intensa con scosse convulsive, midriasi, salivazione, diuresi e vomito. In un secondo tempo sopraggiunge una specie di torpore interrotto da qualche contrazione convulsiva. Se la dose non è mortale, l'animale si ristabilisce rapidamente; nel caso contrario, la paralisi si accentua e l'animale muore per arresto respiratorio e in completa risoluzione muscolare. All'autopsia si constata una congestione generale degli organi ed emorragie sottopleuriche e del parenchima polmonare.
Il cuore isolato di coniglio perfuso con soluzioni di elenina in liquido di Tyrode, reagisce inizialmente con un rallentamento ed un aumento della energia delle contrazioni, poi appaiono delle sistoli incomplete, diminuzione dell'energia di contrazione e arresto in semisistole.
Negli animali cloralosati i fenomeni circolatori sono in relazione con le turbe respiratorie e da queste mascherati. Con dosi deboli, dopo la cessazione delle turbe respiratorie si nota un abbassamento persistente della pressione, dovuto ad una vasodilatazione periferica e non alla diminuzione dell'energia delle contrazioni cardiache che non appare sensibilmente modificata (Chevalier).
h) Azione terapeutica – Secondo Decaux (36) l'Enula campana deve essere considerata, non soltanto come un amaro stomachico, ma come un prezioso medicamento bechico, colagogo, diuretico e antielmintico. L'impiego terapeutico dell'elenina sarebbe subordinato, secondo questo A., alla possibilità di ottenere una purificazione tale da diminuire il suo sapore amaro e l'effetto nauseante. Questi inconvenienti che potrebbero limitarne l'uso, possono essere però completamente eliminati, oltre che con la purificazione, anche ricorrendo alla somministrazione in compresse cheratinizzate.
Chevalier ritiene che l'elenina può trovare un interessante impiego in quei casi ove occorra agire contemporaneamente sul fegato e sul rene e quindi nelle colecistiti, nelle litiasi biliari e renali, nei gottosi, negli artritici, negli oligurici iperazotemici, nei casi di paludismo con oliguria, ipertrofia e congestione epatica. L'A. riferisce di aver impiegato l'elenina in un certo numero di casi, alla dose di g 0,50 in cachets che venivano somministrati due o tre volte al giorno. Questo semplice trattamento avrebbe permesso all'A. di constatare dopo qualche giorno, un miglioramento dello stato generale con diminuzione della sintomatologia dolorosa, un miglioramento funzionale del fegato e un drenaggio della colecisti. Più interessante è sembrata all'A. l’azione eccitosecretoria sul rene, azione che si manifestava obiettivamente con un aumento della diuresi acquosa, clorurata e azotata.
Estratti e preparati vari
Estratto fluido (g 1 = XXXV gtt).
Dosi; g 0.5-1 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido enula campana……………………………………. g 20
Alcool di 20°………………………………. …………………………… g 80
(g 2,5-5 pro dose)
Sciroppo
Estratto fluido enula campana………………………………….. g 5
Sciroppo semplice F.U…………………………………………….. g 95
(a cucchiaini)
Pozione
Estratto fluido enula campana………………………………….. g 15
Sciroppo codeina
Sciroppo balsamo tolù ana g 25
Sciroppo di altea……………………………………………………… g 100
(somministrare a cucchiai nelle 24 h)
BIBLIOGRAFIA
(1) GUENTHER E., The Essepttal Oils, voi. II, 1949, p. 691; voi. V, 1952, p. 453 – (2) KALLEN W., DUt. Roslock, 1875: Ber., 6, 1506, 1873 – (3) BREDT J. e POST W„ LIeb. Annoi., 285, 349, 1895 – (4) HANSEN W„ Ber., 64, 67, 943, 1904, 1931 • (5) RUZICKA L. e coll., Hetv. Chim. Acl'a,. 14, 397, 1931;. â– Ibidem., 16, 268,.3561, 1933 – (6) SPRINZ J„ Ber., 34, 775, 1901; Arch. Pharm., 239, 201, 1901 – (7) KYO- : SUKE TSUDA, 1. Am. Chem. Soc., 79, 1009, 5721, 1957: Cbem Abs., SI, 10432 c, 1957; Ibidem, 52, 5343 I, : 1958 – (8) BENESOVA V, SYKOVA V., HEROirr V. e SORM F„ Chem. Ind., 363, 1958; Chem, Abe., 52, 16410 b, 1958 • (9) KARRER, Hely. Chim. Acla, 5, 129, 1922 – (10) PRINGSHEIM e ARONOWSKY, Ber, 53, 1414, 1922 – (11) HAWORTH W. N, e LEARNER A., 1. Chem. Soc., 133, 619, 1928 • (12) IRVINE t J. C. e STEVENSON J. W„ 1. Am. Chem. Soc., 51, 2197, 1929 – (13) PRINGSHEIM H. e HENSEL W. C„ i Ber., 63, 1096, 1930; 64, 1431, 1931 – (14) IRVINE J. C. e MONTGOMERY T. N„ 1. Am. Chem. Soc., 55, i ; 1988, 1933 – (14 a) BEZZI S, Chim. Ind., 20, *282, 1938 • (15) OIZYCKI F, Arch. Pharm., 287, 57, 1954; CAem. Abs., 51, 14757 e, 1957 – (16) PRINGSHEIM H. e OHLMEYER P ., Ber., 65, 1242, 1932 – (17) DRAGENDORFF G., Maleriallen zu einer Monosraphle ties Inulins, SI. Petersburg, 1870 – (18) RUNDQ-. VIST L„ Svensk. Farm. Tldskr., 1909 – (18 a) ROSENFELD L. I. e coU.. Aplechnoe Deio, 7, 22/27, 1958; Disch. Ap. Zlt„ lOO, a. 6, p, 161, 1960 – (18 b) OUNTHER E., HEEOER E. F. e ROSENTHAL C„ Pharmazie, 7, 40, 1952 • (19) KORAB, Ismcel, I, 672, 1885 – eli. da OSOL- FARRAR in The Dlspensalory ot Ihe U.S.A. 25» ed., p. 1723, LIppIncoll Camp. Philadelphia – Monlreal 1955 – (20) AUDIGNON, Thise de Bordeaux 1895; clL da DECAUX in Rev, de Phyiolhir., 14, IOa 619422, 1950 â– (21) RENON L„ Sue. d'études seleni, sur la lubercolose, Paib 1912 – (22) LECLERC H., Pricls de Phylolhiraple p. 207, Massoq, Paris 1935 – (23) MALECEK, Brallslavsk£ lekarsici Itaty 1928,
H, 7 (Presburger Arziebliiller) cK. da Madaus In Lehrbuch d. Biologisclien Hellmltlel voi. 2, p. 1624;
G. Thieme, Lipsia 1938 • (24) CHABROL E., CHARONNAT R., MAXIMIN M. e WAITZ R., Presse Mid., n. 50, 24 giugno, 930, 1931 • (25) CHEVALIER J., Soc. de Thìrapeulique, seance 11 gennaio 1939 –
(26) RICHARD A. N., WESTFALLE B. B. e BOTT P. A., Proc. Soc. exp. Blol. Med., 32, 73, 1934 •
(27) SHAMMON e SMITH, 1. tlln. Inveri., 14, 393, 1935; vedi Edilorlale Inulln, l.A.M.A,, 129, 519, 1945 .
(28) HUEPER W. C., Arch. ot Patholoty, 40, 11, 1945 – (29) OBIOL, Lancel, aprile 1886; eli. da OSOL- FARRAR 1. c. (ved. 19) – (30) BOKENHAM, BrU. Med. ]., 2, 838, 1891; eli. da OSOL-FARRAR 1. e. (ved. 19) – (31) MÒSE, eli. da CZETSCH-LINDENWALD H. in Planla Medica, 4, 5-6, 209-218, 1956 –
(32) BABASAKl, NatasakI Itakkal ZassI, 10, 1578-1590, 1932; eli. da MADAUS l.c. (ved, 23) – (33) KARIYONE e OHKURA, 1, Pharm. Soc. Jap., 53, 248, 1933 – (34) SAXU OZEKL MUNIO KOTAKE e KIO HAYASHI, Proc. Imp. Acad., 12, 1936; Chem. Abs., 31, 1878, 1937 – (35) TINSYO OO, lap. 2, Med. Sci. IV, Pharmacol., 13, 3, 95, 1941 – (36) DECAUX F., Rev. de Phylolhér., 14, 100, 619. 1950.


