Ginestra
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Sarothamnus scoparius Koch. – Fam. LeguminoseIGenistee) (Sin. – Cytisus scoparius Lk. – Spartium scoparium L.)
Ginestra- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Sarothamnus, dal greco saros = scopa, da sarow = spazzo, pulisco e da amnos = arbusto, perche serve a fare le scope.
Cytisus, nome usato da Virgilio (Egl. 1,78), dal greco kutisos nome dell’arbusto, allusione all’origine da Cythnos (la moderna Thermia), una delle Isole Cicladi (da non confondere con Sifno) (Plinio).
scoparius, come Sarothamnus.
Spartium – Secondo alcuni Autori, dal greco spartion = fune, corda, legaccio, perchè può servire, coi suoi rami pieghevoli e tenaci, a fare dei legacci. Secondo altri, da sparus o sparum, latino = piccolo giavellotto o piccolo dardo, perchè i cauli assomigliano, in certo qual modo, a piccole frecce. Secondo altri da spartos = seminato, da speirw = spargo, diffondo, genero, quia sponte seminatur, perchè si diffonde da sè.
Nome volgare – Ginestra scopereccia, Amaracciola, Scornabecco (Tosc.), Ginestròn (Lomb.), Scopiglio (Roma), Sciuri allegru (Sic.).
Habitat – In quasi tutta Europa. Monti e brughiere (terreno siliceo). Comune in Italia nei boschi di collina e bassa montagna e nelle macchie.
Questa specie non va confusa con lo Spartium junceum L. o Ginestra di Spagna o col Cytisus Laburnum L. o Avorniello o Maggiociondolo, i cui fiori sono spesso in commercio col nome di «fiori di Ginestra».
Arbusto.
Parti usate – La pianta.
Componenti principali
Alcaloidi con struttura ad anello chinolizidinico, nucleo indicato con vari nomi; chinolizidina, norlupinano, ottaidropiridocolina, ottaidrochinolizina e l-azabiciclo(4.4.0)decano. Nelle foglie e nei rami sono stati trovati: l-sparteina (1), genisteina (2) e sarotamnina (3) (4).
La l-sparteina (lupinidina), C15H26N2, è la più comune delle tre forme, che si trovano in natura e che sono tanto la levogira e la destrogira, quanto la miscela di entrambe nella forma racemica. Isolata per la prima volta da Stenhouse (1) nel 1851 dal Sarothamnus scoparius K., essa è stata identificata alla lupinidina di Liebscher, estratta dal Lupinus luteus (5) (6). L’esatta formula grezza, C15H26N2, è stata assegnata da Stenhouse (1) e confermata dai lavori di Mills (7). Per lo studio della formula di struttura importanti ricerche sono state eseguite da Moureu e Valeur (8), i quali proposero una prima formula di costituzione simmetrica, corrispondente ad un dichinuclidinmetano, che fu poi abbandonata. Altre formule furono proposte successivamente da Winterfeld (9), da Ing (10) e da Clemo (11), tra cui quelle di Ing (I) e di Clemo e Raper (II), qui sotto indicate, sembrarono le più attendibili.
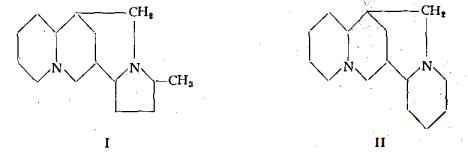
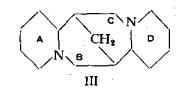
In seguito agli studi sulla sintesi della sparteina (12) (13) (14) (15) (16), che hanno condotto alla sintesi completa, operata, da Léonard e Beyler (15) (16), è stata confermata l'esatta configurazione proposta da Clemo e Raper. Pertanto la formula di costituzione della sparteina si rappresenta ora, secondo il seguente schema:
La sarotamnina, C30H50N4, isolata in origine da Valeuri (3), che assegnò a questo alcaloide la formula C15H24N2, è stata successivamente studiata da Delaby, Baronnet e Guy (4), cosicché attualmente si considera essa sia un alcaloide di tipo bisparteinico con formula grezza C30H50N4.
La l-a-isosparteina (genisteina), C15H26N2, ha la medesima formula di struttura della sparteina, essendo uno stereoisomero di questa. E’ stata ottenuta sinteticamente ed è stata trovata in natura nel Lupinus caudatus Kellogg (17). Più recentemente essa è stata identificata con la «genisteina» (18) (19), che era già stata isolata dal Cytisus scoparius L. ed alla quale era stata erroneamente assegnata la composizione C16H26N2 (3) (20) (2l).
Il contenuto di sparteina, il principale alcaloide del Sarothamnus scoparius, varia in misura notevole nel corso della vegetazione della pianta.
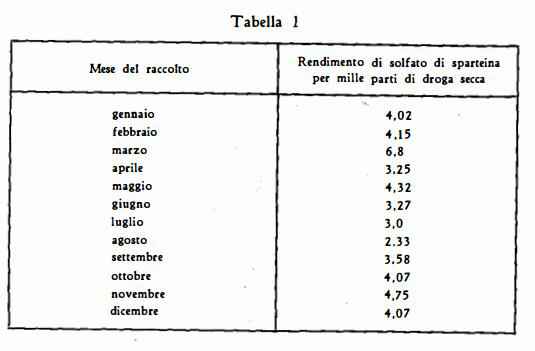
I titoli riportati in letteratura sono molto discordanti: da titoli nulli per le parti legnose sino a 8-9 %o e più nei rami verdi. Anche per quanto riguarda i valori massimi e minimi riferibili ai diversi periodi del ciclo vegetativo si sono riscontrate rilevantiti differenze (22). Chevalier (22a), notò un massimo contenuto nel mese di marzo ed un minimo in agosto, come risulta dalla seguente tabella:
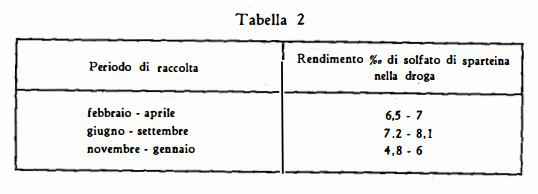
Secondo Bellavita (23), il contenuto massimo di sparteina si ha dal giugno al settembre e dal febbraio all'aprile nei rami verdi, mentre il contenuto delle parti legnose è trascurabile:
Bourcet e Dugué (24), analizzando solo i giovani rami non ancora lignificati, ottennero un titolo minimo in marzo (0,1 %) e titoli massimi di sparteina in agosto (0,9 %) , cioè immediatamente dopo la fruttificazione, ed in periodo invernale.
Jaretzky e Axer (25), controllando il titolo di tutti i rami della pianta (giovani e vecchi), trovarono due valori massimi, l'uno in maggio, l'altro nel periodo invernale.
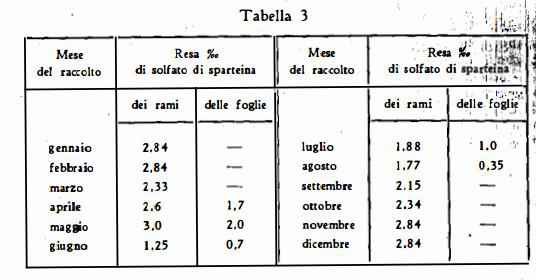
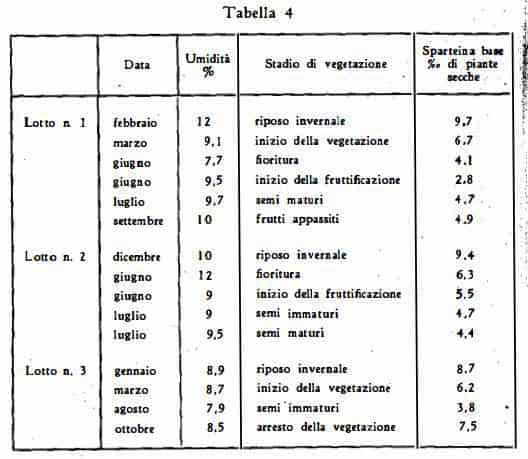
Faugeras (26) trovò un massimo contenuto di sparteina in periodo invernale ed un contenuto minimo nel periodo della formazione dei frutti (ved. tabella 4).
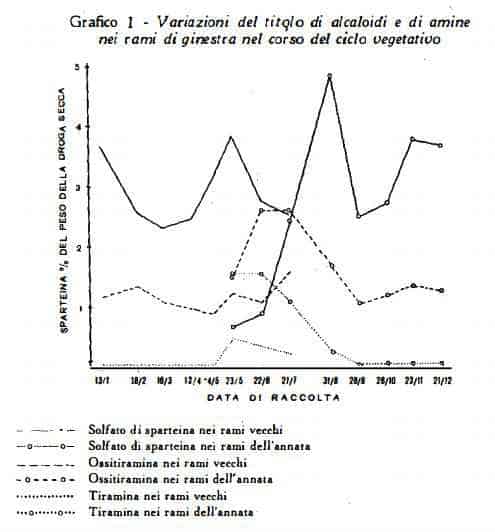
Jarninet (27), che ha condotto uno studio analitico sui rami verdi, nel corso del ciclo vegetativo completo dell'anno 1958, ha ottenuto per i titoli di sparteina e di amine i risultati riportati nei seguenti diagrammi:
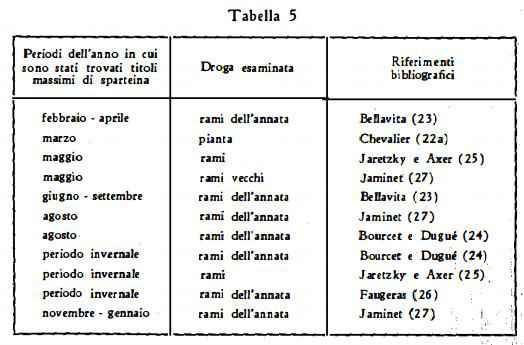
Dai grafici qui sopra riportati risulta che il contenuto massimo di sparteina nel Sarothamnus scoparius si ha in periodi dell'anno differenti a seconda dell'età dei rami deIla pianta e cioè in maggio per i rami vecchi, in agosto ed in periodo invernale, da novembre a gennaio, per i rami dell'annata. Basandoci su questa constatazione, ci si può render ragione dell'apparente discordanza tra le opinioni degli AA. circa i periodi annuali, in cui si ha il maggior rendimento di sparteina. Infatti se si mettono in relazione i titoli massimi trovati con l'età della droga saggiata si nota che, riferendosi a rami della stessa età, la maggior parte degli AA. hanno trovato la massima resa nei medesimi periodi dell'anno (ved. la tabella 5). Si ha cioè un maggior rendimento per i rami giovani nell'estate, secondo il Bellavita (23), specialmente in agosto, secondo Io Jaminet (27) e secondo il Bourcet e Dugué (24). Il Bourcet e Dugué (24), lo Jaretzky e l'Axer (25), il Faugeras (26) e lo Jaminet (27) sono poi concordi nel giudicare, quale periodo di elevato rendimento quello invernale, quando cioè la pianta ha raggiunto il massimo sviluppo ed entra in riposo. In quanto alle elevate differenze quantitative tra i titoli massimi di sparteina riscontrati dai diversi AA., si deve certamente tener conto che il contenuto dell'alcaloide è variabilissimo, secondo il luogo di provenienza (terreno ed esposizione al sole) e secondo le condizioni metereologiche (27a).
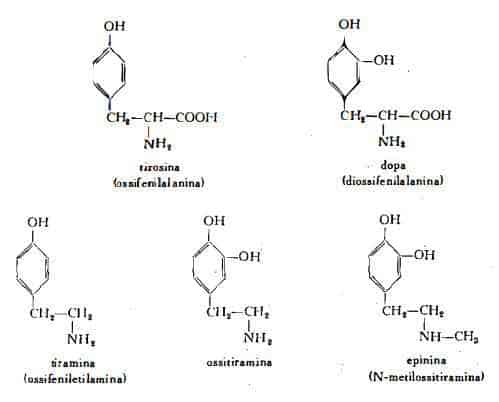
Aminoacidi ed altre basi azotate oltre agli alcaloidi sono stati isolati dal Cytisus scoparius Lk. (rami e fiori): 3,4diossifeniletilamina (ossitiramina) (28) (29) (30) (32), tiramina (30), metilossitiramina (32), diossifenilalanina (Dopa), tirosina (31). E' stata inoltre segnalata la presenza.di una «sostanza adrenalinosimile» (33) in notevoli quantità in giugno e luglio.
Come si è visto sopra per il titolo della sparteina, anche per il contenuto delle amine si hanno variazioni nel corso del ciclo vegetativo. Vedasi a questo proposito il grafico n.1, che raccoglie i dati analitici ottenuti dallo Jaminet (27) e che mette in rilievo le oscillazioni del titolo di ossitiramina e di tiramina nei rami verdi del Sarothamnus scoparius durante i diversi stadi di vegetazione. Lo Jaminet ha notato nei rami dell'annata titoli massimi per la ossitiramina in giugno ed in luglio, per la tiramina in maggio ed in giugno, nei rami vecchi valori massimi in febbraio, in maggio ed in luglio per la ossitiramina, nella seconda metà di maggio per la tiramina. Secondo i dati analitici di Correale e Cortese (32) il contenuto di ossitiramina nei rami e nei fiori freschi è risultato pari allo 0,015% in primavera, 0,025% in estate, 0,05% in autunno.
Nei fusti, nelle foglie, nei fiori e nei baccelli sono stati trovati scoparina ed altri tre flavoni non identificati (34). Nella pianta e nei fiori: i flavoni luteolina, libera e come 4'-glucoside, e quercetina, libera e come glicoside (35).
La scoparina, isolata sin dal 1851 da Stenhouse (36) dai fiori del Sarothamnus scoparius K. è stata identificata da Mascré e Paris (37) con il ramnoside di un etere metilico della quercetina con formula grezza C22H22O11. Gli stessi AA. (37) hanno ottenuto dai fiori essiccati di Ginestra I'1-1,2 % di scoparina.
Altri componenti: acido caffeico (35), olio etereo 0,031 % con furfurolo, acido palmitico ed una paraffina (38): nella frazione insaponificabile due alcooli C23H48O e C14H26O rispettivamente (39); flavoxantina, C40H56O3, crisantemaxantina, C40H56O3, xantofilla-epossido (eloxantina), C40H56O3, nei fiori ( 40): manganese 18 mg % nei fiori secchi ( 41): acqua 72-75% nelle parti verdi (42).
Proprietà farmacologiche ed impiego terapeutico
A proposito dell'azione farmacologica e terapeutica della Ginestra occorre distinguere l'azione della droga e dei suoi preparati da quella del suo principio, attivo principale, la sparteina.
Quello che si richiede infatti ai preparati della droga, non è tanto l’azione cardiotonica, quanto e soprattutto, quella diuretica e declorurante, nell’ammettere la quale sembra esistere un certo accordo.
Quest'azione non sarebbe attribuibile alla sparteina di cui le preparazioni galeniche di Ginestra sarebbero piuttosto povere ma, sembra, alla scoparina ed alle sostanze resinoidi che faciliterebbero la diuresi determinando una modica irritazione sugli epiteli secernenti renali [Leclerec (43)].
L'azione diuretica della Ginestra era nota agli antichi autori i quali anzi usavano classificarla fra i diuretici, anziché fra i cardiotonici e sotto questo aspetto, anche oggi se ne consiglia l'impiego nella terapia degli edemi dovuti a ritenzione di cloruri, casi nei quali la sua azione, può completare e rendere più efficace quella dei digitalici (Leclerc).
I preparati di Ginestra sono ritenuti utili come coadiuvanti, anche nelle affezioni acute dell'albero respiratorio (pleurite, bronchite, broncopolmonite) specialmente allorché l'analisi delle urine dimostri l'esistenza di una ritenzione di cloruri.
Secondo Busquet e Vischniac (44) l'estratto di Ginestra conterrebbe, un principio attivo la cui natura chimica non è stata ben chiarita, al quale verrebbe dagli AA. attribuita un'azione vasocostrittrice piuttosto energica, esercitantesi sia sulla muscolatura liscia dei vasi venosi ed arteriosi che sui centri vasomotori. Questa doppia azione farebbe della Ginestra un potente emostatico i cui effetti si avvicinerebbero a quelli dei preparati surrenalici.
Secondo Leclerc (45) la Ginestra è un medicamento la cui efficacia sarebbe incontestabile per combattere la debolezza e ristabilire il ritmo cardiaco, per elevare il tono vascolare, per prevenire i disturbi che conseguono agli stati ipotensivi, per attivare la diuresi, per favorire l’eliminazione dei cloruri e il riassorbimento degli edemi.
Questo A. descrive due casi, uno dei quali riguarda un malato di broncopolmonite con notevole ritenzione di cloruri (0,95%o nelle urine), dispnea, cianosi e debolezza cardiaca. La somministrazione di un infuso di Ginestra condusse ad un notevole aumento dell'eliminazione dei cloruri, la cui concentrazione nelle urine raggiunse, dopo 3 giorni, il 5 %o. mentre i sintomi più allarmanti andarono attenuandosi.
II secondo caso descritto dall'A. concerne un malato di nefrite, conseguente a scarlattina, il cui quadro sintomatologico era caratterizzato da oliguria, albuminuria, ritenzione dei cloruri e di urea. La somministrazione di infuso di Ginestra ebbe l'effetto di triplicare la secrezione urinaria nelle 24 h, normalizzandone anche la composizione.
L'estratto fluido somministrato alla dose di 1-3 g sarebbe dotato, secondo Busquet e Vischniac, di notevoli proprietà emostatiche che ne giustificherebbero l'impiego come rimedio preventivo e curativo delle emorragie post-partum.
Sparteina – Questo alcaloide, già largamente impiegato, ha perduto oggi molta di quella importanza terapeutica che gli veniva attribuita in passato come analettico cardiovascolare. La sua azione farmacologica, sotto questo aspetto, non sembra essere sufficientemente documentata e sulla sua reale efficacia terapeutica nel risolvere alcune alterazioni funzionali dell'attività cardiaca, esistono oggi molti e forse non ingiustificati dubbi.
Le ricerche svolte durante quest'ultimo decennio hanno tuttavia contribuito a chiarire alcuni aspetti dell'azione farmacologica della sparteina, il che potrebbe condurre a nuove seppur diverse applicazioni e quindi ad una sua almeno parziale rivalutazione terapeutica.
In questo capitolo noi ci limiteremo a considerare le ricerche più recenti rimandando per quelle anteriori al 1949-50, al capitolo sulla sparteina redatto dal Dixon (46) per l’Handbuck der exp. Pharmakologie dell’Heffter ed alla completa relazione del Soriani (47) nella quale la bibliografia sull’argomento vi si trova aggiornata sino al 1948.
Sull’apparato cardiovascolare – Le ricerche eseguite anteriormente al 1950 concludono in complesso negativamente, per quanto riguarda la possibilità di attribuire alla sparteina un'azione digitalisimile.
Gli AA. sono per lo più concordi nel ritenere che essa agisca negativamente sull'attività cardiaca e che determini un effetto paralizzante sulle terminazioni nervose a dosi che sono piuttosto vicine alle tossiche.
Per quanto riguarda le sue applicazioni terapeutiche, esse potrebbero essere limitate alla sostituzione della chinidina nelle diverse forme tachicardiche e in particolare in quella basedowiana in cui la Digitale è controindicata, nelle extrasistolie e nella fibrillazione atrio-ventricolare, casi questi in cui la sparteina avrebbe sulla chinidina il vantaggio di una minor tossicità.
Sulla pressione arteriosa normale la sparteina dopo un lieve e transitorio aumento, determina di solito un marcato e durevole effetto ipotensivo.
Sui vasi isolati, la maggior parte degli AA., notò un effetto vasocostrittivo e tale effetto è stato rilevato anche nell'animale in foto, contemporaneamente alla caduta della pressione, la quale fu pertanto attribuita ad un minor volume di sangue immesso in circolo dal cuore. Ciò escluderebbe dunque la possibilità di un impiego della sparteina come analettico circolatorio.
Fra le ricerche eseguite successivamente, citeremo quelle di Hazard e coll. (48) che studiarono l’antagonismo sparteina-eserina e trovarono che sotto questo aspetto, l’azione della sparteina, come inibitore ganglionare, è simile a quella della procaina.
Le contrazioni muscolari indotte dall'eserina nel cuore di cane cloralosato, scompaiono sotto l’azione della sparteina la quale inoltre, analogamente alla novocaina, riesce ad annullare l'effetto dell'acetilcolina sul cuore, senza influenzarne l’azione ipotensiva.
Secondo gli AA., l’azione delle due sostanze, pur differendo per alcuni particolari secondari, può essere ritenuta simile.
Precedentemente Io stesso Hazard (49) aveva trovato che la sparteina è capace di antagonizzare gli effetti inibitori della yoimbina sulle azioni ipotensiva e ipoglicemizzante dell’adrenalina.
Secondo Donzelot e coll. (50) la sparteina non sarebbe soltanto un cardiotonico ma anche un regolatore del ritmo. Essa sottrarrebbe il cuore all’influenza dell’innervazione estrinseca e tenderebbe a sopprimere le turbe dell’eccitabilità intrinseca di origine miocardica. Mercier e coll. (51) trovarono che la sparteina, nei cani, diminuisce il flusso coronarico e il consumo di ossigeno; il lavoro del cuore sarebbe leggermente diminuito mentre la sua efficienza ne ritulterebbe sensibilmente aumentata. Successivamente Io stesso Mercier e coll. (52), in un ben condotto studio in cui furono considerati certi aspetti dinamici ed energetici dell’azione cardiaca dei glucosidi digitalici e della sparteina, hanno trovato che la digitalina, la digossina, la ouabaina e l'adonidoside, non modificano praticamente il rendimento del cuore normale, in dosi terapeutiche. I risultati sarebbero invece diversi nel caso in cui esista insufficienza cardiaca, che non è però realizzabile sperimentalmente. La sparteina invece, somministrata a dosi di 5-10 mg/Kg nel cane, dà luogo ad una diminuzione della portata circolatoria, del lavoro e della frequenza cardiaca, delle resistenze periferiche e del flusso coronarico. Aumenta la differenza artero-venosa coronarica ma in complesso diminuisce anche il consumo di ossigeno da parte del miocardio.
Tale diminuzione avviene tuttavia, in misura maggiore del lavoro cardiaco, per cui il rendimento del cuore aumenta. Coi dosaggi e nelle condizioni sperimentali attuate dagli AA. non è stato possibile riconoscere una analogia d'azione dinamica e metabolica fra i quattro digitalici e la sparteina, gli effetti della quale sembrano spiegare almeno in parte, il beneficio che il cuore insufficiente può trarre dalla sua somministrazione.
Il Fuentes (5 3) ha studiato l’effetto antiacceleratore della sparteina sul preparato cuore-polmoni di cane, con un volume di sangue di circa un litro. In queste condizioni la sparteina, alla dose di 5-100 mg, determina una azione cronotropa negativa che non è influenzata dall’atropina alla concentrazione di 10-5.
Con dosi di 20 mg e più, la sparteina determina un effetto cronotropo negativo che può essere prevenuto mediante pretrattamento con ouabaina alla dose di 20-50 g, senza interferenze sull’azione cronotropa negativa. La sparteina antagonizza l'azione acceleratrice dell’adrenalina e, analogamente alla veratramina, la sparteina è capace di dissociare l’azione inotropa positiva da quella cronotropa positiva dell’adrenalina.
Con efedrina alla dose di 3 mg, si ottiene un effetto acceleratore massimale, sul quale l’attività antiacceleratrice della sparteina sarebbe, secondo l’A., pari a 1/260 di quella determinata dalla veratramina.
L’iniezione endovenosa di sparteina determina nei conigli una rapida caduta della pressione, effetto questo che non sarebbe evitato, secondo Sukurai (54), dalla somministrazione preventiva di atropina o dal taglio dei vaghi. L'iniezione endorachidea, sempre nel coniglio, determina una ipotensione che è più intensa negli animali anestetizzati. II riflesso di Bezold, indotto dall'iniezione endovenosa di veratrina, verrebbe inibito dalla sparteina come dalla procaina. L'ipotensione iniziale determinata da iniezione endovenosa di nicotina, viene inibita dalla sparteina ma l’ipotensione successiva ne risulterebbe aumentata. Anche le variazioni emodinamiche indotte da aminocordina sono influenzate dalla sparteina. L'ipertensione da adrenalina viene potenziata dalla sparteina la quale non riesce però a modificare l’effetto ipotensivo dell’acetilcolina. Inibisce fortemente la reazione ipotensiva dovuta alla stimolazione del moncone periferico del vago ma molto debolmente l'effetto della stimolazione centrale. L’ipotensione dovuta alla stimolazione del nucleo amigdaloide è debolmente inibita dalla sparteina mentre, in misura molto maggiore, viene inibita l’ipertensione provocata dalla stimolazione dell’ipotalamo.
L'effetto della sparteina sulla muscolatura liscia e sul sistema vascolare sarebbe dovuto, secondo Kreuzer e Luth (55) ad un aumento dell’eccitazione delle terminazioni nervose simpatiche con depressione del parasimpatico, fenomeni questi che sarebbero stati sino ad ora poco studiati.
Oltre che per stimolare le contrazioni dell’utero durante il parto, come vedremo in seguito, la sparteina comincia ad essere impiegata anche nella terapia delle varicositi ed è appunto quest’azione che gli AA. hanno voluto indagare.
In 16 pazienti vennero misurate, prima e dopo la somministrazione di sparteina, la pressione venosa, la pressione arteriosa, la pressione intramuscolare, la frequenza del polso e degli atti respiratori. E’ risultato che la somministrazione di solfato di sparteina determina un rapido e transitorio aumento della pressione venosa, dovuto alla sua azione periferica. La pressione intramuscolare aumenta anche ma con un certo ritardo e meno marcatamente della pressione venosa. La temperatura cutanea non risulta influenzata dalla sparteina, la pressione arteriosa subisce un leggero aumento iniziale mentre in alcuni casi, la pressione sistolica diminuisce leggermente per poi ritornare ai valori iniziali. La frequenza e la profondità respiratoria vengono transitoriamente aumentate, mentre non si sono notate variazioni della frequenza del polso nè effetti collaterali dannosi. Gli AA. concludono che i risultati ottenuti giustificano l’impiego dei preparati di sparteina nella terapia delle varicositi.
Sull'apparato respiratorio l’azione della sparteina si riduce ad un eccitamento riflesso determinato dalle piccole dosi e da una depressione di origine centrale per le dosi più elevate.
Depongono in questo senso i risultati delle ricerche di Mercier e coll. (56), di Donnini (57), di Van Dongen e coll. (58) ecc.
Le ricerche più recenti sotto questo aspetto furono eseguite fra il 1925 e il 1948 e da esse non si può dedurre la possibilità di un’utile applicazione terapeutica della sparteina come analettico respiratorio.
L’azione della sparteina sul sistema nervoso centrale non è rilevante e non prelude ad applicazioni terapeutiche. Gli AA. attribuiscono a questo alcaloide un’azione prevalentemente depressiva sul sistema nervoso centrale (sia cerebrale che midollare) anche se inizialmente e per le piccole dosi esso può indurre un effetto transitoriamente eccitante.
Interessante l’osservazione di Mercier (59) secondo cui la sparteina iniettata nello speco vertebrale, può indurre una completa anestesia delle vie sensitive e può inibire e prevenire (anche se somministrata per via endovenosa) le convulsioni scatenate da dosi opportune di caffeina somministrata endovena (60).
Sulle terminazioni sensitive: da ricerche di Guinard e Geley (61) che risalgono al 1894, risulta che la sparteina sarebbe dotata di un’azione anestetica locale simile a quella della cocaina, tanto che i suddetti AA. ne proposero l’uso in oculistica in sostituzione della cocaina stessa.
Sulle giunzioni neuro-muscolari dei muscoli scheletrici, mentre a piccole dosi la sparteina aumenta la reazione del muscolo alla stimolazione nervosa, a dosi elevate induce una paralisi di tipo curarico. Depongono in questo senso i risultati di numerosi AA. fra i quali Cushny e Mathews (62), Pere (63), Weill (64), Mercier e Chebuliez (65), Heathcote (66),Poujol (67), Coppée e Bacq (68), Van Dongen e coll. (69) i quali ultimi hanno posto in evidenza l'azione antagonista sui muscoli striati (m. retto di rana) verso l’acetilcolina la quale, com’è noto, è oggi considerata come il mediatore chimico della trasmissione neuro-muscolare, non solo della fibra muscolare liscia ma anche di quella striata dei muscoli volontari.
Sul sistema nervoso autonomo l'azione della sparteina è stata molto studiata e non ancora ben chiarita nei suoi diversi aspetti. Indubbiamehte essa è molto complessa in quanto sembra agire secondo un meccanismo che ricorda quello della nicotina, della coniina. della piperidina [Sollmann (70)] e dell’acetilcolina, manifestantesi tanto sugli accettori colinergici quanto sulle sinapsi gangliari, con riflessi negativi anche sulla adrenalinogenesi che verrebbe bloccata, mentre gli effettori simpatici verrebbero sensibilizzati all'azione adrenalinica.
Fra le ricerche più recenti sull’azione della sparteina sul sistema nervoso autonomo, citeremo quelle del Boriani (71), il quale ha dimostrato che questa sostanza è dotata di'un’intensa attività anticolinesterasica che si manifesterebbe con maggior elettività, sia sulla colinesterasi serica che su quella cerebrale. Il Boriani sottolinea il fatto che anche per la sparteina si dimostra sperimentalmente la contraddizione, già nota anche per altre sostanze, secondo la quale un’attività anticolinesterasica non esclude affatto l’esistenza di attività antiacetilcoliniche.
Successivamente lo stesso A. (72) ha studiato l’antagonismo sparteina-acetilcolina di cui è stata ulteriormente dimostrata l’esistenza e, dal punto di vista quantitativo, sembrerebbe esistere un rapporto fra le quantità di acetilcolina e quelle di sparteina necessarie ad impedirne l’azione, rapporto che appare diretto per le dosi più basse, mentre per le dosi più elevate, le quantità di sparteina sufficienti ad inibire l'acetilcolina, aumentano molto meno rapidamente che la quantità dell’acetilcolina. L’A. fa notare inoltre che la soglia di sensibilità all’acetilcolina è molto più elevata per il muscolo liscio che per quello striato.
Più recentemente, Buchel e coll. (73), hanno saggiato sul ratto (con trazione del duodeno isolato) e sul cane (pressione arteriosa), la sparteina ed altre droghe che agiscono, sulla trasmissione sinaptica e in entrambi i casi la sparteina dimostrò di agire come un agente inibente e non manifestò alcuna azione eccitante.
E’ stata inoltre osservata dagli AA., un’azione locale anestetico-simile, sulle fibre pregangliari del duodeno del cane.
Rientra in questo capitolo l’attività che la sparteina manifesta sulla libra muscolare liscia dei diversi organi, in quanto dovuta alle sue proprietà antiacetilcoliniche e sulle sinapsi gangliari.
>Sulla fibra muscolare liscia la sparteina agisce di solito come inibente ma, specialmente quando venga impiegata a piccole dosi, può agire anche in senso contrario. Ciò deriva dal fatto che l’inibizione acetilcolinica può essere preceduta da una stimolazione (Boriani l.c.), oppure perchè, come avviene anche per molti altri farmaci, può agire nell’un senso o nell’altro, a seconda delle condizioni sperimentali e di tonalità dell’organo nel momento in cui la sostanza viene fatta agire.
I primi studi sull’attività della sparteina sulla motilità del tubo gastroenterico si debbono forse al Chistoni (74) il quale trovò che essa agisce determinando un effetto inibente, ciò che venne confermato in seguito anche da altri AA. che successivamente studiarono l’attività della sparteina sulla motilità intestinale [Tamba-Goro (75), Heathcote (66)]. Altri notarono invece reazioni diverse sia su segmenti di intestino isolati che sull'organo in situ, a seconda dell'animale, delle condizioni sperimentali e del sale di sparteina (solfato, etilfenilbarbiturato) impiegato [Tani-Shoichi (76), Raymond-Hamet (77), Mercier (78), Mercier e coll. (79), Donnini (57), Van Dongen (69)].
Tani-Shoichi avrebbe inoltre notato che la sparteina ha un effetto paralizzante sul muscolo bronchiale isolato di bovino, sul quale sarebbe capace di inibire anche l'azione contratturante dell'acetilcolina.
Un'azione molto interessante della sparteina, in quanto suscettibile di un utile impiego terapeutico, è quella oxitocica, notata fin dal 1921 da Tamba-Goro (80) sull'utero di coniglia, successivamente confermata da Kreitmair e Sieckmann (81) e sperimentata clinicamente per la prima volta da Klein (82) nel 1939.
Lévy-Solal e coll. (83) considerano il solfato di sparteina superiore ai preparati di post-ipofisi in quanto le contrazioni dell'utero che ne conseguono, sono intervallate da periodi di completo rilasciamento. Somministrata a dosi opportune (g 0,10-0,20 intramuscolo) la sparteina non provoca mai quelle contrazioni tetaniche cui spesso danno luogo i preparati post-ipofiasri e soltanto con dosi molto elevate (g 1,5) essa potrebbe provocare contrazioni pericolose sia per la madre che per il feto.
I risultati sperimentali e clinici ottenuti da molti altri AA. (Mercier (84), Varangot e coll. (85), Petrescu e Rodeanu (86), Salvanescu e coll. (87), Savini (88), Caldeyro Barcia e Halvarez (89) ecc.) confermano l'importanza terapeutica della sparteina come oxitocico.
II Morin (90) consiglia dosi di g 0,15-0,20 di solfato di sparteina, anche ripetute se necessario ed afferma che con tali dosi non si è mai notata la comparsa di segni di depressione respiratoria fetale.
Gazet du Chatelier e Assenmacher (91), sperimentando sull'utero isolato di cavia, trovarono che esiste un notevole sinergismo di potenziamento fra sparteina e bleu di metilene e che queste due sostanze, sia isolatamente considerate che in associazione, non manifestano alcuna tossicità sull'organo sopravvivente che continua a contrarsi a lungo, senza indebolimento apprezzabile della sua energia di contrazione.
Precedentemente era stato notato un notevole sinergismo fra sparteina e Cardiazolo e Durant (92) afferma che l'associazione di queste due sostanze (g 0,10-0,20 dell'una e dell'altra) costituisce un eccellente preparato oxitocico e ne consiglia l'impiego in tutti i casi in cui esista una insufficienza cardiaca o respiratoria materna, nei casi di ipotono dell'utero e per accelerare il parto anche normale. La sua azione sarebbe graduale e progressiva, le contrazioni sempre ritmiche e con intervalli regolari di completo rilasciamento. Secondo l'A. questa associazione avrebbe poche controindicazioni e il suo effetto persisterebbe da un minimo di 45' ad un massimo di 2-3 h.
Il Savini (93) osservò inoltre che contrazioni tetaniche provocate con dosi elevate di sparteina sull'utero sia in vitro che in situ, potevano essere trasformate in contrazioni ritmiche e regolari dal Cardiazolo il quale, secondo l'A., determinerebbe sull'utero delle contrazioni “fisiologiche rinforzate”.
Effetti sinergici sono stati osservati sperimentalmente anche fra sparteina ed estratti post-ipofisari, ergotamina ed ergometrina su utero di gatta [Van Dongen (58)] e fra sparteina ed adrenalina da Holtz e Schumann (94) e da Van Dongen.
Secondo Merger e Chadeyron (95) il sale di scelta sarebbe il solfato di sparteina, più attivo come oxitocico del canfosolfonato allorché venga somministrato per via intramuscolare alla dose di g 0,10-0,20. Le iniezioni ripetute ad intervalli di ½-1 h lasciano un largo margine di sicurezza poiché, come già detto, occorre raggiungere la dose di g 1,5 per provocare un effetto tetanizzante.
Alcuni AA. [Mahon e Delaplace (96) e Palliez e coll. (97)], analogamente ai preparati post-ipofisari, somministrarono la sparteina per perfusione endovenosa lenta. In questo caso venne impiegato lo jodometilato di sparteina, meno tossico per via endovenosa, del solfato.
Nonostante la sua attività e la sua innocuità, all'impiego della sparteina viene spesso preferito attualmente, quello dell'ossitocina somministrata per perfusione endovenosa lenta, trattamento questo la cui efficacia é ritenuta clinicamente superiore a quella di tutti gli altri oxitocici somministrati per altra via, ossitocina compresa. Tuttavia, secondo Merger e Chadeyron, la sparteina può sostituire l'ossitocina specialmente allorché l’impiego di questa é reso difficile per l'impossibilità di una continua assistenza medica (parti a domicilio per es. ), nei casi di ipocinesia parziale, nei casi di fragilità dell'utero (pluripare, gestanti che abbiano subito il taglio cesareo anteriore, gravidanza gemellare con utero eccessivamente disteso) ed anche nei casi in cui esistano fatti di insufficienza cardiaca in cui l'uso della sparteina, specialmente in associazione col cardiazolo, può essere più indicato.
La sparteina al contrario, non manifesta alcuna attività se somministrata ante-partum per provocare le doglie o per accelerare l'inizio del parto, né può essere impiegata in sostituzione dei preparati di Segale cornuta post-partum, poiché sotto questo aspetto risulta del tutto inattiva.
Impiego terapeutico – Da quanto si può dedurre da tutto ciò che é stato sin qui esposto e nonostante le incertezze che ancora sussistono su alcuni particolari aspetti della sua attività farmacologica e terapeutica, crediamo di poter concludere che la sparteina possa essere utilmente impiegata come leggero tonicardico e soprattutto come regolatore del ritmo cardiaco, nelle tachicardie e in particolare in quelle di origine basedowiana in cui la digitale é controindicata; nelle extrasistolie, nelle fibrillazioni atrio-ventricolari, casi in cui la sparteina, come già detto, avrebbe sulla chinidina il vantaggio di una minor tossicità.
Come regolatore del ritmo cardiaco Donzelot e coll. (50) ne consigliano la somministrazione per os, alla dose di cg 15-20 ripartita nelle 24 h il primo giorno, poi 10-12 cg come cura di mantenimento, nelle aritmie poco accentuate. Nelle forme di media gravità gli AA. consigliano la somministrazione per via intramuscolare di 5 cg pro dose, 4 volte nelle 24 h. In un caso di bigeminismo tenace, gli AA. hanno somministrato per via endovenosa la dose di 5 cg di sparteina.
Secondo gli AA. non é consigliabile superare questa dose per via endovenosa, anche se dosi superiori sono di solito ben tollerate, al fine di evitare il pericolo di una intossicazione sparteinica ed i fenomeni di dissociazione atrio-ventricolare che ne potrebbero conseguire. Essi credono opportuno ricordare a questo proposito, che gli accidenti tossici provocati da dosi troppo elevate di sparteina, possono essere sperimentalmente bloccati mediante iniezioni endovenose di cloruro di calcio.
Un'applicazione terapeutica molto interessante della sparteina è quella dovuta alla sua attività oxitocica che si è rivelata molto utile per aumentare la validità e il ritmo delle contrazioni dell'utero durante il travaglio del parto.
Secondo alcuni AA. l'azione deIIa sparteina in questi casi, sarebbe superiore e più innocua di quella di qualsiasi altro oxitocico e sarebbe superata soltanto dall'ossitocina allorché venga somministrata per perfusione endovenosa lenta, somministrazione che, per altro, non è sempre possibile praticare.
Le dosi più opportune in questi casi sono quelle di g 0,10-0,20 intramuscolo di solfato di sparteina, ripetute ad intervalli di 1/2-1 h.
Ottimi risultati si otterrebbero con l’associazione sparteina-Cardiazolo (ana g 0,10-0,20).
Ricordiamo infine che la sparteina è stata impiegata nel trattamento delle varicositi, impiego che i risultati sperimentali di Kreuzer e Luth (55) tenderebbero a giustificare. .
I preparati della droga (infuso, estratto fluido) vengono invece impiegati soprattutto per le loro proprietà diuretica e declorurante, sia isolatamente che come coadiuvante dell'azione dei digitalici, per favorire il riassorbimento degli edemi e in tutti i casi in cui esista una ritenzione di cloruri.
Busquet e Vischniac (44) vantano l'azione emostatica dei preparati di Ginestra e consigliano l'impiego dell’estratto fluido alla dose di g 1-3, nel trattamento preventivo e curativo delle emorragie post-partum.
Estratti e preparati vari
Estratto fluido (g 1 = XXXIII gtt).
Dosi: g 1-2 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido ginestra……………………………………………… g 20
Alcool di 20° …………………………………………………. g 80
(a cucchiaini)
Sciroppo
Estratto fluido ginestra……………………………………………….. g… 5
Sciroppo semplice F.U………………………………………………. g 95
(a cucchiai)
Gocce cardiotoniche
Estratto fluido ginestra
Estratto fluido adonide …………………………………………. ana g 20
Estratto fluido convallaria g 10
(XX-XXX gtt 2-3 volte pro die)
BIBLIOGRAFIA
(1)STENHOUSE J., Phtios. Trans., 2. 422; lgJ1; Ann. Chem. Phorm., 78. I, 1851; .Lieb. Ann., 78, I, 1851
(2) VALEl"JR A., Compt. rend., 167. 163, 191-8 – (3) VALEUR A., Compì. rend., 167. 26, 1918 – (4) DELA- BY R., BARONNET R. e GUY J., Bull. Soc. Chim., 16, 152, 1949 – (5) LIEBSCHER G., Zbi. Agrikultur. Cht 180, 1880- (6) WILLSTAlTER R. e MARX W., Ber., 37, 2351, 1904; 38, 1772, 19-05- (7) MILLS,
Lieb. Ann., 125. 71, 1863 – (8) MOUREU C. e VALEUR A., Compt. Rend., 140, 1601 e 1645, 1905; 145,
1184, 1908; 151, 527, 1911; Ann. Chim. Phys., 27. 245, 1912 – (9) WINTERFELD K. e KNEUER, Ber., 64, ISO, 1931 – (10) ING H. R., J. Chem. Soc., 504, 1933; 2778, 1932 – (H) CLEMO G. R. e RAPER R., J.
Chem. Soc., 64, 1933 – (12) CLEMO G. R., MORGAN W. e RAPER R., J. Chem. Soc., 1025, 1936 –
(13) GALINOVSKY F. e KAINZ G., Monofsh., 77. 137, 1947 – (14) SORM F. e' KEIL B., Collectlon Cuchosiov. Chem. Communs., 12, 655, 1947 – (15) LEONARD N. J. e BEYLER R. E., /. Am. Chem. ,Soc., 71, 757, 1949 – (16) LEONARD N. J. e BEYLER R. E., I. Am. Chem. Soc., 72. 1316, 1950 • (17) MARION L., TURCOITE F. e OUELLET J., Can. I. Chem., 29, 22, 1951 – (18) MARION L. e LEONARD N. J., 29. 297, 1951 • (19) KEITELHACK D., RINK M. e WINTERFELD K., Arch. Pharm., 287, I, 1954; Chem. Ahs., 49. 12499 i, 1955 – (20) WOLFES O., KREITMAIR H. e SIECKMANN W., E. Merck’s Jahresber., 50. 111, 1936 – (21) WINTERFELD K. e NITZSCHE F., Arch. Pharm., 278. 393, 1940 • (22) CAPRA C., Fitoterapia, 31, 21, 1960 – (22a) CHEVALIER, Compt. Rend., 150, 1068, 1910 . (23) BELLAVITA V., li Farmaco, J, 426, 1948 – (24) BOURCET e DUGUE’, Bull. Sci. Pharm., 37, 1930 – (25) JARETZKY R. e AXER B., Arch. Pharm., 272, 152, 1934 – (26) FAUGERAS G., Alcalotdes et Flavonoides des Oénistées, Paris, 1956; Travaux Lab. Matière Médicaie, Fac. Pharm. Paris, 41, ì957;Pianta Med., 6. 219, 1958 • (27} JAMINET F., Pharm. Acta Helv., 34, 571, 1959 – (27a) CAITORINI P. E., Fitoterapia, 21, 110, 1950 – (28) SCHMALFUSS L. e HEIDE R., Biochem. Z., 236, 226, 1931 – (29) WOLFES O., Merck's Jahresber., 50, 111, 1936 – (30) JAMINET F., J. Pharm. Belg., 8, 23, 1953; 9, 9, 1954; Pharm. Acta Helv., 34, 571, 1959^ (31) GUGGENHEIM M., Die blogenen Amine, Base! e New York.' 1951 – (32) CORREALE P. e CORTESE
J., Nat!frwlss., 40, 57, 1953 – (33) GORRIL F. S., SILVA J. S. e McDOWALL J. S., I. Physiol., 85, 37, 1935 – Ì34) PARIS R. e FAUGERAS G., Ann. Pharm. Franf., 13, 359, 1955 – (35) hOrHAMMER L., WAGNER H. e DHINGRA H. S., Dtsch. Ap. Ztg., 98. 884, 1958 – (36) STENHOUSE J., Lieb. Annui., 78, 15, 1851; J. Chem. Soc., 4, 216, 1852 – (37) MASCRE* M. e PARIS R., Bull. Sci. Pharmacol.,39, 401, 1937; Compt. rend., 204, 1270, 1937 • (38) HAENSEL, Apoth. Ztg., 14, 283, 1909" • (39) CORCILIUS F., Pianta Med., 4, 104, 1956; Chem. Abs., 51, 7651, 1957 . (40) KARRER P. e KRAUSE-VOITH E., Helv, Chim. Acta, 17, 1585, 1944; 30. 1158, 1947 – (41) KÙHN K. C., Dtsch. Ap. Ztg., 91, 799, 1952 • (42) BELLAVITA i V., 11 Farmaco, 3, 426, 1948 – (43) LECLERC H., Préds de Phytothérapie 3° edit. Masson, Paris 1935, ; p. 293 – (44) BUSQUET H . e VISCHNIAC C., C. R. Soc. Biol., 1925 – (45) LECLERC H., Rév. de Phyto- ' thérapie, 13. 96, 549-51, 1949 – (46) DIXON V. E., Hefjter Hond. exp. Pharmakol., 2°, p. II, 1924 • (47) , BORIANI A., Arch. Jt. Sci. Farmacol. li ser.. I, 1, n. 4, 1948 • (48) HAZARD R., CORTEGGIANI E.
e CORNEC A., C. R. Acad. Sci. Parb, 113, 211, 1951 • (49) HAZARD R., Compt. rend., 194, 486, 1923 (cit. da MARCEL J., DALLEMAGNE e HEYMANS C. in The Alkalolds, Manske e Holmes voi. V, Pharmacology; Academie Presse Inc., Pubtishers, New York 1955, p. 124 • (50) DONZELOT, HEIM DE BOLSAC e SAMUEL, Acacl. Nat. de Méd., 25 aprDe, 1954; Presse Méd., 62, 34, 729, 1954 • (51) MERCIER F., MERCIER J., SESTIER M. R. e GAVEND M., C.R. Soc. Biol., 150, 1412-15, 1956 • (52) MERCIER F., MERCIER J., GAVEND M. e OAVEND M. R., Arch. de Mal. du Coeur et de Vaiss., .n, 177, 1959 – (53) FUENTES J., J. Pharmacoi. exp. Therap., 119, 427-35, 1957 – (54) SAKURAI S., Yonagu Jagaku Zasshi, IO, 1119, 427-35, 1957 – (55) KREUZER H. e LÌrrH V., Deut. Med. Woch., 84, 941, 1959 – (56) MERCIER F., DELPHANT J. e BOUJART M., C. R. Ac<1d. Scien., 129, 318, 1938 – (57) DONNiNI A., Atti Ace. Fisiocrit. Sieno, Il, 20, 1940 – (58) VAN DONGEN K. J., BOS J. A. e TAAL A., Arch. Int.- Pharmar:odyn. et de Thérap., 76, 163, 1948 – (59) MERCIER F., C.R. Acad. Sclen., J85,_U62, 1927 • (60) MERCIER F., ibtd. 108. 92, 1931 – (61) GUINARD L. e GELEY G., C. R. Soc. Biol., 46. 583, 1894 – (62) CUSHNY A. R. e MATHEWS S. A., Arch. exp. Path. u. Pharmakol., 35. 129, 1895 – (63) FEKE' C., C. R. Soc. Biol., 53, 927, 1901 (64) WEILL J., ibid. 74, 308, 1913 – (65) MERCIER J. e CHEBULIEZ A., ibid. 94, 730, 1926 – (66) HEATHCOTE R., J. Pharmacoi. exp. thér., 17. 431, 1926 – (67) POUJOL M., C. R. Soc. Biol., 101, 91, 1929 – (68) COPPÉE G. e BACQ L. M., Acta Biol. Belg., l, 177, 1941 – (69) VAN DONGEN K., BOS A. e TAAE A., Arch. Int. Pharmacodyn. et de thér., 76. 163, 1948 – (70) SOLLMANN T., A Manual of Pharmacology VII* ed. Saunders Co. Philadelphia-London 1950. p. 353-54 • (71) BORIANI A., Boil. Soc. Jt. Biol. Sperim., 17. J bis, 440-2, 1951 – (72) BORIANI A., ibid. 27, 5, 722-3, 1951 • (73) BUCHEL L., LEVY Y. e MICHEL-BER E., J. Physiol. (Parls), 48. 781, 1956; Chem. Abs., 51. 10744Ì, 1957- (74) CHISTONI A., Arch. Sci. Bioi., 2. 31, 1931 – {75) TAMBA-GORO, Ber. u. Ges. Physiol. u. Pharmakol., II, 155, 1922 – (76) TANI-SHOICHI, ' Okayoma Igakkai Zasshl, 43, 1931 – (77) RAYMOND-HAMET, C. R. Soc. Biol., 115, 24, 1934 – (78) MERCIER F., ibld. 114. -615, 1933 – (79) MERCIER F. e KRIJA' NOWSKY A., ibid. 123. 1211, 1936 – (80) TAMBA GORO, Acta Scholae Med. Unlv. Imp. Kioto, 4, 84, 1921 – (81) KREITMAIR H. e SIECKMANN W., Merck's Jahrsber., 50, 193"6 e Ann. Merck ed. Fran^., 382-98, 1937 (IV) – (82) KLEIN H. O., Kiin. Woch., 18 (I). 360, 1939 • (83) LEVY-SOLAL E., MORIN P. e REMLINGER A., Gynécol. et Obstetr., 45, 210. 1946 – (84) MERCIER F., Trav. Soc. Pharm. de Montpeliter, voi. VI, 1947; Presse Méd., n. 45, 754, 1946 – (8S) VARANGOT /., GRANDJON A. e VASSY S., Gynécol, et Obstetr.. 45, 3, 210, I94il – (86) PETRESCU V. e RODEANU A., Méd. Romaine, J, 4, 210. 1946 – (87) SALVANESCU D., SARBU P. e JURES D., Presse Méd., n. 48, 543, 1947 – (88) SAVINI E., Co^^cu. a.Ila Soc. de Thérap. et dc Pharmacodyn., IS-IlI – 1950 – (89) CALDEYRO BARCIA R. e ALVAREZ H., J. Obstetr. Gynécol. Brit. Empire, 56, 646, 1952 – (90) MORIN P., Bull. Med., 161, 1946 -(91) GAZET DU CHATELIER G. e ASSENMACHER CH., Ann. Pharm. Frane., 8, 2, 114-118, 193O -(92) DURANT T., BruxeOes Méd, 27, 20, 1947 – (93) SAVINI E., Théraple, S, 133-39, 1950 – (94) HOL'I2 P. e SCHUMANN H. J., Arch. exp. Path. u. Phar-1<.ol., 206, 171-79, 1949 – (95) MERGER R. e CHA- DEYRON P., Thérapie, JS, 3, 438-39, 1960; Comunica::. alla Soc. Fran$. de Therapeutique et de
codyn .. 18-V-1960 – (96) MAHON e DELAPLACE, Bull. Ftd. Soc. Gyntcol. Obstttr.. 4, 481, 1954 – (97) PALLIEZ e coll., ibid., 8, I, 90-02, 1956.


