Limone
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Citrus medica var. Limonum L. – Fam. Rutacee/Citracee/Esperidee)
(Sin – Citrus Limonum (o Limonium) Risso – Citrus Limonia Osb.) (corrisponde al Limonia malus Black. Herb. – Limon vulgaris Ferr. Hesp.).
Limone- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Citrus, nome latino dal greco kitron.
medica – della Media (antico Iran n/o).
Limonum – dall'arabo limoun ed anche dal greco leimwn = prato, luogo
erboso, perchè quando il frutto è acerbo ha il color verde, simile a quello dei prati.
Nomi volgari – Limone, limùn (lig.), limma (nap.), ponzino (nap.), limiuni, ramicella, zagara (sic.).
Zitrone, Citronenbaum (albero) (ted.), Lemon, citron (ingl.), Citron, Citronnier (albero) (fr.), Limao, Limoneiro (albero) (port.), Limon, Limobero (albero) (spagn.), Limon (russ.).
Habitat – Originario dall’Oriente (India, Cina, Cocincina). Selvatico in India (Monti Hilghiri o Nilaghiri, nella regione calda ai piedi dell'Himalaja, da Garwal e Sikkim, nel sud/est a Chittagong, Burma, nel sud/ovest Monti Gati occidentali e Monti Satpura (sp. Citrus limonum sylvaticum Risso – Citrus medica sativa Desf.). Coltivato in tutta la regione mediterranea (Tripolitania, Cirenaica, Fezzan, Algeria, Marocco, Spagna, Portogallo, Francia/s, Turchia, Egitto, Siria, Palestina). Cina, Indocina, Giappone, Giava, Tahiti, Martinica, Guadalupa, America del sud, U.S.A. (California, Florida), Nossi Bé (dove si trova anche selvaggio nelle foreste di Lokobé e presso Kalempe, a n/ dell'isola), Abissinia, Senegal. Introdotto in Italia, pare, nel III e IV sec. estesamente coltivato in Sicilia (dove si trova anche allo stato semiselvaggio), Calabria, nella regione del Lago di Garda, in Liguria.
Frutice o albero sempreverde, talora spinoso (5-6 m. alt,).
Parti usate – La scorza del frutto (flavedo) o pericarpio (zeste) (fr.).
Componenti principali
Olio essenziale – Il contenuto di olio essenziale è di circa 0,3 % nei frutti di California, anche più di 0,4% nei frutti italiani (1). In limoni della Spagna ne sono state trovate quantità pari a 0,3-0,4% (limoni «comuni») ed a 0,25% (limoni «verna») (1). In frutti del Brasile 0,27% di olio essenziale con basso contenuto di citrale (2%) ed elevato residuo fisso (3,8%) (1). L’olio di Limone di Palestina presenta caratteri chimico-fisici normali, ma ha odore e sapore diversi da quelli dell’olio dei frutti di Sicilia.
La composizione chimica dell’olio essenziale della scorza di Limone è stata oggetto di studio specialmente per gli oli italiani — della Sicilia e della Calabria — e della California, zone che sono le principali produttrici mondiali dei frutti e dell’olio essenziale.
a) In olio essenziale dei frutti italiani (Messina) sono stati trovati i seguenti costituenti:
— un idrocarburo di formula grezza C8H18 oppure C8H16 (ottilene?) (2).
— d-limonene (3), quale componente predominante, a-pinene, presente in piccole quantità od anche assente (4) (5), b-pinene (6), b-fellandrene (7) e g-terpinene (6).
— bisabolene (8-10) e cadinene (9).
— aldeidi 3,7-5,7 % calcolate come citrale (12); tra esse citrale (10) (11) (15), che è il più importante e caratteristico componente odoroso, inoltre citronellale (13) (15), le aldeidi ottilica, nonilica (14) (15), decilica, laurica (10) (15) (16) e due altre aldeidi non identificate (15).
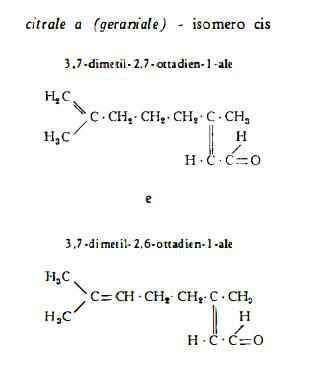

— metileptenone (17).
— alcooli terpenici; a-terpineolo (18) nella forma levogira (19): geraniolo, nerolo e citronellolo probabilmente come acetati (10): oltre a geraniolo, anche linalolo in forma di acetato, secondo Umney e Swinton (20). La presenza di linalolo, sia libero che come acetato, è stata in seguito contestata da Bohnsack (10). Probabilmente è presente anche un alcool sesquiterpenico primario (10).
— gli acidi acetico, caprico e laurico (10).
— esteri 2,7-3,5 % (12): antranilato di metile (21), oltre agli esteri acetici degli alcooli geraniolo, nerolo, citronellolo ecc., sopracitati.
— un composto C10H18O2 + 3H2O, trovato in olio deterpenato (22).
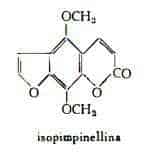
— nel residuo, rimanente dopo la distillazione dell’olio essenziale ottenuto per spremitura, sono state identificate le seguenti cumarine: citroptene (limettina), C11H10O4 (10) (15), isopimpinellina, C13H10O5 (15) ed altre cumarine non identificate (15) (23).
b) In olio essenziale dei frutti di California sono stati riconosciuti i seguenti componenti:
— d-limonene (24), come principale componente, 90,6 % (25), anche
66,59 % (25a), a-pinene 5% (24), anche 2,52% (25a), b-pinene
20,69 % (25a), g-terpinene (24) 6,88% (25a), p-cimene 1,68%, mircene 1,28%, terpinolene 0,14%, canfene 0,08% (25a).
— bisabolene (24) 1,5% (25) e cadinene (24), la presenza dei quali è stata anche negata (25a).
— aldeidi 2-3,7%, in media 2,8%, calcolate come citrale (24), tra cui oltre al principale componente, il citrale, le aldeidi nonilica, ottilica (24), undecilica (25a), un'aldeide non identificata (24) [forse identica al composto C10H18O2 trovato da Romeo (22) in olio essenziale di frutti italiani] ed infine un'aldeide di formula grezza C10H14O (circa 3 %) (25). Più recentemente in olio essenziale ottenuto per pressione a freddo è stato dimostrato essere presenti le aldeidi esilica, eptilica, ottilica, nonilica, decilica, undecilica, dodecilica, tridecilica, tetradecilica, pentadecilica, esadecilica, eptadecilica ed inoltre citronellale, nerale e geraniale (25b).
— metil-eptenone (25).
— geraniolo, linalolo (tracce) ed un alcool terziario, C10H18O2 (24).
— gli acidi acetico, caprilico e caprico, ottenuti dalla frazione degli esteri
(24). Assenza di acido formico (24).
— acetati di ottile, di citronellile e probabilmente anche di n-decile e propionato di linalile (25a).
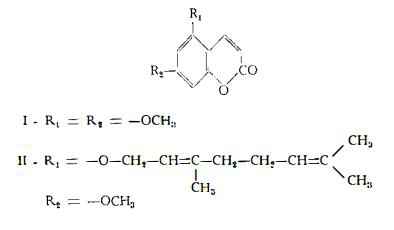
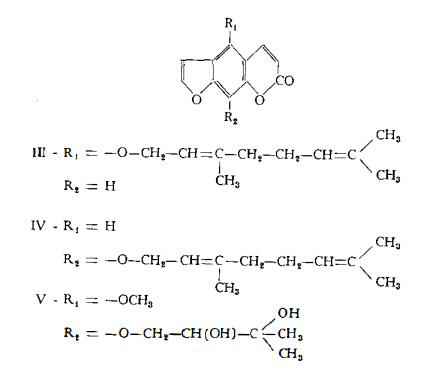
Dal residuo fisso dopo la distillazione delle frazioni volatili dell'olio ottenuto per espressione a freddo sono stati separati un composto amorfo non identificato, diverso dal citroptene (24) e le seguenti cumarine; 1 ) citroptene (1), C11H10O4, (53,2 mg %), identico al composto già isolato dall'olio essenziale italiano; 2) 5-geranossi-7-metossicumarina (II), C20H24O4 (116 mg%), in cui l'identità del geranossile è dubbia; 3) 5-geranossipsoralene (III), C21H22O4, (90 mg %); 4) 8-geranossipsoralene (IV), C21H22O4, (59,3 mg %): 5) biacangelicina (V), C17H18O7, (9 mg %); 6) due cumarine non identificate (rispettivamente 2,5 e 3,0 mg %) (26).
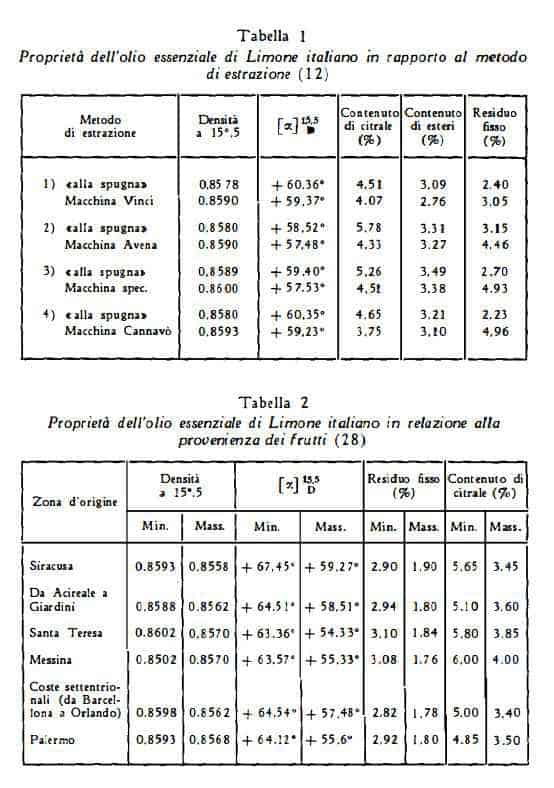
Le variazioni quali- quantitative, che si riscontrano per l'olio essenziale sono riferibili a diversi fattori, ma specialmente alle condizioni di maturazione dei frutti, al metodo di spremitura ed anche alla provenienza dei frutti stessi. Per gli oli italiani si è notato che all’inizio del principale periodo di raccolta (cioè dalla fine di novembre a tutto dicembre) si ha la qualità migliore di olio, cioè quella con il massimo contenuto di citrale, il più elevato potere rotatorio e con la più bassa percentuale di residuo fisso. Nei mesi successivi con la maturazione del frutto il titolo di citrale e l’indice di rotazione diminuiscono, mentre aumenta la quantità di residuo fisso (26a).
Anche gli oli provenienti da differenti località presentano diverse proprietà, specialmente per quanto riguarda il potere rotatorio (12).
Particolarmente elevate sono le differenze nella qualità dell’olio che dipendono dal metodo di estrazione (12) (27). Tra i metodi meccanici di spremitura il metodo delle «sfumatrici» (con cui si lavora sulla sola buccia) dà risultati nettamente superiori rispetto al metodo delle «pellatrici» (agenti sul frutto intero) e produce olio di qualità, che si avvicina a quella dell'olio migliore, ottenuto per spremitura a mano (processo «alla spugna») (12).
Dal confronto tra campioni di olio essenziale italiano e di olio di California sono risultati migliori i primi, poiché nell’olio americano si sono rilevate in media quantità maggiori di residuo fisso (in media 0,5 % in più) e quantità inferiori di citrale (in media 1,7% in meno) e di esteri (in media 0,6% in meno) (24).
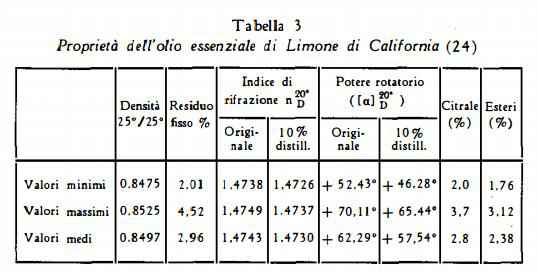
Dall’esame di 73 campioni di olio di Limone, provenienti da 7 zone della California, Poore (24) ha ottenuto i dati analitici raccolti nella tabella 3.
Nell’olio bene conservato il rapporto alcooli liberi/citrale è di circa 0,3. In olio deteriorato si ha una diminuzione del contenuto di citrale, accompagnato da un aumento degli alcooli, per cui il rapporto alcooli liberi/ citrale assume valori varianti da 0,7 a 1,2 (29).
Per deterpenazione di un olio essenziale con il 5,35 % di citrale (30) si è ricavato un olio deterpenato con il 40,5-43,2% di citrale. La successiva eliminazione dei sesquiterpeni ha dato una resa del 5,36% di olio rispetto alla quantità dell'olio originale completo ed un contenuto di citrale pari al 60,5%.
Da olio italiano, prodotto con il metodo alla spugna, si è ottenuto olio deterpenato. avente i seguenti componenti (31):

Secondo la Face (32), l'olio di Limone deterpenato può però avere composizione notevolmente diversa in rapporto alla provenienza dei frutti ed al metodo di spremitura dell’olio originale.
Nei processi di deteriorazione dell’olio essenziale si forma p-cimene per ossidazione del g-terpinene (32a).
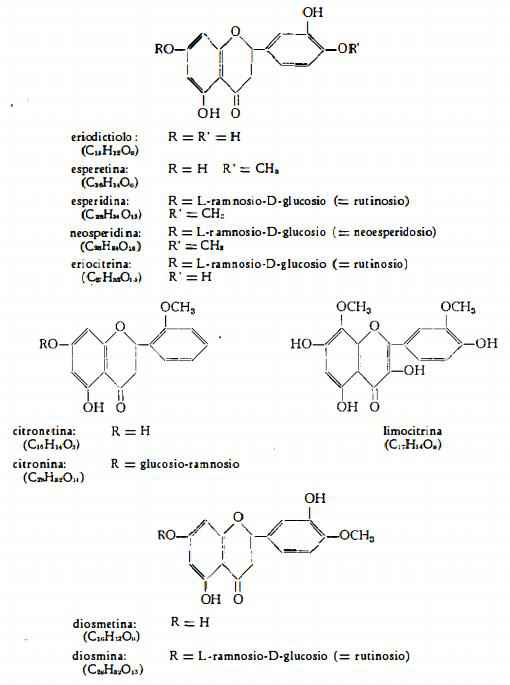
Flavonoidi
Nella scorza dei frutti di Limone sono contenuti inoltre alcuni flavonoidi: i flavanoni citronina (33) (34), esperidina (35-38), un nuovo glucoside dell’eriodictiolo (eriocitrina) (38), neoesperidina (39), il flavone diosmina (38) ed il nuovo flavonolo limocitrina (40). In un primo tempo è stata isolata «citrina», miscela di glucosidi flavonoidi (35-37), in cui sono stati trovati i flavanoni esperidina ed «eriodictina», quest’ultimo considerato come glucoside dell’eriodictiolo. Eriodictiolo (3’,4’,5,7-tetraossiflavanone) in forma di L-ramnoside («eriodictina») è stato isolato da Mager (41), ma non è stato trovato da Horowitz (38), che invece ha rilevato la presenza dello stesso eriodictiolo combinato come 7-b-rutinoside ed ha proposto per questo nuovo glucoside il nome di eriocitrina.
Da g 200 di flavonoidi totali, previa idrolisi enzimatica, sono stati estratti g 5 di eriodictiolo (42) .
Horowitz (38) ha confermato la presenza di esperidina (7-rutinosido-esperetina) ed ha inoltre isolato diosmina (7-rutinosido-diosmetina). Sono stati inoltre identificati neoesperidina (7-neoesperidosido-esperetina) (39): citronina (7-glucoramnosido-citronetina) (33) (34) ed un nuovo glucoside del flavonolo limocitrina (40). Dal Citrus limonum var. ponderosa Hort. è stato estratto lo 0,13% di citronina (33).
Altri componenti della scorza del Limone: pectine 10% (43), olio grasso, resina (44), vitamine A (45) e B (46), acido l-chinico (46 a); stachidrina, C7H13O2N, isolata come cloridrato in quantità pari allo 0,01 % nella sostanza secca (47). Enzimi: in prevalenza per ossidasi (46); anche catalasi e ossidasi (48); la presenza di ossidasi è stata contestata da Willimott e Wokes (49); più recentemente sono stati identificati pectinesterasi (50) e decarbossilasi dell’acido glutammico (51). Sostanze ipo- ed iper-glicemizzanti di natura chimica non definita (52).
Proprietà farmacologiche ed impiego terapeutico
L’azione farmacologica e terapeutica del Limone (scorza del frutto) è dovuta in gran parte all’essenza contenuta nell’esocarpo del frutto. Essa è dotata di una notevole attività sul sistema nervoso centrale, attività che è stata indagata soprattutto da Cadéac e Meunier (53) i quali trovarono che, somministrata a dosi opportune, determina nell’uomo uno stato di eccitazione iniziale, seguito da depressione e da ipnosi.
Le dosi di 50-80 gocce sono sufficienti per determinare nell'adulto, 10 minuti dopo la somministrazione, un'eccitazione cerebrale e muscolare cui segue, dopo 30’ circa, ottundimento delle facoltà mentali e, dopo un’ora, il sonno. Il completo ritorno alla norma avviene di solito, dopo 3 ore.
Boudran (54) indica la dose di g 12,4 come la massima che può essere somministrata nell’adulto. Tuttavia le applicazioni pratiche della essenza di Limone non derivano da questa attività sul sistema nervoso centrale, attività comune del resto a molti altri oli essenziali, ma piuttosto alla sua notevole azione batteriostatica e battericida verso numerosi tipi di germi patogeni.
Il merito di aver studiato per primo l’essenza di Limone sotto questo aspetto, spetta forse a Chamberland (55), le cui ricerche furono seguite poi da quelle di Cadéac e Meunier (53) e da molti altri AA. fra i quali Kobert (56), Cavel (57), Morel e Rochaix (58 e 59), Courmont e coll. (60), School e Kusama (61), Martindale (62), Rideal e Sciver (63), Collier e Nitta (64), Malowan (65), Tecce (66), Klosa (67), Sangiorgi (68), Harvey (69), Risler e Coursier (70), Gattefossé (71) ecc. [ved. anche Muller (72)]. Dai risultati ottenuti da questi AA. appare che la essenza di Limone è notevolmente attiva contro diversi gruppi di germi patogeni (bacilli della morva, di Ebert, di Kock, difterico, pseudodifterico, coli, dissenterico, prodigioso, sul Vibr. colerigeno, sul meningococco, sugli stafilococchi, sul gonococco e sul Micrococco tetrageno).
L’attività antibatterica dell’essenza di Limone può essere elevata facendo agire su di essa ossigeno o aria ozonizzata in particolari condizioni, in maniera da elevare il tenore dei perossidi [ved. Rovesti (73)], oppure con l’associazione di altre essenze (Timo, Bergamotto, Benzoino), come risulta da ricerche cliniche e batteriologiche di diversi autori che hanno sperimentato con preparati derivati appunto dall’associazione di essenza di Limone con altre essenze [Garosi (74). Benedicenti (75), Fiorentino (76), Angelino (77), Trivellini (78), Manna (79), Santillo (80), Cattaneo (81), Baravalle (82), Virdis (83), Buscemi (84), Biancheri e Oberti (85), Puntoni (86), Ricci (87), Martini (88), Rubbiani e Riva (89), Nocentini (90), Caffau (91), Graziadei-Celoria (92)].
Preparati risultanti da queste associazioni in dispersione acquosa, hanno trovato applicazione pratica sia come disinfettanti ambientali che in terapia, per uso esterno e interno. Per uso esterno sono stati impiegati in chirurgia per la preparazione del campo operatorio e in dermatologia nel trattamento di alcune infezioni della pelle (piodermiti ecc.) casi nei quali questi preparati presentano il vantaggio di non limitare la loro azione alla sola superficie ma di essere facilmente assorbiti e di estenderla quindi a tutto lo spessore della cute.
Sotto forma di pomata e per frizioni, l’essenza di Limone è stata impiegata anche per la sua azione leggermente revulsiva, come coadiuvante nella terapia del reumatismo, di alcune nevralgie e mialgie ed anche in cosmetologia sotto forma di creme.
Sotto forma di varie preparazioni galeniche (soluzioni saponose, ovuli, oli medicati) l’essenza di Limone, sola od associata con altre essenze, ha trovato utile applicazione in ostetricia e in ginecologia (81) e, sotto forma di colluttori, aerosol, pasticche, dentifrici ecc., in otorinolaringoiatria (93) e in odontoiatria.
Per uso interno l’essenza di Limone ha trovato impiego come balsamico, antisettico ed eupneico in alcune affezioni dell’apparato respiratorio [bronchiti subacute e croniche, alcune forme settiche specifiche e aspecifìche (Carpi (94)] e nella terapia di alcune infezioni delle vie urogenitali [Cattaneo (81)]. Da ricerche di Mascherpa (95) e di Rossi (96) risulta che il limonene, componente dell’essenza di Limone, somministrato per os, viene eliminato in parte con l’aria espirata e in parte con la secrezione urinaria sotto forma di un prodotto solfoconiugato.
La scorza di Limone, per il suo contenuto in composti flavonoidi, quali la citrina, può esercitare anche una non trascurabile azione sulla permeabilità vasale. Binet e Tanret (97) trovarono utili i preparati da essa ottenuti, nella terapia dell’ascite cirrotica, ciò che fu in seguito confermato da Laederich (98) e dalla Benoit (99).
Fisher e McKinley (52) trovarono che nell’esocarpo, nell’endocarpo e nel succo di Limone, di Arancio e di Cedro, sono contenute sostanze ad azione ipoglicemizzante e iperglicemizzante e che a seconda del rapporto fra il contenuto di ognuna di queste due sostanze nei preparati impiegati, può prevalere l’azione dell’una o dell’altra. Con adatti processi di estrazione e di purificazione, gli AA. sarebbero giunti a separare le due sostanze.
Per quanto l’argomento non rientri in questo capitolo in cui si tratta particolarmente della corteccia, ricorderemo che Cannavò e Ortoleva (100) dimostrarono che di un’azione ipoglicemizzante, evidente specialmente negli iperglicemici, è dotato anche l’acido citrico di cui il succo di Limone è notevolmente ricco.
Accenneremo anche alla nota azione antiscorbutica di cui è dotato il succo di Limone per l’elevato contenuto in acido ascorbico, azione già nota molto prima dell’identificazione della vitamina C.
I preparati di scorza di Limone (estratti, tinture) trovano largo impiego come amaro-aromatici, tonici ed eupeptici e nella tecnica galenica come correttivi dell’odore e del sapore di preparati che contengono sulfamidici, acido paraminosalicilico, vitamina B1 e altre vitamine, barbiturici, antistaminici, olio di fegato d merluzzo, estratti di Gelsemio e di Valeriana, sostanze acide, sostanze inodore, insipide e amare, sostanze amarosaline non alcaline [Capra (101].
Estratti e preparati vari
a) Estratto fluido alcool-idrosolubile (g 1 = XLVII ggt).
Dosi: g 1-2 o più pro dose.
b) Estratto fluido (g 1 = XLVII gtt).
Dosi: come sopra.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido limone………………………………………… g 20
Alcool di 70° …………………………………………………………. g 80
(g 5-10 o più pro dose).
Sciroppo
Estratto fluido limone alcool-idrosolubile……………………. g 5
Sciroppo semplice F.U……………………………………………….. g 95
(ad libitum).
BIBLIOGRAFIA
(1) GUENTHER E.. The Essential Oils, 1949, voi. Ili, pp. 83 e 92 – (2) BURGESS H. E., PAGE T. H., /. Chem. Soc,. S5, 1328. 1904 – (3) WALLACH, Lieb. Ann., 227, 29a 1885 – (4) Ber. Schimmet. aprile 1897. 19; ottobre 1897. 22; aprile 1902. 24; ottobre 1902. 33 – (5) BURGESS e CHILO, Chem. Drugg.. 62, 476. 1903 . (6) GILDEMEISTER e MULLER, Festschrìft Ono Wallach, Gottingen, 441, 1909; Ber. SchimmeL, ottobre 1909, 49 – (7) Ber. Schimmel, ottobre 1897, 22 – (8) OLIVERI. Gazz. Chim. Itai., 21, 318, 1891 – (9) GILDEMEISTER e MULLER. Festschrift Otto Wallach, Gottingen, 109, 448 e 449; Ber. Schimmel, ottobre 1909, 50 – (10) BOHNSACK, Ber., 77 B. 428. 1944 – (11) BERTRAM. Ber. Schimmel. ottobre 1888, 17 – (12) LA FACE F., Boli. Uff. Stai- Ind. Ess. Deriv. Agrumari. Reggio Calabria, 5, 182. 1930 – (13) DOEBNER, Arch. Pharm., 232, 688, 1894; Ber., 27, 352, 1894 – (14) SODEN e ROJAHN. Ber., 34. 2809, 1901 * 05) CALVARANO M., Essenze deriv. agrumari, 27, 173, 1957 – (16) ELZE, Riechstoff Ind., 181, 1926; Ber. Schimmel, 1927, 43 – (17) Ber. Schimmel, ottobre 1902, 35 – (18) Ber. Schimmel, ottobre 1902, 812 – (19) PAOLINI, Gazz. Chim. Ita!., 55. 804. 1925 – (20) UMNEY e SWINTON. Pharm. J., 61. 196, 370, 1898 – (21) PARRY. Chem. Drugg., 56. 993, 1900 – (22) ROMEO, Ann. chim. appi., 15, 305, 1925 – (23) RODIGHIERO G.. CAPORALE G. e RAGAZZI F., Isr venero sci. lettere ed arti. Ili, 125, 1952; Chem. Abs.. 48. 14116 g, 1954 – (24) POORE, U.S. Dept. Agr. Tech. BulL n. 241, marzo 1932 – (25) PING- HSIEN YEH, Am. Per/umer Essent. OH Rev., 65, 23. 1955; Chem. Abs.. 49, 7196, 1955 – (25a) CLARK J. R. e BERNHARD R. A., Food Research, 25, 389. 731, 1960; Manufact. Chem., 32. 463, 1961 – (25b) IKEDA R. M., ROLLE L. A., VANNIER S. H. e STANLEY W. L., J. Agr. Food Chem.. 10, 98, 1962; Chem. Abs., 57, 11618, 1962 – (26) STANLEY W. e VANNIER S. H., J. Am. Chem. Soc., 79, 3488. 1957 • (26a) AJON, Annali della R. Staz- sper. agrumicoli, e frutticoli.. Acireale. 8. 106. 1926 – (27) DONOVAN, Perfum. Essent. OH Record, 26, 1937 – (28) Ber. Schimmel, 34, 1925 • (29) GUENTHER E., The Essential Oils, 1949, voi. ni, p. 107 – (30) LEONE, KiV. Hai. ess. prof., 28, 5. 1946 – (31) ROMEO. Atti Congresso naz. chim. pura appi., 2, 870, 1926 – (32) LA FACE F.. comunicaz. privata: GUENTHER E.. The Essential Oils. 1949, voi. Ili, p. 109 – (32a) IKEDA R. M.. STANLEY W. L., VANNIER S. H. e ROLLE L. A., Food TechnoL, 15, 379. 1961; Chem. Abs., 56, 553 c, 1962 – (33) YAMAMOTO R. e OSHIMA Y.. /. Agr. Chem. Soc. Japan, 312, 1931 – (34) SHINODA S., SATO S., J. Pharm. Soc. Japan, 51, 78, 1931; JZ 139, 1932 – (35) RUSZNYAK S. e SZENT-GYORGYI A.. Nature, 138. 27. 1936 – Q6) BRUKNER V. e SZENT-GYORGYI A., Nature, 138, 1057, 1936 – (37) SZENT-GYORGYI A., Z. physiol. Chem., 255, 126, 1938 – (38) HOROWITZ R. M. e GENTILI B., J. Am. Chem. Soc., 79, 2803, 196 0 – <39) SARIN P. S. c SESHADRI T. R., /. Sci. ìnd. Res., 18 B. 129, 1959; Chem. Abs., SS, 22260, 1959 – (40) HOROWITZ R. M., /. Am. Chem. Soc.. 79, 6561, 1957; 7- Org. Chem., 26, 2899, 1961 – (41) MAGER A., Z. physiol. Chem., 274, 109, 1942 – (42) HOROWITZ R. M„ U.S. 2.817.318, 21 ottobre 1958; Chem. Abs., 53, 1648, 1959 – (43) PAECH K. e TRACEY M. V.: Moderne Methoden dcr Pflanzenanalyse, 1955, voi. II, p, 260 – (44) WEHMER C., Die Pflanzcnstoffe, II ed., p, 632 – (45) COOPER. Proc. Soc. ExpH. Biol. Med., 18, 243, 1921 . (46) WILLIMOTT e WOKES, Pharm. J„ 118, 770, 1927 – (46a) TING S. V. e DESZYCK E. J., Nature, 183. 1404, 1959; Chem. Abs., 55. 839, 1961 – (47) YOSHIMURA K. e TRIER G., Z. physiol. Chem., 77, 290, 1912 – (48) AJON, Riv. ital. ess. prof., 8, 87. 1926 – (49) WILLIMOTT c WOKES, Biochem. J., 20, 1008. 1926 – (50) ROUSE A. H. e ATKINS C. D., Proc. Florida State Hort. Soc., 67, 203, 1954; Chem. Abs., 49, 13371h, 1955 – (51) AXELROD B.. JANG R. e LAWRENCE J. M„ 1. Agr. Food Chem., 3. 1039, 1955; Chem. Abs., 50, 4423b, 1956 – (52) FISHER N. F. e MCKINLEY E. B., Proc. Soc. Exptl. Biol. Med.. 21, 248, 1924 • ERSPAMER V., Droghe e principi ipoglicemizzanti di origine vegetale – Quaderni di Fitoterapia, n. 5, Ed. Inverni & Della Beffa, Milano, 1943 • (53) CADÉAC e MEUNIER. Ann. Inst. Pasteur IH, 1889 • (54) BOUDRAN, Bull. sci. pharm., 236, 1902 – (55) CHAMBERLAND. Ann. Inst. Pasteur I, 153. 1887 – (56) KOBERT. Ber. Schimmel, 2, 157, 1906 – (57) CAVEL, Comp. rend., 827, 1918 – (58) MOREL e ROCHAIX, C. R. soc. btol.. 861, 1921 – (59) MOREL e ROCHAlX, Ibld., 933, 1922 – (60) COURMONT, MOREL e BAY, ibid., 1313, 1927 – (61) SCHOOL e KUSAMA, Philippine J. Sci-, aprile 1924 – (62) MARTINGALE, Perfum. Essent. OH Record, 266, 1910 – (63) RIDEAL e SCIVER, Ibld., 285, 1928 – (64) COLLIER e NITTA, Z. Hyg. u. Infektlonsk., 301, 1930 – (65) MALOWAN, ibid., 93, 1931 – (66) TECCE, Igiene Moderna, sett. 1936 – (67) KLOSA, Seifen Oele, Fette Wachse,. 432, 1951 – (68) SANGIORGI, Comunicai. Ist. Studi deriv. veget,, 1936 – (69) HARVEY E. H., Am. /. Pharm., 100, 524. 1928 – (70) RISLER e COURSIER, Contrib. à l'étude des huiles essent., Paris 1936, p. 17 • (71) GATTEFOSSÉ, Aroma Thérapie, Paris 1937 – (72) MULLER A., Die Physiol. u. Pharmak. Wirkungen d. Ath. Oele. Heidelberg 1951 – (73) ROVESTI P., /?iV. ital. ess. prof., 39, 605, 1957 – (74) GAROSI L.. Preparai, del campo operatorio con le essenze vegetali • Esperienze compiute negli istituti di Batteriologia, Anatomia patologica dell'Università di Roma e presso l'Istituto Regina Elena di Roma • (75) BENEDICENTI A., Atti Soc. Sden. e Leti, di Genova, 2, 1, 1937 – (76) FIORENTINO G.. Rass. Med. Sarda, n. 8, 1937 – (77) ANGELINO P., Uarte ostetrica, n. 3, 1937 – (78) TRIVELLINI A., Atti e Mem. Soc. Lombarda di Chir., 5, 3. 1957 – (79) MANNA A., Policlinico, sez. prat., 45. 32, 1938 – (80) SANTILLO T.. Giorn. di Med. mllit., ott. 1938 • (81) CATTANEO L., Pensiero Medico, 27, 2, 1938 – (82) BARA VALLE C., Giorn. Med, deirAlto Adige, n. 5, 1938 – (83) VIRDIS M., Gazz- degli Osp. e delle Clin., n. 16, 1938 – (84) BUSCEMI F.. La settimana Med., 27, 25, 1939 – (85) BIANCHERI T. c OBERTI G., Accad. Med., n. 10, 1940 – (86) PUNTONI V., Le Forze Sanitarie, 10. 12, 1941 – (87) RICCI V., Atti della R. Accad. Ligure di Scien. e Lett., 1, 2, 1941 – (88) MARTINI G., Comunicai, al IV Congr. Naz. di Farm. Ospedaliera Catania, sett. 1958 – (89) RUBBIANI M. c RIVA G., Min. GinecoL, 10, 21. 854, 1958 – (90) NOCENTINI P., Policlinico, sez. chir., 65. 141, 1958 – (91) CAFFAU G., Min. Chir., 14. 13. 854, 1959 – (92) GRAZIADEI- CELORIA M., Nuovi Ann. di Igiene e Microbio!.. 11, 2, 1960 – (93) NOVI J., cit. da ROVESTI l.c. – (94) CARPI, cit. da ROVESTI l.c. – (95) MASCHERPA P.. L'Ateneo Parmense, 8, 2, 123. 1936; Boli. Soc. Med. Chir., Catania, 5, 6, 398, 1937 – (96) ROSSI A., // Farmaco, 2, 2. 108. 1947 – (97) BINET L. c TANRET P., Rev. de Phytathér., 9, 57, 147. 1945 – (98) LAEDERICH, cit. da BINET c TANREI (97) – (99) BENOIT N., Thése de Paris 1943, cit. da BINET e TANRET (97) – (100) CANAVÓ C. e ORTOLEVA G., Boll. soc. ir. biol, sper., 14, 740, 1939, cit. da ERSPAMER V. l.c. (ved. 52) – (101) CAPRA C., Il Farmaco, 13, 499, 1958.


