Strofanto
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Strophanthus Kombé Oliver – Fam. Apocinacee/Echitoidee/Echitidee)
Strofanto- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Strophanthus, dal greco strofh = giro o strofas = tortuoso e anqos = fiore, per i lobi del fiore contorti a spirale.
Kombé – è il nome del veleno per le frecce, ricavato dai semi della pianta.
Nomi volgari – Strophantus seed (ingl.), Strophanthusamen (ted), semilla de estrofanto (spagn.).
Habitat – Bacino dello Zambesi e del suo affluente Chiré (o Shiré), Kenya, Tanganika, Mozambico, Niassaland, regioni dei Grandi Laghi.
Arbusto.
N.B. – Lo Strophanthus Kombé, specie creata da Oliver, può essere considerata una varietà o forma dello Strophanthus hispidus DC. Le differenze sono minime. Nella regione Tchad (o Ciad) grande palude del Sudan centrale, esistono piante che passano indistintamente dall'una all’altra specie e si può ammettere, secondo Blondel e lo stesso Oliver, che il Kombè non è che una forma orientale dell’hispidus. Le due piante non sono ben definite se non nelle zone estreme dell’ovest e dell’est.
Parti usate – I semi (Strophanthi semen F.U.).
Componenti principali
Glucosidi con nucleo sterolico congiunto con l’anello lattonico pentatomico, caratteristico delle genine digitaliche. Essi si possono distinguere nei quattro gruppi seguenti a seconda della genina che li costituisce:
1) Glucosidi della strofantidina: K-strofantoside, K-strofantina-b, cimarina, gluco-erisimoside, erisimoside.
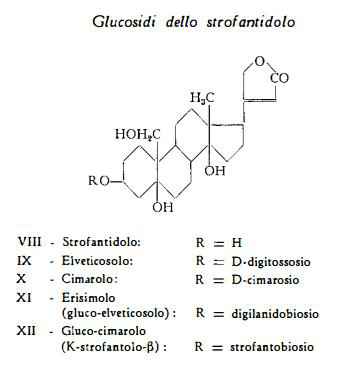
2) Glucosidi dello strofantidolo: glucocimarolo, cimarolo, erisimolo,
3) Glucosidi della periplogenina: emicimarina.
4) Glucosidi della allo-periplogenina: allo-periplocimarina, allo-emicimarina.
La conoscenza dei glucosidi delle diverse specie di Strophanthus è rimasta per lungo tempo confusa per la dubbia origine botanica dei semi usati dai diversi ricercatori.
Praser (1) fu il primo ad isolare una strofantina amorfa da semi di Strofanto, probabilmente di Strophanthus Kombé. Lo stesso A. (2) più tardi (1887-1889) ottenne la cristallizzazione di una strofantina, cui attribuì la formula C20H34O10.
Hardy e Gallois (3) nel 1877 estrassero un prodotto cristallizzato dallo Strophanthus gratus e nel 1888 Catillon (4) e Arnaud (5) isolarono, in forma cristallina, la strofantina dello S. Kombé e quella dello S. gratus. Arnaud (6) negli anni successivi approfondì le ricerche su queste sostanze, studiandone la composizione centesimale, dopo d'avere riconosciuta, nello ouabaio, la presenza di un altro glucoside, l'oubaina (7).
Nel 1898 Kohn e Kuhlich (8) separarono un glucoside cristallizzato da semi di identità non sicura, ma probabilmente di Strophanthus hispidus.
Thoms (9) riconobbe la costanza di composizione dell'ouabaina di Arnaud, derivante dallo Strophanthus gratus, in confronto con la diversità di composizione delle strofantine delle altre specie di Strofanto e propose di designare ciascuna sostanza con la lettera iniziale della specie originaria: G-strofantina (S. gratus), H-strofantina (S. hispidus), K-strofantina (S. Kombé).
I lavori di Feist (10) degli anni 1898-1900 sulla strofantina Boehringer, ricavata dallo Strophanthus Kombé, e le ricerche di Heffter e Sachs (11) del 1912 e di Brauns e Closson del 1914 (12) sui glucosidi dei semi dello Strophanthus Kombé e dello S. hispidus misero in evidenza i rapporti esistenti tra le diverse strofantine e portarono alla conoscenza dei primi dati riguardanti la struttura chimica delle molecole glucosidiche.
Seguirono le ricerche di Windaus e coll. (13) nel 1915, di Thoms e Unger (14) nel 1924, i fondamentali lavori di Jacobs e coll. dal 1922 al 1935 (15-23), di Kon (24) e di Tschesche (25) nel 1934 sulla struttura della strofantidina, gli studi di Stoll e coll. (26) nel 1937 circa il K-strofantoside, di Rabald e Kraus (27) nel 1940 sulla composizione dello strofantidolo, di Reichstein e coll. (28-30) negli anni 1944-1946 su altri quattro glucosidi dei semi dello Strophanthus Kombé, denominati emicimarina, allo-periplocimarina, allo-emicimarina (28) (29) e cimarolo (30), e le più recenti indagini di Kaiser e coll. nel 1959 (31) e nel 1961 (32), che hanno condotto all’isolamento del gluco-erisimoside, erisimoside, gluco-cimarolo ed erisimolo.
Si deve infine a Reichstein e coll. (33-73) uno studio approfondito, tuttora in corso, dei glucosidi di numerose altre specie di Strophanthus, tra cui Strophanthus amboensis (Schinz) Engl. et Pax. (33-35), S. arnoldianus De Wild. et Th. Dur. (36), S. Boivini Baill. (37) (38), S. caudatus (Burm. ex L.) Kurz.. (39), S. congoensis Franch. (40), S. divaricatus (Lour.) Hook. et Arn. (41) (42), S. Eminii Asch. et Pax. (43), S. Gerrardi Stapf. (44), S. gracilis K. Schum. et Pax. (45), S. hispidus A. P. DC. (46), S. hypoleucus Stapf. (47), S. intermedius Pax. (48) (49), S. Ledienii Stein. (50), S. mirabilis Gilg. (51) (52), S. Nicholsonii Holmes. (53), S. sarmentosus A. P. DC. (54-63), S. sarmentosus var. glabriflorus Monach. (58), S. sarmentosus var. major Derwévre (60), S. Schuchardtii Pax. (64) (65), S. speciosus (Ward. et Harv.) (66) (67), S. Thollonii Franch. (68-70), S. Vanderijstii Staner. (71), S. Welwitschii (Baill.) K. Schum. (72), S. Wightianus Wall. (73).
1) Glucosidi della strofantidina:
A – K-strofantoside – K-strofantina-b – Cimarina
K-strofantoside (K-strofantina-g), C42H64O19, così denominato da Stoll. Renz e Kreis (26), che l’hanno isolato dai semi dello Strophanthus Kombé, è stato più recentemente estratto anche dai semi dello Strophanthus arnoldianus da Schindler e Reichstein (36). Rabald e Kraus (27) l’hanno indicato con il nome di K-strofantina-g.
K-strofantina-b, C36H54O14, è stata estratta dai semi dello S. Kombé da Jacobs e Hoffmann (74).
Cimarina (K-strofantina-a), C30H44O9, è la sostanza isolata da Windaus e Hermann (13) dai rizomi dell'Apocynum cannabinum, ma come prodotto grezzo era già stata separata dai semi dello Strophanthus Kombé (75). Jacobs e Hoffmann (74) l'hanno ottenuta in forma pura dalla K-strofantina grezza. E’ stata isolata anche dai semi dello Strophanthus hispidus P. DC. (76), dello S. Eminii Asch. e Pax. (77) (78), S. Nicholsonii Holm. (79), S. hypoleucus (47), S. mirabilis Gilg. (52), S. arnoldianus (36), S. Ledienii (50), dalla Periploca graeca (80), dall'Adonis amurensis (81) e dall'A. vernalis (82).
Per idrolisi acida del K-strofantoside si producono l'aglucone strofantidina e strofantotriosio, costituito da 1 mol. di cimarosio e da 2 mol. di glucosio. L’idrolisi mediante strofantobiasi, l'enzima preparato da Jacobs e Hoffmann (83) dallo Strophanthus Courmontii, produce cimarina e 2 mol. di glucosio. La scissione enzimatica con a-glucosidasi libera invece una sola molecola di glucosio con formazione di K-strofantina-b. Stoll, Renz e Kreis (26) hanno dato il seguente schema per la scissione del K-strofantoside:
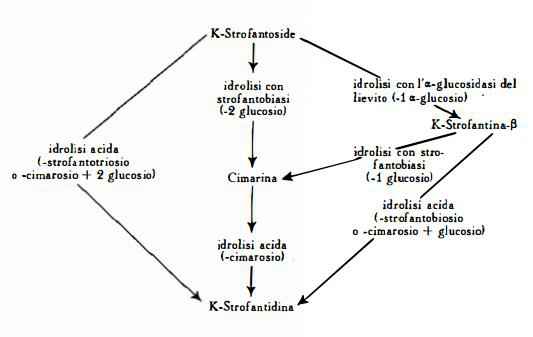
Il K-strofantoside, la K-strofantina-b e la cimarina contengono quindi lo stesso aglucone strofantidina e differiscono nella composizione della catena zuccherina. Nel K-strofantoside, il più complesso dei tre glucosidi, la strofantidina è legata con strofantotriosio (1 mol. di cimarosio + 2 mol. di glucosio), nella K-strofantina-b è legata con strofantobiosio (1 mol. di cimarosio + 1 mol. di glucosio) e nella cimarina con 1 mol. di cimarosio.
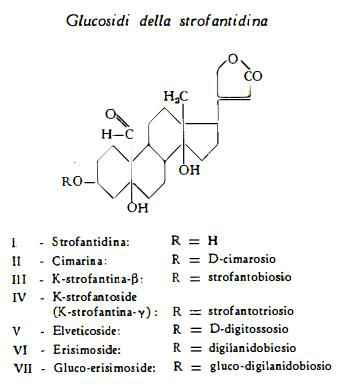
B – Gluco-erisimoside – Erisimoside
Gluco-erisimoside, C41H62O19, è stato separato dai semi non fermentati ed è stato identificato chimicamente da Kaiser e coll. (32). Esso è costituito dalla genina strofantidina combinata con gluco-digilanidobiosio (2 mol. di glucosio + 1 mol. di digitossosio).
Erisimoside (gluco-elveticoside), C35H52O14, è stato isolato dai semi dello Strophanthus Kombé da Kaiser e coll. (31) (32). Fu denominato erisimoside da questi stessi AA., essendo stato riconosciuto identico all'erisimoside estratto da AA. russi (84) dall'Erysimum diffusum Ehrh. Esso è stato identificato da Kaiser e coll. (32) alla 3-glucosido-digitossosido-strofantidina estratta dall’Erysimum perofskianum Fisch. et Mey (85) e dall’Erysimum crepidifolium (32).
L'elveticoside, C29H42O9, già isolato dall'Erysimum helveticum (Jacquin) A. P. DC. (86) è stato ottenuto, previa scissione enzimatica, anche dai semi dello Strophanthus Kombé (31) (32) (87), evidentemente come derivato della scissione idrolitica dell'erisimoside. E' la 3-b-D-digitossosido-strofantidina (86).
La genina strofantidina, C23H32O6, ha assunto diversi nomi — corcorina (88), apocinamarina (89), cinotossina (90), cimarigenina (13), convallatossigenina (91) — in relazione ai nomi delle diverse droghe Corchorus capsularis (88), Apocynum androsaemifolium (89), A. cannabinum (90), Convallaria majalis (91), da cui è stata estratta. Lo studio della composizione chimica della strofantidina è stata oggetto di numerosi lavori ad opera specialmente di Jacobs e coll. (15-22). Per essa è stata stabilita la formula di struttura I (23-25).
Il) Glucosidi dello strofantidolo:
Gluco-cimarolo – Cimarolo – Erisimolo
Gluco-cimarolo (K-strofantolo-b), C36H56O14, estratto dai semi non fermentati dello S. Kombé da Kaiser e coll. (31) (32), è composto dall’aglucone strofantidolo e da strofantobiosio.
Cimarolo, C30H46O9, scindibile per idrolisi in strofantidolo, C23H34O6, e cimarosio, C7H14O4, è stato ottenuto dai semi dello S. Kombé (30), dello S. Nicholsonii Holm. (79), S. hypoleucus (47), S. Eminii (51) (77), S. mirabilis (52), S. arnoldianus (36) e dello S. Ledienii (50).
Erisimolo, (gluco-elveticosolo), C35H54O14, separato dai semi di S. Kombé da Kaiser e coll. (31) (32), è composto di 1 mol. di glucosio e di elveticosolo (D-digitossoside dello strofantidolo), già ottenuto da Reichstein e coll. (87) per riduzione dell'elveticoside.
Strofantidolo, C23H34O6, l'aglucone dei tre glucosidi sopracitati, è stato così denominato da Rabald e Kraus (27), che l'hanno ottenuto per riduzione della strofantidina e ne hanno identificata la formula di struttura VIII, differente da quella della strofantidina per la presenza di un gruppo —CH2OH al posto del gruppo —CHO in posizione 19.
III) Glucosidi della periplogenina:
Emicimarina
Emicimarina (E-strofantina), C30H46O9, è stata isolata dai semi dello Strophanthus Eminii Asch. e Pax. (92) e successivamente anche dai semi dello S. Kombé (28) e da altre specie di Strofanto: [S. Nicholsonii Holm. (79), S. hypoleucus Stapf. (47), S. gracilis (K. Sch.) e Pax. (93), S. mirabilis Gilg. (52), S. Ledienii Stein. e S. Vanderijstii Staner. (50) (71)]. E’ la 3-D-digitalosido-periplogenina (29).
La genina periplogenina, C23H34O5, è il derivato sterolico con formula di struttura XIII, definita in seguito agli studi di Jacobs e coll. (80) (94) (95), di Tschesche (25) e di Reichstein e coll. (29) (96).
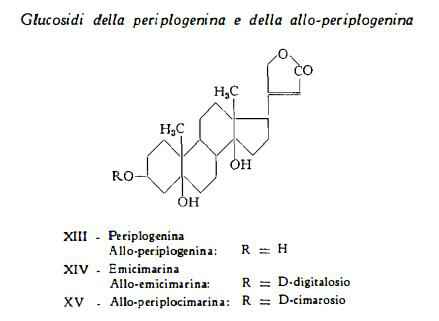
IV) Glucosidi della allo-periplogenina:
Allo-periplocimarina – Allo-emicimarina
Allo-periplocimarina, C30H46O8, estratta dai semi dello S. Kombé da Katz e Reichstein (28), è stata identificata dagli stessi AA. (29) con la 3-D-cimarosido-allo-periplogenina.
Allo-emicimarina, C30H46O9, che per idrolisi si scinde con formazione di allo-periplogenina e di D-digitalosio, è stata dapprima isolata dallo S. Eminii Asch. et Pax. (78) (92) e successivamente anche dallo S. Kombé (28).
La genina allo-periplogenina, C23H34O5, isomero ottico della periplogenina (96), è stata ottenuta in forma pura come aglucone della alloemicimarina (28) (29) (78).
Contenuto di glucosidi dei semi
Titoli di glucosidi totali, varianti dal 2 al 10%, sono stati trovati per i semi dello Strophanthus Kombé (97): secondo i dati della letteratura risultano valori raggiungenti anche il 9 % ca. (99).
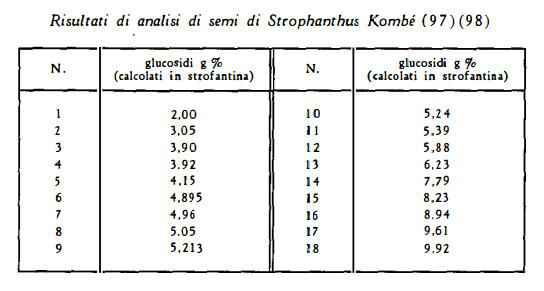
Cimarina nella quantità del 2,3-2,5 % è stata estratta dai semi (100).
Da semi non fermentati Kaiser e coll. (31) hanno ricavato gluco-elveticoside nella proporzione del 15-25% dei glucosidi totali, insieme con circa 1 % di gluco-elveticosolo e gluco-cimarolo.
Da 400 g di semi, dopo fermentazione, Reichstein e coll. (87) hanno avuto la seguente resa di glucosidi: cimarina g 2-3, periplocimarina mg 100, cimarolo mg 300, emicimarina mg 200, 17-a-cimarina mg 30, elveticoside mg 200 e 17-a-elveticoside mg 100.
Glucosidi grezzi, solubili in cloroformio, sono stati estratti nella quantità del 4,5 % dai semi; da questa frazione grezza è stato ottenuto il 2,8 % di cimarolo (30),
Altri componenti
Oltre ai glucosidi, nei semi dello S. Kombé sono stati trovati i seguenti componenti: trigonellina (101), emulsina, lipasi, esterasi, strofantobiasi (b-glucosidasi), a-glucosidasi, perossidasi, catalasi, fenolossidasi, reduttasi (99) (103); dubbia è la presenza di glutatione (99) (102); 31,4-32,3% (104), anche 34% di olio grasso (99): resina, mucillaggine, protidi, amido, 4,2% di ceneri (99).
Nell’olio grasso 21 % di acidi saturi ( 70% di acido stearico e 30% di acido palmitico), 73% di acidi insaturi ( 80 % di acido oleico, 20 % di acido linoleico); frazione insaponificabile 1,37 % con un fitosterolo di p.f. 137° (105).
Proprietà farmacologiche ed impiego terapeutico
Sembra che debba attribuirsi a Sir John Mirk che nel 1861 fece parte della spedizione del Vescovo missionario Makenzie nel centro dell’Africa, il merito di aver identificato nei semi di Strofanto la materia prima con la quale gli indigeni di quelle regioni preparavano il micidiale veleno per le loro frecce.

Fu però il Reverendo Orazio Waller che, facendo parte della stessa spedizione, casualmente ne scoperse l’azione cardiotonica e il curioso episodio così viene riferito dal Benedicenti (106):
«…Avendo egli attraversato durante i suoi viaggi alcuni terreni paludosi e sentendosi sfinito, si pose a giacere nella sua tenda in preda a malessere e con polso frequente. Alzatosi dopo un po’ per lavarsi i denti, avvertì durante questa operazione un sapore amaro in bocca e s’avvide che lo spazzolino si era imbrattato con la polvere del veleno Kombé che egli aveva raschiato dalle frecce e che teneva in un pacchetto con tutto il resto, nel suo sacco da viaggio. Quasi subito osservò che, per l’involontaria ingestione del veleno, il suo polso si era regolarizzato e pensò che questa sostanza potesse essere un buon rimedio per il cuore».
I semi di Strofanto che nel 1863 furono portati in Inghilterra dal Kirk, vennero studiati nello stesso anno dal Sharpey e quindi da Hilton Fagge e da Stevenson nel 1865.
Queste prime ricerche farmacologiche vennero completate quattro anni dopo nell’Istituto di Materia Medica di Edimburgo dal Fraser cui lo stesso Waller ed il missionario Buchanan poterono inviare un più abbondante materiale da esperimento.
Fu appunto il Fraser che riuscì a dimostrare chiaramente l’azione dello Strofanto sul cuore e fu in seguito a queste ricerche che lo Strofanto entrò definitivamente nell’uso terapeutico come il miglior succedaneo della Digitale.
Al Fraser va anche attribuito il merito di aver isolato la prima strofantina amorfa [(vedi parte chimica (1, 2)], da certi semi di Strofanto, sull’origine botanica dei quali però egli s’ingannò, attribuendo la strofantina da lui estratta ai semi di Str. hispidus, mentre in realtà egli usò per l’estrazione, semi di Str. Kombé. Errori di questo genere furono piuttosto frequenti durante il periodo iniziale della strofantinoterapia e furono senza dubbio dovuti alla molteplicità delle specie da cui provenivano i semi stessi, ancora imperfettamente noti dal punto di vista botanico ed alla variabilità dei prodotti di estrazione che se ne ottenevano.
A queste ragioni debbono essere attribuiti anche gli inconvenienti terapeutici, talvolta gravi, che non raramente si osservavano durante questo periodo e le non del tutto ingiustificate diffidenze che sorsero e che nonostante i pregevoli studi di numerosi autori dell’epoca, ritardarono il divulgarsi di questa nuova terapia la cui diffusione coincise con l’isolamento della ouabaina dalla Acocanthera ouabaio avvenuta nel 1888 per merito di Arnaud (5).
L’azione farmacologica dei glicosidi strofantinici è fondamentalmente simile a quella dei glicosidi digitalici e per ciò rimandiamo a quanto è stato detto a proposito della Digitalis purpurea e della Digitalis lanata, mentre l’aggiunta di alcune notizie sulle più recenti acquisizioni a proposito dell’influenza che i glicosidi digitalici in generale e le strofantine in particolare esercitano sul trasporto cationico nel muscolo cardiaco, varrà a completare l’argomento.
Abbiamo detto che nonostante la grande importanza che viene attribuita al Ca++ nella contrattilità normale del miocardio, non è ancora certa l’esistenza di un rapporto diretto fra l’azione cardiotonica dei glicosidi digitalici ed il Ca++. I risultati di più recenti indagini tenderebbero invece a dimostrare l’esistenza di un tale rapporto, specialmente per quanto riguarda gli scambi ionici che avvengono attraverso la membrana cellulare.
E’ noto che la presenza del Ca è indispensabile per mantenere l’eccitabilità elettrica a livelli normali. Sembra che l’attività di questo ione si manifesti a livello della membrana cellulare e che interferisca su quella successione di fatti non ancora completamente chiariti, che coordinano e collegano l’eccitazione alla contrazione.
Reiter (108) sperimentando su strisce di miocardio di ratto aveva già osservato che il Ca è in grado di mantenere un gradiente cationico determinando, probabilmente, una inibizione della permeabilità del Na.
A concentrazioni inotropicamente attive, la strofantina inibisce il trasporto cationico attivo e passivo, mentre a concentrazioni maggiori essa inibisce il trasporto attivo determinando un aumento della concentrazione intracellulare del Na ed una diminuzione di quella del K.
Nell’azione inotropa del Ca e della strofantina sarebbero coinvolti differenti meccanismi, ma tanto l’uno che l’altro conducono, secondo l’A. allo stesso effetto sul trasporto cationico durante la stimolazione del miocardio.
Holland e Sekul (109) hanno studiato l’influenza del K e del Ca sull’effetto che determina l’ouabaina sull’afflusso del Ca45 e sulla contrattura, negli atri isolati di coniglio, tentando di individuare i fattori che influenzano la velocità di attacco e la reversibilità delle contratture indotte dalla ouabaina.
In preparati a riposo trattati con ouabaina, non si verificano contratture o aumento dell’afflusso del Ca. L’aumento della concentrazione di K nel liquido di Ringer previene le contratture, aumenta la velocità di afflusso, rilascia gli atri contratti e riconduce la velocità di captazione del Ca a livelli normali.
La riduzione della concentrazione del Ca, previene un aumento della tensione a riposo indotta dalla ouabaina ma se la concentrazione del Ca viene ripristinata, compaiono le contratture ed aumenta il suo ritmo di afflusso. Questi risultati dimostrano, secondo gli AA., che l’ouabaina agisce sugli stadi iniziali del meccanismo che condiziona il collegamento dell’eccitazione alla contrazione, stadi che sono apparentemente Ca-dipendenti.
La fissazione dell’ouabaina è bloccata dal K, ma non è influenzata da variazioni di concentrazione del calcio o dalla frequenza dello stimolo.
Successivamente Sekul e Holland (110) hanno dimostrato che la ouabaina (G-strofantina) alla concentrazione di 4×10-8-1×10-6 M., non ha effetto sull’afflusso del Ca45 in atri a riposo di coniglio, ma lo aumenta in quelli stimolati elettricamente, il che fa concludere agli AA. che i glicosidi digitalici modificano soltanto lo scambio del Ca che accompagna il processo di attivazione.
Anche più recentemente Klaus e coll. (111), al fine di controllare la teoria secondo cui i glicosidi digitalici migliorano la contrazione del muscolo cardiaco determinando una inibizione del trasporto attivo di ioni e quindi una diminuzione del trasporto di K+ intracellulare ed un aumento di quella del Na+, hanno misurato l’azione di una concentrazione terapeutica di digitossina (3×10-7 g Mol., che produce solo un effetto inotropo positivo) e di una concentrazione tossica (10-6 g Mol., che produce contrattura) su atri isolati di cavia stimolati elettricamente.
I risultati da essi ottenuti dimostrano che negli atri di cavia, dosi terapeutiche di digitossina non hanno effetto sull’efflusso di K. L’afflusso viene invece aumentato inizialmente pur senza che la concentrazione intracellulare di K venga aumentata in maniera dimostrabile. Le concentrazioni intracellulari del Na+ e del Ca++ diminuiscono invece marcatamente.
Le dosi tossiche di digitossina producevano una chiara inibizione dell’afflusso di K+ mentre l’efflusso veniva aumentato di due volte. La concentrazione intracellulare del K+ era quindi ridotta, mentre era corrispondentemente aumentata quella del Na+. La concentrazione del Ca++ sembrava essere aumentata.
Questi risultati dimostrano secondo gli AA., che l’effetto terapeutico inotropo della digitossina, non può essere dovuto ad una alterazione della concentrazione del K+ o ad un’influenza sugli scambi di K+ attraverso la membrana, in quanto queste variazioni avvengono solo dopo l’applicazione di dosi tossiche di digitossigenina e sono dovute molto verosimilmente ad una inibizione del trasporto degli ioni e ad un aumento della permeabilità della membrana.
Lullmann e Holland (112) hanno inoltre studiato l’influenza della ouabaina sulla frazione di Ca variabile, sulla forza contrattile e sulla tensione a riposo degli atri di cavia.
Essi hanno dimostrato che la ouabaina sugli atri isolati di cavia, a concentrazioni che provocano un effetto inotropo positivo, produce un incremento della frazione scambiabile di Ca dell’ordine 0,08 fino a 0,3 m Eq/kg spazio intracellulare. Esiste una correlazione fra la tensione contrattile e la frazione scambiabile di calcio. Quando insorge contrattura, il calcio tessutale aumenta da 5,2 a 6,5 m Eq/kg e la frazione scambiabile da 0,94 a 2,6 m Eq/kg. I risultati di queste ricerche, come quelli delle altre riferite precedentemente, deporrebbero dunque a favore dell’esistenza di un rapporto fra effetti dei glicosidi digitalici e scambi di calcio attraverso la membrana cellulare.
L’azione della strofantina sulla concentrazione intrcaellulare del Na+ e del K+ nel miocardio è stata investigata anche recentemente da vari autori, fra i qauli ricorderemo Tuttle e coll. (113) i quali trovarono che le variazioni di contrattilità indotte dall’ouabaina nel miocardio di coniglio, non sono in relazione con le variazioni delle contrazioni intracellulari del K+ e del Na+.
L’ipotesi di Hjdu sull’esistenza di una relazione causale fra il K ed il Na intracellulare e la contrattilità, non sono confortate, secondo gli AA., dai risultati da essi ottenuti, poiché le variazioni della concentrazione intracellulare del K+ sembrano seguire piuttosto che precedere gli effetti inotropi della ouabaina.
Una relazione fra la perdita di K+ e lo scoppiamento della fosforilazione ossidativa, può essere possibile, avendo Lee e coll. (114) riferito che un aumento della captazione dell’ossigeno, sembra anch’essa seguire piuttosto che precedere gli effetti tossici della ouabaina sulla contrattilità.
Successivamente Klaus e coll. (115) dimostrarono che la diminuzione della concentrazione di K+ intracellulare non influisce sull’effetto inotropo dei glicosidi digitalici, ma che tale diminuzione è caratteristica dell'azione tossica della sola ouabaina.
Schreiber e coll. (116) hanno studiato l’effetto dell’ouabaina sulle variazioni del K+ nel cuore di cavia mediante K42 in vitro ed in vivo. Essi hanno trovato che in vitro, il K varia secondo due velocità tanto nei preparati lavati quanto in quelli non lavati.
L’ouabaina in vitro determina una inibizione dell’afflusso del K nei compartimenti varianti lentamente, ma non agisce sull’afflusso nei compartimenti fermi o sull'afflusso dei compartimenti fermi o lenti. Anche i risultati di esperienze in vivo farebbero pensare che vi sia più di una velocità di variazione.
Gli AA. suppongono che l'inibizione delI'ouabaina sia diretta verso la frazione del K+ intracellulare variante lentamente.
Giustina e coll. (117) hanno studiato l’influenza di alcuni glicosidi cardioattivi (ouabaina, K-strofantina, digitossina) sul potere concentrante degli elettroliti da parte della tiroide. Essi hanno trovato che la concentrazione di ouabaina necessaria a ridurre la captazione di I del 50% era di 5×10-4 M/l. Questa stessa concentrazione provoca una deplezione del 50% del K+ della tiroide.
L'accumulo di radioiodio nei ratti trattati con digitossina era più bassa che nei controlli. Questa diminuzione era in relazione, secondo gli AA., con una diminuzione del peso della tiroide piuttosto che con una ipofunzione. L'influenza dei glicosidi cardioattivi sul metabolismo del K+ e del Na+ sugli animali è stato studiato da Greeff (118) il quale sperimentando su ratti ha dimostrato che la strofantina ha un notevole effetto sul metabolismo minerale anche a dosi terapeutiche. Iniezioni sottocutanee di strofantina determinano infatti un forte aumento dell’escrezione del K. Dopo l'iniezione di una dose pari a 12,5 g si osserva un aumento del 50%; dopo una dose di 25 g, un aumento del 100% e dopo una dose di 100 g, si ha un aumento dell’800 %. Dosi inferiori provocano una diminuzione dell’escrezione del Na ed un aumento con dosi più elevate.
Il dosaggio contemporaneo di CI– e Ca++ dimostra che un aumento della loro escrezione si può ottenere soltanto dopo dosaggi elevati. I risultati dei dosaggi dell'escrezione elettrolitica renale, del K e del Na nel siero e nei muscoli scheletrici, hanno condotto l’A. a concludere che l’aumentata escrezione del K dopo strofantina, è dovuta ad un effetto renale, ad un arresto cioè, del riassorbimento tubolare, piuttosto che ad un'influenza degli elettroliti sui tessuti e sul plasma ematico.
L'A. ha poi eseguito alcune ricerche comparative fra l'azione della strofantina e quella degli ormoni mineralattivi corticosurrenalici, trovando che una dose di 2 mg/100 g di p.c. di DOCA, fa aumentare l'escrezione renale di K del 42%, in confronto del 50% ottenuto con 25 g/100 g p.c. di strofantina; l'escrezione del Na diminuiva invece del 63 e del 42 % rispettivamente. Questa somiglianza di comportamento fra strofantina e DOCA sembra verificarsi soltanto entro certi limiti di dosaggio.
Un'analoga attività corticosurrenalesimile della G-strofantina sulla concentrazione ionica ematica, era stata precedentemente notata da Varga e coll. (119) dai quali però tale analogia non è stata potuta confermare per quanto riguarda la normalizzazione della diminuita fosforilazione del glicogeno in animali con insufficienza surrenalica (120).
Che l’aumentata escrezione renale degli elettroliti prodotta dai glicosidi cardioattivi sia dovuta ad un diminuito riassorbimento nei tubuli, è stato successivamente confermato da Dazai (121) il quale avendo iniettato G-strofantina o scillarene direttamente nell'arteria renale sinistra di cani e raccogliendo separatamente le urine dei due ureteri, ha trovato un notevole aumento dell'escrezione di urina, di Na e di CI dal rene sinistro, mentre nessuna variazione quantitativa venne notata nelle urine escrete dal rene destro. Successivamente lo stesso Dazai in collaborazione con altri
(122), ha continuato queste indagini su cani in anestesia da pentobarbital, confermando i risultati precedentemente ottenuti e precisando che l’iniezione di G-strofantina unilaterale nell'arteria renale, provoca un notevole aumento dell'escrezione urinaria del rene in cui la G-strofantina è stata iniettata ed una diminuzione compensatoria dell'escrezione urinaria dall'altro rene; inoltre, che la diuresi unilaterale continua per un periodo di oltre 3 h, raggiungendo il suo massimo un’ora dopo l'iniezione di G-strofantina e che l'escrezione del Na e dei cloruri aumenta notevolmente e parallelamente all'aumento del volume dell’escrezione urinaria, mentre l'aumento dell'escrezione del K non è costante.
Quantunque il flusso ematico renale diminuisca per l'azione vasocostrittrice della G-strofantina, la diuresi unilaterale aumenta in maniera notevole indipendentemente dalle variazioni della pressione ematica sistemica e dalla emodinamica renale.
Altri autori hanno studiato l’effetto dei glicosidi cardioattivi sulle variazioni cationiche a livello mitocondriale. Schreiber e coll. (123) hanno studiato le variazioni prodotte dalla G-strofantina sul contenuto di K nei mitocondri del miocardio, sia su preparati normali che su quelli trattati con strofantina, per determinare se il K mitocondriale rappresenti la frazione lentamente variante.
Il K mitocondriale rappresenta soltanto il 15 % del K ventricolare totale, mentre la fase variante lentamente ne contiene circa il 50%.
La perfusione con G-strofantina determina un’inibizione dell’afflusso del K nella fase lentamente variabile ventricolare, ma non è stato trovato alcun effetto specifico isolato sul K mitocondriale.
Le variazioni del K mitocondriale riflettono direttamente le variazioni del K totale ventricolare. Una frazione mitocondriale, nelle condizioni sperimentali realizzate dagli AA., resta invariabile.
Questi risultati indicano, secondo gli AA., che il K mitocondriale non rappresenta la maggior parte della frazione lentamente variabile.
Altre ricerche sugli effetti della strofantina (e della protamina) sulle variazioni del K, del Na e dell'acqua mitocondriali, sono state eseguite da Share (124), il quale ha trovato che la strofantina, a concentrazioni estremamente elevate (1 g/100 ml) induce, in vitro, un rigonfiamento dei mitocondri del fegato, del rene e del cuore di ratto e interferisce con la proprietà dei mitocondri a concentrare il K.
Kondrashova (125) ha studiato l'effetto della K-strofantina sulla fosforilazione aerobica su preparati di muscolo cardiaco di coniglio, gatto e ratto, contenenti sarcosomi, microsomi e jaloplasma. L'A. ha potuto constatare che la captazione di ossigeno ed il rapporto P:O nei preparati di animali normali era più elevato di quello di animali miocarditici.
La K-strofantina a concentrazioni da 10-8 a 5×10-5 M. ha un effetto stimolante sulla fosforilazione aerobica nei preparati tessutali.
Questo effetto sembra essere più strettamente collegato all'aumento dell'esterificazione dei fosfati inorganici che all'aumento della respirazione che conduce ad un aumento del rapporto P:O ed appare più pronunciato nei preparati di miocardio di animali miocarditici che in quelli di animali normali.
L’effetto della G-strofantina sul metabolismo ossidativo del muscolo cardiaco è stato studiato da Nayler (126) confrontando la velocità di captazione dell’O in cuori di rospo (Bufo vulgaris), attivamente pulsanti, con quella di cuori arrestati in sistole per somministrazione di CaCl2 ed in diastole per somministrazione di KCl dopo aggiunta di G-strofantina alla concentrazione di 10 g/ml. Quest’ultima provoca un meccanismo ossidativo nei cuori attivamente pulsanti ma non in quelli arrestati. Gli stessi effetti si ottengono con l’aggiunta di lanatoside C alla concentrazione finale di 20 g/ml. La velocità di captazione di O nel cuore arrestato in sistole o in diastole, cade gradatamente in un periodo di 3 h, mentre nei controlli rimane costante.
Durante la prima ora di perfusione i cuori arrestati da K presentano un consumo di O pari a 1,59 ml/min./100 g di p.c., in confronto a 4,233 ml/min./100 g di p.c., nei cuori arrestati con Ca.
Szekeres e coll. (127) al fine di indagare l’azione della strofantina sul metabolismo miocardico di ratti normali e ipossici, hanno studiato i suoi effetti sulla captazione dell’O, sulla glicolisi anaerobica e sul contenuto di fosfati e di glicogeno nel miocardio.
La strofantina alla concentrazione di 10-4 M. E di 10-6 M., aumenta significativamente il consumo di O in fette di cuore di ratto normale, mentre un uguale aumento della respirazione tessutale non è stato osservato su fette di miocardio di animali ipossici. La glicolisi anaerobica viene invece ridotta dalla strofantina, tanto nei cuori normali quanto in quelli ipossici.
La diminuzione del contenuto dei fosfati ad alta energia e del glicogeno, non è prevenuta dalla strofantina nei cuori ipossici.
Indagini sull’attività enzimatica della strofantina sono state eseguite anche recentemente da alcuni autori.
Covasneanu e coll. (128) hanno studiato l'attività anticolinesterasica della strofantina in vivo ed in vitro su diversi substrati biologici.
I risultati ottenuti sperimentando su eritrociti e sul siero di coniglio e su vari tessuti animali, hanno dimostrato l'effetto anticolinesterasico della strofantina. La colinesterasi eritrocitica è in parte inattivata nell’84-91 % delle prove e la colinesterasi serica nel 50-74%.
Gli AA. suppongono che nel cuore la strofantina possa mobilizzare l’acetilcolina e che questa, non idrolizzandosi, interferisca con altri processi del metabolismo dei carboidrati.
Godfraind e coll. (129) hanno trovato che i glicosidi cardiotonici (digitossina, ouabaina, K-strofantoside) manifestano sull’ileo di cavia una azione antistaminica ed antiacetilcolinica. Questo antagonismo sarebbe dovuto, secondo gli AA., ad una riduzione della sensibilità da parte della fibra muscolare liscia, ai mediatori chimici, provocata da una modificazione del contenuto ionico cellulare, piuttosto che da un blocco dei recettori per l'istamina e per l'acetilcolina.
Questa attività anticolinesterasica della strofantina può spiegare quanto venne precedentemente osservato da Boehm (130), da Gremels (131) e più recentemente, da Gaffney e coll. (132) e cioè che la strofantina sensibilizza il cuore alla stimolazione vagale.
L’attività enzimatica della strofantina è stata studiata anche da Oganesyan (133) sull'adenosintrifosfatasi ed i risultati ottenuti indicano che essa viene inibita dalla strofantina la quale influisce inoltre sulla distribuzione del glucosio e del Na+.
Per quanto lo Strofanto svolga, come già detto, un’azione simile a quella della Digitale sull'apparato cardiovascolare e sulla diuresi, esistono alcune differenze che debbono essere considerate, specialmente in ordine alle sue applicazioni terapeutiche.
La maggior solubilità in acqua dei glicosidi strofantinici, comporta intanto una maggior prontezza d’azione (più breve periodo di latenza) ed una maggior rapidità di eliminazione.
L’azione dello Strofanto sarà quindi meno durevole di quella della Digitale, fatto questo dovuto, oltre alla più rapida eliminazione dei suoi glicosidi rispetto a quelli digitalici, anche al loro minor potere di ancoramento sul muscolo cardiaco.
Tale loro maggior reversibilità d’azione ha il vantaggio di evitare quei fenomeni di accumulo che caratterizzano l’azione dei glicosidi contenuti

nella Digitalis purpurea, causa dei noti inconvenienti che insorgono allorché la loro somministrazione non venga praticata con le prescritte cautele (vedi digitale).
L'attività dello Strofanto è inoltre più energica sulla contrattilità del miocardio, mentre inferiore è la sua azione bradicardica e sulla conducibilità degli stimoli.
Gli effetti emodinamici, specialmente per quanto riguarda l'aumento della portata cardiaca e della gettata sistolica, sono quantitativamente più evidenti con i glicosidi strofantinici che con quelli digitalici.
Terapia – Le indicazioni dello Strofanto e dei suoi glicosidi sono in linea di massima, le stesse di quelle della Digitale. In generale, la strofantina somministrata endovena trova, per il più breve periodo di latenza con cui agisce, più esatta indicazione allorché si desideri ottenere un'azione rapida e intensa.
In particolare la strofantina per via endovenosa, sarà pertanto indicata nell'insufficienza cardiaca acuta, con asma cardiaca o edema polmonare, casi nei quali la terapia strofantinica viene utilmente associata con il salasso e con la morfina. Nel collasso cardiocircolatorio conseguente a insufficienza acuta del cuore sinistro o destro, come nel cuore polmonare acuto; nel cuore polmonare cronico con eventuali segni di insufficienza cardiaca, la strofantina è indicata specialmente in associazione con diuretici e, in particolare, con l'acetazolamide [Beretta ed altri (134)]; nell’edema polmonare acuto in soggetti con segni di insufficienza cardiaca, per somministrazione protratta, alla dose di 1/8–1/4 di mg pro die endovenosa, la strofantina contribuisce a determinare la rarefazione o la scomparsa delle crisi [Bastai e Beretta (135)]: nello scompenso cardiaco la strofantina aumenta la portata cardiaca e la gettata sistolica.
Nell’infarto miocardico, con segni di insufficienza cardiaca destra o sinistra, sebbene non tutti gli autori siano d'accordo, la strofantina endovena a piccole dosi 1/8–1/4 di mg diluita in 10 cc di soluzione fisiologica e iniettata lentamente è indicata per la sua azione rapida, per la sua blanda azione bradicardizzante e per il suo scarso potere di accumulo [Beretta (136)].
Nell’angina di petto la terapia cardiotonica sarebbe indicata secondo alcuni autori, anche in assenza di segni di insufficienza cardiaca. Si ricorre alla strofantina nell'angina da decubito, nel qual caso ove esistano segni di scompenso, si ottengono buoni risultati. Nell’angina da sforzo invece la strofantina non viene di solito impiegata [Beretta (137)].
Altre indicazioni della strofantina e dei cardiotonici in generale è il mixedema con arteriosclerosi coronarica e con gravi segni di scompenso cardiaco. Questi casi vanno trattati come cardiopatie, per cui alla terapia tiroidea deve essere associata una terapia a base di Digitale o strofantina, di diuretici, ecc. [Beretta (138)].
Somministrata per via intramuscolare o rettale, essa è inoltre indicata anche nel caso di trattamenti protratti, essendo eccezionale il manifestarsi di quei fenomeni di accumulo caratteristici dei glicosidi della Digitale.
Il quesito se esistono casi di insufficienza cardiaca che possono essere compensati dalla strofantina quando la Digitale, a dosaggio sufficiente, non ha dato risultati, è stato molto discusso ma le risposte non sono state univoche. La conclusione che si può trarre dai risultati di molte esperienze cliniche è, secondo Moll (139), che non sarebbe giustificato consigliare il trattamento con la sola strofantina o con la sola digitossina. La terapia dovrebbe invece mirare allo scopo di scegliere il rimedio a seconda delle esigenze del singolo caso, di istituire cioè, una terapia differenziata. Così la strofantina è consigliabile nel collasso cardiaco acuto e nelle sue diverse manifestazioni (edema polmonare, asma cardiaca) ed anche nelle forme bradicardiche dell'insufficienza cardiaca. Anche questo A. dà la preferenza alla strofantina allorchè un disturbo coronarico è complicato da insufficienza cardiaca, come ad esempio nell’infarto miocardico.
Interessante secondo Moll, anche sotto l’aspetto clinico, sarebbero le ricerche di G. Lamprecht (140) e di W. Lamprecht (141), le quali dimostrano che sotto l'azione della strofantina si stabilisce un aumento di ATP il cui contenuto miocardico risulta essere ridotto in ogni forma di insufficienza cardiaca.
Un altro problema collegato con la terapia strofantinica è quello che riguarda gli eventuali vantaggi terapeutici che potrebbero derivare da un trattamento misto Digitale-Strofantina [Ferber e Roth (142), Steinberg (143)]. A proposito della Digitale abbiamo già detto che l’optimum dell’azione terapeutica si ottiene dopo che al paziente è stata somministrata la dose massima tollerata, dopo cioè che è stato raggiunto il livello di saturazione digitalica. Altrettanto si può dire per gli altri glicosidi cardiotonici, per cui, se la saturazione non è stata raggiunta con un determinato glicoside (per insufficiente dosaggio o per intolleranza del paziente), è possibile che la somministrazione di dosi addizionali di un altro glicoside, possa condurre alla piena saturazione e quindi all’effetto terapeutico.
Questa terapia combinata non è però di facile applicazione e può essere causa di qualche incidente dovuto a iperdosaggio, ove non venga praticata con le dovute cautele. Intanto non è sempre facile, secondo Spang (144), stabilire il grado di satuarazione, il quale può essere rivelato attendibilmente soltanto con un esame ECGrafico.
tyle=”font-family:arial unicode ms”>L'azione clinica di un glicoside rimane latente e quindi non si manifesta, allorchè esso viene somministrato alla dose di ¼ di quella necessaria per la completa saturazione. E' quindi facile che una dose complementare di un secondo glicoside, possa superare quella saturante e produrre sintomi da iperdosaggio.
Il Moll (139) tuttavia, d'accordo con Spang (144), ritiene che con la terapia combinata non sia possibile ottenere risultati superiori a quelli che si ottengono con la sola strofantina o con la sola Digitale (o suoi glicosidi), allorchè questi farmaci vengono somministrati a dosi opportune.
Desiderando istituire una terapia combinata, è consigliabile che il trattamento strofantinico preceda quello digitalico essendo l'inverso più pericoloso. Nel caso di pretrattamento digitalico è buona regola attendere almeno tre giorni prima di iniziare la somministrazione di strofantina. Nel primo caso, quando cioè il trattamento digitalico segue quello strofantinico, la dose del preparato digitalico deve essere superiore a quella di mantenimento (Moll.).
Il potenziamento dell'azione dei glicosidi digitalici che si può ottenere con la loro associazione alla carbossilasi è stato recentemente confermato da Michel e Hartleb (145).
Sperimentando su 60 pazienti cardiopatici, gli AA. hanno osservato che la sola carbossilasi può esercitare effetti cardiovascolari che si manifestano con riduzione della prima fase della sistole isometrica e della durata dell'intervallo QT, con aumento della Il fase della sistole isometrica, della sistole isotonica, della pressione arteriosa e con riduzione della pressione venosa. Queste modificazioni sono più evidenti ove esista uno stato di insufficienza cardiaca che nei casi di compenso circolatorio. L’indagine statistica indica che la somministrazione combinata di strofantina e di carbossilasi determina un rinforzo dell'azione della prima. Questa associazione dovrebbe essere indicata nei casi in cui esiste una deficienza di carbossilasi od una riduzione della sua attività, come per esempio nei casi di ipossidasi miocardica.
Controindicazioni – Le controindicazioni della terapia strofantinica sono, in generale, le stesse di quelle indicate a proposito della digitale, a queste si debbono aggiungere le controindicazioni dell'impiego della strofantina immediatamente dopo un trattamento digitalico e quella dovuta alla presenza di extrasistolia polimorfa a salve.
Nelle forme di scompenso con aritmia totale, se non proprio controindicato, il trattamento strofantinico è meno giustificato di quello digitalico.
Casi di intossicazione da strofantina, con bradicardia, extrasistoli e fenomeni di blocco, sono piuttosto rari ma possono insorgere ove esista una spiccata meiopragia miocardica (miocardiosclerosi, miocardite, cuore senile, ecc.) (135).
Vie di somministrazione, preparati e dosi
La via di somministrazione elettiva della strofantina è indubbiamente l’endovenosa consentendo essa il raggiungimento dei migliori risultati. L'effetto che si ottiene con l'impiego della strofantina per via endovenosa è energico, pronto ed il trattamento può essere protratto senza inconvenienti, purché si osservino alcune cautele.
La posologia normale è di 0,25 mg/pro dose/giorno, ma è consigliabile saggiare la sensibilità con dosi inferiori, per esempio di 0,12 mg per poi salire a 0,25.
L'iniezione deve essere fatta lentamente, come già detto, diluendo il contenuto della fiala a 10-20 cc con soluzione fisiologica e sorvegliando il polso durante l'iniezione. Se insorgono extrasistoli, l'iniezione deve essere interrotta.
Allorchè non è necessario un intervento d'urgenza ed un effetto pronto, la strofantina può essere somministrata anche per via intramuscolare. In questo caso la dose è di solito di 0,50 mg ed è utile l’associazione di un anestetico per diminuire gli effetti dell'irritazione locale prodotta da questi glicosidi.
La strofantina risulta ben tollerata ed efficace anche per via rettale sotto forma di supposte, caso nel quale essa viene impiegata alla stessa dose di quella prescritta per via intramuscolare.
Sull'assorbimento della strofantina per via perlinguale le opinioni sono discordi. Secondo Lozada (146) data la lentezza di soluzione e quindi di assorbimento della strofantina, essa non raggiungerebbe una concentrazione in circolo nell'unità di tempo, tale da assicurare una soddisfacente azione terapeutica.
Secondo Sarre (147) invece, l'assorbimento anche per questa via sarebbe buono e con effetti simili a quelli che si ottengono per via endovenosa. Sperimentalmente è stato studiato anche l'assorbimento della strofantina per via percutanea. Meyer (148) trovò che la soluzione alcoolica di K-strofantina non viene assorbita dalla cute della cavia, mentre gli idrocarburi clorurati, ad eccezione del C2H4Cl2, permettono un rapido assorbimento del glicoside. L'esano e l’l-esene sono buoni veicoli ma non così i loro alcooli. Disciolta in cicloesano la K-strofantina viene rapidamente assorbita. In considerazione del fatto che i glicosidi strofantinici, a differenza di quelli digitalici, sono irregolarmente assorbiti ed in parte distrutti lungo il tubo gastroenteritoco, la strofantinoterapia orale è di solito sconsigliata.
Occorre inoltre tener presente che i preparati di Strofanto somministrati oralmente non sempre sono ben tollerati in quanto, per la loro azione irritante sulle mucose gastrica e intestinale, provocano a volte, sintomi di nausea, di vomito o di diarrea.
Molti tentativi sono stati fatti per ottenere preparati strofantinici adatti per la somministrazione orale, al fine cioè di migliorare l'assorbimento dei glicosidi e di proteggerli dalle alterazioni che essi subiscono lungo il tubo digerente, con risultati che possono essere giudicati sodisfacenti anche se non risolutivi.
Un preparato derivante dall'associazione della strofantina con decasolfonato di sodio, controllato da Redonnet (149), non ha dimostrato di migliorare le condizioni di assorbimento nè di proteggere il glicoside della distruzione gastroenterica, mentre un preparato di strofantina sotto forma di compresse con rivestimento gastroresistente, contenente 2 mg di glicoside associato con una sostanza favorente l'assorbimento, il laurilsolfonato di sodio, sperimentato da Maskoff e Dietz (150) ha dato risultati migliori. Ricerche su animali hanno dimostrato che entro 2 h viene assorbito il 10-20% della quantità di strofantina somministrata. Nelle cavie, con il test del nuoto, gli AA. hanno potuto constatare che dosi terapeutiche di strofantina prolungano il tempo di nuoto da 3 a 5 volte.
Anche i risultati di prove cliniche condotte su 60 pazienti con insufficienza coronarica in scompenso, cui venne somministrato il suddetto preparato alla dose di 2-3 compresse al giorno, sono stati buoni e soltanto raramente si sono osservate azioni secondarie dovute a intolleranza gastrointestinale.
Anche Eybl (151) sperimentando su cavie in narcosi uretanica, ha potuto constatare che l'assorbimento e l'attività della strofantina sono notevolmente migliorati dal laurinsolfonato di sodio: la dose di 1 mg/kg associata a questa sostanza agisce, secondo i risultati ottenuti da questo A., come una dose superiore di 10 volte se somministrata isolatamente.
A risultati pressocchè analoghi era giunto precedentemente Krause (152) sperimentando comparativamente su cani, conigli, cavie e gatti, un preparato sotto forma di pillole con rivestimento gastroresistente, contenente soltanto G-strofantina (preparato A) con un altro in cui alla G-strofantina era associato il laurinsolfonato di sodio (preparato B).
La dose tossica del preparato B è stata trovata pari a 0,6-0,7 mg/kg con un effetto tossico che si manifestava dopo 2,30-3,30 h. La velocità di assorbimento è circa 2 volte maggiore che nel preparato A e di 3-4 volte maggiore della G-strofantina somministrata sotto forma di polvere.
Nelle cavie in narcosi uretanica, la somministrazione del preparato B risulta letale in 2 h. La stessa dose somministrata sotto forma del preparato A o in soluzione acquosa, non è letale entro 5 h.
La somministrazione enterale del preparato B o di una miscela di G-strofantina e laurilsolfonato di sodio a gatti, conigli e cani in anestesia, dimostra che almeno il 10% della G-strofantina è assorbita dall’intestino entro 8 h. Il laurilsolfonato di sodio aggiunto al preparato B è ben tollerato, non provoca sensibilizzazione all’azione della G-strofantina, l'assorbimento della quale risulta facilitato soltanto quando esso viene somministrato simultaneamente e a concentrazione elevata. Questo fatto sarebbe dovuto, secondo l'A., oltre ad un aumento della solubilità, anche ad una maggior velocità di soluzione.
L’associazione del laurilsolfonato di sodio alla strofantina, specialmente se sotto forma di preparati con rivestimento gastroresistente, sembra dunque veramente capace di migliorare l’assorbimento enterale del glicoside e tale da costituire, secondo l'opinione di Krause, un progresso nella terapia strofantinica orale.
Altro argomento che ha richiamato l’attenzione dei chimici e dei farmacologi, è quello che riguarda l'attività delle diverse strofantine.
Secondo alcuni autori, mentre qualitativamente l’azione delle varie strofantine (H, K, G) può essere ritenuta fondamentalmente uguale, quantitativamente esisterebbero invece sensibili differenze (153). Così la G-strofantina cristallizzata (ouabaina) sembrerebbe possedere, secondo Klenperer e Rost (154), un'attività doppia della K-strofantina amorfa. Fasching (155) invece, sperimentando sul cuore isolato di Rana temporaria, non ha potuto constatare notevoli differenze d’azione fra queste due strofantine.
Secondo Pulsson (156) la G-strofantina sarebbe meno attiva della K-strofantina mentre secondo Franck (156) sarebbe vero precisamente il contrario. Questo argomento venne esaurientemente trattato anche dal Tiffenau (157) fin dal 1922 in una memoria alla quale rimandiamo. Egli sperimentò comparativamente sulla K-strofantina cristallizzata preparata dal Goris, molto difficile ad ottenersi e che non si trova in commercio, sulla K-strofantina amorfa e sulla G-strofantina.
Chistoni (158) sperimentando comparativamente sul cuore di rana e sul cuore isolato di coniglio, l'azione di due tinture preparate con semi di Str. Hispidus e di Str. Kombé, portate allo stesso titolo chimico, trovò sensibili differenze nel loro comportamento e che il glicoside dello Str. Hispidus (H-strofantina) è meno tossico di quello dello Str. Kombé (K-strofantina) mentre la sua attività biologica ha dimostrato molte analogie con quella della ouabaina. Egli concluse pertanto, non essere indifferente usare una tintura piuttosto che l'altra e propose che le farmacopee prescrivano un'unica varietà di Strofanto da usarsi per le preparazioni galeniche. Secondo questo A. la preferenza dovrebbe essere data allo Str. Hispidus.
Più recentemente Pfeiffer (159) studiando comparativamente la tolleranza e la differenza d’azione della G-strofantina e della K-strofantina, trovò che la prima è, nell’uomo, di 1/5–1/4 più attiva della seconda.
Sarebbe troppo lungo e al di fuori dei limiti che ci siamo imposti, il ricordare tutte le numerose ricerche che sono state eseguite al fine di studiare comparativamente l'attività delle diverse strofantine. Quelle che sono state sin qui ricordate ci sembrano già sufficienti per dimostrare che l’unica strofantina la cui attività può essere ritenuta costante, è la G-strofantina, o ouabaina, cristallizzata ed è logico ritenere che tale sua costanza d'azione sia dovuta alla sua individualità chimica ben definita.
Le altre strofantine, amorfe, sono invece come afferma il Tiffenau, molto lontane dall'essere costanti, sia per costituzione chimica che per attività biologica. Esse risultano infatti costituite da un miscuglio di glicosidi strofantinici, per cui la loro composizione e la loro attività, può variare a seconda del metodo di preparazione con il quale sono state ottenute.
Il controllo biologico di sei campioni di K-strofantina eseguito nel nostro laboratorio, sul coniglio con il metodo di Hatcher-Brody modificato, ha dato i risultati seguenti:
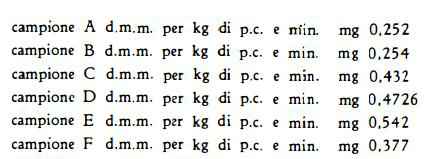
I campioni suddetti furono tutti prelevati da partite di strofantina del commercio. Dai risultati ottenuti appare evidente che l'attività delle K-strofantine di diversa provenienza, può variare entro limiti molto ampi. Considerando infatti, uguale ad 1 il valore della d.m.m. relativo alla K-strofantina risultata più attiva (campione A), troviamo un valore di 0,46 per quella che si è dimostrata meno attiva (campione E), il che vuol dire che fra due K-strofantine di diversa provenienza può esistere una differenza di attività anche superiore al 100 %. Se si considerano l’elevata attività di questi farmaci, le cautele che debbono essere osservate specialmente allorchè vengono somministrati endovena e gli incidenti che ne possono derivare, appare evidente la necessità di titolare biologicamente le loro soluzioni, al fine di evitare che la stessa dose ponderalmente valutata, possa esplicare un'attività farmacologica tanto diversa.
In un nostro lavoro pubblicato nel 1951, nel quale si sosteneva la necessità di titolare biologicamente i preparati strofantinici (160) notammo anche che la d.m.m. della G-strofantina per il coniglio, determinata con il metodo di Hatcher-Brody modificato, corrisponde quasi esattamente alla dose considerata terapeutica per l'uomo, somministrata endovena. Tale dose è infatti com'è noto, pari a mg 0,25 e può essere considerata praticamente uguale a quella di mg 0,235, che corrisponde appunto all'unità coniglio determinata con il metodo suddetto.
In considerazione di questa quasi perfetta identità fra dose terapeutica di strofantina per via endovenosa e d.m.m. per kg di p.c. nel coniglio del campione di G-strofantina da noi allora impiegato, proponemmo che l’unità coniglio di G-strofantina (mg 0,235/kg/min.), venisse considerata come unità clinica cui riferire l'attività delle strofantine amorfe (H, K) e di impiegare una unità clinica per es. di K-strofantina per via endovenosa e due unità cliniche per via intramuscolare.
Aggiungiamo ora che non disponendo all'epoca in cui furono eseguite le suddette titolazioni, di un campione internazionale di G-strofantina, impiegammo come standard la G-strofantina Merck cristallizzata DAB VI (1939) per la quale era indicata la formula C30H46O12-9H2O, mentre successivamente lo stesso Index Merck (1952 e 1960), la Farmacopea Inglese (B.P. 1948 e 1958), l'Americana (U.S.P. 1947, 1950, 1960) e la Farmacopea Internazionale (1951), indicano per la G-strofantina la formula C29H44O12-8H2O e a tale formula corrisponde anche l'attuale campione internazionale.
La d.m.m. per questa G-strofantina (campione internazionale) nel coniglio, è stata trovata, con il suddetto metodo, pari a mg 0,22 kg/min. con oscillazioni del 10-15% in più o in meno, dovuti all'errore sperimentale, alle variazioni stagionali di sensibilità degli animali ed alla loro diversa provenienza. Tenuto conto di queste oscillazioni, l'attività trovata per la G-strofantina DAB VI (1939) e quella trovata per il campione internazionale, possono essere considerate praticamente uguali, anche perchè variazioni di attività dell'ordine di centesimi di mg, possono essere considerate del tutto trascurabili, di fronte alle ben più importanti variazioni che si notano nei preparati strofantinici dosati ponderalmente.
Le stesse considerazioni valgono per la titolazione dei preparati di H e K-strofantina per somministrazione rettale (vedi Digitale) e per gli altri preparati galenici quali l'estratto fluido e la tintura.
Attualmente, per le ragioni anzidette, esistono molti e non ingiustificati dubbi sull'attività dei preparati galenici di Strofanto somministrati enteralmente ed in particolare, sull'attività terapeutica della tintura. Occorre riconoscere però che nella pratica corrente, essa trova ancora un impiego relativamente esteso, nel trattamento delle forme più leggere della insufficienza cardiaca. La sua attività è veramente molto incostante ma, in questo caso, ciò non è dovuto soltanto alla parziale distruzione gastroenterica dei suoi principi attivi ed al loro incompleto assorbimento ma anche, e soprattutto forse, alla sua preparazione irrazionale, quale del resto è consigliata dalle diverse farmacopee ed in particolare dalla nostra F.U.VI. Occorre prima di tutto considerare che il contenuto di strofantina nei semi di Strofanto subisce variazioni di notevole entità (vedi parte chimica) e che non tutte le farmacopee prescrivono per la tintura di Strofanto un titolo biologico.
Il metodo di preparazione non ha importanza per le tinture per le quali è prescritto un titolo, specialmente se biologico. Per quelle non titolate invece, come la tintura di Strofanto F.U., il metodo di preparazione non razionale può contribuire ad aggravare le variazioni di attività. La F.U.VI per esempio prescrive, per la preparazione della tintura, di pesare prima i semi polverizzati e poi sgrassarli in percolatore con benzina. Se si considera che, secondo il Brun (161), i semi di Strofanto contengono un olio grasso nelle proporzioni variabili dal 30 all’80 %, apparirà chiaro come anche questo fatto possa influire e non indifferentemente sull'attività di una tintura. Essa infatti verrà preparata non più con il 10 % di semi di Strofanto, come prescritto, ma con una percentuale diversa e variabile in proporzione della quantità di olio grasso contenuta nei semi e asportata con il solvente.
Eliminando queste cause di variabilità dei principi attivi contenuti nella droga, con la titolazione biologica, l'attività e la costanza di azione della tintura vengono notevolmente migliorate, pur permanendo le variazioni relative alle condizioni di assorbimento.
Numerose prove cliniche eseguite con tintura di Strofanto cui era stato conferito un titolo biologico pari allo 0,3% riferito alla G-strofantina (campione internazionale), hanno dimostrato infatti che anche questa vecchia e tradizionale preparazione può esplicare un'attività cardiotonica non trascurabile, tanto da trovare utile impiego nelle insufficienze cardiache di media gravità ed in particolare nell'uso pratico, quando si desideri ricorrere ad un cardiotonico che, evitando i noti incidenti da accumulo, possa essere somministrato senza rendere necessaria una rigorosa sorveglianza medica.
Estratti e preparati vari
a) Estratto fluido titolato biologicamente al 3% di k-strofantina (g 1 = LIV gtt).
Dosi: I-Il gtt più volte pro die.
b) Tintura F.U. al 10% di semi.
Dosi: V-X gtt più volte pro die: massimo g 1,50 pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido strofanto g 10
Alcool di 70° g 90
(come sopra).
Tintura composta
Tintura strofanto
Tintura digitale
Tintura noce vomica…………………………….. ana g 10
(X-XV gtt più volte pro die negli scompensi cardiaci).
Gocce cardiotoniche sedative
Tintura strofanto
Tintura valeriana………………………… ana g 10
Tintura biancospino
Tintura arancio dolce ana g 20
(XV-XX gocce tre-quattro volte pro die).
Tintura cardiotonica diuretica
Tintura strofanto
Tintura scilla
Tintura adonide
Estratto fluido arancio dolce……….. ana g 10
(X-XV gocce tre-quattro volte pro die).
BIBLIOGRAFIA
(1) FRASER T. R., Pharm. J., 3 523 1873 – (2) FRASER T R ibid., 18, 69, 1887; 20, 206 c 328, 1889 – (1) FRASER T. R., Pharm. J., 3, bJi^ ^ i â– iv., ib^^ ^ ^ ^ ^ . _34
(3) HARDY c GALLOIS, Compt. rend., 84. 261 , 1877 – (4) CATILLON, 1. pharm.^ ch^m.., 17. 281, 534
^ j Ify 179 Mf2 1888 • (6) ARNAUD . ibid., 126, 346. 450,
1888 – (5) ARNAUD, Compt. rend., 107. 179, l1^2, KUHìlcH
1208. 1280, 1654 e 1872, 1898 – (7) ARNAUD, ibid., 106. l»11, >888 ‘ (8) K?flN J f(UHl!I904H-, «er 31 514 1898- Monatsh Chem.. 19, 385, 1898 – il THO^, Bpr.Phann. Ge^4.
(10)’ r:Er<!–T , ner ' 31          534               1898' 33. 2063, 2069,        190T – ai) HCTn'ER e SACHS.                             Biochem.
^e^lschr 4Ó 83," 1912 – (1,2) BRAUNS e C LOSSON, Arch. pharm.^ 252. 294, 1914 • (Ch) 'â– VIN- Dre:.US ; HÉRMAN4f4, Ber., 48, 979 e 991, 1915 – (14) â– rHC)5/tSce UNGj''253^.19a2n2geW(16':h;AmcoB;s' 721, 1924 _ (l5) JACOBS W. A. e HEIDELBERGER M., J. Bi°l. Chem-. 54> 2f3; 192.2 " (.1,68)) J.'AGoBS ; COLLINS, ibid.. 64, 383, 1925 – (17) JACOBS '. e GUSTU1WE., FrE,^^. E^3 ,ibi]1 '977^8^sJA^>'^2‘S.
W e FLDERFIELD R ibid., 97. 727, 1932 – (19) ;aCOBS w. e FLECK E., ; . ^,
^'o) erAECLODBESRWEE:Lphysi<;,. Review:;, 222, 1933 – (21) ELDERFIELD R3 e R0THEN) A'J.i. ^o:^°lwGhAm^ 106. 71 . 1934 – (22) JAICOBS W. e ELDERFIELD R., ibid.. 107â– 143. 1934_:,(22I)/23;3®E934 '.A(25)
tss7S‘„Led.Rdcâ– .;J".lS3m”•22;352„,-x0N2£SrJi ;^.,i:S'3ri9:H
C2h8‘)mjcArZaA2C, R^IJK-HSTEnN ^^phRaAmBAALDta huH.. 19. 23L 19.4 4 – (29) KATZ A, e RI-ICHSTEItNeT.,
H28|{iCr;m.6Ac-;KA;TBR945-7HAACK0MEc3W^
2J^. 36750, 1994169 –((32) K3AISER HAACK 1^..hDOLBErC3 U.,e CPINGALCtR
1i^6v1.,-iH3(GHEGGsh^;!Sta'^''^h.,^eiChsETE^n ir., li^id^^^3^. 1348938714954 â– 5535)(3SC)HsINiDI'nERl0^ '
3^, 64, 1956 – (36) SCHINDLEr O. e .RE^CHSTEJ.NJ" E8<ÌiISTe1I9N 5T:, L3i!|.,ii5H7No'D1952 – (39)
RÉICHSTEIN T., ibid., 35. 673, 1952 – (38) schinDler o. e rL;;;h^-1-R Ò'.,"rfICHSTEIN T., ibid..
0 e REICHSTEIN T., ibid., 37. 103, 1954 . (40) schinDLer O. 9 REICHENE ^ sCIjI,N-
(41) SCHINDLER O. e REICHSTEIN T., ibid.. 36. 1007;.1933 • (4ZLLLNNNK°R''Ei^0. REICHSTEIN T., ibid,. 42. 160, 1959 • (43) SCHINDLer O. e zelNIK R., tb,d., 4°. 4i .1957 – (44) EUW J. v. e REICHSTEIN T., ibid., 33. 522, 1950 – (45) ROSSELET J. P. e REICHSTEIN
T., ibid., 36. 787, 1953 – (46) KELLER L. e TAMM CH., ibid., 42. 2467, 1959 – (47) EUW J, v, e REICHSTEIN T., ibid., 33. 544, 1950 • (48) HEGEDUS H., TAMM CH. e REICHSTEIN T., ibid.. 36, 357, 1953 – (49) HEGEDUS H., TAMM CH. e REICHSTEIN T., ibid., 38. 98, 1955 – (50) LICHTI H., TAMM CH. e REICHSTEIN T., ibid., 39, 1914, 1956 – (51) PRIMO E. e TAMM CH., ibtd., 37, 141, 1954 – (52) BALLY P. R. O., SCHINDLER O. e REICHSTEIN T., ibid., 35, 138, 1952 – (53) REICHSTEIN T., ibid.. 35, 64, 1952 – (54) RICHTER R., MOHR K. e REICHSTEIN T., ibtd.. 36, 1073, 1953 – (55) EUW J. v. e REICHSTEIN T., ibid., 33. 2153, 1950 – (56) BUZAS A., EUW J. v, e REICHSTEIN T., ibid., 33, 465, 1950 – (57) EUW J. v. e REICHSTEIN T., ibid., 35, 1560, 1952 – (58) SCHINDLER O. e REICHSTEIN T., ibid., 36. 921, 1953 – (59) FECHTIG B., EUW J. v., SCHINDLER O, e REICHSTEIN T., ibid.. 43, 1570, 1960 – (60) EUW J, v., MOHR K., SCHINDLER O. e REICHSTEIN T., ibid.. 39, 326, 1956 – (61) FECHTIG B., SCHINDLER O. e REICHSTEIN T., ibid.. 43, 727, 1960 • (62) FECHTIG B., SCHINDLER O. e REICHSTEIN T., ibid., 42. 1448, 1959 – (63) EUW J. v., GURTLER J., LARDON A., MOHR K., REBER F., RICHTER R., SCHINDLER O. e REICHSTEIN T., ibid.. 4(), 2079, 1957 – (64) HEGEDUS H. e REICHSTEIN T., ibid., 38. 1133, 1955 • (65) EDELMANN O., TAMM CH. e REICHSTEIN T, ibid., 39. 16, 1956 – (66) EUW J. v. e REICHSTEIN T., ibid., 33, 666, 1950 – (67) SCHINDLER O. e REICHSTEIN T., ibid., 35, 442, 1952 – (68) WEISS E., SCHINDLER O. e REICHSTEIN T., ibid.. 41, 736, 1958 – (69) WEISS E., SCHINDLER O. e REICHSTEIN T., ibid.. 40. 980, 1957 – (70) EUW J. v., SCHINDLER O. e REICHSTEIN T., ibid.. 38. 987, 1955 – (71) LICHTI H., TAMM CH. e REICHSTEIN T., ibUl., 39, 1933, 1956 • (72) EUW J. v., HEITZ G. A. 0., HESSE H., SPEISER P. e REICHSTEIN T., ibid., 35. 152, 1952 – (73) RANGASWAMI S., REICHSTEIN T., SCIHNDLER O. e SESHADRI T. R., ibid., 36. 1282, 1953 – (74) JACOBS W. A. e HOFFMANN A., J. Bloi. Chem., 67, 609, 1926; 69, 153, 1926 • (75) FRASER T. R., Arch. Pharm.. 203. 229, 1873 – (76) JACOBS W. A. e HOFFMANN A., J. Bioi. Chem., 79, 531, 1928 – (n) LARDON A., Heiv. Chim. Acta, 33, 639, 1950 – (78) LAMB J. D. e SMITH S., J. Chem. Soc., 442, 1936 – (79) EUW J. v. e REICHSTEIN T., Heiv. Chim. Acta, 31, 883, 1948 – (80) JACOBS W. A. e HOFFMANN A., J. Bioi. Chem., 79. 519, 1928 • (81) SANTAVY E. e REICHSTEIN T., Pharm. Acta Heiv., 23. 153, 1948 – (82) REICHSTEIN T. e ROSENMUND H., ibid., 15, 150, 1940 – (83) JACOBS W. A. e HOFFMANN A., J. Bioi. Chem., 69, 157, 1926 – (84) MSLENNIKOVA V. A., KHRISTULAS F. S. e ABUBAKIROV N. K., Doklady Akad Nauk S.S.S.R., 124, 822, 1959; Chem. Abs., 53. 16204, 1959 – (85) KOWALEWSKI Z., JAGER H., SCHINDLER O. e REICHSTEIN T., Heiv. Chim. Acta. 43. 957, 1960 – (86) NAGATA W., TAMM CH. e REICHSTEIN T., Festschrift fiir A. Stoll, Basel, 1957 – (87) ZELNIK R., EUW J. v., SCHINDLER O. e REICHSTEIN T., Heiv. Chim. Acta, 43. 59 3, 196 0 – (88) TSUNO, Monat:h. Prakt. TierheUk., 6, 455, 1895 – (89) MOORE C. W., J. Chem. Soc., 95. 734, 1909 – (90) FINNE- MORE, ibid., 95, 77, 1909 • (91) TSCHESCHE R. e HAUPT W., Ber., 69. 459, 1936 – (92) JACOBS W. A. e BIGELOW N. M., J. Bioi. Chem,, 99, 521, 1933 – (93) AEBI A. e REICHSTEIN T., Heiv. Chim. Acta, 34. 1277, 1951 – (94) JACOBS W. A. e ELDERFIELD R. C., J. Bioi. Chem., 91. 625, 1931; 92. 313, 1931 • (95) JACOBS W. A. e ELDERFIELD R. C., Science, 80, 533, 1934; J. Bioi. Chem., 108. 497, 1935 – (96) SPEISER P. e REICHSTEIN T., Heiv. Chim.. Acta. 30, 2143, 1947; 31, 622, 1948 • (97) Dati inediti di analisi, eseguite nei Laboratori Inverni & Della Bella – Milano – (98) Confr. con: CAPRA C., Fitoterapia, Ed. Farm., 33. 3, 1962 – (99) WEHMER C., Die Pllanzenstoffe, II ed., p. 994 – (100) de GRAEVE P., Buii. :;oc. chim. Frane., 449, 1954 • (101) KARRER W., Konstitution und Vorkommen der organischen Pllanzenstolle, 1958, p. 997 – (102) DI MATTEI, Arch. Intern. Pharmakoi. Thérap.. 35. 113, 1928 – (103) Kommentar der Pharm. Helv. V, p. 745 – (104) RIEDEL A. G., Riedeis Ber.. 33, 1913 – (105) MATHES e RATH, Arch. Phaim., 252, 683, 1914 – (106) BENEDICENTI A., Malati, medici e farmacisti, Hoepli, Milano 1924, voi. II, p. 1463 – (107) FRASER, Transact of the Royal Soc. of Edimburg 35, parte IV, 1890 e Acokanthera p, Il – (108) REITER M., Arch. Ges. Phjsioi.. 267. 158, 1958 – (109) HOLLAND W. e SEKUL A., J, Pharm. Exptl. Therap.. 133, 288, 1961 – (110) SEKUL A. e HOLLAND W. C., Am. J. Phjsioi., 199, 457, 1960 – (111) KLAUS W., KUSCHINSKY G. e LULLMANN H;, Arch. exp. Path. u. Pharmakoi., 242, 480, 1962 – (112) LÙLLMANN H. e HOLLAND W. C., J. Pharm. Exptl. Therap., 137, 186, 1962 – (113) TUTTLE R. S., WITT P. N. e FARAH A., ibid., 133. 281, 1961 • (114) LEE K. S., SCHWARTZ A e BURSTEIN R. Y., J. Pharm. Exptl. Therap., 129. 123, 1960 – (115) KLAUS W., KUSCHINSKY G. e LULLMANN H., Klin. Woch., 40, 823, 1962 • (116) SCHREIBER S. S., ORATZ M., ROTHSCHILD M. e QUESENBERRY R., Am. J. Phjsiol., 200, 1055, 1961 – (117) GIUSTINA G., libro D., CAVAGNA G., MAGGI N. e BERTOLINI A. M., Soc. Lomb. Sci. Med. Biol., 14, 191, 1959 – (118) GREEFF K., Verhandl. Deut. Ges. Kreislaullorsch. 22. Tagung Bad Nauheim, 312, 1956 • (119) VARGA E., BAYDY D. e KESZTYUES L., Arch. Exp. Path. u, Pharmakoi., 207, 29, 1949 – (120) VARGA E., FUEZES E. e KESZTYUS L., ibid., 207. 213, 1949 – (121) HAKAICHIRO DAZAI, Nippon Yakurigaku Zasshi, 1361, 1960 – (122) TANABE T., TSUMENI J., ABIKO J. e DAZAI H., Arch. Int. Pharmacodyn. et de Thér., 133. 452, 1961 – (123) SCHREIBER S. S., ORATZ M., ROTHSCHILD M. A. e THOMPSON G., Am. J. Physioi., 198. 89, 1960 • (124) SHARE L., ibid., 199, 653, 1960 – (125) KONDRASHOVA M. N., Voprosy Med. Khim., 3, 403, 1957 – (126) NAYLER W. G., l:/ature, 188, 70, 1960 – (U7) SZEKERES L., LENARD G. e TOROK T., Arch. Int. Pharmacodyn. et de Thér., 119, 102, 1959 – (128) COVASNEANU Z., SUCKMANSCHI M. e PIRIANU A., Rev. Fisioi. Nonu Si Patol., 5, 149, 1958 -(129) GODFRAIND T. e GODFRAIND-DE BECKER A., Arch. Int. Pharmacodyn. et de Thér., 144, 226, 1963-(130) BOEHM R., 1. Physiol., 5, 153, 1872, clt. da GAFFNEY e coll. in (132)-(131) GREMELS H., Arch. Exp. Path. u. Pharmakol, 179, 360, 1935 – (132) GAFFNEY T. E., KAHN J. B. Jr., VAN MAANEN E. F. e ACHESON G. H., J. Pharmacol. Exp. Ther., 122, 423, 1958 – (133) OGANESYAN A. S., Dokl. Akad. Nauk. Arm. SSR, 35, 177, 1962; Chem. Abs., 58, 11851, 1963 – (134) BERETIA A., Malattie dell’apparato circolatorio – Trattato di medicina e terapia, Bastai, Ed. Min. Med., Torino 1959, p. 431 – (135) BASTAI e BERET1A A., ibid., p. 238 • (136) BERETIA A., ibld., p. 730 – (137) BERETIA A., ibid., p. 750 – (138) BER^^A A., ibid., p. 1160 – (139) MOLL A., Pianta Medica, 4, 166, 1956 – (140) LAMPRECHT G., Dissert. Miinchen, 1956 – (141) LAMPRECHT W., Deut. Med. Woch., 81, 534, 1956 – (142) FERBER F. e ROTH K., Med. Welt, 12, 387, 1951 – (143) STEINBERG H., Med. Klinlk, 49, 927, 1954 – (144) SPANO K., Deut. Med. Woch., 79, 1308, 1954 – (145) MICHEL D. e HARTLEB O., Z. Kreislaufforsch., 48, SS7, 1959 – (146) LOZADA B. B., Rev. Arg. de Cardiol., 19, 197, 1952 – (147) SARRE H., Therapiewoche, 3, 311, 1953; in Min. Med., 44, 1387, 1953 – (148) MEYER F., Arch. Exp. Path. u. Pharmakol., 236, 238, 1959 – (149) REDONNET A., Rev. Clin. EspaR., 61, 291, 1956 – (ISO) MASKOFF E., DIETZ H., Die Medlz.lnlsche, 4, 1375, 1955 – (151) EYBL V., Pharmazie, 12, 30, 1957 – (152) KRAUSE D., Arzneim-Forsch., 5, 428, 1955 – (153) STRAUB, in Heffter Handb. d. Exp. Pharmakol., voi. II, p, 1359, 1360, 1361 – (154) KLENPERER e ROST, cit. da MADAUS in Lehrbuch d. Biologischen Heilmittel, voi. IH, p. 2636, Lipsia 1938 – (155) FASCHING, cit. da MADAUS, ibid. – (156) PULSSON, FRANCK, vedi Indcx Mcrck, p. 342, VIII ediz., 1935- (157) TIFFENAU, Bull. Sci. Pharmacol., 34, pp. 68, 123, 244, 248, 1922 – (158) CHISTONI A., L'Ateneo Parmense, 3, n. 4, 1931 – (159) PFEIFFER E., Sci. Pharm., 28, 216, 1960, in Pharm. Acta Hetv., 36, 285, 196i • (160) BENIGNI R., // Farmaco, 6, 867, i951 – (161) BRUN P., Précis de Matière Médicale, G. Doin & C., Edit. Paris, 1936, p. 439.


