Tubercolosi: incubazione, contagiosità, terapia e profilassi
Tubercolosi: scheda riassuntiva di notifica e profilassi
Classificazione ICD-9: 010.-/018.-
Tipo di Notifica: Classe III
Periodo di incubazione: Circa 4-12 settimane dall’infezione alla comparsa di una lesione primaria dimostrabile o della positività del test alla tubercolina.
L’infezione può persistere allo stato latente per tutta la vita; il rischio di evoluzione verso la tubercolosi polmonare e/o extrapolmonare è massimo nei primi due anni dopo la prima infezione.
Periodo di contagiosità: Fintanto che bacilli tubercolari sono presenti nell’escreato e in altri fluidi biologici.
La terapia antimicrobica con farmaci efficaci determina la cessazione della contagiosità entro 4-8 settimane.
Provvedimenti nei confronti del malato: Isolamento respiratorio1 in stanze separate e dotate di sistemi di ventilazione a pressione negativa per i soggetti affetti da tubercolosi polmonare, fino a negativizzazione dell’escreato;
precauzioni per drenaggi/secrezioni2 nelle forme extrapolmonari;
sorveglianza sanitaria3 per almeno 6 mesi. In caso di scarsa compliance alla terapia, di sospetta farmacoresistenza, o di condizioni di vita che possono determinare l’infezione di altre persone, in caso di recidiva è indicato il controllo diretto dell’assunzione della terapia anti-tubercolare.
Provvedimenti nei confronti dei conviventi e dei contatti: Sorveglianza sanitaria3 di conviventi4 e contatti stretti5 per la ricerca di altri casi di infezione o malattia.
Esecuzione di test alla tubercolina con successiva radiografia del torace dei casi positivi e, in caso di negatività, ripetizione del test a distanza di 2-3 mesi dal momento della cessazione dell’esposizione.
Chemioprofilassi nei contatti stretti5 cutipositivi; questa è, altresì, indicata per i contatti cutinegativi ad alto rischio di sviluppare la malattia.
2 Precauzioni per drenaggi/secrezioni: uso di guanti per la manipolazione o il contatto con materiali contaminati, e di camici in caso di possibile insudiciamento, per prevenire la trasmissione di infezioni per contatto diretto o indiretto con materiale purulento o di drenaggio da un sito di infezione.
3 Sorveglianza sanitaria: obbligo di sottoporsi a controlli da parte dell’Autorità sanitaria, senza restrizione dei movimenti, per un periodo di tempo pari a quello massimo di incubazione della malattia.
4 Conviventi: tutti coloro che condividano con il paziente la stessa abitazione.
5 Contatti stretti: soggetti che frequentino “regolarmente” (quotidianamente) il domicilio del paziente, partners sessuali, compagni di classe, colleghi di lavoro che condividano la stessa stanza, operatori sanitari esposti.
Generalità
La tubercolosi, una delle più antiche malattie che colpiscono il genere umano, è causata da batteri appartenenti al complesso del Mycobacterium tuberculosis.
La malattia di solito interessa i polmoni, anche se in una percentuale di casi che può arrivare fino a un terzo del totale sono interessati altri organi.
Se adeguatamente trattata, la tubercolosi sostenuta da ceppi sensibili ai farmaci è curabile praticamente in tutti i casi.
Se non trattata, la malattia è fatale entro cinque anni in più della metà dei casi.
La trasmissione, di solito, avviene attraverso la diffusione per via aerea di nuclei di goccioline espettorati da pazienti con tubercolosi polmonare infettante.
Eziologia
I micobatteri appartengono alla famiglia delle Mycobacteriaccae e all’ordine delle Actinomycetales.
Tra le specie patogene appartenenti al complesso di Mycobacterium tuberculosis, l’agente più frequente e più importante che determina la malattia umana è lo stesso Mycobacterium tuberculosis.
Il complesso comprende Mycobacterium bovis (il bacillo tubercolare bovino, un tempo importante causa di tubercolosi trasmessa mediante il latte non pastorizzato e attualmente causa di una piccola percentuale di casi nei Paesi in via di sviluppo), Mycobacterium africanum (isolato in una piccola percentuale di casi in Africa occidentale e centrale) e Mycobacterium microti (il bacillo dell’“arvicola”, un microrganismo assai simile ma rilevato di rado).
Mycobacterium tuberculosis è un batterio a forma di bastoncello, non forma spore, è sottile, aerobio e misura circa 0,5 μm x 3 μm.
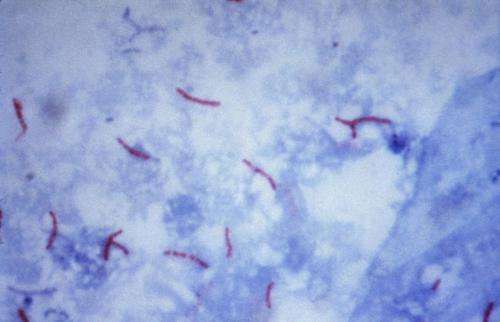
I micobatteri, incluso Mycobacterium tuberculosis, non si colorano facilmente e sono spesso neutri alla colorazione di Gram.
Tuttavia, una volta colorati, i bacilli non possono essere decolorati dall’acido e dall’alcol, una caratteristica che giustifica la loro classificazione come bacilli alcol-acido-resistenti.
Nella parete cellulare micobatterica, i lipidi (come l’acido micolico) sono legati ai sottostanti arabinogalactano e peptidoglieano.
Questa struttura e responsabile della permeabilità molto bassa della parete cellulare e della risultante inefficacia della maggior parte degli antibiotici nei confronti di questo batterio.
Le diverse proteine caratteristiche di Mycobacterium tuberculosis comprendono quelle presenti nella tubercolina, come derivato proteico purificato (purified protein derivative, PPD), un precipitalo di molecole non speciespecifiche ottenuto dal filtrato di colture in brodo sterilizzate al calore e concentrate.
Epidemiologia e diffusione della Tubercolosi
Alla fine degli anni ‘90, all’Organizzazione Mondiale della Sanità (OMS) sono stati notificati annualmente tra 3,5 e 4 milioni di nuovi casi di tubercolosi (tutte le forme: polmonari ed extrapolmonari), il 90% dei quali nei Paesi in via di sviluppo.
Si stima che nel 1997 vi siano stati 8 milioni di nuovi casi di tubercolosi nel mondo, con quasi 2.000.000 di morti, la maggior parte dei quali nei paesi in via di sviluppo.
Nei paesi occidentali, la tubercolosi non è frequente tra i giovani adulti di stirpe europea, che solo raramente sono stati esposti all’infezione da Mycobacterium tuberculosis durante le ultime decadi.
Al contrario, la prevalenza dell’infezione da Mycobacterium tuberculosis, a causa dell’alto rischio di esposizione nel passato, è relativamente elevata nella popolazione caucasica anziana, che continua ad avere un aumentato rischio di sviluppare la tubercolosi attiva.
In Europa, la tubercolosi è ricomparsa come importante problema di sanità pubblica, principalmente in conseguenza del verificarsi di casi tra gli immigranti provenienti da Paesi ad alta prevalenza.
In particolare, in Italia è stato osservato un incremento, a partire dalla metà degli anni ’80, del numero dei casi di tubercolosi, in parte legato alla epidemia di AIDS.
La più bassa morbilità è stata registrata nel 1983 (4.9 casi per 100.000 abitanti), mentre nel 1995 l’incidenza è stata del 9,4 per 100.000 abitanti, con un incremento medio del 6.7% annuo.
Negli ultimi anni il maggior numero di casi di tubercolosi è stato notificato dalle regioni dell’Italia settentrionale (10-15 casi per 100.000), contro una incidenza di circa il 5/100.000 nelle regioni meridionali.
La tubercolosi extrapolmonare è aumentata maggiormente rispetto a quella polmonare e risulta triplicata tra il 1988 e il 1995.
L’incidenza è stata maggiore nelle classi di età di 25-39 e di 60-75 anni, mentre la tubercolosi infantile è molto rara.
Non è interamente chiarito quale andamento abbia avuto la tubercolosi nei decenni passati nei Paesi in via di sviluppo dell’Africa e dell’Asia.
Dall’esposizione all’infezione
Mycobacterium tuberculosis viene trasmesso, nella maggior parte dei casi, da un paziente con tubercolosi polmonare contagiosa alle altre persone, mediante i nuclei di goccioline che vengono aerosolizzati con la tosse, gli starnuti o l’atto del parlare.
Le piccole goccioline si essiccano rapidamente: le più piccole (da meno di 5 a 10 μm di diametro) possono rimanere sospese nell’aria per diverse ore e possono guadagnare l’accesso diretto alle vie aeree inferiori.
Vi possono essere fino a 3.000 nuclei infettanti per ogni colpo di tosse.
Nel passato, una fonte frequente di infezione era rappresentata dal latte non pastorizzato, proveniente da mucche tubercolotiche, contenente Mycobacterium bovis.
Altre vie di trasmissione dei bacilli tubercolari, come la cute o la placenta, non sono frequenti e non hanno significato epidemiologico.
Importanti fattori nella trasmissione sono le probabilità di contatto con un caso fonte di tubercolosi, l’intimità e la durata del contatto, il grado di contagiosità del caso e l’ambiente in cui tale contatto ha luogo.
L’affollamento in stanze poco ventilate è uno dei fattori più importanti nella trasmissione dei bacilli tubercolari, dal momento che determina un aumento dell’intensità del contatto con un caso indice.
In breve, il rischio di acquisizione dell’infezione da Mycobacterium tuberculosis è determinato principalmente da fattori esogeni.
Dall’infezione alla malattia
Contrariamente a quanto accade per il rischio di acquisizione dell’infezione da Mycobacterium tuberculosis, il rischio di sviluppare la malattia dopo essere stati infettati dipende largamente da fattori endogeni, quali l’innata suscettibilità individuale alla malattia e il livello della funzione dell’immunità cellulo-mediata.
La malattia clinica che fa seguito direttamente all’infezione viene chiamata tubercolosi primaria ed è frequente nei bambini al di sotto dei 4 anni di età.
Anche se questa forma è spesso grave e disseminata, di solito non è contagiosa.
Quando l’infezione viene acquisita in una fase successiva della vita, vi sono maggiori probabilità che questa venga contenuta dal sistema immunitario, almeno temporaneamente.
Nella maggior parte dei casi, gli individui infetti che svilupperanno nel corso della vita la tubercolosi si ammalano nel primo anno o nei primi due anni dall’acquisizione dell’infezione.
I bacilli quiescenti, tuttavia, possono persistere per anni prima di riattivarsi per produrre la tubercolosi secondaria (o postprimaria), che è spesso contagiosa.
Complessivamente, si ritiene che circa il 10% delle persone infette svilupperà una tubercolosi attiva.
L’età è un fattore importante nel determinare il rischio di sviluppare la malattia dopo l’infezione.
Tra le persone infette, l’incidenza della tubercolosi è maggiore durante la tarda adolescenza e la fase iniziale dell’età adulta: le ragioni non sono chiare.
Il rischio può aumentare nell’età avanzata, probabilmente a causa dell’indebolimento del sistema immunitario e di patologie concomitanti.
Diverse malattie favoriscono lo sviluppo della tubercolosi attiva.
Negli individui infetti, il più potente fattore di rischio per lo sviluppo della tubercolosi è chiaramente la coinfezione da HIV, che sopprime l’immunità cellulare.
Il rischio che un’infezione latente da Mycobacterium tuberculosis proceda fino alla malattia attiva è direttamente correlato al grado di immunosoppressione del paziente.
Decorso della Tubercolosi
Studi condotti in diversi Paesi, prima dell’avvento della chemioterapia, hanno dimostrato chiaramente che la tubercolosi non trattata è spesso fatale.
Circa un terzo dei pazienti moriva entro 1 anno dalla diagnosi e la metà entro 5 anni.
La mortalità a 5 anni dei casi a espettorato positivo era del 65%.
Tra coloro che sopravvivevano a 5 anni, circa il 60% era andato incontro a remissione spontanea, mentre il rimanente 30% stava ancora eliminando bacilli tubercolari.
L’introduzione di un’efficace chemioterapia ha marcatamente modificato la storia naturale della tubercolosi.
Con un appropriato trattamento, i pazienti hanno buone probabilità di guarire, ma occorre considerare che l’uso improprio dei farmaci antitubercolari, se da un lato riduce la mortalità, dall’altro può determinare la presenza di un grande numero di casi cronici infettanti, spesso sostenuti da bacilli resistenti ai farmaci.
Patogenesi e Immunità
L’interazione di Mycobacterium tuberculosis con l’ospite umano inizia quando vengono inalati i nuclei di goccioline provenienti dai pazienti infetti, contenenti i microrganismi.
Mentre la maggior parte dei bacilli inalati rimane intrappolata nelle vie aeree superiori e viene espulsa dalle cellule cibate della mucosa, una frazione di questi (di solito meno del 10%) raggiunge gli alveoli.
A questo livello, macrofagi alveolari non specificamente attivati ingeriscono i bacilli.
L’equilibrio tra l’attività battericida del macrofago e la virulenza del bacillo determina gli eventi che fanno seguito alla fagocitosi.
Anche il numero di bacilli che ha invaso l’ospite è importante.
Se i bacilli si moltiplicano, la loro crescita uccide rapidamente i macrofagi, che vengono lisati.
I monociti non attivati, richiamati dal sangue nel luogo dell’infezione da vari fattori chemiotattici, ingeriscono i bacilli liberati dai macrofagi lisati.
Questi stadi iniziali dell’infezione sono di solito asintomatici.
Da due a quattro settimane dopo l’infezione, si sviluppano due ulteriori risposte dell’ospite contro Mycobacterium tuberculosis‘, una risposta che danneggia i tessuti e una risposta attivante i macrofagi.
La risposta che danneggia i tessuti è il risultato di un’ipersensibilità di tipo ritardato nei confronti di vari antigeni bacillari: distrugge i macrofagi non attivati che contengono i bacilli in corso di moltiplicazione.
La risposta attivante i macrofagi è un fenomeno cellulomediato che determina 1’attivazione dei macrofagi capaci di uccidere e di digerire i bacilli tubercolari.
Anche se entrambe queste risposte possono inibire la crescita dei micobatteri, e l’equilibrio che si instaura tra le due che determina la forma di tubercolosi che, eventualmente, si svilupperà successivamente.
Con lo sviluppo dell’immunità specifica e l’accumularsi di un gran numero di macrofagi nella sede dell’infezione primaria, si formano i granulomi specifici (tubercoli).
Queste lesioni sono costituite da linfociti e da macrofagi attivati, cioè cellule epitelioidi e cellule giganti.
Inizialmente l’unico evento in grado di limitare la crescita micobatterica all’interno dei macrofagi è la risposta che danneggia i tessuti, che si è appena sviluppata.
Questa risposta, mediata da vari prodotti batterici, non solo distrugge i macrofagi, ma produce anche una precoce necrosi compatta al centro del tubercolo.
Anche se Mycobacterium tuberculosis può sopravvivere, la sua crescita è inibita, all’interno dell’ambiente necrotico, dalla bassa tensione di ossigeno e dal basso pH.
A questo punto, alcune lesioni possono guarire ed esitare in fibrosi e calcificazione, mentre altre vanno incontro a un’ulteriore evoluzione.
In questo stadio precoce, è cruciale l’immunità cellulomediata.
Nella maggior parte degli individui infetti, i macrofagi locali vengono attivati quando gli antigeni bacillari, processati dai macrofagi, stimolano i linfociti T a rilasciare una serie di linfochine.
Queste cellule attivate si aggregano intorno al centro della lesione e neutralizzano efficacemente i bacilli tubercolari, senza determinare ulteriore distruzione tissutale.
Nella parte centrale della lesione, il materiale necrotico assume l’aspetto di un formaggio molle (necrosi caseosa).
Anche quando avviene la guarigione, i bacilli vitali possono rimanere quiescenti all’interno dei macrofagi o nel materiale necrotico, per anni o anche per tutta la durata della vita del paziente.
Queste lesioni “guarite” nel parenchima polmonare e a livello dei linfonodi ilari possono successivamente andare incontro a calcificazione (complesso di Ranke).
In una minoranza di casi, la lesione tende a ingrandirsi ulteriormente e il tessuto circostante viene a essere progressivamente danneggiato.
Al centro della lesione, il materiale caseoso va incontro a liquefazione e le pareti bronchiali, così come i vasi sanguigni, sono invase e distrutte, con formazione di caverne.
Il materiale caseoso liquefatto, che contiene numerosi bacilli, viene drenato attraverso i bronchi.
All’interno delle pareti delle caverne i bacilli tubercolari possono ora moltiplicarsi e possono diffondersi nelle vie aeree e nell’ambiente attraverso il catarro espettorato.
L’immunità protettiva è probabilmente il risultato della reattività a un ampio numero di differenti anligeni micobattcrici.
In concomitanza con la comparsa dell’immunità, si sviluppa l’ipersensibilità di tipo ritardato nei confronti di Mycobacterium tuberculosis.
Questa reattività dell’ospite è la base del test cutaneo con il derivato proteico purificato della tubercolina (PPD), attualmente l’unico test che rileva in maniera affidabile l’infezione da Mycobacterium tuberculosis nelle persone asintomatichc.
Manifestazioni cliniche della Tubercolosi
La tubercolosi viene di solito classificata come polmonare ed extrapolmonare.
Tubercolosi polmonare
La tubercolosi polmonare può essere distinta in primaria e postprimaria (secondaria).
Tubercolosi polmonare primaria
La tubercolosi polmonare primaria è il risultato della iniziale infezione con i bacilli tubercolari.
Nelle zone di alta prevalenza di tubercolosi, questa forma di malattia si osserva spesso nei bambini ed è frequentemente localizzata a livello dei campi polmonari medi e inferiori.
La lesione che si forma dopo l’infezione è di solito periferica ed è accompagnata da linfoadenopatia ilare o paratracheale, che può non essere rilevabile alla radiografìa del torace.
Nella maggior parte dei casi, la lesione guarisce spontaneamente e successivamente può essere evidenziata come un piccolo nodulo calcifico.
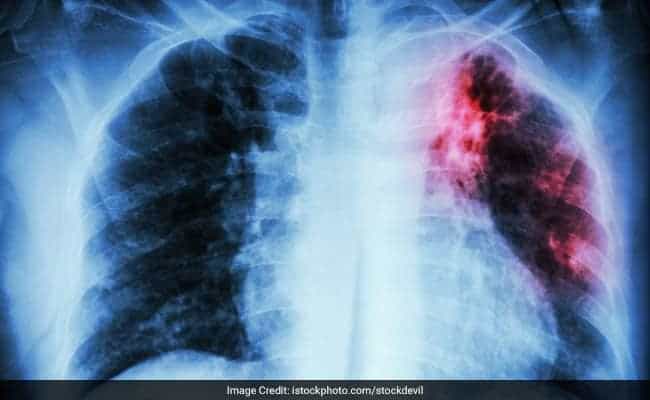
Nei bambini e nei soggetti con immunità compromessa, come quelli con malnutrizione o infezione da HIV, la tubercolosi primaria polmonare può progredire rapidamente fino alla malattia clinica.
Il versamento pleurico, un reperto frequente, deriva dalla penetrazione dei bacilli nello spazio pleurico da un adiacente focolaio subpleurico.
La tubercolosi nei bambini piccoli è quasi invariabilmente accompagnata da linfoadenopatia ilare o mediastinica, dovuta alla diffusione dei bacilli dal parenchima polmonare attraverso i vasi linfatici.
La disseminazione ematogena, che è frequente ed è spesso asintomatica, può avere come risultato le manifestazioni più gravi dell’infezione primaria da Mycobacterium tuberculosis.
I bacilli, dalla lesione polmonare o dai linfonodi, raggiungono il torrente ematico e si disseminano nei vari organi, dove possono produrre lesioni granulomatose.
Anche se frequentemente l’evoluzione è verso la guarigione, i soggetti immunocompromessi (per es., le persone con infezione da HIV e quelle in convalescenza dal morbillo) possono sviluppare la tubercolosi miliare e/o la meningite tubercolare.
Tubercolosi polmonare post-primaria o secondaria
Definita anche malattia degli adulti, riattivazione o tubercolosi secondaria, la malattia postprimaria deriva dalla riattivazione endogena di un’infezione latente ed è di solito localizzata ai segmenti apicali e posteriori dei lobi superiori, a livello dei quali l’elevata concentrazione di ossigeno favorisce la crescita micobatterica.
Sono inoltre frequentemente interessati anche i segmenti superiori dei lobi inferiori.
L’estensione dell’interessamento del parenchima polmonare varia notevolmente, da piccoli infiltrati a un’estesa malattia cavitaria.
Con la formazione delle caverne, il contenuto necrotico, andato incontro a liquefazione, viene eliminato nelle vie aeree, con conscguente formazione di lesioni satelliti nell’ambito dei polmoni; queste possono andare incontro a loro volta a escavazione.
L’interessamento massivo di segmenti o di lobi polmonari, con coalescenza delle lesioni, produce la polmonite tubercolare.
La maggior parte dei pazienti presenta una netta risposta clinica al trattamento, con defervescenza, riduzione della tosse, aumento ponderale e miglioramento generale nell’arco di alcune settimane.
Nella fase precoce della malattia i segni e i sintomi sono spesso non specifici e insidiosi: principalmente sono rappresentati da febbre, sudorazione notturna, perdita di peso, anoressia, malessere generale e astenia.
Tuttavia, nella maggior parte dei casi, con l’evoluzione della malattia si sviluppa la tosse, a volte inizialmente non produttiva e successivamente accompagnata dalla produzione di espettorato purulento.
Frequentemente viene documentata la striatura ematica dell’espettorato.
L’emottisi massiva può conseguire all’erosione di un vaso completamente pervio localizzato nella parete di una caverna, ma può anche derivare dalla rottura di un vaso dilatato in una caverna (aneurisma di Rasmussen) o dalla formazione di un aspergilloma in una vecchia caverna.
Il dolore toracico di tipo pleurico si sviluppa in pazienti con lesioni parenchimali subpleuriche, ma può essere anche la conseguenza di strappi muscolari dovuti alla tosse persistente.
I reperti obiettivi sono di limitata utilità nella tubercolosi polmonare.
Molti pazienti non hanno anomalie rilevabili all’esame del torace, mentre altri presentano, nelle aree colpite, rantoli rilevatali durante l’inspirazione, specialmente dopo la tosse.
Talvolta si possono apprezzare ronchi dovuti alla parziale ostruzione bronchiale e classici rumori anforici nelle zone in cui siano presenti grandi caverne.
Gli aspetti sistemici comprendono la febbre (spesso di basso grado e intermittente) e il decadimento fisico.
In alcuni casi si sviluppa pallore e ippocratismo digitale.
I dati ematologici più frequenti sono una lieve anemia e la leucocitosi.
Tubercolosi extrapolmonare
Le sedi extrapolmonari più frequentemente interessate nella tubercolosi sono, in ordine di frequenza, i linfonodi, la pleura, il tratto genitourinario, le ossa e le articolazioni, le meningi, il peritoneo, ma possono essere colpiti tutti gli organi
La tubercolosi extrapolmonare si osserva più comunemente oggi che in passato, quale risultato della disseminazione ematogena negli individui infettati da HIV.
Tubercolosi linfonodale
La malattia linfonodale è una delle presentazioni più comuni della tubercolosi extrapolmonare (viene documentata in più del 25% dei casi) ed è particolarmente frequente nei pazienti infettati da HIV.
Si presenta come una tumefazione non dolente dei linfonodi, più frequentemente a livello lateroccrvicale e sopraclaveare.
I linfonodi sono di solito ben delimitati nella fase iniziale della malattia, tuttavia possono essere infiammati e presentare tragitti fistolosi drenanti del materiale caseoso.
La diagnosi viene stabilita mediante agoaspirazione o biopsia chirurgica.
Tubercolosi pleurica
L’interessamento della pleura è comune nella tubercolosi primaria e deriva dalla penetrazione di pochi bacilli tubercolari nello spazio pleurico.
In relazione all’entità della reattività, il versamento può essere piccolo, rimanere inosservato e risolversi spontaneamente, oppure può essere sufficientemente importante da causare sintomi come la febbre, il dolore toracico pleurico e la dispnea.
I reperti obiettivi sono quelli del versamento pleurico: ottusità alla percussione e assenza del murmure vescicolare.
Una radiografìa del torace evidenzia il versamento e, in non più di un terzo dei casi, dimostra anche la presenza di una lesione parenchimale.
Per accertare la natura del versamento è necessaria la toracentesi.
Il fluido è di colore giallo paglierino e talvolta emorragico; si tratta di un essudato con una concentrazione proteica superiore al 50% di quella del siero, una concentrazione di glucosio normale, un pH che è generalmente inferiore a 7,2 e una quantità rilevabile di globuli bianchi (di solito da 500 a 2.500/ml).
I neutrofìli possono predominare nelle fasi iniziali, mentre nelle fasi successive si osservano tipicamente le cellule mononuclcatc.
Le cellule mesoteliali sono generalmente rare o assenti.
È molto raro che si possano osservare i bacilli acidoresistenti sullo striscio diretto, ma in una percentuale che può arrivare fino a un terzo dei casi la coltura può essere positiva per Mycobacterium tuberculosis.
Questa forma di tubercolosi pleurica risponde bene ai chemioterapici e può guarire spontaneamente.
Tubercolosi delle prime vie aeree
La tubercolosi delle vie aeree superiori, quasi sempre complicanza di una forma avanzata di tubercolosi cavitaria, può interessare la laringe, la faringe e l’epiglottide.
I sintomi comprendono la raucedine e la disfagia, oltre alla tosse cronica produttiva.
I reperti obiettivi dipendono dalla sede dell’interessamento e alla laringoscopia si possono osservare ulcerazioni.
Gli strisci diretti dell’espettorato, colorati per mettere in evidenza l’acidoresistenza, sono spesso positivi, ma in alcuni casi per accertare la diagnosi può essere necessaria la biopsia.
Tubercolosi genitourinaria
La tubercolosi genitourinaria costituisce circa il 15% di tutti i casi extrapolmonari, può interessare qualsiasi tratto dell’apparato genitourinario ed è solitamente conseguenza della disseminazione ematogena che fa seguito all’infezione primaria.
Dominano il quadro i sintomi locali: pollachiuria, disuria, ematuria e il dolore al fianco sono i sintomi più comuni.
I pazienti possono, tuttavia, essere asintomatici; in questo caso l’identificazione della malattia avviene solo dopo che si siano sviluppate gravi lesioni destruenti renali.
L’analisi delle urine dà risultati anormali nel 90% dei casi, dimostrando ematuria e piuria.
La documentazione di piuria con urinocoltura negativa e pH urinario acido deve far sospettare la tubercolosi. È di aiuto nella diagnosi la pielografia per via endovenosa.
Le calcificazioni e le stenosi ureterali sono rilievi suggestivi e possono portare a idronefrosi e danno renale.
La tubercolosi genitale viene diagnosticata più comunemente nei soggetti di sesso femminile.
Nelle donne sono interessate le tube di Falloppio e l’endometrio e la malattia può causare sterilità, dolore pelvico e anormalità mestruali.
La diagnosi richiede la biopsia o la coltura di campioni ottenuti per dilatazione e raschiamento.
Nei maschi la tubercolosi colpisce prevalentemente l’epididimo, determinando la comparsa di una massa lievemente dolorabile che può drenare all’esterno attraverso un tramite fistoloso; si possono anche sviluppare orchite e prostatite.
In quasi la metà dei casi di tubercolosi genitourinaria è presente anche malattia del tratto urinario.
La tubercolosi genitourinaria risponde bene alla chemioterapia.
Tubercolosi ossea
La tubercolosi delle ossa e delle articolazioni è responsabile di circa il 10% dei casi di tubercolosi extrapolmonare.
Nella malattia delle ossa e delle articolazioni, la patogenesi è legata alla riattivazione di focolai ematogeni o alla diffusione a partire da linfonodi adiacenti paravertebrali.
Le articolazioni che sostengono il peso (ovvero, nell’ordine, quelle della colonna vertebrale, anche e ginocchia) sono le più comunemente colpite.
La tubercolosi spinale (morbo di Pott o spondilite tubercolare) interessa spesso due o più corpi vertebrali adiacenti.
Mentre la parte superiore della colonna toracica è la localizzazione più comune della tubercolosi vertebrale nei bambini, nell’età adulta sono di solito colpite le ultime vertebre toraciche e le prime vertebre lombari.
Dall’angolo anterosuperiore o inferiore del corpo vertebrale, la lesione raggiunge il corpo adiacente, distruggendo anche il disco intervertebrale.
Nella malattia avanzata il collasso dei corpi vertebrali determina la cifosi (gibbo).
Una complicanza catastrofica del morbo di Pott è la paraplegia, di solito dovuta a un ascesso o a una lesione che esercita un’azione compressiva sul midollo spinale.
La tubercolosi delle articolazioni delle anche causa dolore e zoppia; la tubercolosi del ginocchio, che determina dolore e tumefazione, talvolta fa seguito a un trauma.
Meningite tubercolare e tubercoloma
La tubercolosi del sistema nervoso centrale costituisce circa il 5% dei casi extrapolmonari di tubercolosi.
La meningite tubercolare deriva dalla diffusione ematogena della malattia polmonare primaria o postprimaria, oppure dalla rottura di un tubercolo subependimale nello spazio subaracnoideo.
La malattia può presentarsi subdolamente con cefalea e modificazioni mentali, oppure acutamente con confusione, letargia, alterazione del sensorio e rigidità nucale.
Tipicamente, la malattia evolve in 1-2 settimane, un decorso più lungo di quello della meningite batterica.
La paresi dei nervi cranici (in particolare dei nervi oculari) è un reperto comune e l’interessamento delle arterie cerebrali può causare ischemia focale; è comune l’idrocefalo.
La rachicentesi è fondamentale per la diagnosi: l’esame del liquido cerebrospinale evidenzia un’elevata conta leucocitaria (di solito con predominanza di linfociti, ma spesso con una prevalenza di neutrofìli nelle fasi iniziali), un contenuto di proteine tra 1 e 8 g/1 (da 100 a 800 mg/dl) e una ridotta concentrazione di glucosio.
I bacilli acidoresistenti vengono osservati all’esame diretto del liquido cefalorachidiano solo nel 20% dei casi, ma l’efficacia diagnostica può essere accresciuta dalla ripetizione delle punture lombari.
La coltura del liquor è diagnostica in una percentuale che raggiunge 1’80% dei casi.
Se misconosciuta, la meningite tubercolare è invariabilmente fatale.
Questa malattia risponde alla terapia: purtroppo, sequele neurologiche vengono documentate nel 25% dei casi trattati, di solito in quelli in cui vi e stato un ritardo nel formulare la diagnosi.
Tubercolosi gastrointestinale
Qualsiasi parte del tratto gastrointestinale può essere colpita dalla tubercolosi.
Sono coinvolti diversi meccanismi patogenetici: la deglutizione dell’espettorato con conseguente disseminazione diretta, la diffusione ematogena o, raramente, l’ingestione di latte proveniente da mucche affette da tubercolosi bovina.
L’ileo terminale e il ceco sono le sedi più comunemente colpite.
Al momento dell’esordio vengono osservali comunemente dolore addominale, a volte simile a quello associato all’appendicite, diarrea, ostruzione, ematochczia e la presenza di una massa palpabile a livello dell’addome.
Sono anche frequentemente presenti la febbre, la perdita di peso e la sudorazione notturna.
Se vi è interessamento della parete intestinale, la formazione di ulcere e di fistole può simulare la malattia di Crohn.
La presenza di fistole anali giustifica una valutazione diagnostica per la ricerca della tubercolosi rettale.
Dal momento che nella maggior parte dei casi si rende necessario l’intervento chirurgico, la diagnosi può essere accertata mediante l’esame istologico e la coltura del campione ottenuto nel corso della procedura invasiva.
La peritonite tubercolare può essere conseguenza o della diffusione diretta dei bacilli tubercolari, in seguito a rottura di linfonodi e di organi intra-addominali infetti, o della disseminazione ematogena.
Pericardite tubercolare
La tubercolosi pericardica è dovuta o alla diretta progressione di un focolaio primitivo a livello del pericardio, o alla riattivazione di un focolaio latente, oppure alla rottura di un linfonodo adiacente.
Nei Paesi con bassa prevalenza di tubercolosi era una malattia che interessava spesso la popolazione anziana, ma oggi si sviluppa frequentemente nei pazienti infettati da HIV: in alcune casistiche la letalità raggiunge il 40%.
L’esordio può essere subacuto, anche se è possibile osservare un esordio acuto con febbre, dolore sordo retrosternale e presenza di sfregamenti.
In molti casi, col progredire della malattia si sviluppa un versamento: in fase avanzata possono comparire sintomi cardiovascolari e segni di tamponamento cardiaco.
In assenza di terapia la tubercolosi pericardica è di solito fatale.
Anche se trattata, si possono sviluppare delle complicanze, come la pericardite cronica costrittiva con ispessimento del pericardio, fibrosi e a volte calcificazione, che può essere evidente alla radiografìa del torace.
Tubercolosi miliare
La tubercolosi miliare è causata dalla disseminazione ematogena dei bacilli tubercolari.
Mentre nei bambini è spesso la conseguenza di una recente infezione primaria, negli adulti può essere dovuta o a una recente infezione o alla riattivazione di vecchi focolai disseminati.
Le lesioni sono solitamente granulomi giallognoli del diametro di 1-2 mm che sono simili ai semi di miglio (da cui il termine miliare, coniato dagli anatomopatologi del diciannovesimo secolo).
Le manifestazioni cliniche non sono specifiche e sono proteiformi, dipendendo dalla sede predominante dell’interessamento.
Nella maggior parte dei casi i sintomi di presentazione sono la febbre, la sudorazione notturna, l’anoressia, l’astenia.
A volte i pazienti presentano nel contempo tosse e altri sintomi respiratori, dovuti all’interessamento polmonare, oltre a sintomi addominali.
I reperti obiettivi comprendono l’epatomegalia, la splenomegalia e la linfoadenopatia.
Per la diagnosi di tubercolosi miliare è necessario un alto indice di sospetto.
Frequentemente la radiografìa del torace presenta un aspetto reticolonodulare miliare (è più facile osservarlo su lastre ottenute con raggi non eccessivamente penetranti), anche se nelle fasi precoci del decorso e nei pazienti con infezione da HIV può non essere ri levabile alcuna anormalità radiografica.
L’esame diretto del l’espettorato è negativo nell’80% dei casi.
Se non viene riconosciuta, la tubercolosi miliare è letale: con un appropriato trattamento, tuttavia, è possibile ottenere la guarigione.
Diagnosi della tubercolosi
La chiave per la diagnosi della tubercolosi è avere un elevato indice di sospetto.
La diagnosi non è diffìcile in un paziente ad alto rischio, come per esempio un soggetto alcolizzato, senza tetto, che presenti sintomi tipici e la cui radiografìa del torace evidenzi la presenza di infiltrati del lobo superiore con caverne.
Di contro, la diagnosi può facilmente essere misconosciuta in un paziente anziano, residente in un reparto di lungodegenza, oppure in un adolescente con un infiltrato focale.
Spesso la diagnosi viene considerata per la prima volta quando, nel corso della valutazione diagnostica di un paziente con sintomi respiratori, la radiografìa del torace risulta anormale.
Più lungo è il ritardo tra l’esordio dei sintomi e la diagnosi, maggiore è la probabilità di trovare una forma cavitaria.
Coltura dei micobatteri
La diagnosi definitiva dipende dall’isolamento e dall’identificazione di Mycobacterium tuberculosis dal materiale diagnostico, nella maggior parte dei casi un campione di espettorato raccolto da un paziente con tosse produttiva.
I campioni possono essere inoculati su terreni a base di uovo o di agar e incubati a 37 °C in atmosfera arricchita di CO2 al 5%.
Dal momento che la maggior parte delle specie di micobatteri, compreso Mycobacterium tuberculosis, sono specie a crescita lenta, possono essere necessarie dalle 4 alle 8 settimane prima che si possa rilevare la crescita.
Anche se Mycobacterium tuberculosis può essere presuntivamente identificato sulla base del tempo necessario alla sua crescita e della morfologia e pigmentazione delle colonie, tradizionalmente veniva utilizzata una batteria di test biochimici per spedare il ceppo di micobatterio isolato.
Nei laboratori odierni, l’uso di terreni di coltura liquidi con rilievo radiometrico della crescita (per es., BACTEC-460) e l’identificazione degli isolati con sonde per gli acidi nucleici o con cromatografia liquida ad alta pressione degli acidi micolici hanno sostituito i metodi tradizionali di isolamento su terreni solidi e l’identificazione con test biochimici.
Questi nuovi metodi hanno ridotto i tempi richiesti per l’isolamento e la speciazione a 2-3 settimane.
Attualmente sono divenuti disponibili altri sistemi per la coltura su terreni liquidi con rilievo non radiometrico della crescita.
Quantiferon test
Il test del Quantiferon si esegue su sangue venoso e misura la quantità di interferone gamma prodotta dai linfociti T e dai monociti di un soggetto, come risposta ad una stimolazione con antigeni del Mycobacterium tuberculosis.
Il Quantiferon risulta utile per:
- la diagnosi differenziale fra tubercolosi polmonare attiva ed infezione da micobatteri non tubercolari;
- individuare una infezione latente di tipo tubercolare nei soggetti maggiormente a rischio.
Il Quantiferon si affianca o può sostituire l’intradermoreazione di Mantoux nella diagnosi di tubercolosi.
Il risultato del test viene espresso in termini di positivo/negativo, rispetto ad un cutoff universale per tutti i soggetti.
Risultano positivi la maggior parte dei soggetti con un’infezione tubercolare in atto; negativi i soggetti vaccinati con BCG.
Amplificazione dell’acido nucleico
Sono disponibili diversi test basati sull’amplificazione dell’acido nucleico dei micobatteri.
Questi sistemi consentono di effettuare la diagnosi di tubercolosi nel breve arco di alcune ore.
Comunque, il loro impiego è limitato dalla bassa sensibilità (minore della coltura) e dall’alto costo.
Al momento questi test sono stati approvati dalla Food and Drug Administration degli Stati Uniti solo per l’identificazione della specie su espettorati positivi per bacilli acidoresistenti.
Con ulteriori miglioramenti della resa diagnostica, questi test possono essere utili anche per la diagnosi di pazienti con tubercolosi polmonare ed extrapolmonare con esame microscopico negativo per bacilli acidoresistenti.
Procedure radiografiche
Come accennato sopra, il sospetto iniziale di tubercolosi polmonare è spesso basato sul reperto di una radiografia del torace anormale in un paziente con sintomi respiratori.
Anche se il quadro “classico” è quello di una malattia dei lobi superiori con infiltrati e caverne, può essere rilevato praticamente qualsiasi aspetto radiografico, dalla normalità alla presenza di un nodulo solitario polmonare, alla presenza di infiltrati alveolari diffusi in un paziente con ARDS.
Nell’era dell’AIDS, nessun quadro radiologico può essere considerato patognomonico.
Test cutaneo con il PPD
Il test cutaneo con il PPD viene ampiamente utilizzato nello screening dell’infezione da Mycobacterium tuberculosis (vedi oltre).
Il test ha valore limitato nella diagnosi di tubercolosi attiva, a causa della bassa sensibilità e specificità.
È frequente che il test sia falsamente negativo nei pazienti immunocompromessi e in quelli con forme di tubercolosi estremamente aggressive.
Talvolta si osservano reazioni positive in pazienti che sono stati infettati da Mycobacterium tuberculosis, ma che non hanno la malattia attiva, così come in soggetti che sono stati sensibilizzati da micobatteri non tubercolari (vedi Cap. 53) o dalla vaccinazione con BCG.
Anche se la vaccinazione con BCG non è frequentemente utilizzata negli Stati Uniti, molti immigrati potrebbero averla ricevuta nei loro Paesi di origine.
In assenza anamnestica di precedente vaccinazione con BCG, il test cutaneo positivo può fornire un ulteriore elemento per la diagnosi di tubercolosi nei casi in cui la coltura sia negativa.
Test di sensibilità ai farmaci
Come regola generale, il ceppo di Mycobacterium tuberculosis che viene isolato per la prima volta deve essere saggiato per valutarne la sensibilità ai farmaci di prima scelta utilizzati nel trattamento: isoniazide, rifampicina, etambutolo, pirazinamide e streptomicina.
Inoltre, è obbligatorio eseguire i test di sensibilità quando i pazienti non rispondono alla terapia iniziale oppure presentano una ricaduta dopo aver completato il trattamento (vedi oltre).
Il test di sensibilità può essere effettuato direttamente (sul campione clinico) o indirettamente (sulla coltura microbiologica), utilizzando terreni liquidi o solidi.
I risultati vengono ottenuti più rapidamente mediante i test diretti di sensibilità su terreno liquido, con un tempo medio necessario per ottenere la risposta di 3 settimane.
Con il test indiretto su terreno solido, i risultati possono non essere disponibili per 8 settimane o più.
Stanno diventando disponibili dei metodi molecolari per l’identificazione rapida della resistenza ai farmaci.
Uno dei più promettenti utilizza la reazione polimerasica a catena (PCR) per il gene rpoB per rilevare la resistenza alla rifampicina.
Terapia della Tubercolosi
Farmaci
Cinque farmaci principali vengono considerati agenti di prima scelta per il trattamento della tubercolosi:
- Isoniazide
- Rifampicina
- Pirazinamide
- Etambutolo
- Streptomicina
I primi quattro, che vengono somministrati di solito per via orale, sono ben assorbiti, con raggiungimento dei livelli serici di picco alla seconda e alla quarta ora ed eliminazione pressoché completa entro 24 ore.
Questi agenti sono raccomandati sulla base della loro attività battericida (capacità di ridurre rapidamente il numero di microrganismi vitali), della loro attività sterilizzatrice (capacità di uccidere tutti i bacilli e quindi sterilizzare l’organo colpito, misurata in termini di capacità di prevenire le recidive) e del loro basso tasso di induzione di resistenza ai farmaci.
A causa del minore grado di efficacia, della minore tollerabilità e della maggiore incidenza di tossicità, diversi farmaci di seconda scelta vengono utilizzati solo nel trattamento dei pazienti con tubercolosi resistente ai farmaci di prima scelta.
In questo gruppo sono compresi i farmaci iniettabili kanamicina, amikacina e capreomicina e gli agenti orali etionamide, cicloserina e PAS.
Recentemente i chinoloni sono divenuti i farmaci di seconda scelta più utilizzati.
Di quelli disponibili, l’ofloxacina è il più ampiamente usato, ma la levofloxacina e la sparfloxacina sono i più attivi, sebbene quest’ultima sia associata a un’alta frequenza di fotosensibilizzazione.
Altri farmaci di seconda scelta sono la clofazimina, l’amitiozone e l’amoxicillina/acido clavulanico.
Schemi terapeutici
Gli schemi abbreviati vengono divisi in una fase iniziale o battericida e in una fase di consolidamento o di sterilizzazione.
Durante la fase iniziale viene uccisa la maggior parte dei bacilli tubercolari, i sintomi si risolvono e il paziente cessa di essere contagioso.
La fase di consolidamento è necessaria al fine di eliminare i bacilli “persistenti” semiquiescenti.
Lo schema terapeutico di scelta, virtualmente per tutte le forme di tubercolosi, sia negli adulti che nei bambini, consiste di una fase iniziale di 2 mesi con l’associazione di isoniazide, rifampicina e pirazinamide, seguita da una fase di consolidamento di 4 mesi con isoniazide e rifampicina.
Fatta eccezione per i pazienti in cui, su base epidemiologica, sia improbabile un’infezione sostenuta da ceppi resistenti, per i primi 2 mesi o fino a che i risultati dei test di sensibilità non siano disponibili andrebbe aggiunto allo schema iniziale l’etambutolo (o la streptomicina).
Il trattamento viene somministrato di solito quotidianamente per tutta la sua durata o in maniera intermittente (tre volte alla settimana per tutta la durata della terapia, oppure due volte alla settimana dopo una fase iniziale di terapia quotidiana).
Una fase di consolidamento con rifapentina e isoniazide una volta a settimana sembra essere efficace per i pazienti che hanno effettuato una fase di terapia iniziale e che hanno colture negative su espettorato a due mesi.
Il trattamento intermittente è particolarmente utile per i pazienti la cui terapia deve essere somministrata sotto osservazione diretta.
Per i pazienti con tubercolosi polmonare a coltura dell’espettorato negativa, la durata del trattamento può essere ridotta a 4 mesi complessivi.
Il più importante ostacolo alla guarigione è la mancanza di adesione allo schema terapeutico da parte dei pazienti.
Inoltre, la mancata adesione allo schema prescritto favorisce l’acquisizione della resistenza da parte dei ceppi micobatterici.
Dal momento che è difficile prevedere quali pazienti aderiranno al trattamento raccomandato e quali no, l’effettuazione della terapia dovrebbe essere controllata in tutti i casi, specialmente durante la fase intensiva iniziale.
Sono disponibili formulazioni di combinazione di più farmaci (isoniazide/rifampicina e isoniazide/rifampicina/pirazinamide) che sono fortemente raccomandate.
Gli effetti collaterali gravi che portano all’interruzione di uno dei farmaci di prima scelta e all’uso di questi schemi alternativi sono rari.
Monitoraggio della risposta al trattamento
La valutazione batteriologica è il metodo preferito per il monitoraggio della risposta al trattamento della tubercolosi.
L’esame dell’espettorato va ripetuto ogni mese nei pazienti con malattia polmonare, fino a che le colture non diventino negative.
Con lo schema raccomandato della durata di 6 mesi, la coltura dell’espettorato è negativa alla fine del secondo mese di trattamento in più dell’80% dei pazienti.
Alla fine del terzo mese, di fatto, la coltura è negativa in tutti i pazienti.
In alcuni pazienti, in particolare in quelli che presentano una malattia estesa, cavitaria e un elevato numero di microrganismi, la negativizzazione dell’esame microscopico può avvenire dopo la negativizzazione dell’esame colturale.
Questo fenomeno è presumibilmente dovuto all’espettorazione e alla visualizzazione microscopica di bacilli morti.
Quando l’espettorato di un paziente rimane positivo oltre i 3 mesi di terapia, si deve sospettare il fallimento del trattamento e la presenza di bacilli resistenti.
Tossicità dei farmaci
Durante il trattamento, i pazienti vanno controllati per evidenziare l’eventuale comparsa di tossicità.
Il più comune effetto tossico rilevante è l’epatite.
I pazienti vanno educati attentamente a riconoscere i segni e i sintomi di epatite da farmaci (cioè urine scure, perdita di appetito) e devono essere istruiti a sospendere prontamente il trattamento e a recarsi dal medico se questi sintomi dovessero manifestarsi.
Anche se non è consigliato il controllo biochimico di routine, una valutazione di base della funzione epatica (misura dei livelli delle transaminasi epatiche e della bilirubina sierica) andrebbe eseguita in tutti i pazienti adulti.
Un modesto incremento dell’aspartato aminotransferasi (fino a 3 volte il limite superiore della norma) si osserva in circa il 20% dei pazienti; non è accompagnato da alcun sintomo e non ha conseguenze cliniche.
L’iperuricemia e l’artralgia causati dalla pirazinamide possono essere gestite con la somministrazione di acido acetilsalicilico; il trattamento con pirazinamide va tuttavia interrotto se il paziente sviluppa un’artrite gottosa.
La rifampicina deve essere sospesa definitivamente nei soggetti che sviluppano la trombocitopenia autoimmune secondaria alla terapia con questo farmaco.
Allo stesso modo, la comparsa di neurite ottica da etambutolo e lo sviluppo di danno dell’ottavo nervo cranico da streptomicina richiedono la sospensione permanente dei rispettivi farmaci.
Altre frequenti manifestazioni di intolleranza ai farmaci, come il prurito e i disturbi gastrointestinali, possono essere gestite senza l’interruzione della terapia.
Fallimento della terapia e ricadute
Come affermato sopra, il fallimento della terapia deve essere sospettato quando la coltura dell’espettorato di un paziente rimane positiva dopo 3 mesi di terapia o, in alternativa, quando l’esame diretto per bacilli acidoresistenti rimane positivo dopo 5 mesi.
Nella corretta gestione di tali pazienti è imperativo che il ceppo isolato venga saggiato per la sensibilità agli agenti di prima e seconda scelta.
Quando, in considerazione delle metodiche utilizzate, si ritenga che i risultati del saggio di sensibilità potrebbero essere disponibili entro alcune settimane, le modificazioni alla terapia possono essere posposte fino a quel momento.
Terapia corticosteroidea aggiuntiva
L’uso dei corticosteroidi a integrazione della terapia aggiuntiva della tubercolosi è giustificato dalla loro potente attività antinfiammatoria in una malattia in cui la risposta dell’ospite gioca un ruolo fondamentale.
Esiste un consenso di base sull’impiego dei corticosteroidi nella meningite e nella pericardite tubercolare per accelerarne il miglioramento clinico (vedi sopra). 1 benefici a lungo termine sono rappresentati da una ridotta mortalità nella pericardite costrittiva e da minori esiti neurologici nella meningite.
Alcuni studi hanno indicato che l’utilità di questi farmaci nella pleurite può essere meno importante di quanto ritenuto in precedenza.
In linea generale, a seconda dell’urgenza e gravità delle condizioni cliniche, il prednisone può essere somministrato a una dose quotidiana di 20-60 mg per un periodo fino a 6 settimane.
Il desametasone (fino a 12 mg/die) è il farmaco di scelta utilizzato nella meningite; la terapia viene proseguita per 4-6 settimane, con una graduale riduzione della dose dopo le prime due settimane.
Si devono tenere in debito conto le interazioni della rifampicina con i corticosteroidi, che portano a un loro accelerato metabolismo e a una potenziale crisi surrcnalica.
Tubercolosi resistente ai farmaci
I ceppi di Mycobacterium tuberculosis resistenti a singoli farmaci prendono origine da mutazioni spontanee puntiformi nel genoma del micobatterio, che si verificano con frequenze basse, ma prevedibili.
Dal momento che non vi è resistenza crociata tra i farmaci comunemente usati, la probabilità che un ceppo sia resistente a due farmaci è pari al prodotto della probabilità di resistenza a ognuno dei farmaci considerati ed è pertanto bassa.
Lo sviluppo di tubercolosi fàrmacoresistente è invariabilmente il risultato della monoterapia dovuta o alla mancata prescrizione da parte del medico di almeno due farmaci cui i bacilli tubercolari siano sensibili o all’incapacità da parte del paziente di assumere correttamente la terapia prescritta.
Dato che la gestione dei pazienti con tubercolosi multiresistente ai farmaci è complicata da fattori sia sociali che medici, la cura di tali pazienti dovrebbe essere effettuata da specialisti e nell’ambito dei programmi di controllo della tubercolosi.
Situazioni cliniche particolari
Anche se gli studi clinici sul trattamento della tubercolosi extrapolmonare sono limitati, i dati disponibili indicano che tutte le forme di malattia possono essere trattate con uno degli schemi della durala di 6 mesi utilizzati per i pazienti con malattia polmonare.
Come regola, ai pazienti con insufficienza renale cronica non si devono somministrare gli aminoglicosidi, mentre l’etambutolo può essere somministrato solo se è possibile controllarne i livelli sierici.
I pazienti con insufficienza epatica presentano un problema particolare a causa della tossicità epatica dell’isoniazide, della rifampicina e della pirazinamide.
I pazienti con grave insufficienza epatica possono essere trattati con l’etambutolo e con la streptomicina; se necessario, si possono utilizzare l’isoniazide e la rifampicina, ma sotto stretto controllo medico.
Gravidanza
Lo schema da utilizzare nelle donne in gravidanza è il seguente: 9 mesi di trattamento con isoniazide e rifampicina, aggiungendo l’etambutolo nei primi 2 mesi.
Qualora sia necessario, può essere somministrata anche la pirazinamidc, anche se non vi sono dati relativi alla sua sicurezza in gravidanza.
La streptomicina è controindicata perché è noto che determina un danno dell’ottavo paio dei nervi cranici del feto.
Durante il trattamento per la tubercolosi, l’allattamento non è controindicato; la maggior parte dei farmaci somministrati è presente in piccole quantità nel latte materno, anche se a concentrazioni troppo basse per fornire un qualsiasi beneficio terapeutico o profilattico per il bambino.
Profilassi della tubercolosi
Vaccinazione con BCG
Il Bacillo di Calmette-Guerin (BCG) fu ottenuto da un ceppo attenuato di Mycobacterium bovis, e venne somministrato per la prima volta all’uomo nel 1921.
Nel mondo sono disponibili molti vaccini preparati con il BCG; derivano tutti dal ceppo originale, ma hanno diversa efficacia.
In effetti, l’ efficacia stimata sulla base dei risultati di studi randomizzati controllati con placebo è risultata molto variabile, raggiungendo in alcuni casi 1’80% ed essendo invece assente in altri.
Una simile gamma di efficacia è stata descritta anche in recenti studi osservazionali (casocontrollo, coorti storiche, studi trasversali) condotti in regioni in cui i bambini vengono vaccinati alla nascita.
Questi studi hanno anche evidenziato una maggiore efficacia del vaccino nel conferire protezione ai neonati e ai bambini nei confronti di forme relativamente gravi di tubercolosi, come la meningite e la tubercolosi miliare.
Il vaccino BCG è sicuro e raramente causa complicanze gravi: gli effetti collaterali (più comunemente ulcerazione nella sede della vaccinazione e linfadenite regionale) si verificano nell’1-10% dei soggetti vaccinati.
La vaccinazione con BCG induce la reattività al PPD, che tende a scomparire con il passare del tempo ma la presenza o le dimensioni della reazione al test cutaneo con PPD dopo la vaccinazione non sono indicative del grado di protezione raggiunto.
BIBLIOGRAFIA
Breiman RE et al: Proccedings of the International Symposium on Tuberculosis Vaccine Development and Evaluation. Clin Infect Dis 30(Suppl 3):S199-322, 2000
Centers eor Disease Control and Prevention: Guidelines for preventing the tran-smission of Mycobacterium tuberculosis in health-care facilities. MMWR 43(RR-13): 1. 1994
——-: Prevention and treatment of tuberculosis among paticnts infected with human immunodeftciency virus: Principles of therapy and reviscd recommendations. MMWR 47(RR-20):l, 1998
Coi.e ST et al: Deciphering thè biology of Mycobacterium tuberculosis from the complete genomc scquence. Nature 392:537, 1998
Collins DM: In search of tuberculosis virulencc genes. Trends Microbiol 4:426, 1996 Crofton J et al: Guidelines for thè Management of Drug-Resistant Tuberculosis. Geneva, World Ealth Organization, 1997
Dooi.ey DP et al: Adjunctive corticosteroid therapy for tuberculosis: A criticai reap-praisal of the litcraturc. Clin Infect Dis 25:872, 1997
Dye C et al: Global burden of tuberculosis: Estimated incidence, prcvalencc, and mor-tality by country. JAMA 282:677. 1999
Ellner JJ: The immune responso in human tuberculosis—implications for tuberculosis control. J Infect Dis 176:1351. 1997
Moore MM et al: Trends in drug-rcsistant tuberculosis in the United States, 1993-1996. JAMA 278:833, 1997
O’Brien RJ: Preventive therapy, in Clinical Tuberculosis. 2d ed. PDO Davies (ed). London. Chapman & Hall, 1998, pp 397-416
Pablos-Mf.ndez A et al: Global surveillance for antituberculosis-drug resistance. 1994-1997. N Engl J Mcd 338:1641. 1998
Raviglione MC et al: Assessment of worldwide tuberculosis control. Lancet 350:624, 1997
Schlossberg D: Tuberculosis and Nontuberculous Mycobacterial Infections, 4th ed. Philadelphia, Saunders, 1999
Schorey JS et al: A macrophage invasion mechanism of pathogenic mycobacteria. Science 277:1091, 1997
Valway SE et al: An outbreak involving extensive transmission of a virulent strain of Mycobacterium tuberculosis. N Engl J Med 338:633, 1998
Wori.d Health Organization: Treatment of Tuberculosis. Guidelines for National Programmes. Genova. World Health Organization, 1997