Colchico
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Colchicum autumnale L. – Fam.. Colchicacee)
Colchico- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Colchicum, dal greco kolcikon = da Colchide, regione del
l'Asia Minore, dove la pianta è presente.
autumnale – perchè fiorisce in autunno.
Nome volgare – Efemere, Fior del freddo, Zafferano bastardo.
Habitat – Europa centrale e meridionale. Si trova nell’Italia settentrionale, nei luoghi erbosi (prati e pascoli, specialmente concimati ed irrigui); nell’Italia centrale e meridionale allignano specie affini, da alcuni AA. considerate come varietà, Tenorei Parl. – neapolitanum Ten. – Bivonae Guss. Nelle isole C. Cupanii Guss. Sulle Alpi, Appenino boreale, Colchicum alpinum Lam. e DC. e la sua var. parvulum Ten. (Appennino dal centro al sud, Sardegna, Corsica). Specie e varietà sono spesso confuse fra loro.
Pianta erbacea.
Parti usate – I semi (Colchici semen F.U.).
Componenti principali
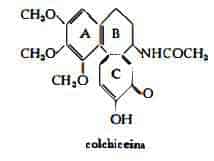
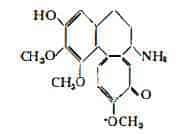
Alcaloidi, di cui il più notevole è la colchicina, isolata da Pelletier e Caventou (1) nel 1820 e considerata allora identica alla veratrina: Geiger e Hesse (2) nel 1833 la riconobbero come sostanza distinta e la denominarono colchicina. Solo più tardi nel 1885-1888 Zeisel (3) iniziò gli studi sulla natura chimica di questa sostanza, giungendo a chiarirne almeno in parte il problema della composizione chimica. Windaus nel 1924 (4) pubblicò la prima formula (1), che riferiva la colchicina agli alcaloidi con nucleo fenantrenico. Gli studi di Cook (5), Dewar (6), Lettré (7), Tarbell (8), Santavy (9) hanno contribuito a determinare l'attuale struttura benzo-cicloeptano-tropolonica (II);
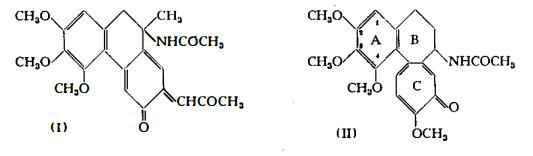
Il gruppo —OCH3 dell’anello C della colchicina è facilmente scisso per idrolisi acida (10) (11) o alcalina (12) (13) con formazione di colchiceina C21H23O6N. Questa facile degradazione della colchicina si verifica nei processi d’estrazione degli alcaloidi del Colchico.
Oltre alla colchicina sono state isolate dal Colchico numerose altre sostanze, derivanti tutte da una medesima struttura fondamentale ed aventi una composizione elementare identica o vicina a quella della colchicina C22H25O6N. Queste sostanze si possono distinguere in principi tropolonici e non tropolonici.
Principi tropolonici
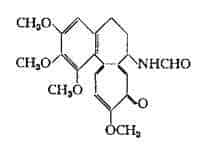
La N-formil-desacetil-colchicina o sostanza B si trova in piccole quantità nei diversi tessuti del colchico (10) (14) (15) (16); essa è stata riprodotta per sintesi parziale a partire dalla desacetil-colchicina (10) o dal suo etere-metilico (17). Ha la seguente formula:
La 2-demetil-colchicina o sostanza C, isolata dai semi (10) (18) e dai bulbi (10) (19) del Colchico presenta la struttura seguente:
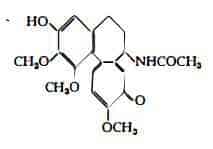
La 3-demetil-colchicina o sostanza E, E1, E2, isomera della sostanza C e molto simile a questa si ottiene dai semi, dai bulbi, dai fiori, dalle foglie e dai pericarpi del C. autumnale L. (20) (21) (22).
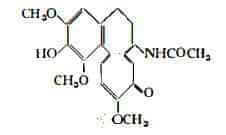
La N-metil-desacetil-colchicina o demecolcina o colcamina o sostanza F (14) (23) è stata trovata in tutti i tessuti del Colchico (10) ( 16) (18) (19) (20) (21). E’ stata denominata demecolcina da Santavy e coll. (24) ed è identica alla colcamina del Colchicum speciosum Stev. (25):
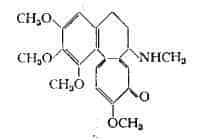
Dal Colchicum autumnale L. (10) e dal Colchicum speciosum Stev.
(25) è stata estratta una sostanza cristallizzata, indicata come sostanza G o colchicerina. Si trattava in realtà di una combinazione cristallina di colchicina con la sostanza F (26).
Le sostanze Ka (16) e N (15), isolate rispettivamente dai semi e dai fiori del Colchico in piccole proporzioni, danno le reazioni dei tropoloni.
La sostanza R è stata isolata dai bulbi di C. autumnale. Non ne sono stati precisati i dati analitici, ma sembra sia presente il nucleo tropolonico (24 a).
La 3-demetil-N-desacetil-N-metil-colchicina o sostanza S (27) è stata estratta dai semi, dai bulbi e dai fiori ed ha la seguente formula:
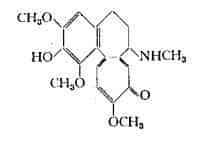
Bellet e Muller (28) hanno isolato un O-demetil-N-metildesacetilcolchicina, che successivamente è stata riconosciuta identica alla sostanza S (50 a) .
La sostanza indicata come sostanza Ta (demecolceina) è stata identificata con la N-desacetil-N-metil-colchiceina secondo la seguente struttura (27):
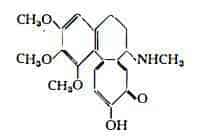
La sostanza U sarebbe la 2-demetil-N-desacetil-colchicina (15) (16) ed è stata isolata in piccole proporzioni dai semi, dai bulbi e dai fiori.
Il colchicoside, estratto dai semi di Colchico ed identificato da Bellet (29) (30) (31) (31a), è il glucoside naturale della sostanza C ed ha la seguente formula di struttura:
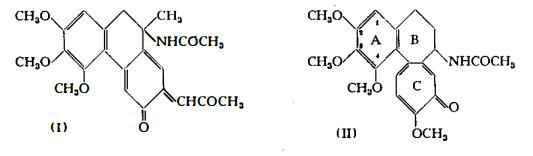
0
Sostituendo con un atomo di zolfo l’ossigeno del gruppo ossimetilico dell'anello C del colchicoside, Velluz e Muller (30 a) hanno ottenuto un nuovo glucoside, il tiocolchicoside, dotato di interessanti proprietà terapeutiche.
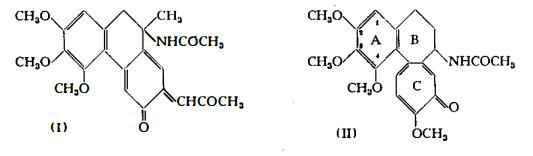
1
Principi non tropolonici
Le sostanze D, I e J, le cui strutture non sono state precisate, si distinguono nettamente dagli altri derivati della colchicina sinora isolati: esse non presentano la struttura tropolonica. Sono lurniderivati naturali, che sono stati identificati con i derivati fotochimici artificiali di altri componenti del Colchico.
La sostanza D (10) (20) è identica alla lumisostanza E ed il suo metilderivato corrisponde alla sostanza I (32).
La sostanza I (10) (20) è stata identificata alla lumicolchicina I di Santavy (32) ed alla lumicolchicina P di Grewe e Wulf (33).
La sostanza J (18) (19) (34) è identica alla lumicolchicina II (32) o g (33).
La sostanza M, trovata in piccole quantità nei fiori del Colchico, sembra corrispondere al glucoside della sostanza D (15).
La sostanza O (15), che esiste in tracce nei fiori, è un isomero della colchicina, di costituzione non tropolonica.
La sostanza P è stata ottenuta dai bulbi del Colchico. Non ne sono stati precisati i dati analitici, se non per quanto riguarda la presenza di quattro gruppi metossilici e di un gruppo acetilico. Il nucleo tropolonico sembra essere assente (24 a).
La sostanza To, è stata isolata dai bulbi del C. autumnale (24 a). Probabilmente contiene quattro gruppi metossilici ed un gruppo acetilico.
Dai semi Bellet e Muller (28) hanno isolato un alcaloide solforato C22H25NO4S2 nelle proporzioni dello 0,003 %. Esso non dà le reazioni del nucleo tropolonico.
Nei semi la colchicina, secondo Blau (45) e Grimme (43), è localizzata nella cuticola mentre, secondo Lipatz (35), si trova prevalentemente nell'endosperma.
Il contenuto di colchicina è maggiore nei semi rispetto alle altre parti della pianta: in media 0,5-0,8 % nei semi, 0,15 % nei bulbi, 0,2-0,3 % nei fiori (31a). Nei semi la colchicina è stata trovata in quantità molto variabili: 0,2-0,4% secondo Tunmann e Rosenthaler (42), 0,4-0,63% (metodo polarimetrico) secondo Gillet (40), 0,38-1,06 %, secondo Santavy (41), 0,69-0,90 % secondo Caesar e Loretz (37). 0,6-0,7% secondo Schulze (38), 0,6-1,23 %, secondo Santavy e Buchnicek (39). Tra i fattori, che influiscono su questa variabilità di titolo, notevole è lo stato di maturazione dei semi. La determinazione del titolo di colchicina nei semi, saggiati da Buchnicek (36) durante il periodo di maturazione, ha dato i seguenti risultati (espressi in % della droga secca):
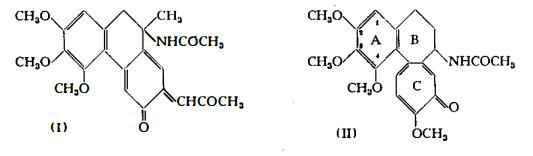
2
Altri componenti: nei semi grasso 6,6-8,4 %, anche 17,6% (43) zuccheri (glucosio) 0,9-7% (44), fìtosterolo (45): nei bulbi acido chelidonico (46), asparagina 0,023 % (47), apigenina (24a), amido sino a 21 %, gli acidi benzoico, salicilico (48) e 2-ossi-6-metossi-benzoico, saccarosio e fitosterolo (49): non sono state trovate saponine (50).
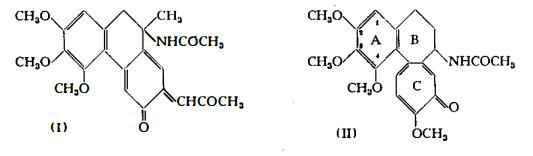
3
Proprietà farmacologiche ed impiego terapeutico
Non è ben certo se quella varietà di Colchico proveniente dal Mar Nero di cui si trova menzione nelle opere di Dioscoride, corrisponda esattamente al Colchico autunnale di Linneo attualmente considerato officinale, esistono anzi molti dubbi in proposito ma, ciò nonostante, è proprio a Dioscoride che viene attribuito il merito di aver parlato per primo di questa droga.
Agli antichi medici e farmacognosti tuttavia, il Colchico era noto più per la sua tossicità che per le ancora poco note virtù curative. L’impiego terapeutico era limitato infatti alle sole applicazioni esterne e i ripetuti tentativi di estenderne l’uso, avvenuti anche dopo la constatazione delle sue proprietà antigottose, furono sempre ostacolati dalla elevata e variabile tossicità caratteristica dei preparati della droga.
Nel 1818 il Colchico autunnale veniva inscritto nella Farmacopea di Londra, ma neanche questo riconoscimento ufficiale, come pure la scoperta e l’isolamento della colchicina avvenuta anche, nel secolo scorso, valsero a conferirgli una maggior importanza farmacologica e una maggior estensione del suo impiego terapeutico.
L'interesse dei biologi fu nuovamente attratto dalla colchicina allorché, in epoca relativamente recente, vennero riprese le ricerche sull'influenza che questo alcaloide esercita sulla mitosi cellulare, influenza già notata dall’italiano Pernice (51) fin dal 1889 e successivamente chiarita dal Dustin (52), dal Lits (53), dall’Amoroso (54) e da numerosi altri AA. che in seguito si occuparono di questo argomento il cui interesse non appare limitato soltanto al campo puramente biologico ma investe anche interessanti problemi farmacologici e terapeutici.
Esiste sul Colchico, sulla colchicina e sui suoi derivati naturali e di sintesi, una letteratura tanto vasta che il volerne fare una completa rassegna sarebbe compito molto arduo, oltre che superfluo e inopportuno in questa sede. Noi ci limiteremo a trattare separatamente dell’azione farmacologica generale dei principi attivi del Colchico, della loro azione sulla mitosi cellulare e terapeutica, riferendoci in particolare, ai risultati delle ricerche farmacologiche e cliniche più recenti, valendoci anche dei dati raccolti dal Niccolini nella sua estesa monografia comparsa nel 1953 (55).
Azione locale
Applicata sulla cute la colchicina, in soluzione opportunamente concentrata, vi provoca una notevole irritazione. Sulle mucose l’effetto irritante è molto più intenso, tanto che applicata sulla congiuntiva vi può determinare una infiammazione così violenta da condurre alla cecità.
Oswald (56) ritiene che l’azione irritante della colchicina sia dovuta ai molteplici ossidrili non sufficientemente mascherati dal gruppo metossilico. Non si potrebbe escludere però che tale azione, analogamente a quella di altri irritanti cutanei, possa anche derivare dalla sua possibilità di reagire coi gruppi sulfidrilici delle proteine e degli enzimi tessutali. I metossili possono infatti reagire con tali gruppi sulfidrilici e, nel caso della colchicina e del colchicoside, particolarmente reattivo sotto questo aspetto appare il metossile dell'anello eptatrienico il quale reagendo con tiomercaptano, dà luogo alla tiocolchicina o al tiocolchicoside rispettivamente. Sta di fatto che l'azione irritante è massima nella colchicina, diminuisce nel colchicoside in cui un metossile è sostituito dal glucosio ed è minima nel tiocolchicoside in cui un metossile dell'anello A è sostituito col glucosio e l'O del metossile dell'anello C (eptatrienico), è sostituito con un atomo di S:
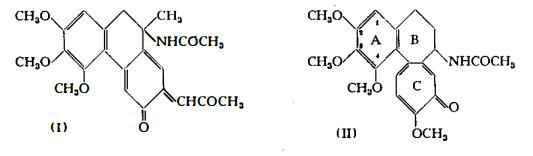
4
Azione sull'apparato digerente
La colchicina somministrata per os, o per via parenterale, manifesta la sua azione dopo 3-6 ore, con aumento della secrezione salivare, gastrica e intestinale, con aumento della peristalsi, congestione e dilatazione capillare. Per le dosi elevate compaiono ecchimosi ed emorragie che interessano tutta la mucosa del tubo gastro-enterico. La peristalsi viene esaltata e compaiono fenomeni diarroici colerosimili, favoriti anche dalla dilatazione capillare addominale, cui consegue un aumento del contenuto idrico e mucoso nel lume intestinale. Il fatto che, questi fenomeni siano dominabili dall’atropina, fa ritenere possibile la partecipazione degli accettori colinergici che con la loro reazione contribuiscono ad aumentare la risposta riflessa.
Sull'intestino isolato la colchicina manifesta di solito un'azione paralizzante sulla fibra muscolare liscia con effetto depressivo sul tono di contrazione. In casi più rari si è osservato anche un effetto eccitante che può essere precoce o tardivo e molto verosimilmente dovuto ad eccitazione del parasimpatico, in quanto antagonizzato dall'atropina.
Questi fatti di non facile interpretazione, sono stati spiegati in maniera diversa. Il Niccolini tenta di conciliare le osservazioni apparentemente contradditorie, ammettendo l'esistenza di un'attività della colchicina in sede parasimpatica, anche se nel metterla in evidenza nell'organo isolato, si incontrino maggiori difficoltà. Questo A. non ritiene giustificato il fatto di considerare separatamente i reperti ottenuti sull'organo isolato e quelli ottenuti sull'organismo integro, sul quale la constatazione che l'atropina riesce a controllare la nausea, il vomito e la diarrea da colchicina, non può essere sottovalutata.
D'altra parte l'A. ammette che l'esatta interpretazione di questi fenomeni è resa più difficile e complicata dal fatto che anche la colchicina riuscirebbe ad antagonizzare l'azione eccitomotrice della muscarina, della arecolina e dell'acetilcolina.
Esperienze eseguite dall'A. avrebbero dimostrato che anche per il Colchico e per la colchicina, si verifica il “fenomeno di ossigeno di Starkestein” secondo cui l'adrenalina per es. inibisce i movimenti intestinali se il liquido di Tyrode è regolarmente ossigenato mentre li eccita se il liquido è privo di ossigeno e l'organo vive in anossibiosi. Il contrario avverrebbe per l'acetilcolina la quale eccita le contrazioni del segmento di intestino se il liquido di Tyrode è normalmente ossigenato, mentre le deprime in assenza di ossigeno.
Per quanto riguarda il Colchico e la colchicina, l'A. ha trovato che, sia l'uno che l’altra, nella posologia impiegata, non agiscono sull'intestino se nel bagno vi è abbondanza di ossigeno, mentre in sua assenza modificano nettamente il tono, in più od in meno, secondo la specie dell'animale, mentre assai meno vengono ridotte le contrazioni automatiche.
La secrezione biliare può essere aumentata dalla colchicina soltanto con dosi tossiche e le contrazioni della colecisti isolata sono per lo più inibite dalla colchicina alla concentrazione di 1:20000-1:5000 [Cannava (57)].
Sull'apparato respiratorio degli eterotermi la colchicina determina dopo parecchie ore dalla somministrazione, un aumento della frequenza prima, quindi l'arresto respiratorio senza che compaiano altre gravi manifestazioni intermedie dell'attività respiratoria.
Negli omeotermi e nel gatto in particolare, compaiono invece convulsioni asfittiche premortali.
Dosi elevate provocano una paralisi del sistema nervoso centrale e progressivo ottundimento del centro respiratorio e di altri centri bulbari.
Il Dixon (58) iniettando la colchicina per via endovenosa, potè dimostrare un'azione broncocostrittrice.
Azione della colchicina sull'apparato cardio-oascolare e sulla crasi ematica – Sull'apparato cardiovascolare l'azione della colchicina è di scarso interesse farmacologico in quanto solo le dosi molto elevate possono provocare variazioni premortali della pressione e dell'attività cardiaca con un meccanismo d'azione molto discusso e sul quale si sta tuttora indagando.
Secondo Busquet (59) la colchicina deve la sua azione attivatrice ad una sensibilizzazione diretta dell'apparato vasocostrittore ai simpaticomimetici. Sul sistema capillare invece gli AA. sono concordi nell’ammettere che la colchicina determina una capillaro-dilatazione paralitica che si manifesta particolarmente in territorio addominale.
La crasi ematica è influenzata dalla colchicina specialmente per quanto riguarda le variazioni del numero dei leucociti. Dixon e Malden (60), fra gli altri, hanno notato che alla somministrazione di dosi opportune di colchicina negli animali da esperimento e nell'uomo, consegue una diminuzione iniziale del numero dei leucociti che si protrae per circa due ore; aumenta quindi progressivamente sino alla decima ora raggiungendo un numero da 2 a 5 volte superiore a quello normale. Tale aumento può protrarsi anche per alcuni giorni e riguarda quasi esclusivamente i polinucleati, mentre i linfociti rimangono pressocchè invariati.
La leucopenia iniziale sarebbe dovuta secondo Dixon alla concentrazione dei leucociti nei capillari profondi di diversi organi (polmoni, fegato, midollo osiseo).
Durante la fase iperleucocitaria i globuli bianchi verrebbero spremuti dai loro depositi e il midollo osseo subirebbe un rapido impoverimento dei mielociti e delle forme immature (polinucleati).
Donatelli e Papini (61) spiegano il fenomeno ammettendo che il passaggio dei leucociti dai depositi al circolo, venga reso più facile da un abbassamento della soglia del midollo osseo, prodotto dalla colchicina. Sopprimendo infatti la risposta compensatoria del midollo osseo mediante sulfamidici, gli AA. hanno osservato che la reazione iperleucocitaria che normalmente consegue alla somministrazione di colchicina, viene a mancare per tutto il tempo in cui perdura l'azione sulfamidica.
Secondo Farri, Costa e Napoleone (62) invece, nel determinismo della reazione iperleucocitaria generata dalla colchicina, entrerebbero anche i centri regolatori ipotalamici della distribuzione dei leucociti. Paralizzando questi centri mediante la somministrazione di un barbiturico (Luminal) la suddetta reazione verrebbe infatti inibita, mentre non lo sarebbe impedendo la risposta ipofisaria agli agenti «stressanti» mediante il paraossipropiofenone.
Il Niccolini riassume ammettendo che la colchicina stimoli il centro leucocito-regolatore ipotalamico e che questo a sua volta e senza alcuna partecipazione dell'ipofisi, abbassi la soglia di passaggio in circolo di questi elementi dal midollo osseo al sangue.
Il Niccolini stesso (63) trovò che la colchicina, mentre in forti dosi impoverisce il midollo dei suoi mielociti, le piccole dosi agiscono su di esso da stimolo, favorendo così lo sviluppo di tali elementi cellulari. Le dosi fortissime provocano distruzione di tutti gli elementi del sangue, tanto che il siero di animali trattati con dosi tossiche di colchicina, appare arrossato per emolisi [Dixon (58), Balduini e Bartolotti (64)].
Tatsumi (65) trovò che l'iniezione di 3 mg di colchicina nel coniglio, determina una microcitosi transitoria della durata di un'ora, cui segue un periodo di macrocitosi che raggiunge il suo massimo dopo 48 ore e che può protrarsi anche per 8 giorni per una sola iniezione.
L'apparato renale per le dosi terapeutiche, è poco sensibile all'azione della colchicina. L'eliminazione dell'urea, degli urati e delle purine non subisce notevoli variazioni sotto l'azione della colchicina. Keeser (66) ritiene esatta l'opinione secondo cui la somministrazione di colchicina provocherebbe lesioni renali e avverte che va tenuto conto delle lesioni renali in atto. In questo caso l'A. consiglia di prescrivere le dosi minime valevoli per i pazienti a reni integri. A dosi tossiche la colchicina provoca nefrite con anuria, albuminuria e cilindruria.
Sui muscoli striati di rana, trattati con dosi elevate di colchicina, alcuni AA. avrebbero notato un effetto veratrinico, effetto che altri non sono però riusciti ad ottenere. Secondo Io Jacobi (67) tale azione non si manifesterebbe con la colchicina pura ma sarebbe invece dovuta ad un suo prodotto di ossidazione, la diossicolcina.
Di parere diametralmente opposto sembra essere il Bacq (68) secondo cui la reazione veratrinica potrebbe essere interpretata come una sensibilizzazione del muscolo al potassio e si manifesterebbe per la colchicina e non per la diossicolcina tanto che, secondo l’A., questa reazione biologica potrebbe servire per distinguere la colchicina dal suo prodotto di ossidazione.
Un fatto che potrebbe avvalorare quanto precedentemente asserito a proposito dell'azione locale, è quello osservato da Lecompte (69). Questo A. trovò che la colchicina alla concentrazione di 5×10-4 e a pH 7, è capace di provocare « l’effetto Lundsgaard » (vedi anche Camomilla volgare) che consiste in una contrattura caratteristica dei muscoli scheletrici della rana, contrattura che è provocata da molte sostanze vescicatorie e lagrimogene. Tale effetto sarebbe proporzionale all'affinità di queste sostanze con i gruppi sulfidrilici del glutatione e degli enzimi glicolitici che catalizzano il metabolismo dei carboidrati. Il fatto che la colchicina sia capace di provocare «l'effetto Lundsgaard» avvalorerebbe l'ipotesi da noi formulata precedentemente a proposito dell'azione locale. Occorre dire però che anche sulla presenza di questa azione contratturante non sembra esistere un completo accordo (70).
Azione sul sistema nervoso centrale
Dosi tossiche di colchicina provocano una paralisi ascendente che ha inizio a livello dei centri midollari e che si estende poi a quelli bulbari. Non è ben certo se lo stato di insensibilità, di immobilità e di apatia che si osserva nel cane e nel gatto gravemente intossicati da colchicina, sia dovuto alla partecipazione dei centri cerebrali oppure, ciò che il Niccolini ritiene più probabile (l.c.), soltanto alla paralisi dei centri sensoriali e motori, come potrebbe farlo supporre il fatto che l'uomo in preda a intossicazione colchicinica, conserva sino alla fine, intelligenza, volontà e lucidità mentale, prerogative queste, che non vengono sensibilmente alterate.
Azione sul sistema nervoso autonomo
Gazet du Chatelier e Mugler (71) da un loro accurato studio sul meccanismo d'azione della colchicina traggono la conclusione che, analogamente a quanto già affermò Busquet (59), essa deve la sua azione attivatrice ad una sensibilizzazione diretta dell'apparato vaso-costrittore ai simpaticomimetici e ad una netta azione sinaptolitica che si manifesta, dopo un tempo variabile da 15' a 1 h, svelata da una considerevole riduzione dell'eccitabilità periferica del vago e da una diminuzione importante degli effetti acetilcolinici.
La colchicina si presenterebbe dunque, secondo gli AA. come una particolare sostanza capace da un lato, di diminuire la reattività del sistema parasimpatico e dall'altra di sensibilizzare a un grado estremo l'organismo all'azione delle droghe simpaticomimetiche, sia aumentando l'eccitabilità delle fibre vasocostrittrici che diminuendo quella delle terminazioni vasosensibili del nervo di Hering, con conseguente aumento dell'intensità e della durata della pressione arteriosa.
Un'analoga azione sensibilizzatrice degli accettori adrenergici, era già stata posta in evidenza dal Raymond-Hamet (72).
In questo insieme di fatti, uno degli AA. precedentemente citati, il Mugler (73), vede uno dei principali meccanismi per i quali la colchicina interviene nell'accesso di gotta, in considerazione del fatto che il gottoso, molto frequentemente, è un vagotonico.
E’ opinione degli AA. che i diversi modi di agire della colchicina sui due rami del sistema nervoso autonomo, permetteranno di chiarire il meccanismo dei fenomeni allergici cutanei, su cui Mugler (74) ha dimostrato l'attività di questa sostanza.
Sulle ghiandole endocrine l'azione della colchicina può manifestarsi, secondo Havas (75) per mobilizzazione di ormoni presenti nell’organismo, per deviazione della polarità di essi, per loro inattivazione locale o generale e, infine, per sinergismo o per antagonismo ormonale.
Nell'ovaio del topo la colchicina, alla dose di mg 1,25/Kg determina modificazioni nucleari che Lits (76) distingue in quattro fasi: nel 1° giorno si osserva un accelerarsi della divisione nucleare della cellula della teca follicolare e dello stroma e comparsa di figure patologiche da agglutinazione dei cromosomi. Nel 2° giorno si nota la comparsa di forme pseudo patogenetiche nei follicoli arresici con figure di divisione dell'ovulo. Nel 3° giorno avviene la degenerazione dei follicoli arresici e dopo 90 ore compaiono figure di mitosi con cromosoni condensati nel corpo luteo. Conseguenza di queste modificazioni follicolari e ovulari sarebbe, secondo Canna (77), un protrarsi anche indefinito dello stato di estro.
Sulle surrenali la colchicina sarebbe capace di determinarvi, secondo Leblond e Segai (78), la cosiddetta «reazione di allarme» fatto questo che, secondo il Niccolini, potrebbe essere ricollegato con l'attività antigottosa della colchicina stessa.
La colchicina agendo sulle zone insulari del pancreas provoca nel cane una progressiva azione ipoglicemizzante che può condurre a morte l'animale. Nell'oxalotl sarebbe stato notato un accumulo di lipidi neutri nelle cellule epatiche.
Negli anfibi la colchicina agirebbe sinergicamente con la tiroide e col timo per quanto riguarda la metamorfosi, mentre agirebbe in senso antagonistico nel ratto.
L’azione antiallergica della colchicina e dei suoi derivati non sarebbe dovuta ad un effetto antistaminico ma piuttosto ad un'azione ormonale. Gli effetti biologici prodotti da iniezioni endovenose di colchicina praticate in alcuni pazienti affetti da malattie allergiche (modificazioni della pressione arteriosa, della glicemia, degli eosinofili) hanno fatto pensare a Mugler, Wachenheim e Grappe (79) ad un'azione di «relai» ormonale (surrenalica) comparabile con quelle dell'ACTH.
Il meccanismo d'azione della colchicina e dei suoi derivati (colchicoside) nelle malattie allergiche, sarebbe aspecifico in quanto queste sostanze non agirebbero che sui sintomi e non in senso antistaminico come avviene per gli antiallergici veri. La loro azione sarebbe dovuta ad un effetto adrenalinomimetico, forse adrenalinosecretore, dovuto alla proprietà della colchicina di stimolare la corteccia surrenalica [Mugler (80)].
Anche Lucherini e coll. (81) accennano all'influenza della colchicina sul surrene e sull’ipofisi, e dimostrano la sua azione ACTH-simile con il fatto che essa determina un’ipertrofia della zona fascicolata del surrene, un aumento della eliminazione degli 11-ossicorticoidi attraverso le urine, inibizione della jaluronidasi ed involuzione acuta degli elementi linfoidi.
Azione antimitotica e carioclasica
Questa interessante azione della colchicina, come fu già accennato, venne osservata per la prima volta dal Pernice nel 1889 (51) e fu approfondita soltanto molto tempo dopo, intorno cioè agli anni 1934-1935 dal Dustin (52), dal suo allievo Lits (53), dall’Amoroso (54) e successivamente da numerosi altri AA. (Brues e Cohen (82), Alien (83), Smith e Gardner (84) ecc,).
Tale proprietà della colchicina consiste essenzialmente nel provocare un andamento atipico della mitosi delle cellule animali e vegetali, la quale mitosi viene accelerata nella profase mentre subisce un arresto nella metafase.
Il fuso cariocinetico che normalmente condiziona la divisione cellulare regolando la migrazione verso i poli dei cromosomi sdoppiati e la loro ripartizione in numero uguale nei nuclei figli, viene per così dire, polarizzata per azione della colchicina. In questo caso, i cromosomi continuano a suddividersi normalmente, ma l’inattività della struttura fusoriale impedisce la formazione del fuso acromatico e dei centrosomi. La convergenza polare dei cromosomi viene così impedita e la divisione cellulare arrestata (mitosi statmocinetica). Ne consegue che si formano nei vegetali superiori ed anche in quelli inferiori, delle cellule atipiche che posseggono un numero doppio di cromosomi (diploidia). Questo processo può ripetersi parecchie volte e i cromosomi così moltiplicati, sono contenuti in nuclei giganti, generando quello stato particolare della cellula detto «poliploidia» che può essere trasmesso ereditariamente, ove le cellule sessuali siano state oggetto del fenomeno. Le cellule poliploidi hanno un volume superiore al normale e i vegetali che ne derivano hanno anche un volume superiore a quello della pianta originaria (mutazione di o poliploidica).
Ciò avviene nelle piante e non in tutte, poiché non tutte le piante sono sensibili all’azione della colchicina. Nelle cellule animali è più difficile provocare forme diploidiche o poliploidiche; in esse la colchicina provoca una degenerazione del nucleo cui segue quella della cellula, in maniera presso a poco simile a quanto avviene nelle cellule irradiate coi raggi Roentgen, ciò che ha dato adito a molte speranze ed a molti tentativi di impiegare la colchicina nella terapia dei tumori.
Sperimentalmente infatti, si è constatato che alcuni tumori da innesto, sono sensibili all’azione della colchicina con la quale si è riusciti ad inibire lo sviluppo del sarcoma di Crocker trapiantato nel topo, del papilloepitelioma del coniglio, di un determinato tipo di carcinoma del ratto. Si è riusciti altresì a far regredire i tumori linfoidi in ratti leucemici ed a provocare la completa scomparsa di tumori mammari nel topo. Tuttavia i risultati clinici sino ad ora ottenuti sono piuttosto dubbi e ciò è dovuto soprattutto all'elevato coefficiente tossico della colchicina ed alla sua aspecificità.
Dosi capaci di influenzare la mitosi provocano effetti secondari consistenti essenzialmente in forti diarree e disturbi a carico del sistema nervoso centrale e, per di più, oltre la mitosi delle cellule neoplastiche viene influenzata anche quella delle cellule normali.
Ricerche sul criceto (Cricetus cricetus L. o Cricetus vulgaris Desm., detto anche Hamster), piccolo roditore molto resistente all'azione della colchicina (85), sono state eseguite con lo scopo di stabilire se impiegando dosi molto elevate di questa sostanza fosse possibile ottenere un’azione mitostatica più intensa sulle cellule tumorali piuttosto che su quelle normali. Le esperienze condotte comparativamente sui tessuti umani, di topo e di criceto in vivo e in vitro, hanno però dimostrato che tanto i tessuti normali quanto quelli embrionali e neoplastici di criceto, pur presentando una resistenza alla colchicina di 100 volte superiore a quella dei tessuti umani (86), sono ugualmente sensibili all’azione della colchicina.
Recentissimamente Verga e Belloni (86 a) hanno condotto uno studio comparativo sull’azione antimitotica della colchicina e della podofillotossina mediante una metodica che consiste nella inoculazione simultanea o intervallata delle due sostanze in embrioni di pollo. Dalle variazioni così indotte sull’attività proliferativa dei megaloblasti circolanti, oltre che da alcuni aspetti morfologici della mitosi, gli AA. precisano il tipo di azione antimitotica delle due sostanze, affermando che la colchicina, accanto ad un’azione statmocinetica analoga a quella della podofillotossina, possiede anche una certa azione radiomimetica. Tale azione si manifesta per un'evidente contrazione del numero delle cellule che entrano in mitosi dalla 64a h alla 68a h di sviluppo, quando la colchicina viene inoculata alla 64a h e, più manifestamente si rivela allorché essa viene iniettata preventivamente o simultaneamente alla podofillotossina.
Gli AA. spiegano questi fatti formulando l'ipotesi che mentre l'azione mitostatica della podofillotossina può essere concepita come essenzialmente di tipo fusoriale (azione sulle proteine del fuso acromatico, blocco dei gruppi sulfidrilici, interferenze sui processi ossidoriduttivi), l’azione colchicinica si rivela più complessa, nel senso che la sua azione si manifesta su di un substrato enzimatico più vasto, interessante non solo i fenomeni dinamici, fusoriali della cariocinesi, ma anche quelli che accompagnano le modificazioni metaboliche (glicolisi, respirazione, polimerizzazione degli acidi nucleinici) che preparano la divisione cellulare stessa.
Occorre aggiungere che quest’azione mitostatica non é posseduta soltanto dalla colchicina ma anche dai suoi derivati fra i quali la desacetilcolchicina, il colchicoside e il suo aglucone (4-desmetilcolchicina), la demecolcina e da altre sostanze di cui tratta ampiamente il Lettré (87). Per quanto riguarda la desacetilcolchicina. Lenti e Tortarolo (88) trovano che essa ha forse un campo di indicazioni più vasto di altri antimitotici considerati dagli AA. in quanto dotata di un’efficacia curativa in molti casi più pronta con effetti tossici nettamente inferiori.
L’azione mitoclasica del colchicoside e del suo aglucone, é stata studiata comparativamente con quella della colchicina da Mascré e Deisson (89) i quali hanno trovato che l'azione mitoclasica della 4-desmetilcol-chicina è di 8 volte inferiore a quella della colchicina mentre quella del colchicoside è inferiore di 50 volte.
Schar, Lanstalot e Cross (90) hanno eseguito un approfondito studio su di un altro alcaloide del Colchico, la demecolcina (sostanza F o desacetilmetilcolchicina). Anche questa sostanza sarebbe dotata di un elevato potere antimitotico, capace di modificare, secondo gli AA., quali e quantitativamente la divisione cellulare, nella stessa maniera della colchicina della quale sarebbe però notevolmente meno tossica (30 volte inferiore per via parenterale, meno per os).
La demecolcina arresta nei topi e nei ratti lo sviluppo di alcuni tumori da innesto, mentre resta senza effetto su altri. Le dosi utili inoltre, arrestano anche la rigenerazione dei tessuti normali ad alto potenziale di moltiplicazione (quali il midollo osseo, il sistema linfatico, l’epitelio cutaneo). Tuttavia il coefficente terapeutico della demecolcina, sia negli animali che nell'uomo, sarebbe più elevato rispetto alla colchicina.
Von Moeschlin, Von Bock e Cross (91) hanno impiegato la demecolcina nel trattamento delle mielosi croniche e Cardini (92) in quello delle carcinosi cutanee, ma altri AA. non avrebbero ottenuto alcun risultato in prove di trattamento di tumori differenziati. Ciò nonostante, in considerazione del suo coefficente terapeutico più favorevole e delle sue spiccate proprietà citostatiche e citolitiche, attualmente si ritiene che alla demecolcina competa un posto non ultimo fra le sostanze antimitotiche impiegabili nel trattamento dei tumori maligni dell'uomo.
Azione antibatterica
La colchicina e la colchiceina sarebbero dotate, secondo Cohar e Makkawi (93), di una certa attività antibatterica sullo Staph. aureus, Gaf. tetragenus, B. anthracis, B. subtilis, M. Phlei, C. hofmanni, Salm. tiphi, Salm. paratiphi A, Shig. flexneri, Shig. Schmitzi, E. coli, V. cholerae, Ps. aeruginosa, Kleb. pneumoniae.
La colchiceina, prodotto di decomposizione della colchicina, è meno tossica di questa ed è dotata di azione antibatterica più intensa. In vivo colchiceina ha un effetto protettivo dubbio nelle infezioni streptococciche della cavia, ma le esperienze sino ad ora eseguite non sono tali da permettere conclusioni definitive.
Un certo effetto sinergico sembrerebbe esistere fra colchicina e colchiceina da un lato, penicillina e composti sulfamidici dall'altro.
La tossicità di queste sostanze e in particolare quella relativa alla colchicina, fa si che il loro valore terapeutico nel trattamento delle infezioni batteriche, sia piuttosto limitato ma, secondo gli AA. sarebbe tuttavia possibile, approfittando della loro specificità, di utilizzarle per la preparazione di certi mezzi selettivi.
L’eliminazione della colchicina avviene principalmente attraverso il rene ed, in parte, per via intestinale, anche se somministrata per via parenterale. L’eliminazione è comunque molto lenta e per ciò i periodi di somministrazione debbono essere opportunamente intervallati da periodi di sospensione, al fine di evitare l’insorgere di eventuali fenomeni da accumulo.
Azione terapeutica
a) Nella gotta
Sembra si debba al medico arabo Ibn-Beithar, nato a Benana nei dintorni di Malaga, il merito di aver impiegato per primo il Colchico nel trattamento della gotta (44). Secondo altri sarebbe stato Alessandro di Tralles (VI secolo) ad usare per primo questa droga per curare i dolori articolari (95).
Dopo un lungo periodo di abbandono, il Colchico venne riesumato nel 1718 durante un'epidemia di peste, dal Wedel che lo consigliava non solo per somministrazione interna, ma anche appeso al collo come efficace amuleto per prevenire e curare oltre il terribile morbo, anche la dissenteria e le malattie esantematiche. Non sembra però che queste ottimistiche convinzioni del Wedel venissero accolte con eccessivo entusiasmo dai medici del suo tempo e la droga sarebbe stata certamente dimenticata di nuovo se lo Stòrck, dopo averne sperimentata la tossicità su se stesso, non avesse contribuito ad introdurla nell'uso terapeutico. Tuttavia, mentre secondo alcuni lo Stòrck si sarebbe limitato ad impiegare il Colchico soltanto come drastico e come diuretico nel trattamento dell'idrope (94), altri gli attribuiscono il merito di averlo per primo indicato nella terapia della gotta (95). Goodmann e Gilman (95) ricordano che ad introdurre questa droga negli Stati Uniti, fu nientemeno che Beniamino Franklin il quale, sofferente di gotta, aveva potuto, evidentemente, apprezzarne le virtù curative durante il suo soggiorno in Europa.
Non è ancora ben noto il meccanismo d'azione secondo cui il Colchico, la colchicina ed i suoi derivati, riescono nella maggior parte dei casi a stroncare l'attacco acuto di gotta.
Abbiamo già veduto precedentemente, in base a quali considerazioni Gazet du Chatelier e Mugler (71, 72, 73) attribuiscano l'azione antigottosa della colchicina alla sua azione sul sistema nervoso neurovegetativo. Gli stessi AA. in una rivista critica sulle varie opinioni riguardanti il meccanismo d'azione della colchicina (96), portano un'ulteriore documentazione in favore di un'azione AC'TH-simile della colchicina azione che sarebbe più facilmente dimostrabile allorché venga somministrata per via endovenosa alla dose di 3 mg.
Questa azione stimolante corticosurrenalica verrebbe dimostrata dal dosaggio urinario degli ormoni corticali, dal quale risulterebbe un aumento medio del 30 % del deidrocorticosterone sotto l'azione della colchicina. Tale azione, secondo gli AA., contribuirebbe molto verosimilmente, ad accelerare e ad intensificare il potere antiflogistico del medicamento.
Per quanto riguarda l'azione della colchicina sul sistema nervoso vegetativo gli AA., in base ad un'ulteriore documentazione sperimentale, ne confermano l'azione parasimpaticolitica e l'effetto simpaticomimetico, sia centrale che periferico con potenziamento dell'azione adrenolitica.
Da queste constatazioni gli AA. traggono la conclusione che l’attacco di gotta può essere identificato con una turba vegetativa acuta, caratterizzata da tutti i segni della sindrome di irritazione di Reilly (forte vasodilatazione, esosierosi, diapedesi) suscettibile di essere provocata da stimoli non specifici. D'altro lato, il carattere aspecifico dell'attacco di gotta risulterebbe nettamente, secondo gli AA., anche dalla constatazione delle proprietà antiallergiche della colchicina, proprietà che essa ha in comune anche con altre sostanze: ACTH, cortisone.
Inoltre, la scoperta dell’azione parasimpaticolitica, permette agli AA. di meglio interpretare la specificità riconosciuta in tutti i tempi alla colchicina nei gottosi, se si ammette, come dagli AA. stessi è stato sostenuto altrove, che questi malati sono prima di tutto e particolarmente in periodi di crisi, degli ipervagotonici. Conclusioni queste che, come gli AA. stessi riconoscono, esigono però un'ulteriore dimostrazione. Questi differenti effetti, spiegherebbero comunque, i risultati clinici che si ottengono nell'attacco acuto di gotta: effetto di vasocostrizione, diminuzione dell'edema per aumento della resistenza capillare e diminuzione del dolore.
Fra le ipotesi più verosimili precedentemente formulate per spiegare l'azione antigottosa della colchicina, va ricordata quella che considera la sua proprietà di determinare un’iperemia delle cartilagini articolari e delle epifisi, il che ha fatto ritenere che la colchicina agisca, almeno in parte, modificando la circolazione articolare [Japelli (97) ].
Qualunque sia il meccanismo d'azione, certo è che la colchicina somministrata a dosi sufficienti e nel momento opportuno, riesce nella grande maggioranza dei casi, a determinare nello spazio di poche ore, la totale scomparsa o la notevole attenuazione della sintomatologia caratteristica dell’attacco acuto di gotta.
Se la colchicina viene somministrata inizialmente e cioè immediatamente dopo i primi sintomi, si calcola che soltanto il 5 % dei casi si dimostrano refrattari alla sua azione.
La dose iniziale di attacco è di 1 mg cui si fanno seguire dosi da 0,25 mg ogni ora o di 1 mg ogni 2 ore (95). Se compaiono sintomi dovuti ad intolleranza o ad intossicazione e cioè, nausea, vomito, diarrea, la somministrazione deve essere temporaneamente sospesa. In ogni caso essa deve essere interrotta per 3 giorni dopo che il paziente ha assunto la dose complessiva di 4-8 mg, ad evitare fenomeni tossici dovuti ad accumulo. Tale dose è di solito sufficiente a determinare nelle prime 12 ore un'attenuazione della sintomatologia e la completa scomparsa dopo 24-48 ore.
Se la remissione dell'attacco non è immediata, la somministrazione della colchicina può essere continuata sino alla comparsa dei primi sintomi di intossicazione che potranno essere combattuti sintomaticamente con antiemetici e con antidiarroici (oppiacei, bismuto).
Nella terapia degli attacchi successivi, i periodi di somministrazione debbono essere più brevi poiché anche piccole dosi possono dar luogo a fenomeni tossici (95).
Altri AA. consigliano di iniziare con piccole dosi e di aumentarle progressivamente, protraendo il trattamento per 3-7 giorni. Nei casi in cui la somministrazione orale si dimostrasse insufficiente, si può ricorrere alla via endovenosa iniettando una fiala da 3 mg al giorno [Serane (98)].
La colchicina può essere impiegata anche a scopo preventivo nei casi di gotta cronica, nei periodi intercritici, per ridurre la frequenza e attenuare l'intensità degli attacchi acuti. A questo scopo essa può essere somministrata alla dose di 0,5-2 mg per notte o a notti alterne, determinando la dose caso per caso; oppure alla dose di 1 mg al giorno per 4 giorni ogni settimana (95-98).
Secondo Goodmann e Gilman (95) un'adatta somministrazione di colchicina al primo accenno dello stadio acuto, può eliminare la crisi parossistica e prevenire l'artrite gottosa cronica. Gli AA. ritengono essenziale per l'efficacia del trattamento, che tale somministrazione venga fatta tempestivamente ed a dosi inizialmente elevate.
Contemporaneamente alla colchicina, può essere indicata, in alcuni casi, la somministrazione dell'ACTH e del prednisone (95-98) e, ove si impieghi isolatamente la terapia ormonica, è opportuno far seguire il trattamento colchicinico, ad evitare l'insorgere dell’attacco acuto dopo cessata la somministrazione dei suddetti ormoni (95). Nei pazienti anziani o deboli e in quelli affetti da disturbi cardiaci, renali o gastrointestinali, la colchicina deve essere prescritta con particolare cautela.
Il trattamento medicamentoso della malattia gottosa deve essere ovviamente associato a misure dietetiche. La dieta deve essere globalmente ridotta e limitate le sostanze puriniche, gli alcoolici e soprattutto i grassi, la cui responsabilità nella patogenesi della gotta verrebbe, secondo il Serane, generalmente sottovalutata. Opinione questa che potrebbe trovare conferma nei risultati delle ricerche di Spitzer e Spitzer (99) i quali trovarono che la colchicina può, in un certo qual modo interferire nel metabolismo dei grassi.
Linn e coll. (100), indicano la colchicina, somministrata per via endovenosa, come un mezzo rapido, sicuro e semplice, nella terapia dell'artrite gottosa acuta e come mezzo diagnostico di speciale valore in quei casi in cui la diagnosi della gotta è incerta e ciò anche in considerazione della sua azione rapida, con assenza di effetti secondari, quali nausea, vomito e diarrea che spesso si manifestano per somministrazione orale.
Ryckewaert (101) ritiene che la colchicina come medicamento specifico dell'attacco acuto di gotta, non sia stata detronizzata dal fenilbutazone o dagli ormoni antiflogistici. La sua efficacia e la sua quasi innocuità le permettono di conservare ancora la sua preminenza. Anche questo A. sostiene che l'efficacia della colchicina è condizionata dalla dose e dalla precocità con cui viene impiegata. Essa non provoca quasi mai accidenti gravi purché non si oltrepassi la dose massima prescritta dal Codex, di 4 mg nelle 24 h.
La posologia consigliata dall’A. è la seguente:
1 mg di colchicina ai primi segni dell'accesso, poi un mg ogni 2 o ogni 3 ore, senza sorpassare la dose complessiva di 4 mg nelle 24 ore. Nelle ore seguenti la dose deve essere progressivamente ridotta. La rapidità di questa riduzione è variabile a seconda dei casi. Il trattamento dura in media una settimana, qualche volta meno ma spesso di più. La colchicina può essere iniettata anche endovena alla dose di 3 mg; in questo caso le reazioni di intolleranza gastroenteriche sono più rare o di minor intensità e i risultati più rapidi e forse più brillanti.
Un inconveniente di questa via di somministrazione è dovuto alla reazione venosa infiammatoria nel punto dell'iniezione. Tali reazioni sono senza gravità ma molto frequenti.
Secondo l'A. è opportuno ricorrere alla via endovenosa soprattutto quando si voglia impiegare la colchicina a scopo diagnostico, in malati che soffrono di artropatie infiammatorie di natura dubbia e nei malati che manifestano una particolare intolleranza alla colchicina somministrata per os.
Nelle malattie allergiche
Gli estratti di Colchico, la colchicina e i suoi derivati di cui si dirà a parte, si sono dimostrati efficaci nel trattamento delle malattie allergiche, quali l'orticaria, l'edema di Quincke, gli eczemi e le diverse forme di prurito. L'azione di questi farmaci secondo Mugler (102) sarebbe però aspecifica in quanto essi non potrebbero essere considerati come antiallergici veri e propri, dotati cioè di proprietà antistaminiche. La loro azione sarebbe soltanto sintomatica e dovuta, secondo l'A., alla loro proprietà adrenalinomimetica e, forse, adrenalinosecretrice in relazione con l'attività stimolante corticosurrenalica riconosciuta alla colchicina.
Lo stesso Mugler, in collaborazione con Wackenheim e Grappe (103), descrive 5 casi di malattie allergiche fra cui un caso di orticaria da iniezioni di ACTH, un caso di orticaria post-trasfusionale e 3 casi di eritema post-sierico. Nei casi trattati con colchicina per via endovenosa venne confermata la notevole efficacia antiallergica anche precedentemente notata, di questa sostanza. L'effetto si manifesta prima sul prurito e quindi sulle manifestazioni eritematose con un'attività che in 2 casi si è dimostrata superiore agli antistaminici i quali in un caso, furono somministrati per via endovenosa. Il trattamento è risultato senza inconvenienti e, per quanto riguarda il meccanismo d'azione, le modificazioni notate a carico della pressione, della glicemia e degli eosinofili, permettono agli AA. di pensare ad un'azione di « relai » ormonale (surrenalica) comparabile a quella dell'ACTH. In un caso di prurito dovuto ad ittero meccanico. Mugler e Hauswald (104) osservarono che la colchicina somministrata alla dose di 3 mg per via endovenosa, dimostrò un'efficacia superiore a quella di un antistaminico di sintesi (Antistin), fatto questo che fu spiegato dagli AA. ammettendo un'azione simpaticolitica vasale.
Buoni risultati furono conseguiti dallo stesso Mugler e coll. (105) anche in una forma di prurito manifestatasi in un paziente affetto da morbo di Hodgkin e da Nonclercq (106) che trattò diverse forme di prurito con colchicina e con i suoi derivati (colchicoside).
Nella terapia antiblastica
Abbiamo precedentemente accennato all'azione antimitotica della colchicina e dei suoi derivati, alla loro influenza sullo sviluppo dei tumori sperimentali e ai tentativi di terapia antiblastica nei tumori umani. Esiste in proposito una letteratura molto vasta ma i risultati sino ad ora ottenuti sono piuttosto dubbi, poiché, come già fu detto, l'attività terapeutica della colchicina è ostacolata dalla sua elevata tossicità e soprattutto dal fatto che tanto le cellule normali quanto quelle tumorali, sono ugualmente sensibili alla sua azione. I risultati quindi sono spesso negativi o incompleti, ma non per questo privi di interesse. Noi esamineremo intanto, alcuni casi trattati da diversi AA. perchè i risultati da essi ottenuti ci aiutino a meglio precisare ciò che attualmente è possibile attendersi dalla terapia colchicinica in questo campo.
Seed, Slaughter e Limarzi (107) hanno trattato quattro.pazienti affetti da carcinoma, con colchicina. In due di questi casi si ottenne una regressione rapida, parziale, degenerativa dei tumori i quali però, dopo le ulcerazioni primarie, ebbero uno sviluppo accelerato.
Cramer e Brodersen (108) impiegarono una pomata a base di N-etilcolchicoside e colchicina, per elettroforesi, in cancroidi, in recidive di carcinomi mammari, in carcinomi basocellulari del viso e in un melanosarcoma. Nella maggiore parte dei casi si ottenne un'avanzata colliquazione e perfino la totale scomparsa del tumore. Altri casi risultarono refrattari al trattamento con dosi di colchicina che raggiunsero i 3 mg al giorno, senza però superare la dose complessiva di 60 mg. Lenégre e Soulier (109) ottennero risultati degni di nota, nell'adenopatia cronica infiammatoria, nella linfoadenite acuta, nella leucemia linfoide, nella reticolite maligna e nell'adenite cervicale neoplastica, tutti casi nei quali era da escludere la possibilità di altri interventi (chirurgici, Roentgen, elettrocoagulazione).
In un caso di leucemia micromieloblastica, trattata dal Landolt (110) con colchicina alla dose di 2-6 mg al giorno per os, sino alla dose complessiva di 25 mg, il numero dei leucociti diminuì da 66.000 a 8.000, diminuzione cui seguì un miglioramento dello stato generale che si protrasse per molte settimane e altrettanto avvenne in un caso di leucemia mieloide cronica, il che dimostra che la colchicina può agire nelle leucemie e policitemie, ledendo profondamente il nucleo delle cellule patologicamente aumentate.
Risultati ugualmente favorevoli sono stati ottenuti nella leucemia da Grant (111), da Keibl e Latsch (11), da Keibl (113), da Widmann (114), da Levillain e Garnier (115), mentre altri [Eichler (116), Kneedler (117)] non avrebbero ottenuto alcun risultato.
Carcinomi cutanei ed altri carcinomi superficiali vennero invece trattati da Eichler (116) con risultati favorevoli. Carcinomi cutanei del viso e delle mani trattati con una pomata di colchicina allo 0,2-0,4 %, guarirono lasciando una cicatrice appena visibile. Anche carcinomi inoperabili o Roentgen-refrattari, delle labbra o del condotto uditivo, guarirono e un netto miglioramento fu notato in due casi di lupus cancerizzato. Questi casi furono però seguiti soltanto per un anno e l’A. non può quindi esprimersi sulla persistenza o meno dei risultati ottenuti.
Grollmann e coll. (118) impiegarono la colchicina somministrandola parenteralmente alla dose di 3 mg ogni tre giorni per periodi variabili, in alcuni casi di morbo di Hodgkin ribelli ad altri trattamenti. La sostanza venne ben tollerata dai malati nei quali fu notato un miglioramento notevole caratterizzato da effetti antipiretici e analgesici che gli AA. definiscono sorprendenti. Ma le remissioni furono in ogni caso, di breve durata.
Risultati favorevoli e più o meno duraturi, nel morbo di Hodgkin, furono ottenuti anche da altri AA. Isch-Wall (119) e Volterra (120), riferiscono di aver ottenuto risultati temporanei e Braun (121) descrive remissioni della durata da 2 settimane a 6 mesi in 405 casi trattati con un’associazione di colchicina, desossicorticosterone e acido ascorbico. Altri risultati favorevoli furono riferiti anche da Consoli (122), da Leonardi e D’Angelo (123), da Zbinden (124) e da Sampey (125) che ottenne remissioni nell' 81 % dei casi trattati.
Rispondono transitoriamente alla terapia colchicinica anche altre forme neoplastiche quali il linfosarcoma [Storti e Gallinelli (126)], il carcinoma del polmone [Zbinden (124)] e il cancro della cervice [Feletig (127)].
Legros e Lheureux ( 128) ottennero buoni risultati nel trattamento delle verruche plantari e vulvari con colchicina all' 1 % in soluzione fisiologica, iniettata alla dose di cc 0,1-0,2 nel margine della verruca. Una sola iniezione, secondo gli AA. può essere sufficiente.
King e Sullivan (129) avvertono che la colchicina (come la podofillina) non manifesta alcuna attività sulle verruche volgari e su altre lesioni in cui esista un’estesa
Nell'atrofia muscolare
Kaindl e Schober (130) hanno sottoposto a trattamento colchicinico 12 pazienti affetti da atrofìa muscolare spinale progressiva, impiegando dosi di 1,5 -2 mg per os e per giorno, sino a raggiungere la dose complessiva di 15-30 mg. In 8 malati furono osservati importanti miglioramenti: l'atrofia subì un arresto, il dinamometro confermò l'aumento della forza muscolare e la deambulazione ritornò possibile. In 7 malati la creatinuria diminuì contemporaneamente alla creatininuria, senza tuttavia raggiungere i valori normali e senza un costante parallelismo col miglioramento clinico.
Gli AA. non osservarono alcun fatto tossico seguire al trattamento e formulano l’ipotesi che la colchicina agisca in questi casi, influenzando il metabolismo della creatina.
Azione terapeutica dei principali derivati della colchicina
I vari derivati colchicinici sono dotati, fondamentalmente, della stessa azione della colchicina, dalla quale differiscono per una minor tossicità, per una maggior tollerabilità locale e generale e per il loro coefiicente terapeutico più favorevole.
a) Desacetilcolchicina. Fra le prime ricerche eseguite sull’attività terapeutica di questo derivato di sintesi della colchicina, vanno annoverate quelle degli italiani Paolino, Pierri e Resegotti (131). Da precedenti ricerche eseguite presso il National Cancer Institute di Bethesda (U.S.A.) risultava che il rapporto fra dose massima tollerata e dose minima efficace, era uguale a 2 per la colchicina e a 50 per la desacetilcolchicina e quindi a questa estremamente favorevole.
In base a questi dati, gli AA. iniziarono delle ricerche cliniche precedute da alcune indagini sperimentali le quali confermarono prima di tutto, che la tossicità della desacetilcolchicina è nettamente inferiore a quella della colchicina; poi, che essa è dotata di un effetto di blocco della mitosi la cui intensità è giudicata dagli AA. di 3 volte inferiore a quella della colchicina e che nei riguardi del tessuto mieloide, presenta sulla serie granuloblastica, un effetto più spiccato della colchicina. Ciò che dimostrerebbe una differenza d’azione, nei confronti di quest’ultima, non solo quantitativa, essendo apparsa anche una differenza di tropismo cellulare.
Un'altra differenza di ordine qualitativo fra le due sostanze sarebbe stata dimostrata da uno degli AA. in collaborazione con l'Euler (132), anche sulle catalasi epatiche. Queste catalasi, che negli animali portatori di tumori sono diminuite, verrebbero aumentate dalla desacetilcolchicina, mentre non verrebbero influenzate dalla colchicina.
Clinicamente gli AA. trovarono che la desacetilcolchicina esplica una attività antiblastica più intensa della colchicina e su di un maggior numero di affezioni. Nella leucemia mieloide cronica, l'effetto è risultato rapido, costante e senza il minimo segno di intolleranza, anche per dosi molto elevate (20 mg al giorno) o per somministrazioni molto prolungate.
Le remissioni furono però di breve durata e non altrepassarono, nei casi trattati, i due mesi.
Discretamente efficace si è dimostrata la desacetilcolchicina nel morbo di Hodgkin e in maniera notevole ha agito in tre casi di reticolosarcoma. Buoni risultati sono stati ottenuti dagli AA. anche nel trattamento di carcinomi del polmone, oltre che in altre forme di neoplasie maligne.
In ogni caso però le remissioni furono di breve durata, eccetto che in alcuni casi di carcinoma polmonare.
a)Della demecolcina o sostanza F (desacetil-metilcolchicina) abbiamo già parlato precedentemente (87, 90, 91, 92). Aggiungeremo ora che Moeschlin e coll. (91) consigliano questo preparato nel trattamento continuato della leucemia mieloide cronica. La dose iniziale consigliata sarebbe di 1 mg per os, tre volte al giorno, dose che può essere elevata a 7 o al massimo a 10 mg al giorno, nel corso del trattamento. Allorché il quadro ematologico appare migliorato è consigliabile continuare il trattamento con piccole dosi da determinarsi caso per caso, ad evitare che la sospensione provochi un nuovo e rapido aumento del numero dei leucociti, tanto più che riprendendo il trattamento, l'efficacia tarderebbe a manifestarsi. Secondo gli AA. la sostanza F sarebbe strettamente controindicata nella leucemia linfatica. Nel carcinoma, nel mieloma e nel morbo di Hodgkin, non fu osservato dagli AA, un chiaro effetto. La tollerabilità da parte dell'apparato gastro-enterico è apparsa buona.
Bock e Cross (133) ottennero buoni risultati nella mielosi cronica, nella quale consigliano anch'essi un trattamento continuo. L'impiego della sostanza F nelle leucemie acute, nelle linfoadenosi croniche e nei tumori circoscritti, è sconsigliato dagli AA.
Léonard e Wilkinson (134), in 6 casi di leucemia mieloide cronica ottennero, impiegando dosi di 10 mg pro die, una forte diminuzione dei granulociti, una rapida diminuzione della splenomegalia ed un evidente miglioramento clinico.
Il quadro ematico non viene però completamente normalizzato e le remissioni si mantengono soltanto per 2-6 settimane.
Nella leucemia mieloblastica acuta, l’azione della demecolcina sarebbe scarsa, e addiritura controindicata nella leucemia linfatica cronica.
Una terapia di mantenimento con dosi di 5, 8 e anche 10 mg al giorno di demecolcina, ha permesso a Bock e Cross di mantenere tre pazienti in un buono stato di compenso per un anno e Moeschlin (135) riuscì ad ottenere una remissione della durata di 7 mesi in un caso di leucosi acuta, somministrando mg 3 di questa sostanza per via orale.
Se è richiesto un effetto immediato, la demecolcina può essere somministrata anche per via endovenosa ma, secondo questo A. potrebbe provocare in questo caso, fenomeni di vertigine e nausea anche se iniettata lentamente. Furono osservati anche altri effetti secondari, quali leggera caduta dei capelli, inibizione della spermiogenesi e dell’ovulazione, oltre la rapida caduta dei granulociti. Nessun disturbo a carico dell’apparato digerente.
Berres (136) ottenne risultati favorevoli praticando applicazioni locali di demecolcina, sotto forma di pomata all' 1 %, in un caso di morbo di Bowen. Dopo 3 settimane di trattamento, la cura venne continuata con radioterapia con la quale si ottenne la rapida scomparsa delle lesioni cutanee.
La demecolcina venne sperimentata da Midana e Ormea (137) anche in alcuni casi di micosi fungoide. Dosi di 1-3 mg somministrati per via endovenosa, determinano la rapida scomparsa del prurito e la graduale regressione dei segni clinici.
b)Il colchicoside fra i derivati della colchicina è forse il più noto e il più studiato. Dopo che questa sostanza venne isolata dal Bellet (29), il Mugler ne intraprese lo studio ne determinò la tossicità e avendo trovato che questa può essere considerata da 50 a 100 volte inferiore a quella della colchicina, la sperimentò clinicamente somministrandola per via endovenosa, alla dose di 10 mg, disciolta in 5 cc di soluzione fisiologica.
In parecchie centinaia di casi in cui l'A. praticò queste iniezioni, non furono mai osservate reazioni locali o generali, mentre la loro efficacia sulle manifestazioni cutanee delle malattie allergiche si manifestò in maniera notevole.
Il Mugler pubblicò, in collaborazione col Wackenheim (138) un primo studio sull'azione del colchicoside in alcune forme di pruriti cronici e alcuni mesi dopo, in collaborazione con Mant e Margraff (139), l'A. riferì i risultati ottenuti col colchicoside nel trattamento di alcuni casi di reazioni eritemo-edematose e di malattie da siero.
Il colchicoside venne impiegato alla dose di 6-10 mg, dose che secondo gli AA., può essere considerata del tutto normale come dose di attacco e tale da poter essere ripetuta anche due volte nello stesso giorno, senza alcun inconveniente locale o generale.
Il meccanismo d'azione sarebbe, secondo gli AA., molto simile a quello della colchicina. Sperimentalmente sono state riconosciute al colchicoside proprietà adrenolinomimetiche (140-141) e effetto thorn-positivo (142). Clinicamente gli AA. hanno potuto constatare l'efficacia del colchicoside negli accessi di gotta e nelle malattie allergiche, con effetti molto rapidi sui sintomi cutanei di tali manifestazioni.
Risultati molto incoraggianti sono stati ottenuti nella terapia della gotta anche da Krewer (143) il quale pone in evidenza le caratteristiche di atossicità e di maneggevolezza di questa sostanza, i cui effetti antiflogistici e analgesici sarebbero comparabili con quelli della colchicina e simili a quelli dell'ACTH, mentre la sua azione eosinofilizzante sarebbe quasi inesistente. Il Kohen (144) ottenne buoni risultati nelle affezioni allergiche dell'albero respiratorio (rinite spasmodica, asma bronchiale) negli adulti e in campo pediatrico, dove il colchicoside venne impiegato nella terapia della rinite, della tosse spasmodica e nella dispnea.
Huriez e Desmons (145) hanno trattato 22 casi di eczemi allergici con iniezioni endovenose di colchicoside alla dose di 10 mg pro die.
I risultati ottenuti possono essere ritenuti buoni in più della metà dei casi, anche se il suddetto trattamento non si è dimostrato sufficiente a mantenere i risultati ottenuti con i corticotropi.
c)Il tiocolchicoside fra i derivati della colchicina è quello che da questa più si allontana per la sua azione farmacologica e per le sue applicazioni terapeutiche.
Il tiocolchicoside fu ottenuto da Velluz e Muller (146) sostituendo un atomo di O con uno di S nel metossile dell'anello C del colchicoside.
II Gros (147) dedicò a questo nuovo derivato di sintesi, uno studio terapeutico, cui seguirono quelli di Jequier e coll. (148) e di molti altri AA. Le principali caratteristiche di questo nuovo corpo, possono essere riassunte come segue:
Il tiocolchicoside è 12 volte più tossico (nel topo) del colchicoside e determina un'intossicazione immediata, a differenza di quanto avviene per il colchicoside e per la colchicina, sostanze per le quali una lunga fase di latenza intercorre fra il momento in cui vengono somministrate e la comparsa dei primi sintomi di intossicazione (148-149).
Il tiocolchicoside è quasi completamente privo di attività antimitotica: occorre sorpassare la elevatissima dose di 30 mg/Kg per osservare un minimo effetto statmocinetico (149).
Dosi quotidiane somministrate per lungo tempo a giovani animali, non modificano affatto la loro crescita e non provocano alcuna alterazione ematica (150).
A dosi elevate, superiori a 10 mg/Kg, il tiocolchicoside è un veleno convulsivante che provoca la morte dell’animale in uno stato epilettico. A dosi deboli, al contrario, ha un’azione deprimente centrale (149).
Il tiocolchicoside è dotato di un'azione decontratturante muscolare di particolare interesse terapeutico per i risultati che si ottengono, per la loro durata e per la specificità di tale sua azione. Questa infatti differisce profondamente da quella del curaro e dei curarizzanti in quanto si esercita elettivamente sulle ipertonie patologiche, mentre il tono muscolare normale e la motilità dei territori sani, non subiscono la sua azione [Pluvinage (149)].
Il tiocolchicoside inoltre, impedisce la rigidità da decerebrazione nella rana e, sotto la sua azione, gli stimoli periferici, quali quelli auditivi e sensoriali non inducono modificazioni dell'E.E.G. (151). Plotka e Jequier (151) ritengono inoltre che l'azione del tiocolchicoside sul sistema nervoso centrale, possa essere situata a livello dei lobi ottici, almeno nelle rane, e dei centri midollari.
Sulla respirazione il tiocolchicoside esercita una stimolazione notevole, specialmente sull'animale in anestesia generale in cui questa funzione è depressa.
Sulla pressione arteriosa esso esercita un'azione variabile a seconda della specie animale considerata: ipertensiva nel coniglio, nella cavia e nel ratto e ipotensiva nel cane. Sulla pressione arteriosa e sui vasi periferici il tiocolchicoside manifesta una certa azione antistaminica e sarebbe privo di azione sul cuore e sugli organi isolati. Quest'ultima affermazione sarebbe però contraddetta, almeno in parte, dai risultati sperimentali e clinici ottenuti successivamente dagli stessi AA. (Plotka e Jequier), in collaborazione con Breat e Hidden (1512) i quali trovarono che sull’utero isolato di ratta in estro, il tiocolchicoside provoca un aumento di ampiezza e di frequenza delle contrazioni spontanee, azione che si manifesta anche sull'utero in situ, ma più irregolarmente, in relazione forse con lo stato endocrino dell'animale.
In terapia il tiocolchicoside è stato impiegato nel trattamento di diverse forme di contratture muscolari, quali quelle piramidali [Sigwald e coll. (153), Pluvinage e coll. (154)]; in quelle extrapiramidali della malattia di Parkinson [Pluvinage e coll. (154)]; nelle emiplegie e paraplegie con contrattura muscolare [Lereboullet e Lemoine (155), Pluvinage e coll. (154), Manceau e coll, (156)]: nelle contratture riflesse quali si osservano nelle affezioni reumatologiche [Pluvinage e coll. (154), Gaucher e Suplet (157), Serre e Simon (158)]; come decontratturante in varie forme di spasmi che si manifestano nella malattia di Parkinson, nei postumi dell’encefalite, nei grandi tics isterici [Manceau e coll. (156)]; nella dismenorrea [Pluvinage e coll. (154), Herbert e Gros (159)]; nel corso del parto come decontratturante dell'utero (152); in alcune affezioni neurologiche con contrattura [Lereboullet e coll. (160)].
Capron e Yves-Colas (161) hanno riferito un caso di delirio ipocondriaco in cui i sintomi sono scomparsi rapidamente, in maniera spettacolare, dopo una sola serie di 8 iniezioni di tiocolchicoside.
Bret e coll. (152) hanno sperimentato il tiocolchicoside in donne che nel corso del parto avevano presentato fenomeni di ipertonia uterina con arresto del travaglio. Somministrato alla dose di 2-4 mg intramuscolo, il tiocolchicoside ha risolto lo stato spastico, permettendo il normale svolgimento del parto, senza recare danno nè alla gestante nè al neonato.
Lafon e coll. (162), infine, hanno sperimentato il tiocolchicoside in un caso di grande catatonia schizofrenica, datante da parecchi anni e refrattaria ai comuni mezzi terapeutici. L'azione decontratturante si è manifestata spettacolarmente dopo mezz'ora dall'iniezione endovenosa di 4 mg. Il trattamento è stato protratto per 15 giorni somministrando giornalmente la stessa dose e l’effetto si è mantenuto per tre giorni dopo la sospensione. Una sospensione più prolungata conduce al ritorno dello stato iniziale. Gli AA. considerano il tiocolchicoside nettamente efficace nella catatonia e ne propongono l’impiego nel periodo acuto della malattia e cosi pure nel periodo di occupazione e di ergoterapia.
Secondo Pluvinage ( 149) l’impiego del tiocolchicoside dovrebbe essere riservato ai casi più o meno stabilizzati nei quali si può sperare di ottenere risultati favorevoli a partire dal momento in cui si è riusciti a vincere l’immobilizzazione dovuta al blocco articolare. Nelle emiplegie e nelle paraplegie il tiocolchicoside può indurre un considerevole miglioramento dello stato del malato, permettendo una più efficace rieducazione motrice [Pluvinage e coll. (150), Lereboullet e Lemoine (155)].
Tossicologia
L’avvelenamento da colchicina e da suoi derivati, ad eccezione del tiocolchicoside, è caratterizzato da un lungo periodo di latenza che intercorre fra la somministrazione e la comparsa dei sintomi.
La DL50 per via endovenosa nei ratti è di circa 1.7 mg/Kg e la morte sopraggiunge dopo due settimane [Ferguson (163)]. Prove eseguite sulla tossicità cronica dimostrano che dosi di mg 0,4/Kg somministrate quotidianamente endoperitoneo ai ratti, diminuisce la crescita e che con mg 1,6/Kg il 35 % dei ratti muore dopo il 5° giorno [Ferguson (163)]. I gatti sono più sensibili all’azione della colchicina, la dose di mg 0,25/Kg endovena è già tossica per questi animali.
La sintomatologia dell’intossicazione acuta è dominata da gravi e prolungati disturbi gastroenterici di origine nervosa.
Nell’uomo i sintomi dell’avvelenamento colchicinico, si manifestano con vomito e diarrea colerosimile o ematica, gastroenterite grave, dolori al dorso e agli arti, contrazioni e crampi muscolari, disturbi visivi e della parola, ipertonia, forte senso di sete, nausea, stranguria e diminuita secrezione urinaria [Hofmann e Held (146)]. Possono manifestarsi anche sintomi di bruciore all’esofago e alle fauci, disfagia, tenesmo, angoscia precordiale, dispnea e cianosi, delirio. Lo stato di abbattimento si può prolungare per alcuni giorni dopo superato il primo periodo.
Ove esistano lesioni renali, anche la dose terapeutica può riuscire tossica [Schròder (165)].
Seifert (166) ha descritto il caso di un bambino che avendo ingerito alcuni semi di colchico, mori dopo 36 h. In questo caso i primi sintomi di diarrea colerosimile, tachicardia e collasso, si manifestarono dopo 3 ore e mezza. La colchicina potè essere svelata soltanto biologicamente, determinando l’arresto della mitosi dei fibroblasti del cuore di pollo.
Nell’avvelenamento colchicinico, la morte avviene di solito in un periodo di tempo variabile fra le 7 e le 48 ore.
Terapia dell’avvelenamento colchicinico
Inizialmente e in particolare se il vomito tarda a manifestarsi, come spesso accade, è opportuno praticare il vuotamento dello stomaco mediante lavaggio. Il ritardo della comparsa del vomito rende di solito, più infausto il pronostico.
Come antidoto chimico, l’acido tannico si è dimostrato il più efficace. Ad assorbimento avvenuto, la terapia è essenzialmente sintomatica e consiste nel combattere l’adinamia, il collasso e la paralisi cardiaca mediante analettici: alcoolici per os, caffeina, etere, canfora per via ipodermica. Stimolazioni cutanee e riscaldamento del corpo per combattere l’ipotermia. Il vomito e la diarrea che inizialmente possono favorire l’eliminazione del veleno, possono essere frenati in secondo tempo, mediante la somministrazione di pozioni alcaline, mucillaginose, di astringenti tannici e in particolare, di oppiacei.
Si consiglia di continuare la vigilanza dell’intossicato anche quando la remissione della sintomatologia potrebbe far credere che la fase acuta sia stata superata, poiché un aggravamento improvviso potrebbe condurre rapidamente a morte l’intossicato.
Estratti e preparati vari
a) Estratto fluido: (titolo chimico 0,35 % colchicina) (g 1 = LVII gtt).
Dosi; I-Vl gtt pro dose due-tre volte pro die.
b) Tintura F.U. (titolo chimico 0,04 % colchicina).
Dosi: X-XXX gocce prò dose.
c) Colchicina amorfa U.S.P.
C27H23NO6 p.m. 399,45
[a]20D= -410°/ -435° (C = 1 acqua).
Dosi: mg 1-2 per os sino a 4 mg pro die (dose massima): dose iniziale di attacco 1 mg seguita da dosi di 0,25 mg ogni ora o di 1 mg ogni 2 h, sospendendo quindi per 3 giorni dopo assunzione della dose complessiva di 4-8 mg. Per via endovenosa mg 3 pro dose e pro die.
d) Colchicina cloroformica cristalli D.A.B.
C27H25NO9 + ½ CHCI3 p.m. 458,9
87 % di colchicina.
Dosi: come sopra.
e) Colchicoside cristalli
C27H30NO11 p.m. 547.54
Dosi: mg 6-10 per via endovenosa in 5 cc di soluzione fisiologica.
Preparazioni usuali e formule galeniche
Tintura F.U.
Estratto fluido colchico…………………………………. g 11.4
Alcool di 70°……………………………………………………… g 88.6
(X-XXX gocce pro dose Dosi mass. F. U.: g 1,5 pro dose, g 5 pro die)
Tintura composta
Tintura colchico
Tintura aconito
Tintura china…………………………………………………………. g 10
(XX-XXX gtt pro die).
Tintura antigottosa
Estratto fluido colchico
Estratto fluido guajaco
Estratto fluido cardamomo……………………………………. ana g 25
Estratto fluido rabarbaro detannizzato
Estratto fluido zenzero…………………………………………. ana g…. 50
Alcool di 60° q. b. a………………………………………………….. g 1000
(XX-XXX gtt tre volte pro die).
Granuli di colchicina
Colchicina………………………………………………………………………. mg 1
Eccipiente q. b. per un granulo
[1-2 granuli sino a 4 mg pro die (dose massima)]
Fiale di colchicoside
Colchicoside……………………………………………………………. mg 4-6
Soluzione fisiologica q. b. a ………………………………………… cc 5
Per una fiala
(1 fiala al giorno per via endovenosa)
BIBLIOGRAFIA
(1) PELLETIER e CAVENTOU, Ana. CMm Fhys., 14. 82, 1820 – C2) GEIGER e MESSE Ueb. Ann., 7, 274, 1833 – (3) ZEISEL, Monatsh. Chem., 7, SS7, 1886: 9. I e 865, 1888: 34, 1181 e 1359, 1913 – (4) WINDAUS A., Ueb. Ann.. 439, 59, 1924 • (5) COOK J. e coll., 3. Chem. Soc., 176, 1945: 1397, 1951; 607, 1952 • (6) DEWAR M. 1. S., Nature, 153, 141, 1945 – (7) LETTRE’ H., e coll., Ueb. Ann., 576, 147, 1952 – (8) TARBELL D. S. e coll., Ueb. Ann.. 376, 147, 1952 • (9) SANTAVY F. e GECH 1., Coll. Czechoslov. Chem. Comm., 14, 532, 1949 – CIO) SANTA VY F. e REICHSTEIN T., Helv. Chim. Aera, 33, 1606, 1950 • (II) ZEISEL S., Monatsh. Chem., 4, 162, 1883 • (12) SANTA VY F„ Chem. Usty, 46, 280, 1952 – (13) ZEISEL S„ Monatsh. Chem., 9, 1, 1888- (14) SANTA VY F., CERNOCH M., MALINSKY 1., LANG B. e ZA5ICKOVA A., Ann. pharm. front.. 9, 50, 1951 – (15) SANTA VY F. e MAGAR V., Chem. Usty, 47, 1214, 1953 – (16) SANTA VY F. e TALAS M., Chem. Usty, 47, 232, 1953 – (17) RAFFAUF R. F., FARREU A.L. e ULLYOT G. E., J. amer. chem. soc., 75. 3854, 1953 – (18) SANTA VY F., Chem. Usty, 42. 177, 1948 – (19) SANTA VY F., Fharm. Acta Helv., 23. 248, 1950 -'(20) SANTAVY F., Coll. Czechosl. Chem. Comm., 13, 552, 1950 – (21) SANTAVY F., LIPOVA J. e COUFALIK E., Ceskosloy. Farm., 1, 239, 1952; Chem. Abstr., 46. 10545, 1952 – (22) SANTAVY F, TALS M. e TELUPILOVA O, Coll. Czechosl. Chem. Comm., 18. 710, 1953; Chem. Usty, 46, 373, 1952 – (23) SANTAVY F., Coll. Czechosl. Chem. Comm., 16. 676, 1951; Chem. Usty. 46. 368, 1952 – (24) SANTAVY F., WINKLER R. e REICHSTEIN T., Helv. Chim. Acta, 36. 1319, 1953 – (24 a) SANTAVY F. e coll., Chem. Usty, 48. 886, 1954 – (25) BEER A. A., RARAPE- TYAN S. A., ROLESNIROV A. I. e SNEGIREV D. P., Dohl. Akad. Nauk. V.R.S.S.. 67, 883, 1949; Chem. Abstr., 44, 800, 1950 – (26) RISSELEW W.^W, MENSCHIROW G. P. e BEER A. A., Dokl. Akad. Nauk.. V.R.S.S., 87. 227, 1952; Chem. Abstr., 48, 695, 1954 – (27) SANTAVY F., Chem. Usty, 32, 957, 1958; Chem. Abstr., 53, 5316 g, 1959 – (28) BELLET P. e MULLER G., ,4nn. Fharm. Franf., 13, 81 e 84, 1955 – (29) BELLET P., Ann. Fharm. Franf., 10, 81, 1952 – (30) BELLET P., AMIARD G., PESEZ M. e PETIT A, Ann. Fharm. Franf., 10, 241, 1952 – (30 a) VELLUZ L. e MULLER G., Bull. Soc. Chim., 197, 1955 – (31) BELLET P. e REGNIER P, Bull. Soc. Chim., 20, 756, 1953 – (3Ia) BELLET P., Ann. Fharm. Franf., 12, 821, 1954 – (32) SANTAVY FXoll. Czechosl. Chem. Comm.. 16, 665, 1951 • (33) GREWE R. e WULF W., Ber. d. Chem. Ges„ 84, 621, 1951 – (34) SANTAVY F. e COUFALIR E., Coll. Czechosl. Chem. Comm., 16, 198, 1951 – (35) LIPATZ P., Fharm. Monatsh., 8, 1927: Fharm. Zen~ tralh., 510, 1927 – (36) BUCHNICER 3., Fharm. Acta Helv., 23, 389, 1950 – (37) CAESAR e LORETZ, lahresber. d. Fharnu, 41, 67, 1906 – (38) SCHULZE, Amer. 1. Fharm., 73, 293, 1901; Jahresber. d. Fharm„ 36. 83, 1901 – (39) SANTAVY F. e BUCHNICER 1., Fharm. Acta Helv., 24. 20, 1949 – (40) GILLBT I„ Ann. Fharm. Franf., 2. 152, 1944 – (41) SANTAVY F., Cas. ces. lékarn., 57, 11, 1944 – (42) TUNMANN O. e ROSENTHALER L„ PHanzerunlkrochemie, Berlin, 1931, p. 440 – (43) ROSENWASSER, ,4mer. 1. Fharm., 49, 435, 1876; GRIMME, Fharm. Zentralh., 61, 521, 1920 – (44) HOLMES E. M., Fharm. 30, 51; Gir. da SCHINDLER H., Tnhaltsstolle und Prllfungsinethoden homòpatblsch verwendeter HeflpAaozeo, 1955, p. 75 – (45) BLAU, Ztschr., Oesterr. Apoth.-Ver., 41. 1067, 1903 – (46) SCHINDLER H., SUdd. Apoth. Ztt; 89, 131, 1949 – (47) STIEGLER A., Ztschr. physiol. Chem., 86. 245, 1913 – (48) BOURQUELOT, COMAR e PELLETIER, cit. da SANTAVY F., toc. cit. (49) – (49) SANTAVY F., Fharm. Acta Helv., 25, 248, 1950 – (50) ROPEZYNSRI S., DIss. Berlin, 1933; SCHINDLER H., cit. (44) – (50 a) SANTAVY F„ Chem. Usty, 32. 957, 1958 – (50 b) MANSRE R. H. F., The Alkaloids, voi, VI, pp. 247-288 – (51) PERNICE, cit. da GOODMANN L. S. e GILMAN A. in 4 The Pharmacologlcal Basic o( Thwa- peutlca – Macmillan Comp. II edU. New York 1955, p. 305 – (52) DUSTIN, Arch. exp. Zellforsch., 22, 395, 1938 – (53) LITS F. J., C. R. Soc. Blol., 113, 1421-23, 1934 – (54) AMOROSO E. C.J4alure, 133, 266-7, 1935 – (55) NICCOLINI G. B., II Colchico, Quaderni di Fitoterapia n. 7, Inverni &. Della Bella edit. Milano 1953 – (56) OSWALD, eli. da NICCOLINI I. c. p. 84 – (57) CANNAVA’, Arch. Int. de Fharma- codyn. et de Thérap., 39, 121, 1938 – (58) DIXON, Manual of Fharmacology Londra 1906, p, 96 – (59) BUSQUET H., C. R. Soc. BloU 130, 870-2, 1939 – (60) DIXON e MALDEN, 1. of. Fhyslol., 37, 50, 1908 – (61) DONATELLI e PAPINI, Follcllnico Sez. FraU 47, 429, 1940 – (62) COSTA E., FARRI L. M. e NAPOLEONE C., Boll. Soc.. II. Blol. Sper., 27, 12, 1647, 1951 – (63) NICCOLINI G, B., 1. c. p. 91 – (64) BALDUINI e BARTOL02TI, Haematolotlca, 31, 1, 1948 – (65) TATSUMI, Min. Med. Akad. Kloto, 23, 772 e 1079, 1938 – (66) REESER E., Med. Welt., n. 11, 279, 1941 . (67) JACOBI, Arch. exp. Fath, u. Fharmacol., 67, 323, 1942 – (68) BACQ, Arch. Int. Fharmacodyn. et de Thérap., 67, 323, 1942 • (69) LECOMPTE, Ibld., 78, 440, 1949 – (70) DANIELLI F. F., Farmacologia e fisiologia cellulare – Trad. Segre Ediz. Einaudi 1951, p. 86, lab. XVII – (71) GAZET DU CHATELIER G. e MUGLER A., Thiraple, 12, 3, 376-87, 1957 – (72) RAYMOND-HAMET, C.R. Soc. Blol. Paris, 118, 1292; U9, 990, 120, 951, 1935 – (73) MUGLER A., Slrarbourg Médlcal, p. 143-151, marzo 1951 – (74) MUGLER A., Ann. de Mfd., 31, 495, 1950 – (75) HAVAS, cit. da NICCOLINI, I. c. p. 99 – (76) LITS, C. R. Soc. Blol. Farli, 118, 393, 1935; cit. da NICCOLINI 1. c. – (77) CANNA, Glorn. di Clln. Osi. Glnecol., 12, 1948; cit. da NICCOLINI I. c. – (78) LEBLOND e SEGAL, C. R. Soc. Blol. Farls, 128, 995, 1938; cit. da NICCOLINI i. c..- (79) MUGLER M. A., WACHENHEIM A. e GRAPPE J., Comunicaz. alla Soc, Méd. des Hfipitauz de Paris, 8 giugno 1951; Fresse Méd., 59, 41, 859, 1951 – (80) MUGLER M. A., Soc. Frane. d’Allergle, 15, VI, 19^; Fresse Méd., 62, 59, 1216, 1954 – (81) LUCHERINI T. e coll.. Il Follcllnico Sez. Fral. n. 4, 213, 1953 • (82) BRUES e COHEN, Blochem. J„ 30, 1363, 1936 – (83) ALLEN E., Anat. Record. 67, supplem., 1, 49, 1936 – (84) SMITH e GARDNER, Am. 1. Anat.. 61, 34, 1937 – (85) ORSINI M. W. e PAUSRY B., Science,
115, 88, 1952 – (86) MIDGLEY A. R., PIERCE B. e DJXON F. J., Science. 130, 40, 1959 – (86 a) VERGA L. e,BELLONl F., Il Farmaco, Ediz. Sclent., 14, 11, 795-800, 1959- – (87) LETIRE’ H., Pharmazie. 11, ' 1, 1956 – (88) LENTI G. e TORTAROLO E., Min. Med., An. 48, voi. I, 1-2, 21-30, 1957 – (89) MAStRil’ M. e DEISSON C.., Acad. de Pharmadc, 4 marzo 1953; Ann. Pharm. Frang.. 9, 4, 242 e 259-68, 1953 – (90) SCHAR B.. LANSTALOT P. e GROSS F., Klln. Woch., 32, 3-4, 49-57.
1954 – (91) MOESCHLIN, BOCK e GROSS, Schwetz. Med. Woch., 83, 41, 990, 1953 – (92) GARDINI, clt. da SCHAR e coll. (90) – (93) GOHAR M. A. e MAKKAWI M., J. Pharm. Pharmacol., 111, 7, 415-19, 1951 • (94) BENEDICENTI A., Malati. Medici e Farmacisti, I, p. 394, 1201, Hoepli Milano 1924 – (95) GOODMANN e GILMAN, I. c. p. 306-7 – (96) MUGLER A., GAZET DU CHATELIER G., Rev. du Rhumatisme, 23“ an., 7-8, 1957 – (97) JAPELLI, cit. da NICCOLINI I. c. p. 100 – (98) SERANE J., La Clinique, 53, 107, 1958 • (99) SPITZER J. J. e SPITZER J. A., Experlentia, 15, 26-7, 1959 – (100) LINN P., CARMICHAEL M. D. e MIAMI FLA., J.A.M.A., 170, 12, 1410-11, 1959 – (101) RYCKEWAERT A., Gazz. Sanit., 30, 10, 524, 1959 – (102) MUGLER A., Presse Méd., 39, 835, 1954 – (103) MUGLER A., WACKENHEIM A. e GRAPPE J., ibid.. 59, 41, 859, 1951 – (104) MUGLER A. e HAUSWALD R., Ann. Merck p. 37, 1953 – (105) BLOCH S., MUGLER'A. e KEMPF J., Presse Méd., 61, 62, 1262, 1953 – (106) NONCLERCQ M. E., Ibid.. 62, 32, 696, 1954 – (107) SEED L., SLAUGHTER D. P. e LIMARZI L. P., Chem. Zbl., Il, 2314, 1940 – (108) CRAMER H. e BRODERSEN H., Dtsch. Med. Woch., n. 35/36, 494, 1944 – (109) LENEGRE J. e SOULIER J. P.,:Presse Méd., n. 51, 727, 1942 – (110) LANDOLT R. F., Deut. Arch. KUn. Med., 191, 4, 378, 1943 – (lll) GRANT A. P., Irisch I. Med. Sci., 347, 497-500, 1954 – (112) KEIBL E. e LATSCH A., Schweiz. Med. Woch., 80, 228-31, 1950 – (113) KEJBL E., Wien. Klln. Wochen., 62, 203-6, 1950 – (114) WIDMANN H., Lancet. 270, 210, 1956 – (115) LEVILLAIN R. e GARNIER J., Presse Méd.. 63, 65, 1333, 1955 – (116) EJCHLER P., Deut. Gesundheitsw., n. 11, 351, 1947 – (117) KNEEDLER W. H., Klin. Woch., n. 37/48, 605, 1947 – (118) GROLLMANN e coll., Ann. Int. Med., 42, 154-70, 1955; Presse Méd., 64, 32, 749, 1956 – (119) JSCH-WALL P., Sang. 689-93, 1952 – (120) VOLTERRA N., Glorn. Clin. Med., 36, 651-8, 1954 – (121) BRAUN G. O., J. Lab. Clin. Med., 36, 803-4, 1950 – (122) CONSOLI G., Glom. 1t. di Chemioter.. I, 154-6, 1954 – (123) LEONARDI D. P. e D’ANGELO D. B., Act. Med. Patavina. 14, 69-109, 1951 – (124) ZBINDEN F., Schwelz. Med. Woch.. 85, 994-1000, 1955 – (125) SAMPEY J, R., A.J. of Pharm. p. 277, agosto 1958 – (126) STORTI E. e OALLINELLI R., Schweiz. Med. Woch., 84, 612-15, 1954 – (127) FELETIG P., Glorn. It. Chemloter., 1, 94-6, 1954 – ù'28) LEGROS A. e LHEUREUX A., Ann. Merck, p. 88, 1953 – (129) KING S. L. e SULLIVAN M., Science. 104, 244, 1946 – (130) KAINDL F. e SCHOBER W., Wien. Zeilschr. f. inn. Medlz.. 30, 8, 316-23, 1949; Presse Méd., 58, 11, 124, 1950 – (131) PAOLINO W., PIERRI G. e RESEGOITI L., Min. Med., 46, I, 1-2, 1-12, 1955 – (132) RESEGOTTI L. e EULER H., dt. dai precedenti I. c. – (133) BOCK H. E. e GROSS R., Klìn. Woch.. n. 33-34, 816, 1953; Aerztl. Woch., n. 15-16, 34^ 1954 – (134) LEONARD J. e WILKIN- SON J. F., Brit. Med. J.. !, n. 4918, 874, 1955 – (135) MOESCHLIN Praxis, n. 4, 66, 1954 – (136) BERRES H. H., Zbl. Haut. Geschl. Kranhh., 90, n. 2/3, 128, 1955 • (137) MIDANA A. e ORMEA F., ihid.. 89, n. 3/4, 177, 1954 – (138) MUGLER A. e WACKENHEIM A., Comunicaz. alla Soc. Frane. d’Algerie – (139) MUGLER A., MANTZ J. M. e MARGRAFF M. A., Presse Méd., 61, 55, 1121, 1953 – (140) JEQUIER R. e PETERFALVI, Arch. Jnt. Pharmacodyn. et de Thérap., 1953 – (141) SCHMID F. e MUGLER A., C.R. Soc. Blol., 144, 1392-94, 1950 • (142) MUGLER A. e WACKENHEIM A., Ricerche indite cit. in (137) – (143) KREWER B., Presse Méd.. 62, 66, 1375, 1954 – (144) KOHEN M., ibid., 62, 59, 1216, 1954; La Semaine des Hòpitaux. 33, 1916, 1955 – (145) HURIEZ CL e DESMONS F., ibid., 62, 28, 592, 1954 – (146) VELLUZ L. e MULLER G., Bull. Soc. Chlm., p. 755, 1954; Bull. Soc. Chim., p, 1072, 1954; Butl. Soc. Chini., p. 194, 1955; Bull. Soc. Chlm., p. 198, 1955 – (147) GROS H., Un noveau dérivé de la Cholchicine, le thiocolchicoside – Etude therapeutique preliminalre – Thése de Paris, 1955 – (148) JEQUIER R., BRANCENI e PETERFALVI M., Arch. Inl. Pharmacodyn. et de Thérap.. 103, 2-3, 243,
1955 – (149) PLUVINAGE R., Les entratiens del Bichat 1956 – (150) PLUVINAGE R., LEMOINE D. e GROS H., La Semaine des Hòpitaux. 33“ ann., 98, 61, 3602, 1957 – (151) PLOTKA C. e JEQUIER R., Arch. hit. de Pharmacodyn. et de Thérap.. 109, 3/4, 386-389, 1957- (152) BRET J., PLOTKA C., JEQUJER R. e HIDDEN J., Presse Méd., 67, 42, 1581, 1959 – (153) SIGWALD J., BAUITIER D., QUETIN A.. HERBERT H. e COMPERE A., La Semaine des Hópltaux. 33» ann., 10, 7, 392, 1957 – (154) PLUVINAGE R., LEMOINE D. e GROS H., ibid., 33" ann., 98, 61, 3602, 1957 – (155) LEREBOULLET J. e LEMOINE D., Bull. et Memoire de la Soc. Méd. des Hopitaux de Paris, 4» Ser. 71» ann., n. 21/22, 827, 1955 • (156) MANCEAU A. G., SUTTER J. M. e PELICIER Y., Soc. d’oto-neur()"()phtalmol. d’Alger, 13, IV, 1957, recensito in La Semaine des Hdpitaux 33« ann., 63, 3740, 1957 – (157) GAUCHER H. e SUPLET P., La Semalne iles Hapiimix. 33", 63, 3707, 1957 – (158) SERRE H. e SIMON L., Presse Méd., 66, 33, 754, 1958 – (159) HERBERT J. e GROS H., Bull. de la fédérat, des Soc. de Gynécol. et d‘Obstetr. de langue /rancf., 8, 1, 19, 1956 – (160) LEREBOULLET J., PLUVINAGE R. e LEMOINE D., Presse Méd., 66, 55, 1284, 1958 – (161) CAPRON e YVES-COLAS, Ann. Mid Psychologlque 117 ann., 1, 5, 931, 1959 –
(162) LAFON R., DUC N., MINYILLE J. e DERMENGHEN J. F., Presse Méd., 67, 55, 1284, 1958 –
(163) FERGUSON F. C., J. Pharmacol., 106, 261, 1952 – Ree. in J. Pharm. Pharmacol.. p. 337, 1953 –
(164) HOFMANN H. e HELD U., Pharmazie, n. 7, p. 316-21, 1951 – (165) SCHRÒDER, Thér. d. Gegenwart, 475, 1933 – (166) SEIFERT P.. Deut. Med. Woch., 75, 21, 717-19, 1951.


