Ippocastano
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Aesculus Hippocastanum L. – Fam. Ippocastanee)
(Sin. – Hippocastanum vulgare Tourn. – Castanea folio multifido C. B. Castanea equina Ger. Park. Ray. Hist. – Aesculus Castanea Gilib. Aesculus procera Salisb.)
Ippocastano- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Aesculus (o esculus) è il nome di una specie di quercia di alto fusto, sacra a Giove = Ischio (Quercus esculus L.). Esculus, da esca, nel senso di nutrimento, perchè le ghiande sono commestibili. Il nome applicato all'Ippocastano è improprio perchè i semi non sono eduli; forse è stato dato per l'aspetto dell’albero simile a quello delle farnie (Quercus sp.).
Hippocastanum, dal greco ippos = cavallo e kastanon = castagna, cioè castagna del cavallo. Questo nome è stato dato perchè il seme si riteneva giovasse ai cavalli bolsi che ne mangino.
Nomi volgari – Castagna amara, Castagna cavallina, Marrone d'India (tosc.), Castegn amar (lomb.), Castagner mat (ven.).
Maronnier d'Inde (fr.), Rosskastanie (ted.), Horsechestnut (ingl.), Hippocastaneo, Castanheiro da India(port.), Castano de la India (spagn.), Fehèr bokrétafa (ungh.).
Habitat – Originario dall'Asia occ., alligna in Persia, nell’India del nord, Asia Minore, nel sud-est d'Europa, dai Balcani al Caucaso. Coltivata estesamente nei parchi, giardini, e per i viali.
Grande albero (10-20 m.).
Parti usate – I semi. E' usata anche la corteccia dei rami giovani.
Componenti principali
Saponine (afrodescina, argirescina, escina, criptoescina) (1-16a), da cui sono state sinora estratte e studiate le sostanze sottocitate:
1 ) Escina, proescigenine, escigenina
Dalla saponina grezza dell’Ippocastano Merkel (10) (11) ha separato due saponine cristallizzate «escina» (emolitica) e «prosapogenina» (non emolitica). L’escino, C54H84O23-H2O, isolata in forma pura mediante precipitazione con colesterolo, esiste in due forme isomere: a- e b-escina (16a). Dalla escina cristallizzata, per trattamento con soluzione alcoolica di alcali caustico, Ròmisch (12) ha ottenuto acido tiglico, acido acetico ed una saponina acida non emolitica in forma di sale di potassio, che l’A. ha denominato escinolo. Per idrolisi più spinta dell’escina lo stesso A. (12) ha ricavato quantità equimolecolari di escigenina, acido tiglico, acido acetico, acido glucuronico e due molecole di glucosio, escludendo perciò la presenza dello xilosio, segnalata da precedenti AA. ( 15). Wagner e Bosse (16a) hanno invece confermata la presenza dello xilosio ed hanno constatato che l’escina produce per idrolisi quantità equimolecolari di escigenina, acido a-metil-b-ossibutirrico, acido acetico, glucosio, xilosio ed acido glucuronico; l'acido tiglico si forma secondariamente per eliminazione di acqua dall'acido a-metil-b-ossibutirrico.
Secondo il grado di idrolisi, accanto agli zuccheri, si liberano quantità variabili di sapogenine: oltre alla escigenina, si distinguono tre prosapogenine (I, Il e III), indicate generalmente con il nome di proescigenine (16a). Queste derivano dal distacco graduale dei componenti xilosio, glucosio ed acido glucuronico, distacco che si verifica più facilmente nel caso dello xilosio, meno facilmente per il glucosio ed ancor più lentamente per l'acido glucuronico. Per idrolisi acida si può ottenere la proescigenina libera dai tre componenti xilosio, glucosio ed acido glucuronico: essa ha proprietà emolitiche più elevate rispetto al glucoside integro (16a). L’idrolisi alcalina permette di eliminare anche l'acido a-metil-b-ossibutirrico e l'acido acetico e causa la perdita dell'attività emolitica (16a) .
Winterstein (6) ha attribuito all’escigenina la formula grezza C35H58O7, che Ruzicka, Janett e Rey (7) e successivamente Ruzicka, Baumgartner e Prelog (8) hanno modificato ulteriormente nella C30H48O5, considerandola equivalente a quella di un triterpene pentaciclico. Secondo studi successivi di Jeger e coll. (9) l’escigenina risulta appartenere al gruppo dei triterpeni pentaciclici b-amirina – acido oleanolico.
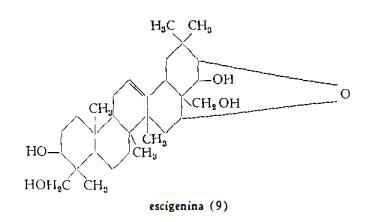
2) Criptoescina
Dopo rimozione della saponina fortemente emolitica, escina, Wagner e Bosse (16 a) (16b) hanno isolato una saponina non emolitica, da essi denominata criptoescina A, C59H94O27-H2O, scindibile con formazione di criptoescigenina, acido a-metil-b-ossibutirrico, acido acetico, acqua, xilosio (1 mol.), arabinosio (1 mol.), glucosio (1 mol.) e acido glucuronico (1 mol.). Per riscaldamento in soluzione acquosa la criptoescina A si trasforma in una saponina emolitica, designata come criptoescina B, che ha lo stesso peso molecolare e la stessa composizione centesimale della criptoescina A, ma si distingue da questa per quanto riguarda il potere rotatorio e l'indice emolitico.
Le saponine sono in maggiore quantità nei cotiledoni, ma sono presenti anche nel tegumento del seme come anche in altre parti della pianta (corteccia del fusto, pericarpo del frutto immaturo, gemme, foglie) (17).
Il contenuto di saponina grezza in rapporto alla droga fresca o secca, secondo i dati riferiti da diversi AA. (18-21), è indicato nella tabella 1.

Flavoni sono stati inoltre identificati nei semi (22-24), ma ne è stata esclusa la presenza nel tegumento del seme (17). Mentre alcuni AA. (22-24) hanno segnalata la quercitrina (3-ramnosido-quercetina) come componente fiavonico dei semi. Fiedler (25) ha rilevato che la quercitrina è il principale componente fiavonico delle foglie, ma non si trova nei semi. In questi sono stati trovati diversi flavoni, tra cui quercetina (25) e canferolo (26), che nei semi sarebbero in forma di biosidi e di triosidi (27), 4'-glucosido-quercetina (spireoside) e 3',4’-diglucosido-quercetina (27a). La presenza di composti flavonici è stata rilevata anche nel pericarpo del frutto, nella corteccia, nelle foglie e nelle gemme (17).
Le ossicumarine esculina (6-glucosido-7-cumarina), C15H16O9, e frassina (8-glucosido-7-ossi-6-metossi-cumarina), C15H18O10, e gli agliconi delle stesse, esculetina (6,7-diossicumarina), C5H6O4, e frassetina 7,8-diossi-6-metossicumarina, C10H8O5, sono state trovate nella corteccia, nelle gemme e nel pericarpo del frutto, ma non nel seme dell'Ippocastano ( 17).
Antocianine, una catechina (28) (29) e un tannoide risultano essere presenti nel tegumento del seme (28).
Purine sono state pure isolate dai semi dell’Ippocastano e precisamente adenina, adenosina, guanina e acido urico, la cui presenza è stata riconosciuta anche nei fiori e nelle foglie (30),
L(+-lisina e L(—)-triptofano, rispettivamente sino al 9,44% e al 2,7% sono stati trovati nella globulina «ippocastanina», estratta dai cotiledoni (31).
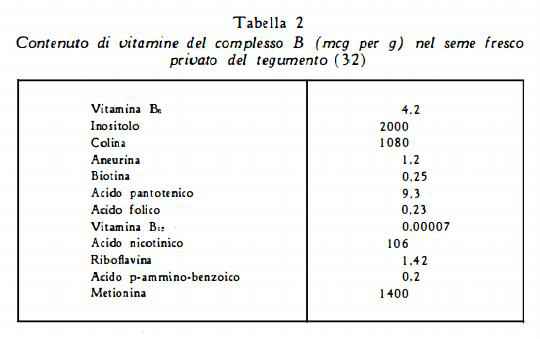
Vitamine del gruppo B sono state saggiate microbiologicamente da Haenel (32), che ha ottenuto i risultati indicati nella tabella 2.
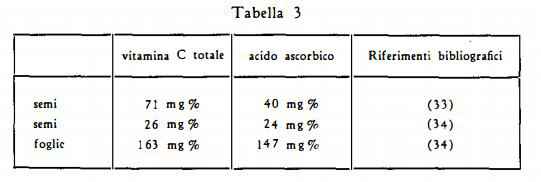
Vitamina C è stata determinata nei semi e nelle foglie fresche (ved. tabella 3).
Una provitamina D è stata ottenuta nella quantità dello 0,76% da una frazione fitosterolica (0,012% della droga secca) (35).
Vitamina K1 (800 unità Dam in 1 g di droga secca) è stata trovata nelle foglie di Ippocastano (36).
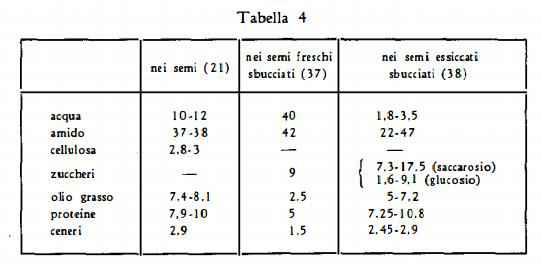
I semi contengono inoltre amido, zuccheri, olio grasso, sostanze proteiche in quantità variabili, secondo i dati analitici (g %) riferiti da alcuni AA. (21) (37) (38) e raccolti nella tabella 4:
Nell’olio grasso (3-4,8% nei semi senza tegumento) sono stati trovati il 94,2% di acidi grassi e l’1,3% di frazione insaponificabile; gli acidi risultano composti del 67,2% di acido oleico, 22,7% di acido linoleico, 2,2% di acido linolenico, 3,6 % di acido stearico e 4,4% di acido palmitico (39). Nella frazione insaponificabile sono stati identificati triacon-tano, a-spinasterolo ed i derivati triterpenici friedelina, butirospermolo e taraxerolo (40).
Proprietà farmacologiche ed impiego terapeutico
L’Ippocastano venne importato in Europa dalla Persia nel XVI secolo dai turchi. In Francia venne introdotto nel 1651, ma le sue proprietà terapeutiche, già note nella medicina popolare dell’Asia minore, vennero valorizzate più recentemente, soprattutto per merito di Artault de Vevey le cui osservazioni cliniche vennero rese note fra il 1896 e il 1909 (41-43).
Questo A. sperimentò l’Ippocastano sotto forma di alcolaturo e ne dimostrò l’efficacia nella terapia delle varicositi in generale e in quella delle emorroidarie in particolare, nelle quali esplicherebbe una spiccata attività antiflogistica ed anestetica.
Una base sperimentale alle osservazioni cliniche dell'Artault de Vevey venne offerta, in un certo senso, dai risultati delle ricerche farmacologiche eseguite durante questi ultimi dieci anni, i quali rivelarono una interessante azione dei preparati di Ippocastano, sulla barriera vasotessutale, manifestantesi con notevoli proprietà vasoprotettiva, entiessudativa e antiedemigena.
Numerose sono ormai le ricerche cliniche e quelle farmacologiche eseguite con lo scopo di precisare il meccanismo, l’estensione e il valore pratico delle suddette proprietà e di stabilire inoltre, quale o quali, fra i principi attivi contenuti nella droga, ne siano i responsabili.
Il Lavalloy (44) stabilì che certe sostanze cumariniche, quali l’esculoside e l'esculetolo, sono dotate di proprietà analoghe a alcuni derivati flavonici capaci di elevare la resistenza capillare, quali il rutoside, il xantoramnoside, il quercetoside, il luteololo, il quercetolo, il ramnetolo ecc.
Secondo Lecocq e coll. (45), l’esculoside non dovrebbe essere considerato come una vitamina P ma piuttosto come una vitamina C2 per le sue proprietà acidosiche e per il suo sinergismo con l’acido ascorbico.
Perlick e Bódecker (46) constatarono che la somministrazione endovenosa di un estratto di Ippocastano, determina un considerevole aumento della resistenza capillare, la normalizzazione della resistenza eritrocitica, l’aumento del tempo di riassorbimento e del tasso antitrombinico protoplasmatico.
Secondo Lorenz e Marek (47) l’attività antiedemigena, antiessudativa e vasoprotettiva degli estratti di Ippocastano sarebbe esclusivamente dovuta alla saponina triterpenica escina. Con l’eliminazione di essa, l’attività emolitica e quella sulla barriera vasotessutale verrebbero infatti contemporaneamente ridotte sino alla scomparsa totale negli estratti completamente privi di escina e in quelli ottenuti da altre parti della pianta prive di attività emolitica.
L’attività antiedemigena dell’escina è, secondo gli AA., straordinariamente intensa e duratura. Essa sarebbe apprezzabile nel ratto, già alla dose di 0,5 mg/kg per via endovenosa e persisterebbe per parecchi giorni. Confrontata con quella della rutina, l’attività dell’escina risulterebbe superiore di oltre 600 volte.
A conclusioni pressocchè analoghe era giunto precedentemente anche Auster (48) il quale trovò che l’aumento della resistenza capillare determinato da un estratto totale di Ippocastano da lui studiato, ha una durata superiore a quella dovuta alla rutina. Anche altre proprietà riferibili alla azione antiessudativa dell’Ippocastano, quale quella protettiva contro l’asma da istamina e da proteine nella cavia, presenterebbero secondo Lorenz e Marek, un netto parallelismo con il contenuto di escina nell’estratto. Paris e Quevauviller (49), trovarono che estratti di Ippocastano esercitano un’azione protettrice verso il broncospasmo acetilcolinico, ma non precisano se anche quest’effetto sia riferibile al contenuto di escina o di altre sostanze presenti negli estratti totali della droga.
Il coefficente terapeutico dell’escina è piuttosto elevato e non apprezzabilmente diverso da quello relativo agli estratti totali di Ippocastano somministrati per via endovenosa.
L’eliminazione di gran parte di escina da questi estratti, piuttosto che un aumento del coefficente terapeutico, condurrebbe ad una sua diminuzione.
Gli estratti totali privati della maggior parte di escina conservano ancora un’azione apprezzabile sulla barriera vasotessutale, il cui valore è proporzionale alla quantità dell’escina residua.
Tali estratti manifestano evidenti ma molto transitori effetti circolatori sulla pressione arteriosa del gatto e sul cuore isolato e perfuso di cavia, effetti questi dovuti alla presenza negli estratti totali, di sostanze ad azione ipotensiva ma non antiedemigena, rappresentate da derivati purinici, da sostanze tanniche e da prodotti colinosimili.
Tanto l’escina pura, quanto gli estratti totali di Ippocastano, non manifestano alcuna attività vasoprotettiva o antiedemigena, allorché vengano somministraci per os.
Vogel e Uebel (50) che hanno indagato il meccanismo d’azione della escina, giungono alla conclusione che essa inibisce i processi essudativi nell’infiammazione sperimentale da corpo estraneo (caolino) e l’edema flogistico delle reazioni tessutali anafilattoidi.
L’integrità della funzione corticosurrenalica sarebbe premessa indispensabile, secondo gli AA. perchè l’escina possa esplicare la sua azione farmacologica. Essa esercita infatti, un effetto adeguato soltanto allorché può agire su di un substrato cellulare il cui metabolismo si trovi sotto l’influenza di ormoni corticosurrenalici.
Secondo gli AA. l’escina non sarebbe una sostanza stimolante aspecifica, nè un antiflogistico nel senso dei pirazoli, essa esplicherebbe la sua azione preferibilmente su quelle reazioni tessutali che sono accompagnate da essudazione sierosa.
Gli AA. escludono quindi che nel meccanismo d’azione dell’escina e degli estratti totali di Ippocastano, interferisca un’azione antijaluronidasica, azione che venne invece precedentemente ammessa dal Busing (51).
A conclusioni analoghe giunse più recentemente Preziosi il quale ha inoltre, ulteriormente precisato alcuni aspetti dell’azione dell’escina, il cui effetto antinfiammatorio, particolarmente evidente nei ratti, verso gli edemi da destrano, da bianco d’uovo e da formalina, manca negli animali surrenectomizzati chirurgicamente, oppure chimicamente mediante sostanze capaci di bloccare la produzione di glucocorticoidi (triparanolo, SU 4885).
L’escina, d’altro lato, dimostra, nel ratto, a dosi attive antiedema, una discreta attività stimolante sulla corteccia surrenalica la quale pertanto, viene ad assumere una importanza essenziale ai fini dell’attività antiedema di questa sostanza. Sia negli animali surrenectomizzati che in quelli trattati con inibitori della steroidogenesi in senso glucocorticoide, l’attività dell’escina può mancare, o perché può risultare esclusa, nelle condizioni anzidette, la sua azione di stimolo sulla produzione dei glucocorticoidi o perché la sua attività ha bisogno, per manifestarsi, della presenza alla periferia, di steroidi glucoattivi i quali sono assenti nei ratti surrenectomizzati chirurgicamente o fortemente diminuiti in quelli trattati con inibitori della steroidogenesi glucoattiva corticosurrenalica.
Non é da escludere, secondo l’A., che entrambi questi eventi possano verifìcarsi in ratti con tessuto corticosurrenalico assente per ablazione chirurgica o non funzionante per azione di inibitori che blocchino la produzione di glucocorticoidi, pur permettendo la produzione di aldosterone (triparanolo) o di steroidi mineraloattivi «precursori» (SU 4885).
Terapia – De Gracianski e coll. (52) hanno studiato l’azione dell’esculoside in 50 casi di eczema. La somministrazione sia per os (80 mg) che per via endovenosa, ha determinato un miglioramento nei casi di eczema acuto, con guarigione più rapida dovuta al più rapido assorbimento dell'edema; nei casi di eczema cronico, l’influenza favorevole dell’esculoside è risultata meno netta e meno costante.
Sartori (53) riferisce di aver impiegato con successo un estratto di semi di Ippocastano, nella prevenzione delle flebotrombosi e delle fleboembolie.
L’estratto di Ippocastano agirebbe in questi casi, accelerando la circolazione venosa allorché essa abbia subito un rallentamento per cause patologiche varie o per lunghe degenze a letto [Chott e Kiihlmayer (54), Naegeli e coll. (55), Scheele (56), Sartori (57)].
Anche altri AA, [Ratschow e Bòdecker (58), Grewe e Kremer (59), Perlick e Bòdecker (46), Schott (60), Zimitz (61)] sono concordi nel ritenere che i principi attivi dell’Ippocastano agiscono favorevolmente sulle alterazioni circolatorie di diversa origine: flebiti, tromboflebiti (non esclusa la migrans), sindrome di Raynaud, endoangioite obliterante, diatesi emorragica, emorroidi, ulcus cruris ecc. e l’esculina in particolare, agirebbe elettivamente sulla circolazione venosa aumentandone il flusso.
Le suddette proprietà terapeutiche vennero negate da Stamm (62), ma Sartori (57) ritiene che i risultati negativi ottenuti da questo A. siano dovuti al fatto che egli ha impiegato per le sue prove, non un estratto di semi di Ippocastano ma di foglie, la cui composizione chimica è notevolmente diversa.
Tossicologia – Uebel e Patt (63) hanno studiato l’azione tossica della escina giungendo alla conclusione che le alterazioni tessutali che si osservano dopo somministrazione endovenosa di questa saponina, sono dovute prevalentemente alla sua attività emolitica.
L’intossicazione acuta che consegue alla somministrazione endovenosa di dosi elevate (DL50 acuta), si manifesta negli animali da esperimento (conigli, cavie, ratti, topi) con forte emolisi e conseguente ipossia o anossia dei parenchimi più importanti. All’autopsia si notano nel rene, lesioni necrotiche e le caratteristiche alterazioni del «rene da emolisi». Nel cuore, piccole ed isolate lesioni necrotiche.
La somministrazione continua di 1/5 della DL50 (1,1 mg/kg) di escina al giorno per la durata di un mese, non determina nel coniglio alcuna modificazione del comportamento clinico e non si osservano le alterazioni dei parenchimi determinate dall’intossicazione acuta. Come conseguenza dei piccoli episodi emolitici, si osserva invece un forte incremento dei processi eritropoietici.
L’emolisi intravitale dopo somministrazione endovenosa di 2 mg di escina, nell’uomo, é così esigua da non poter essere apprezzata neppure coi metodi più sensibili.
Portata a contatto coi vari tessuti (connettivo, muscolare, mucosa intestinale) l’escina determina intensi fenomeni irritativi che si manifestano con infiammazione, emorragie e necrosi.
Gli effetti tossici più salienti dovuti agli estratti totali di Ippocastano, conseguono alle alterazioni che si determinano a livello della barriera vasotessutale e si estrinsecano con la comparsa di emorragie parenchimali e di edemi parziali o totali.
Secondo Schweitzer (64) i casi di avvelenamento da Ippocastano non sarebbero rari, ma raramente sarebbero mortali, soprattutto perchè le saponine, secondo l'A., verrebbero assorbite soltanto lentamente e in piccolissime quantità; l’assorbimento sarebbe però favorito ed affrettato, ove esistano fatti infiammatori catarrali del tubo gstroenterico.
style=”font-family:arial unicode ms”>Lo stesso Schweitzer riferisce un caso di avvelenamento mortale avvenuto in un bambino, per ingestione di un solo seme di Ippocastano. La morte avvenne dopo 48 ore per paralisi respiratoria centrale, preceduta da eccitazione nervosa, insonnia, perdita dell’appetito, cefalgie, vomito, febbre e paralisi facciale.
Estratti e preparati vari
a) Estratto fluido (g 1 = LIII gtt).
Dosi: V-XX gtt più volte pro die.
b) Estratto molle idroalcoollco (1 p. = 4 p. circa di droga).
Dosi: g 0,05-0,2 pro dose.
c) Estratto secco idroalcoolico (1 p. = 6 p. circa di droga).
Dosi: g 0,04-0,15 pro dose.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido ippocastano………………………………….. g 20
Alcool di 60°……………………………………………………….. g 80
(g 0,50-2 più volte pro die).
Sciroppo
Estratto fluido ippocastano g 5
Alcool e glicerina………………………………………………… ana g 10
Sciroppo semplice F.U……………………………………….. g 75
(a cucchiaini).
Elisir antiemorroidale
Estratto fluido ippocastano g 12
Estratto fluido hamamelis g 10
Estratto fluido viburno g 5
Estratto fluido idraste g 5
Alcool di 60°………………….. g 150
Sciroppo aromatico ………. g 130
Acqua …………………………… g 40
(1/2-1 cucchiaino prima dei pasti).
Supposte
a) Estratto molle belladonna g 0,01
Estratto molle ippocastano g 0,01
Burro di cacao per una supposta g 3
(1-2 supposte pro die).
b) Estratto molle ippocastano g 0,03
Estratto molle giusquiamo g 0,03
Burro di cacao per una supposta g 0,05
(1-2 supposte pro die).
c) Estratto molle ippocastano…………………………………… g 0,01
Estratto molle cipresso……………………………… g 0,05
Estratto molle giusquiamo………………………………………… g 0,02
Anestesina……………………………………………………………….. g 0,01
Burro di cacao per una supposta……………………………… g 0,05
(1-2 supposte pro die).
BIBLIOGRAFIA
(1) ROCHLEDER, J. prakt. Chem., 101, 415, 1867; 102, 16, 1867 – (2) BLAU H., Beilr. z. Kennlis d. Saponine, Diss. Zurich, 1911 – (3) BOSSHARD G. A., Beitr. z. Kenntn. d. Samen d. Rosskastanie, Diss. Zurich, 322, 1916 – (4) VAN DER HAAR A. W., Biochem. Zeitschr., 88, 205, 1918; Ree. Trav. Chim., 42, 1080, 1923; 45, 271, 1926 – (5) MASSON G., Bull. sci. phurm., 23, 65, 1918 – (6) WINTERSTEIN A.. Z. physiol. Chem., 199, 25, 1931 – (7) RUZICKA L., JANETI W. e REY E., Helv. Chim. Acta, 25, 1665, 1942 – (8} RUZICKA L., BAUMGARTNER W, e PRELOG V., ibid., 32, 2057, 2069, 1949 – (9) CAINELLI G., MELERA A., ARIGONI D. e JEGER O., ibid., 40, 2390, 1957 – (10) MERKEL J., DWP., n. 11861, 1953 – (11) MERKEL J., DWP., n. 11942, 1954 – (12) ROEMISCH H., Pharmazie, 7, 475, 1956; Pianta Med., 4, 184, 1956; Pharmazie, 13, 708, 1958 • (13) BOITERI M., La Chlm. e l'tnd., 24, 354, 1942 – (14) VADAS R., Oesterr. Chem. Ztg., 41, 52, 1938 – (15) JERMSTAD A. e WAALER T., Pharm. Acta Helv., 28, 265, 1953 – (16) ROEMISCH H., Pharmazie, 11, 475, 1956 – (16a) WAGNER J. e BOSSE J., Z. physiol. Chem., 320, 27, 1960; ibid., 322, 254, 1960 – (16b) Brevetto della Chcmische – Pharmazeutische Fabrik A. Klinge (BOSSE J., WAGNER J. e WOJAHN F.), Gcr. 1.124.636, Mar. 1, 1962; Appi. Nov. 20, 1959; Chem. Abs., 56, 14407, 1962 – (17) CORCILIUS F., Pianta Med., 3, 55, 1955 . (18) LAVES E., Pharm. Zentralh., 43, 133, 1901 – (19) WINTERSTEIN E. e BLAU H., Z. physiol. Chem., 75, 410, 1911 – (20) KRUEGER M., Dtsch. Hailpfl., 9, 82, 1943 – (21) ALEXA V., FELSEGY E., WEISZ
G. , KONTROL J. e PAPP I., Acad. rep. papulare Romàne (Cluj), Studti cercetari stiim., 3, 109, 1952; Chem. Abs., 50, U562c, 1956 – (22) CORCILIUS F., Pianta Med., 3, 57, 1955 – (23) SCHINDLER H., Arzneim.-Forsch., J, 186, 1951 – (24) GESSNER O., Die Gift und Arzneipflanzen von Mitteleuropa, Heidelberg. 1953, p. 253 – (25) FIEDLER U., Arzneim.-Forsch.. 4, 213, 1954 – (26) NEU R. e NEUHOFF E., Naturwiss., 44, 10, 1957; Chem. Abs., 53, 12586c, 1959 – (27) GEHRMAN H. J., ENDRES L., COBET R. e FIEDLER U., Naturwiss., 42, 181, 1955 – (27a) WAGNER J., Naturwfss., 47, 158, 1960; 48, 54, 1961; Chem. Abs., 55, 14445h e 14826i, 1961 – (28) PARIS R., Ann. pharm. frang., 9, 124, 1951 – (29) FER- NANDER 0., CAPDEVILLA C., PIZARROSO A. e ORTEGA M., Farm. Nueva, 21. 61,'1956; Chem. Abs., 50, 10195d, 1956 – (30) FIEDLER U. e HILDEBRAND G., Arzneim.-Forsch., 5, 447, 1955 – (31) BELOSERSKI A. N. e DUBROWSKAYA J. J., Chem. Zbl., 1, 3658, 1937 . (32) HAENEL H., Pharmazie, 9, 489, 1954 • (33) SEYBOLD A. e MEHNER H., Sìtzungber. heldelberg. Akad. Wìss., 10, 5 e 17, 1948 â– (34) SCHEUNERT A. e THEILE E., Pharmazie, 7, 776, 1952 . (35) WINDAUS A. e BOCK F., Z. physiol. Chem., 250, 258, 1937-(36) DAM H., Ztschr. Vitamin., 8, 248, 1938 . (37) SERGER
H. , Chem. Ztg., 40, 221, 1916 – (38) BAKER e HULTON, Analyst., 42, 351, 1917; Chem. Zbl., 2, 194,
1918 – (39) KAUFMANN H. e BALTES J., Fette u. Seifen, 45, 175, 1938 . (40) ALLAN G. G.,
MCLEAN J. e THOMSON J. B., Arch. Pharm., 295, 865, 1962 – (41) ARTAULT DE VEVEY, Rev. de
Thér. Med. Chir. 1896 – (42) ARTAULT DE VEVEY. ibid. 1900 – (43) ARTAULT DE VEVEY, Anjou Médical 1909 – (44) LAVALLOY J., Compì. rend. soc. biol., 139, 270, 1945 – (45) LECOCQ R., CHAU- CHARD P. e MAZOUÉ H., Presse Méd., 58, 6 , 85, 1950 • (46) PERLICK E., BOEDECKER H., Mì.inch. med. Woch., 93, 1465, 1951 – (47) LORENZ D. e MAREK M. L., Arzeinm.-Forsch., 10, 263, 1960 – (48) AUSTER F.^ Pharmazie, 11, 726, 1956 – (49) PARIS R. e QUEVAUVILLER A., Thùapie, 2, 86, 1947 – (SO) VOGEL G. e UEBEL H., Arzneim.-Forsch., 10, 275, 1960 – (51) BUSING K. H., ibid., 5, 320, 1955 – (52) DE GRACIANSKI, BOULLE. LECLERCQ e SOLIGNAC, Presse Méd., 57, 228, 1949 – (5j) SARTORI C., Therapeut Vnschau u. Medizini.iche Bibl., 17, 16, 1960 . (54) CHOTI F. e KUEHL- MAYER R., Munch. med. Woch., 1309, 1955; cit. da SARTORI l.c. in (53) – (55) NAEGELI TH.,
MATIS P. e SCHMIEDERER H., Medizinische, 1240, 1955; cit. da SARTORI l.c. in (53) – (56) SCHEELE
J. e MATIS P., ibid., 639, 1952; cit. da SARTORI in (53) â– (57) SARTORI C., Munch. med. Woch., 481, 1955; cit. in (53) – (58) RATSCHOW M. e BOEDECKER E., MUnch. med. Wocìt., 27, 1952; cit. da KUKOWKA A. in Pharmazie, 9, 44, 1954 – (59) GREWE H. E. e KREMER K., Thérap. Gegenw., 6, 1952; cit. da KUKOWKA A. ibid. – ( 60) SCHOTT P., Riedel Arch., 5, 1951; cit. da KUKOWKA A. ibid. – (61) ZIMITZ FR., Klin. Woch., 630, 1951; cit. da KUKOWKA A. ibid. (62) STAMM H., Therapeut. Umschau u. Medizinische Bibl., 17, 18. 1960 . (63) UEBEL H. e PATI P., Arzneim.-Forsch., 5, 320, 1955 â– (64) SCHWEITZER H., Med. Klin., 20, 1952; cit. da KUKOWKA A. in Arzneim.-Forsch., 9, 44, 1954.


