Vitamina B2 o Riboflavina: funzioni, carenza, fonti
La Vitamina B2 o Riboflavina è indispensabile per il buon trofismo cutaneo e per la visione.
La sua carenza si manifesta con segni cutanei mucosi ed oculari ed i sintomi, almeno inizialmente, sono sfumati, rendendo la diagnosi di carenza non facile. (Vedi anche “Le Vitamine“)
Indice dei contenuti
- Cenni storici
- Struttura chimica
- Proprietà fisico-chimiche
- Metabolismo
- Fisiologia
- Fonti, Unità, Apporti
- Carenza
- Diagnosi di carenza
- Farmacologia
- Indicazioni e Controindicazioni
- Ricerche attuali
- Conclusioni
Storia della Vitamina B2
La vitamina B2 è inizialmente confusa con le altre vitamine del gruppo B.
Viene successivamente identificata grazie a parecchi lavori intrapresi nel settore della sperimentazione animale.
Dal 1920, A.D. Emmet constata che dopo distruzione del fattore antineuritico (vitamina B1) da parte del calore, persiste negli estratti di lievito un fattore di crescita, termostabile, di cui si dimostra più tardi l’identità con un pigmento giallo isolato dal latte da A.W. Blyth sin dal 1879.
Tra il 1933 e il 1935, diversi ricercatori riescono ad isolare questo fattore di crescita e la sintesi della riboflavina è realizzata separatamente nel 1937 nei laboratori di R. Kuhn e P. Karrer.
Nel 1938, O.H. Warburg e W. Christian isolano e caratterizzano il flavin-adenin-dinucleotide (FAD) e dimostrano che esso svolge un ruolo di coenzima.
Nel 1941, W.H. Sebrell e V.P. Sydenstricker riferiscono le prime osservazioni di ariboflavinosi nell’uomo.
Tuttavia, i sintomi carenziali non sono specifici, quindi non è stato facile individuare il fabbisogno di vitamina B2.
Le prime indicazioni sugli apporti nutrizionali consigliati vengono pubblicate negli Stati Uniti e sono stabilite in funzione dell’apporto proteico (1958), le successive vengono stabilite in funzione dell’apporto energetico (1964).
Negli anni ’70, la possibilità di determinare lo stato vitaminico permette un miglior approccio agli apporti nutrizionali raccomandati.
A partire dal 1982, vengono descritte diverse anomalie ereditarie del metabolismo ribofiavina-dipendenti.
Struttura Chimica
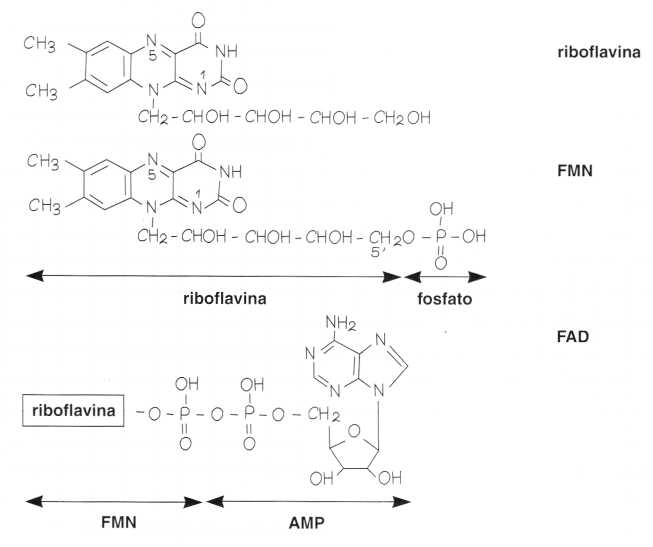
La riboflavina risulta dalla combinazione di una flavina che è un composto eterociclico azotato a 3 anelli (l’isoallosazina) e di uno zucchero a 5 atomi di carbonio (il ribosio).
Questa associazione di ribosio e flavina è all’origine della sua denominazione: riboflavina.
Sul piano metabolico sono particolarmente importanti due derivati:
• Il fosfato di riboflavina o flavin-mononucleotide (FMN) che ha un gruppo fosfato proveniente dall’ATP in posizione 5′,
• Il flavin-adenin-dinucleotide (FAD) che si forma partendo dal FMN mediante combinazione con una molecola di AMP proveniente dall’ATP.
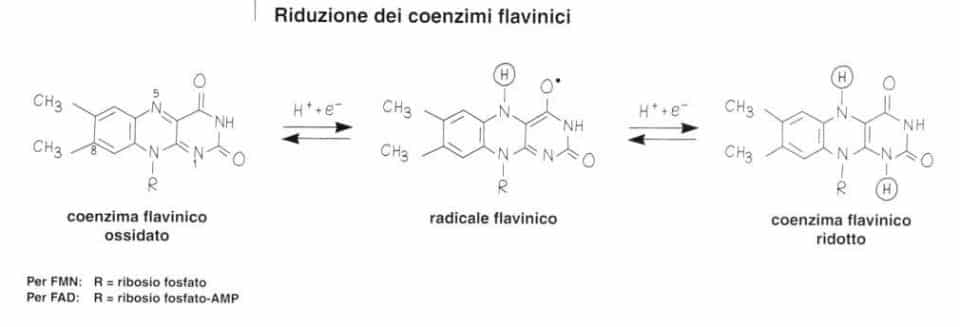
Il FAD può essere ridotto a FADH2 fissando due atomi di idrogeno sull’azoto in posizione 1 e 5.
Proprietà Fisico-Chimiche
La riboflavina è una sostanza cristallina che si presenta sotto forma di aghi sottili, di colore giallo-arancio dal gusto amaro.
E’ stabile al calore e non si ossida all’aria.
Contrariamente ai derivati FMN e FAD, la riboflavina è poco solubile in acqua (1/8.000), ma le conferisce una fluorescenza di colore giallo-verde intenso.
E’ ancor meno solubile in alcool ed insolubile in etere, cloroformio e nei solventi organici.
La riboflavina è solubile e stabile in soluzione acida ma è instabile in soluzione alcalina.
E’ molto sensibile alla luce ed ai raggi ultravioletti che la decompongono rapidamente in un derivato inattivo: la lumiflavina.
Metabolismo
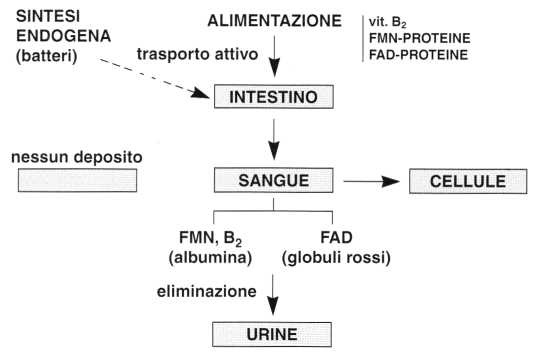
In parecchie specie animali, la riboflavina è sintetizzata dai batteri intestinali.
Nell’uomo, questa sintesi è insufficiente per garantire la copertura del fabbisogno che dipende quindi dall’alimentazione.
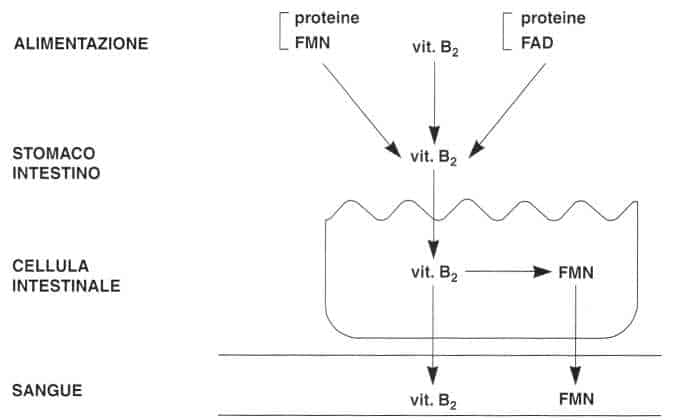
Assorbimento
La vitamina 62 è presente nell’alimentazione sotto forma di flavin-mononucleotide (FMN), di flavin-adenin-dinucleotide (FAD) e di riboflavina libera.
Il FMN ed il FAD sono idrolizzati a livello del tratto gastrointestinale.
Sede
La riboflavina libera è assorbita nella parte alta del tubo digerente.
Meccanismo
Essa è assorbita attraverso un meccanismo di trasporto attivo saturabile.
All’interno della cellula intestinale, la maggior parte della riboflavina viene fosforilata a FMN.
Assorbimento della vitamina B2
Distribuzione
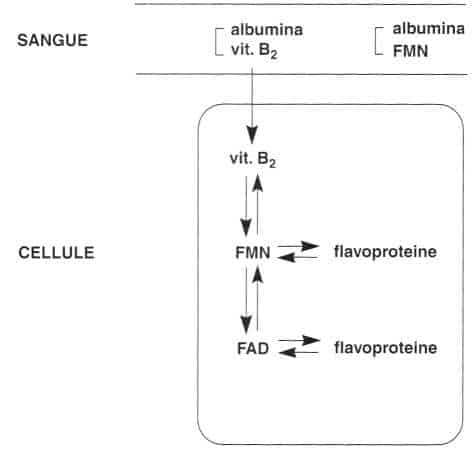
La riboflavina libera e il FMN sono in seguito trasportati al fegato attraverso la vena porta, quindi raggiungono il circolo sistemico.
Nel plasma, la riboflavina e il FMN si legano alle proteine, principalmente all’albumina.
Nei globuli rossi, si trova principalmente il FAD. La concentrazione di vitamina B2 totale (riboflavina + FMN -1- FAD) negli eritrociti è da 5 a 10 volte superiore a quella del plasma.
Concentrazione di riboflavina totale nel sangue
| Concentrazione inµg/l | |
|---|---|
| Plasma | da 26 a 37 |
| Globuli rossi | da 180 a 262 |
| Sangue intero | da 49 a 104 |
Nei tessuti, le concentrazioni sono molto più elevate.
Gli organi più ricchi sono il fegato, i reni ed il cuore.
Il fegato contiene un terzo delle riserve dell’organismo.
Queste sono sufficienti per due – sei settimane.
Concentrazione di riboflavina totale nei diversi organi
| Concentrazione in mcg/g | |
|---|---|
| Fegato | 25 |
| Cuore | 13 |
| Cristaliino | 3,1 |
| Muscoli | 2,7 |
L’assenza di deposito sufficiente di riboflavina nell’organismo spiega la necessità di un apporto quotidiano.
A livello dei tessuti, la riboflavina libera penetra nella cellula quindi viene trasformata in coenzimi attivi, FMN e FAD, mediante le seguenti reazioni:
• sintesi del FMN catalizzata dalla flavochinasi:
![]()
sintesi del FAD catalizzata dalla FAD pirofosforilasi:
![]()
Queste due reazioni sono reversibili e gli ormoni della tiroide intervengono nella regolazione.
Nei tessuti si trova in maggioranza FAD (da 70% a 90%) e FMN (da 5% a 30%) che sono legati alle flavoproteine, e pochissima riboflavina libera (da 0,5% a 2%). Soltanto la retina e la cornea contengono quantità relativamente importanti di riboflavina libera, per motivi non ben noti.
Distribuzione della vitamina B,
Eliminazione
L’escrezione della vitamina B2 avviene principalmente per via urinaria per la maggior parte sotto forma di riboflavina libera, ma si trova anche del FMN.
Esiste una secrezione tubulare in quanto la clearance è superiore alla filtrazione glomerulare.
L’escrezione normale è di 200µg/24 ore ma diminuisce in caso di carenza e quando l’alimentazione è ricca di proteine e di lipidi.
Esiste una bassissima eliminazione con la bile: meno dell’1% della quantità assorbita. L’eliminazione con il sudore è trascurabile.
L’emivita è di circa sedici giorni nell’animale.
Fisiologia
Meccanismo d’azione
FMN e FAD svolgono un ruolo nelle reazioni di ossidoriduzione, sono i coenzimi delle deidrogenasi e delle ossidasi,
I coenzimi flavinici si fissano sull’enzima, nella maggior parte dei casi mediante legami idrogeno o anche mediante legame covalente con il gruppo metilico del carbonio in posizione 8.
• Le deidrogenasi
Sono enzimi che agiscono in fase anaerobica trasferendo una coppia di atomi di idrogeno proveniente da un substrato (X). Avviene quindi la formazione del coenzima ridotto:
FMN o FAD + XH –> FMNH2 o FADH2 + X
I due atomi di idrogeno staccati dal substrato si fissano a livello dell’azoto in posizione 1 e 5 del nucleo di isoallosazina.
In realtà, questa reazione avviene in due fasi con formazione di un radicale flavi-nico, il che permette ai coenzimi flavinici di trasferire uno o due elettroni.
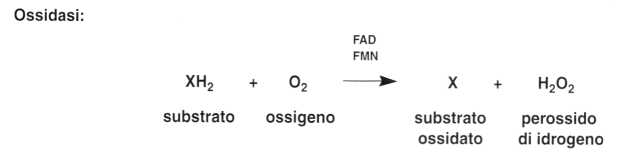
• Le ossidasi
Sono degli enzimi che agiscono in fase aerobica trasferendo direttamente l’idrogeno dal substrato (X) sull’ossigeno molecolare.
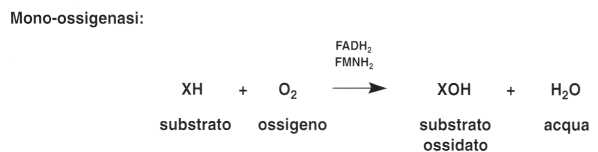
Sul piano fisiologico, sono le deidrogenasi che svolgono il ruolo più importante.
Ruolo metabolico dei coenzimi flavinici
I coenzimi flavinici svolgono un ruolo importante nel catabolismo degli acidi grassi, di alcuni aminoacidi, delle basi puriniche, nonché a livello del ciclo di Krebs e della catena respiratoria.
Ruolo dei coenzimi fiavinici nel metabolismo
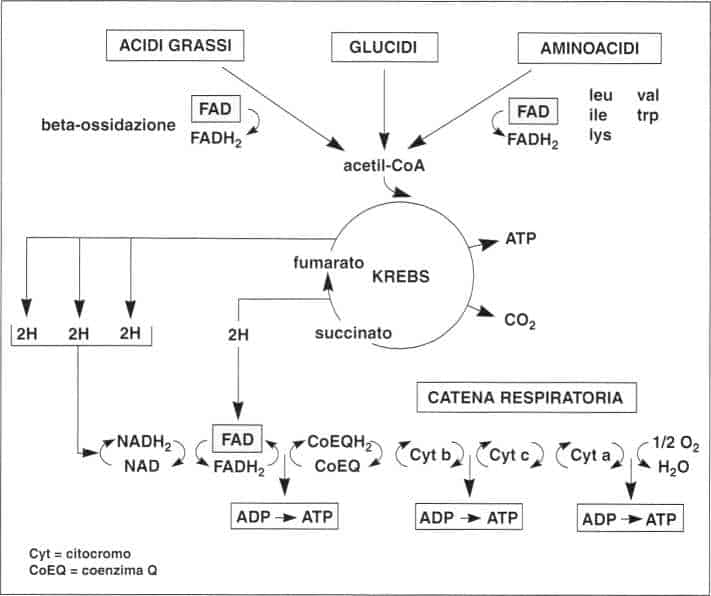
¦ Catabolismo degli acidi grassi
L’idrolisi dei lipidi libera in circolo acidi grassi che sono degradati nei mitocondri da una serie di reazioni detta beta-ossidazione.
La prima di queste reazioni è una deidrogenazione in cui interviene un complesso enzimatico FAD-dipendente.
Questo complesso comprende una acil-coenzima A deidrogenasi (acil-Coa-DH) e due trasportatori di elettroni: l’ETF (Electron Transfer Flnvoprotein) e l’ETF-DFI (Electron Transfer Flavoprotein Deshydrogenase).
L’ETF e l’ETF-DFI regolano il trasferimento degli elettroni dall’acil-Coa-DFI al coenzima Q (CoEQ) della catena respiratoria.
Deidrogenazione degii acil-CoA
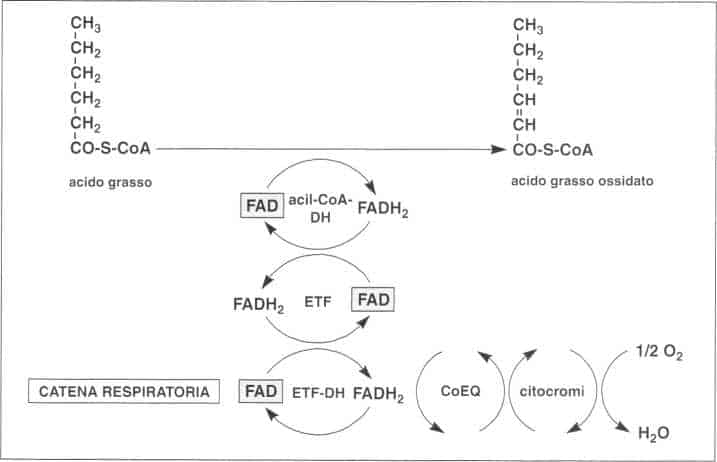
Esistono tre diversi acil-Coa-DH, rispettivamente per gli acidi grassi a catena lunga, media o corta.
La beta-ossidazione porta alla formazione di molecole di acetil-coenzima A che possono seguire diverse vie metaboliche:
– il ciclo di Krebs con produzione di energia,
– la sintesi degli acidi grassi,
– la formazione di corpi chetonici,
– la sintesi del colesterolo.
¦ Catabolismo degli aminoacidi
Cinque aminoacidi seguono una via catabolica di deidrogenazione utilizzando un complesso FAD-dipendente:
– la leucina allo stadio di isovaleril-CoA,
– l’isoleucina allo stadio di a-metil-butirril-CoA,
– la vaiina allo stadio di isobutirril-CoA,
– la lisina ed il triptofano allo stadio di glutaril-CoA.
Inoltre, la deaminazione degli aminoacidi di serie L o D utilizza i coenzimi flavi-nici.
La L-aminoacido ossidasi è FMN-dipendente. È poco attiva e se ne conosce poco il ruolo dato che nell’uomo la degradazione degli aminoacidi fa ricorso alle reazioni di transaminazione.
La D-aminoacido deidrogenasi è FAD-dipendente. È abbondante nel fegato e nel rene. Questo fenomeno è poco comprensibile in quanto, nell’uomo, gli aminoacidi delle proteine sono, nella loro stragrande maggioranza, della serie L. Alcune proteine della parete dei batteri contengono aminoacidi di forma D, facendo quindi ipotizzare il ruolo di difesa aspecifico di questo enzima;
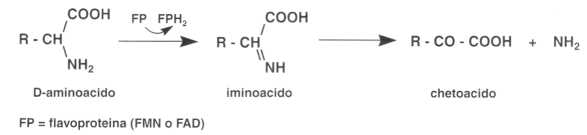
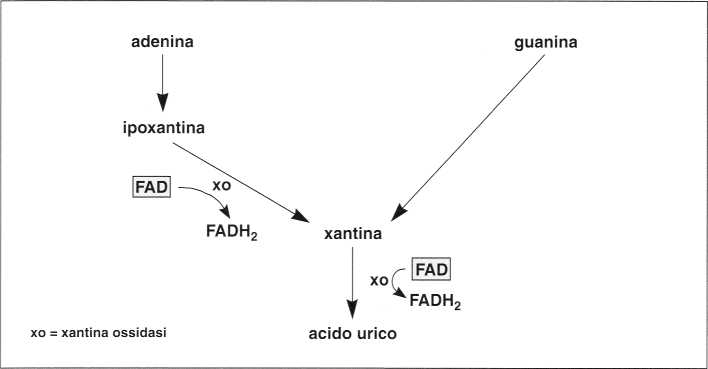
¦ Catabolismo delle basi puriniche
Le basi puriniche (adenina, guanina) sono componenti degli acidi nucleici (DNA, RNA).
Sono degradate ad acido urico mediante una serie di reazioni in cui interviene un enzima FAD-dipendente: la xantina ossidasi.
Catabolismo delle basi puriniche
¦ Ciclo di Krebs
Il FAD è il gruppo prostetico della succinato deidrogenasi che catalizza una reazione del ciclo di Krebs:
![]()
È la sola delle quattro deidrogenazioni del ciclo di Krebs che utilizza il FAD, saltando quindi la prima tappa della catena respiratoria (NAD).
¦ Catena respiratoria
La catena respiratoria trasporta gli atomi di idrogeno sino all’ossigeno per formare una molecola d’acqua. L’energia liberata è immagazzinata sotto forma di ATP.
Le altre tre deidrogenazioni del ciclo di Krebs utilizzano il coenzima NAD:
![]()
NADH2 + FAD –> NAD + FADH2
XH2 + NAD –> X + NADH2
![]()
Il NADH2 è riossidato dal FAD mediante la reazione:
¦ Metabolismo del globulo rosso
Il globulo rosso contiene un enzima, la glutatione perossidasi (GP), che neutralizza il perossido di idrogeno (H2O2) mediante la seguente reazione:
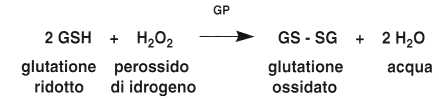
2 GSH + H2O2 –> GS – SG + 2 H2O
La rigenerazione del glutatione ridotto avviene grazie ad un enzima FAD-dipen-dente, la glutatione redattasi (GR):
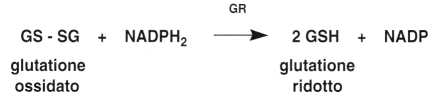
L’esame dell’attività di questo enzima è usato nella diagnosi biochimica della carenza di vitamina B2.
Funzione della glutatione-reduttasi eritrocitaria

Fonti, Unità,Apporti, Stato
Fonti alimentari
La vitamina B2 è molto diffusa in natura. Il lievito secco, il fegato ed il rognone ne sono particolarmente ricchi ma, in pratica, le principali fonti sono i latticini: latte, yogurt, formaggio.

Secondo recenti studi, l’apporto di vitamina B2 si ripartisce in media tra le seguenti fonti alimentari:
| Apporto di vitamina B2 | |
|---|---|
| Latticini | da 36% a 47% |
| Carne, pesce, uova | da 31% a 37% |
| Verdure e frutta | circa 12% |
| Pane, cereali, patate | da 8% a 9% |
| Altri alimenti | da 2% a 5% |
La riboflavina è abbastanza resistente al calore. Tuttavia, la sua solubilità in acqua può essere responsabile di una perdita parziale. Infatti, il 30% della vitamina B2 della carne bollita si ritrova nel brodo.
La riboflavina è molto sensibile alla luce. La distruzione può arrivare all’85% nel latte esposto per due ore alla luce solare.
Unità
La vitamina B2 viene valutata mediante la misura in peso (mg) di riboflavina.
Apporto consigliato
A seconda delle fasce d’età, l’apporto nutrizionale consigliato è 0,6-1,8 mg al giorno.
| mg/giorno | |
|---|---|
| Lattanti | 0,6 |
| Bambini da 1 a 3 anni | 0,8 |
| Bambini da 4 a 9 anni | 1,0 |
| Bambini da 10 a 12 anni | 1,4 |
| Adolescenti, uomini adulti | 1,8 |
| Adolescenti, donne adulte | 1,5 |
| Gravidanza, allattamento | 1,8 |
Stato nutrizionale
• Gli studi francesi dimostrano che apporti alimentari nettamente inferiori alle raccomandazioni interessano una bassa percentuale di individui. Più di tre persone su quattro ricevono almeno l’80% dell’apporto consigliato.
• Lo stato della vitamina B2 può essere valutato mediante il coefficiente di attivazione della glutatione reduttasi eritrocitaria (GRE). Mentre gli studi degli anni 1980-1984 conclusero che \’i è un rischio eccezionale di carenza, lo studio Val-de-Marne (1991) segnala che dal 14% al 31% delle donne e dall’8% al 22% degli uomini presenta un coefficiente GRE indice di rischio elevato di carenza di vitamina B2 (GRE > 1,52).
Carenza di Riboflavina
Clinica
Il deficit di riboflavina si manifesta con segni cutanei, mucosi e oculari. Nell’uomo, i sintomi sono sfumati ed aspecifici. Spesso sono associati con segni relativi a carenze di altre vitamine o proteine.
È sorprendente, data l’importanza e l’ubiquità delle funzioni metaboliche della riboflavina, che la carenza non si manifesti con segni importanti a livello clinico.
Nel corso di una dieta carente, i segni clinici compaiono solo dopo tre-quattro mesi.
¦ Segni cutanei e mucosi
• Le lesioni cutanee si presentano sotto forma cii dermatite seborroica del viso, predominante agli angoli del naso e talvolta sul lobo delle orecchie o alle estremità delle sopracciglia.
Si osserva talvolta anche iperpigmentazione a livello della vulva e dello scroto.
• Le lesioni mucose colpiscono essenzialmente le labbra e la lingua:
– Sulle labbra lisce, brillanti, secche e di colore anormalmente rosso si formano ragadi essudanti e crostose (cheilite). Le commessure labiali presentano delle ragadi (perlèche).
– La lingua diventa color porpora (lingua “rosso magenta”) e presenta atrofia liscia delle papille (glossile).
¦ Segni oculari
1 segni funzionali sono fotofobia e lacrimazione.
La congiuntiva è sede di ipervascolarizzazione che invade la cornea formando delle anastomosi a reti concentriche. Si può anche osservare opacizzazione della cornea.
¦ Carenze sperimentali
• Nel corso di una carenza sperimentale basata su un regime alimentare povero di riboflavina, le manifestazioni cliniche carenziali (lesioni cutanee e mucose) compaiono dopo tre-quattro mesi.
• Se si associa a tale regime alimentare un antagonista della riboflavina (la galat-toflavina), le manifestazioni sono più precoci (da due a sette settimane) e si aggiungono altri segni: anemia normocromica normocitica arigenerativa (da tre a nove settimane), quindi neuropatie periferiche (tre mesi).
• Nell’animale, la carenza è teratogena. Una carenza nella madre provoca spesso malformazioni gravi nel neonato: anomalie dello scheletro, idrocefalo, idronefrosi, malformazioni cardiache ed oculari.
Fisiopatologia – Epidemiologia
La carenza di riboflavina può insorgere attraverso due meccanismi principali:
• diminuzione dell’apporto,
• diminuzione dell’assorbimento.
¦ Paesi in via di sviluppo
Nei paesi in via di sviluppo, la riduzione dell’apporto costituisce il principale meccanismo di carenza.
Se la dieta fornisce abifualmente una quantità di riboflavina sufficiente, una carenza può sopravvenire durante una carestia. In tal caso è molto spesso associata a malnutrizione globale: vitamine, proteine, calorie.
Un malassorbimento può costituire un meccanismo associato in particolare negli individui con intensa parassitosi che presentano una diarrea cronica.
¦ Paesi industrializzati
Nei paesi industrializzati, le manifestazioni cliniche carenziali sono rare. Viceversa, sono stati osservati stati di carenza marginale in gruppi ben precisi.
• L’alcolismo cronico è probabilmente la causa più frequente. Secondo i diversi studi, dal 6% al 50% degli alcolisti cronici presenta uno stato di carenza marginale.
L’insufficiente apporto alimentare di riboflavina ne è la causa principale.
• Malassorbimento cronico
Qualunque ne sia la causa, il malassorbimento cronico può provocare una carenza anche se l’apporto è normale.
• Le persone anziane
Sono state osservate carenze nelle persone anziane.
Questo è probabilmente dovuto al fatto che queste persone consumano pochi alimenti ricchi di riboflavina, in particolare i latticini.
Due studi hanno dimostrato stati deficitari nel 7% e nel 27% dei pazienti anziani.
• La nutrizione parenterale non integrata
L’assenza di riboflavina nella nutrizione parenterale provoca a lungo termine una vera e propria carenza sperimentale. 1 segni biochimici di carenza compaiono a partire dal quindicesimo giorno.
• L’ipotiroidismo
Si osserva una diminuzione del coefficiente di attivazione della glutatione redut-tasi eritrocitaria probabilmente legata al ruolo induttore della tiroxina sulla flavo-chinasi.
11 meccanismo in causa sarebbe quindi una diminuzione della sintesi del coenzima attivo FMN a partire dalla riboflavina.
• Il diabete
Nel diabetico si osserva un aumento dell’escrezione urinaria.
• L’emodialisi
L’emodialisi provoca un aumento delle perdite di vitamine idrosolubili.
• I vegetariani stretti
Poiché i vegetali non sono un’ottima fonte di riboflavina, il regime vegetariano stretto (vegan) espone a rischio di carenza di apporto.
Il latte di madre vegetariana stretta è povero di riboflavina.
• La fototerapia
La riboflavina è degradata dall’irradiazione con ultravioletti e si può osservare una carenza nei pazienti sottoposti a questa terapia.
• Le malattie genetiche
Recentemente sono state descritte anomalie ereditarie del metabolismo riboflavi-na-dipendenti.
Il meccanismo molecolare continua a essere poco noto.
Le anomalie delle acil-CoA deidrogenasi FAD-dipendenti
Esistono un centinaio di casi. Si distinguono due gruppi a seconda che l’anoma-lia riguardi uno o più enzimi:

Esiste un solo caso di deficit di NADH-CoEQ reduttasi.
Sul piano clinico, si distinguono due quadri per queste malattie genetiche, a seconda che le manifestazioni predominino a livello del fegato o dei muscoli.
Le manifestazioni epatiche: si osserva coma ipoglicemico con epatomegalia, steatosi, aumento delle transaminasi, iperammoniemia, anomalie della coagulazione, disturbi della coscienza e convulsioni.
In generale queste manifestazioni compaiono precocemente, nel periodo neonatale o nei primi due anni di vita.
Le manifestazioni muscolari: si osserva miopatia, dapprima prossimale, quindi generalizzata con sovraccarico lipidico. Compaiono talvolta segni parossistici con debolezza muscolare e crampi.
Queste manifestazioni compaiono più tardivamente, nella seconda infanzia, nell’adolescenza o nell’età adulta.
Alcune di queste affezioni ereditarie sono sensibili alla riboflavina, alla dose da 20 a 300 mg al giorno.
Diagnosi di Carenza
Le manifestazioni cliniche carenziali tipiche sono rare. Inoltre, i segni non sono specifici.
La diagnosi molto spesso è sospettata quando si manifestino sintomi aspecifici in un individuo appartenente ad un gruppo a rischio di carenza e richiede una conferma con esami biochimici.
La determinazione dello stato vitaminico può essere effettuata con metodi diretti dosando la riboflavina nel plasma, nei globuli rossi e nelle urine oppure tramite esami funzionali che analizzano reazioni chimiche dipendenti dai coenzimi flavinici.
Dosaggi diretti
La vitamina B2 può essere dosata nel plasma, nei globuli rossi e nelle urine.
• Dosaggi ematici
Il dosaggio piasmatico della riboflavina dà risultati variabili in quanto riflette gli apporti alimentari recenti.
Il dosaggio eritrocitario è più interessante. Un tasso inferiore a 10µg/l00 mi di globuli rossi è un segno di carenza. Tuttavia, la diminuzione del tasso eritrocita-rio è tardiva rispetto agli altri dosaggi e la differenza tra i livelli normali ed i livelli deficitari è minima.
• Dosaggio urinario
Può anche essere utilizzato il dosaggio dell’escrezione urinaria. L’escrezione urinaria normale è superiore ad 80µg/g di creatinina. Un tasso inferiore a 27µg/g di creatinina è considerato ad alto rischio di carenza.
Tuttavia i risultati sono sempre in funzione degli apporti recenti di riboflavina e di proteine. In effetti, in caso di carenza proteica, la riboflavina è escreta massivamente nelle urine.
I risultati variano anche con l’età, in quanto l’escrezione è nettamente superiore nel bambino: da due a cinque volte quella dell’adulto a seconda delle fasce di età.
Esami funzionali
Attività della glutatione reduttasi eritrocitaria
La determinazione dell’attività della glutatione reduttasi eritrocitaria (GRE) è il metodo migliore. Consiste nel misurare l’attività di un enzima eritrocitario FAD-dipendente. Si misura l’attività dell’enzima nei globuli rossi del paziente prima e dopo l’aggiunta di PAD.
In caso di carenza, l’aggiunta di PAD provoca un aumento dell’attività dell’enzima.
II risultato è espresso sotto forma di un coefficiente di attivazione che è il rapporto:
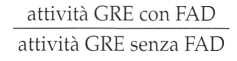
attività GRE con PAD attività GRE senza PAD Il valore normale è inferiore a 1,2.
Questo metodo è attualmente il più sensibile ed il più specifico per valutare lo stato vitaminico della riboflavina.
Interpretazione dei risultati biochimici secondo diversi autori
| stato | Dosaggio eritrocitario Hg/100 mi | Dosaggio urinario |jg/g di creatinina (adulti) | Coefficiente di attivazione della GRE |
|---|---|---|---|
| Normale | >15 | >80 | <1,2 |
| Marginale | 10-14,9 | 27-79 | 1,21-1,3 |
| Carente | <10 | <27 | > 1,3 |
Altri metodi
Esistono altri metodi di esplorazione funzionale indiretta, ma non sono di utilizzo corrente: studio degli acidi organici plasmatici ed urinari, dopo un pasto completo, a digiuno o dopo carico di aminoacidi o trigliceridi.
Farmacologia
Proprietà farmacologiche
Mentre le proprietà biochimiche della vitamina B2 ai quantitativi nutrizionali sono ben definite, meno bene si conoscono i meccanismi della sua attività farmacologica specifica ai dosaggi terapeutici.
In effetti, per la loro anzianità, le indicazioni corrispondenti non sempre sono state confermate con sperimentazioni cliniche controllate.
Interazioni farmacologiche
• Il probenecid diminuisce l’assorbimento intestinale della riboflavina.
• La riboflavina è instabile in soluzione alcalina. Occorre quindi evitare di somministrarla in questo tipo di soluzione.
• L’acido borico induce una carenza rimpiazzando la riboflavina delle proteine piasmatiche ed aumentandone l’escrezione urinaria.
• La clorpromazina è un analogo strutturale della riboflavina. Nel ratto è stato dimostrato un ruolo antagonista sulla trasformazione della riboflavina in FMN.
• Gli ioni metallici bivalenti formano dei chelati con la riboflavina e soprattutto con il FMN.
Incidenti e complicanze
La riboflavina è atossica. Non è stato segnalato alcun effetto secondario dopo la sua somministrazione anche a dosi elevate ed a lungo termine.
Indicazioni e Controindicazioni
Indicazioni
¦ Trattamento terapeutico
• Le carenze di apporto sono trattate con circa 30 mg/giorno per via orale.
• In caso di malassorbimento, si usa la via parenterale allo stesso dosaggio.
• Le anomalie ereditarie del metabolismo richiedono talvolta l’uso di dosi più elevate (sino a 300 mg/giorno). Queste affezioni richiedono un’integrazione continuativa.
¦ Trattamento preventivo
La prevenzione della carenza si basa su un’alimentazione equilibrata che soddisfa facilmente il fabbisogno.
Tuttavia, in alcune situazioni particolari, può essere giustificato un trattamento preventivo.
• La nutrizione parenterale
Per evitare l’instaurarsi di una carenza, la riboflavina è associata a diversi nutrimenti parenterali. La dose raccomandata nell’adulto è di circa 0,03 mg/kg/gior-no.
• L’emodialisi
La supplementazione permette di compensare le perdite dovute a questa tecnica.
• La fototerapia nel neonato
La supplementazione di riboflavina alla posologia di 0,5 mg/kg/giorno previene l’instaurarsi di una carenza.
D’altra parte, permette una più rapida normalizzazione dell’iperbilirubinemia del neonato grazie al suo ruolo fotosensibilizzante.
• Il malassorbimento cronico
Apporti superiori agli apporti nutrizionali consigliati sono necessari per garantire la copertura del fabbisogno. Talvolta, è necessario ricorrere alla somministrazione parenterale.
¦ Altre indicazioni
• La metaemoglobinemia familiare
Alla posologia di 20-40 mg/giorno, consente di mantenere un tasso di metaemo-globina inferiore al 5%, probabilmente agendo sulla glutatione-reduttasi.
• Intossicazione da Akee Nut (Blighia sapida)
L’Akee Nut contiene una tossina, l’ipoglicina, che è un antagonista della riboflavina. Consumato acerbo dai bambini, questo frutto tropicale provoca un’intossicazione i cui sintomi possono essere prevenuti o migliorati mediante la somministrazione parenterale di riboflavina.
• Marker della compliance con la terapia
La riboflavina è eliminata nelle urine e conferisce loro un colore giallo-arancione. Somministrata in associazione con un farmaco, permette di sorvegliarne la compliance guardando il colore delle urine.
¦ Uso abituale
La riboflavina è usata, in forma iniettabile, nella rosacea.
Controindicazioni
Non esistono controindicazioni all’uso della riboflavina.
Ricerche attuali
Le ricerche attuali sono orientate verso una migliore conoscenza delle anomalie genetiche del metabolismo vitamina Bj-dipendenti.
Inoltre, alcuni studi epidemiologici eseguiti in Cina hanno dimostrato un’associazione tra uno stato deficitario di riboflavina ed un maggior rischio di cancro dell’esofago.
Conclusioni
La vitamina B2 svolge un ruolo nel catabolismo degli acidi grassi, di alcuni aminoacidi, delle basi puriniche, nonché nel ciclo di Krebs e nella catena respiratoria.
Le manifestazioni cliniche da carenza sono rare e compaiono sempre in contesti particolari: alcolismo e malassorbimento cronico, nutrizione parenterale non integrata.
Viceversa, stati di carenza marginale sono frequenti. Si ignora se queste carenze abbiano delle conseguenze cliniche.
Indice delle monografie sulle Vitamine:
- Le Vitamine: generalità
- Vitamina A o Retinolo (beta-carotene)
- Vitamina B1 o Tiamina
- Vitamina B2 o Riboflavina
- Vitamina B5 (Acido Pantotenico)
- Vitamina B6 (Piridossina)
- Vitamina B8 o Vitamina B7 o Vitamina H (Biotina)
- Vitamina B9 (Acido Folico)
- Vitamina B12 (Cobalamina)
- Vitamina C (Acido Ascorbico)
- Vitamina D (Colecalciferolo)
- Vitamina E (Tocoferolo)
- Vitamina PP o Vitamina B3 (Niacina)


