Vitamina B1 o Tiamina: storia, funzioni, sintomi da carenza
La Vitamina B1 o Tiamina, è una vitamina idrosolubile del gruppo B. La sua carenza provoca gravi sintomi neurologici, psichiatrici e cardiaci. La malattia da carenza di Vitamina B1 più nota è il Beri-Beri.
Indice dei contenuti
- Cenni storici
- Struttura chimica
- Proprietà fisico-chimiche
- Metabolismo
- Fisiologia
- Fonti, Unità, Apporti
- Carenza
- Diagnosi di carenza
- Farmacologia
- Indicazioni e Controindicazioni
- Ricerche attuali
- Conclusioni
Storia della Vitamina B1
La malattia denominata “beri-beri” è nota in Cina già nel 2600 a.C., ma è solo nel 1885, grazie alla perspicacia dell’ammiraglio giapponese K. Takaki, che si attribuisce ad una causa nutrizionale una sindrome polineuritica osservata nei mangiatori di riso.
Nel 1890, C. Eijkmann riesce a riprodurre sperimentalmente una polineurite nei polli, simile al beri-beri, ed a far scomparire questa malattia facendo assumere agli animali una sostanza idrosolubile presente nella pula del riso.
Nel 1901, Grijns ipotizza che l’assenza nel regime alimentare di una sostanza indispensabile al metabolismo del sistema nervoso spieghi contemporaneamente lo sviluppo del beri-beri e la polineurite del pollo.
Nel 1910, C. Punk isola dalla pula del riso una sostanza cristallina idrosolubile che ha la proprietà di prevenire e guarire rapidamente il beri-beri sperimentale. Dà a questa sostanza, i cui effetti sembrano così interessanti, il nome di vitamina (amina della vita).
“Vitamine” è il nome che sarà dato all’insieme delle sostanze nutritive indispensabili di cui l’organismo non può fare la sintesi e che devono quindi essere assunte con gli alimenti.
La determinazione della struttura della tiamina e la sua sintesi vengono realizzate soltanto nel 1936.
Nel 1943, alcuni studi rivelano che la carenza di tiamina è molto diffusa negli Stati Uniti.
Pertanto, lo US Food and Nutrition Board stabilisce delle norme secondo le quali le vitamine B1, B2, PP ed il ferro devono essere aggiunti alla farina bianca.
Negli anni 1970-1985, lo studio approfondito di diverse rare mutazioni responsabili di errori congeniti del metabolismo permette di superare una tappa nella conoscenza del metabolismo tiamina-dipendente.
Queste malattie ereditarie tiamina-dipendenti rispondono alla somministrazione permanente di dosi massicce di tiamina.
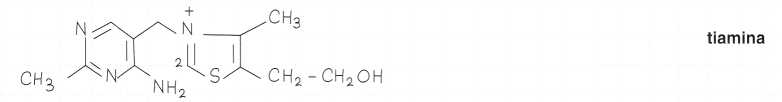
Struttura Chimica
La tiamina è una molecola composta da un anello pirimidinico e da uno tiazolico solforato e azotato.
Questi due anelli sono collegati da un ponte metilenico che costituisce la parte fragile della molecola e ne spiega la termolabilità.
La molecola possiede un gruppo solforato (thia) ed un gruppo aminico, da cui il nome di tiamina che è quello attualmente raccomandato.
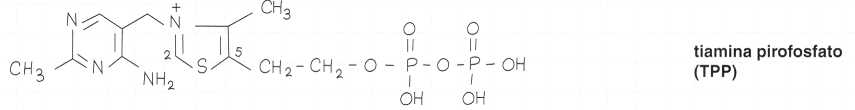
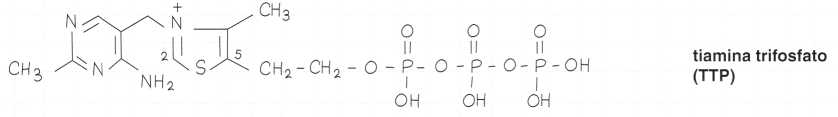
Esistono tre derivati fosforilati: mono, di e trifosfati.
Due sono particolarmente importanti sul piano metabolico:
• il pirofosfato di tiamina, o tiamina-pirofosfato (TPP), o cocarbossilasi, caratterizzato da due gruppi fosfato a livello della catena laterale del carbonio in posizione 5
• il trifosfato di tiamina, o tiamina-trifosfato (TIP), che deriva dal precedente per aggiunta di un terzo gruppo fosfato.
Formule di struttura
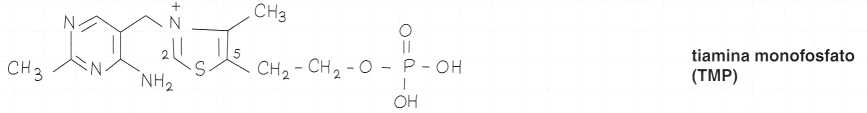
Proprietà Fisico-Chimiche
Sotto forma di cloridrato, la tiamina ha l’aspetto di cristalli bianchi. È inodore quando è assolutamente pura, ma conserva generalmente un odore mattato.
È molto solubile in acqua (1 g/ml), un po’ meno solubile in alcol ed insolubile nei solventi dei grassi: etere, cloroformio, acetone e benzene.
Al riparo della luce e dell’umidità, i sali di tiamina (cloridrato, mononitrato) sono relativamente stabili all’ossigeno dell’aria ed al calore.
La tiamina è stabile in soluzione acida (pH=4), mentre si degrada in soluzione neutra o alcalina.
A 100°C, in mezzo acquoso ed alcalino, si denatura, il che pone un problema di impoverimento dell’alimentazione con certi metodi di preparazione o di conservazione. La tiamina è sensibile all’irradiazione con raggi ultravioletti.
Metabolismo
La sintesi della tiamina può essere effettuata dai vegetali e da alcune specie animali inferiori. Nei mammiferi, ed in particolare nell’uomo, una sintesi parziale può essere realizzata dai batteri intestinali, ma il fabbisogno può essere corretta-mente soddisfatto soltanto grazie alla presenza di tiamina nell’alimentazione. Infatti, la sede di questa sintesi batterica si situa oltre il livello di assorbimento intestinale.
Assorbimento
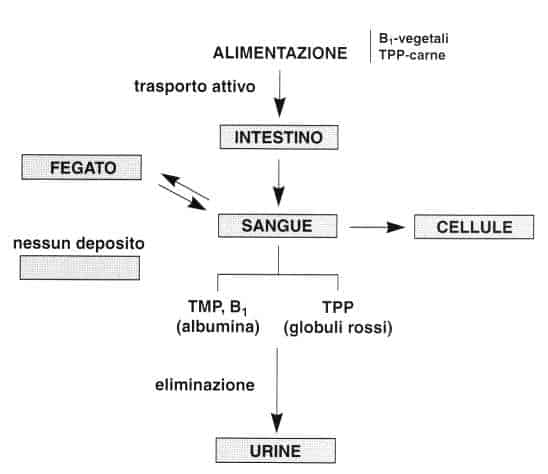
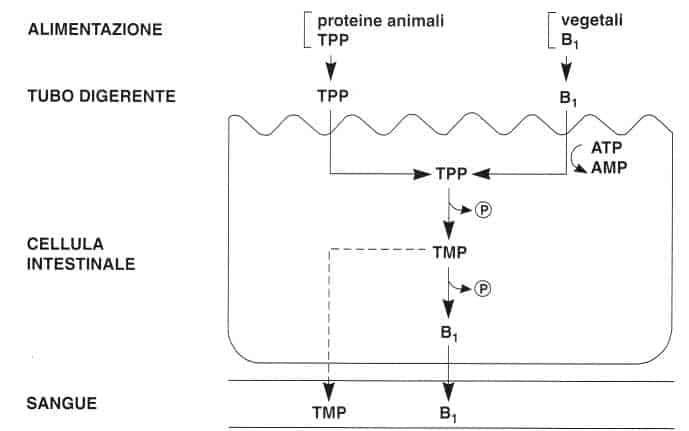
La vitamina B1 degli alimenti si trova principalmente sotto forma di tiamina nei vegetali e in forma fosforilata, legata alle proteine, nei prodotti animali (l’80% come pirofosfato di tiamina).
¦ Sede
L’assorbimento della tiamina avviene principalmente nella parte superiore dell’intestino (duodeno ed intestino tenue prossimale).
Lo stomaco ed il colon ne assorbono solo quantità minime.
¦ Meccanismo
La tiamina può essere assorbita attraverso due diversi meccanismi: il trasporto attivo e la diffusione passiva.
• Il trasporto attivo opera per piccole quantità di tiamina. È di tipo saturabile e permette l’assorbimento della tiamina contro gradiente di concentrazione.
Richiede energia e presenza di sodio e sembra accoppiato ad un processo di fosforilazione/defosforilazione.
La tiamina viene dapprima fosforilata grazie ad una pirofosfochinasi della mucosa intestinale. Quindi, all’interno della cellula intestinale, il pirofosfato di tiamina (TPP) è defosforilato e passa in circolo, principalmente sotto forma di tiamina. Questo meccanismo è prevalente sino a 2,5 mg per assunzione.
• La diffusione passiva interviene per quantità più elevate quando il trasporto attivo è saturato.
Assorbimento della vitamina B1
Distribuzione
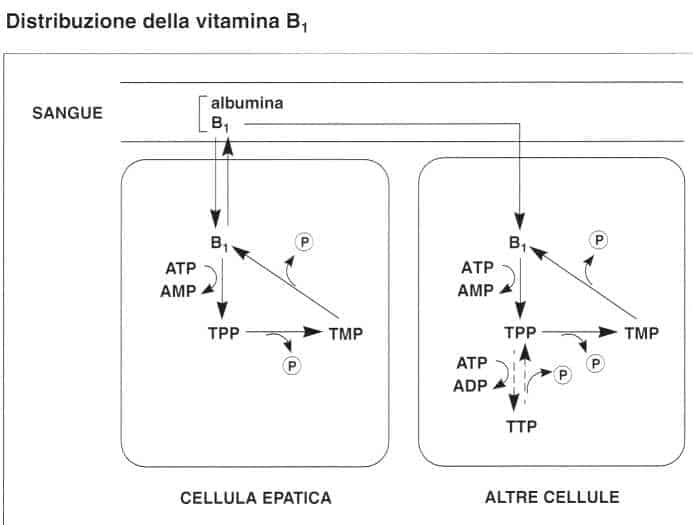
La tiamina è trasportata sino al fegato dalla vena porta. Viene captata dalle cellule epatiche e fosforilata a TPP.
In seguito viene defosforilata, ripassa in circolo sotto forma di tiamina e si diffonde in tutti i tessuti.
• Nel sangue il 90% della vitamina B1 circolante si trova nelle cellule, principalmente sotto forma di TPP.
La concentrazione nei globuli bianchi è dieci volte superiore a quella nei globuli rossi.
Nel plasma si trova tiamina e monofosfato di tiamina (TMP) legati alle proteine (soprattutto all’albumina).
Vitamina B1 nel sangue
| Concentrazione di vitamina (µg/l) | In percentuale della vitamina totale | Principali forme | |
| Siero | 10-62 | 10 | Bi,TMP |
| Globuli rossi | 80 | 80 | TPP |
| Globuli bianchi | 675 | 10 | TPP |
| Sangue | 20-75 | 100 | TPP |
• A livello tissutale, la tiamina è assorbita dalle cellule e trasformata nella sua forma coenzimatica attiva: TPP o cocarbossilasi.
La TPP può, a sua volta, essere fosforilata in trifosfato di tiamina (TTP) e questa forma può, in certi tessuti, rappresentare sino al 10% della vitamina B1.
Queste reazioni sono reversibili ed i diversi composti fosforilati possono essere defosforilati da una fosfatasi.
• Gli organi più ricchi sono il cuore, il rene, il fegato ed il cervello. La concentrazione nei muscoli è più bassa ma rappresenta il 40% del contenuto totale delTor-ganismo a causa della massa muscolare.
Concentrazione di vitamina B1 nei diversi organi
| Concentrazione in mcg/g | |
| Cuore | 2-3 |
| Rene | 1 |
| Fegato | 1 |
| Cervello | 1 |
| Muscolatura striata | 0,5 |
L’intero organismo contiene 25 mg di vitamina B1 di cui meno del 5% sotto forma di tiamina.
Non esiste deposito nemmeno in caso di eccesso di assunzione. Le riserve tissu-tali sono basse e dipendono da un apporto alimentare sufficiente.
In corso di una dieta carente, la diminuzione delle riserve colpisce inizialmente i muscoli. Il cervello è l’ultimo tessuto a perdere le sue riserve.
Eliminazione
Dopo aver svolto il suo ruolo di coenzima, la tiamina viene degradata in diversi metaboliti che sono eliminati per via renale.
Se il consumo giornaliero è scarso, la tiamina viene eliminata sotto forma di composti pirimidinici o tiazolici.
Quando gli apporti aumentano, l’escrezione urinaria aumenta e si vede comparire la tiamina libera, il che evidenzia la limitata capacità dell’organismo di degradare la tiamina.
Nelle feci si trova la tiamina non assorbita nonché quella sintetizzata dalla flora batterica. Piccole quantità di tiamina vengono anche eliminate con il sudore.
Nell’uomo, l’emivita biologica della tiamina è di circa 9-18 giorni.
Fisiologia
Meccanismo d’azione
• La TPP, forma coenzimatica attiva della vitamina B1, ha il ruolo di trasportatore di un gruppo aldeidico legato ad un composto chetonico.
Partecipa alla decarbossilazione ossidativa degli a-chetoacidi nonché alle reazioni di transchetolazione della via dei pentoso-fosfati.
• La TIP ha un ruolo nella neurotrasmissione.
¦ Il coenzima pirofosfato di tiamina (TPP)
• La decarbossilazione ossidativa degli a-chetoacidi
Questa reazione è catalizzata da un complesso polienzimatico mitocondriale a cofattori multipli.
Questo complesso comprende il PAD, il NAD e tre enzimi di cui uno, la decarbossilasi, è legato alla TPP.
La sequenza delle reazioni, detta meccanismo di Breslow, è la seguente:
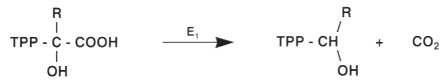
• Prima fase: fissazione dell’a-chetoacido sulla TPP.
L’a-chetoacido si fissa mediante il proprio carbonio a sul carbonio in posizione 2 del nucleo tiazolico;

• Seconda fase: decarbossilazione.
Questa reazione è catalizzata dal primo enzima, l’a-chetoacido decarbossilasi (E]) il cui coenzima è la TPP;
• Terza fase: trasferimento del gruppo aldeidico sull’acido lipoico.
Questa reazione è catalizzata dal secondo enzima, la diidrolipoiltransacilasi (E2):
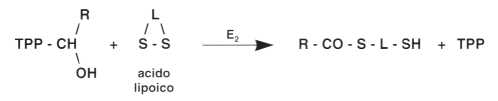
• Quarta fase: trasferimento del gruppo aldeidico sul coenzima A. Questa reazione è catalizzata dallo stesso enzima E2:
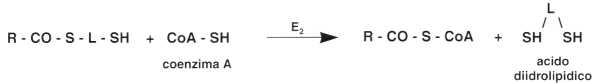
• Quinta fase: la riossidazione dell’acido diidrolipoico.
Questa reazione è catalizzata dal terzo enzima, la lipoamide deidrogenasi (E3):
![]()
• Sesta fase: la riossidazione della FAD da parte del NAD.
FADH2 + NAD –> FAD + NADH2
In queste reazioni, l’acido lipoico fissato sull’enzima E2 funziona come un braccio ruotante. Va a contatto con l’enzima Ej, fissa il gruppo aldeidico, lo trasferisce al coenzima A, quindi si riossida a livello dell’enzima E2.
Per concludere, la reazione può essere scritta nel seguente modo:

L’attività del complesso enzimatico a-chetoacido-decarbossilasi è strettamente regolata da un sistema di fosforilazione/defosforilazione (chinasi/fosfatasi) che attiva o inattiva il primo enzima (Ej).
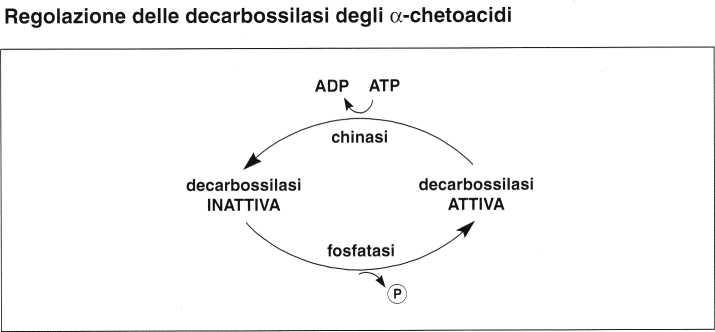
• Le reazioni di transchetolazione della via dei pentoso-fosfati
La reazione di transchetolazione causa il trasferimento di un radicale glicoaldei-dico o chetolico (CH2OH – CHO), di uno zucchero portatore di una funzione chetonica (R1) su un altro zucchero (R2).
La reazione catalizzata dalla transchetolasi (TC) si svolge in due fasi:
• Prima fase: il frasferimenfo del chefolo da R1 sulla TTR
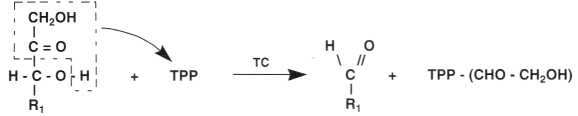
• Seconda fase: il frasferimenfo del chetolo dalla TTP su R1
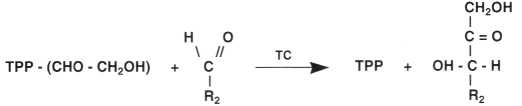
Per concludere, si può schematizzare il trasferimento dei carbonii (C) nel seguente modo:
![]()
Le transchetolasi sono enzimi citoplasmatici presenti in diversi tessuti.
Essi svolgono un ruolo importante nella degradazione degli zuccheri tramite la via dei pentoso-fosfati.
¦ Il neurotrasmettitore trifosfato di tiamina (TTP)
È stato detto che la tiamina, sotto forma di TTP, svolge un ruolo essenziale nella trasmissione nervosa.
La stimolazione nervosa provoca la diminuzione del tasso di TTP e, in minor grado, di TPP con concomitante liberazione di TMP e di tiamina.
Liberata contemporaneamente aU’acetilcolina in corrispondenza della giunzione mioneurale delle fibre colinergiche, ne potenzia gli effetti, verosimilmente tramite inibizione della colinesterasi.
Ruolo metabolico della TPP
Ruolo dei coenzimi tiaminici nel metabolismo
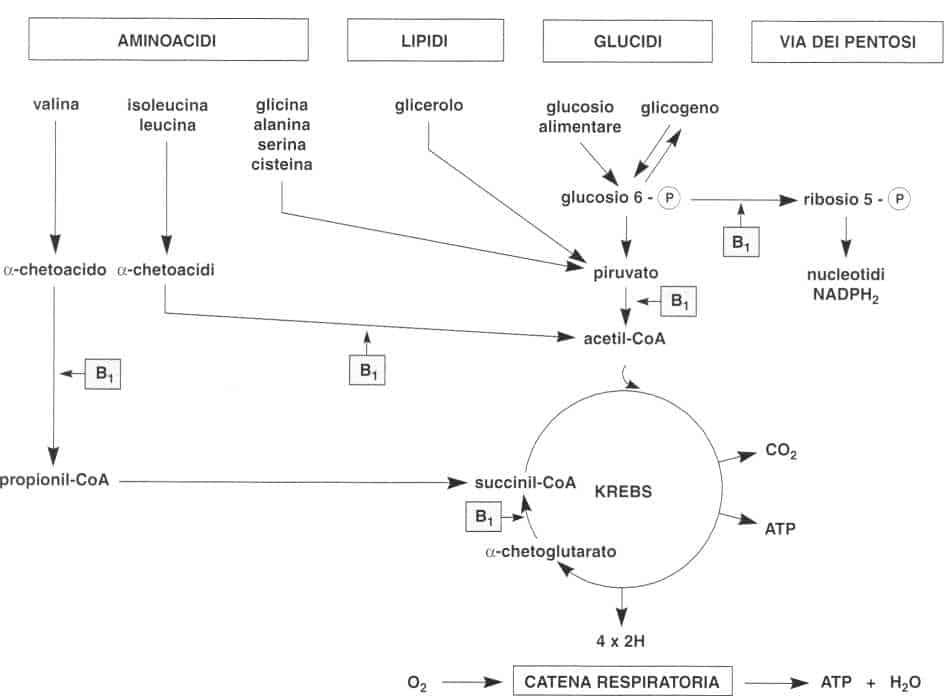
¦ Le decarbossilasi degli a-chetoacidi
La TPP è il coenzima delle decarbossilasi dell’acido piruvico, delTacido a-cheto-glutarico e degli a-chetoacidi provenienti da aminoacidi ramificati.
• La piruvato-decarbossilasi (PD)
Catalizza la seguente reazione:

L’acido piruvico proviene dalla degradazione del glucosio (glicolisi), del glicerolo e di alcuni aminoacidi (glieina, alanina, scrina e cisteina).
L’acetil-coenzima A è un elemento essenziale del metabolismo cellulare. Infatti, può entrare nel ciclo di Krebs dove sarà degradato producendo energia immagazzinata sotto forma di ATP o essere il punto di partenza della sintesi degli acidi grassi e degli steroidi (vedere: vitamina B5, fisiologia).
• L’a-chetoglutarato-decarbossilasi (a-CGD)
Catalizza la seguente reazione:
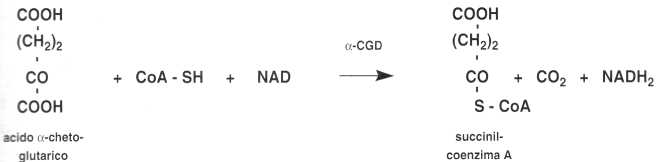
Queste due molecole sono degli intermedi del ciclo di Krebs.
• Le decarbossilasi degli aminoacidi ramificati
Tre aminoacidi ramificati (vaiina, leucina ed isoleucina) sono degradati per questa via. Subiscono una reazione di deaminazione (1) che porta ad a-chetoacidi, quindi una decarbossilazione ossidativa (2) che implica la TPP come coenzima.
Schematicamente le reazioni possono essere scritte nel seguente modo:

| Aminoacido | a-chetoacido | Prodotto della decarbossilazione ossidativa |
| Valina | Acido a-chetoisovalerico | Isobutirrii-CoA |
| Leucina | Acido a-chetoisocaproico | Isovaleril-CoA |
| isoleucina | Acido a-chetometilvalerico | Metilbutirril-CoA |
La leucina e l’isoleucina raggiungono la via dell’acetil-CoA mentre la vaiina rientra nel ciclo di Krebs a livello del succinil-CoA.
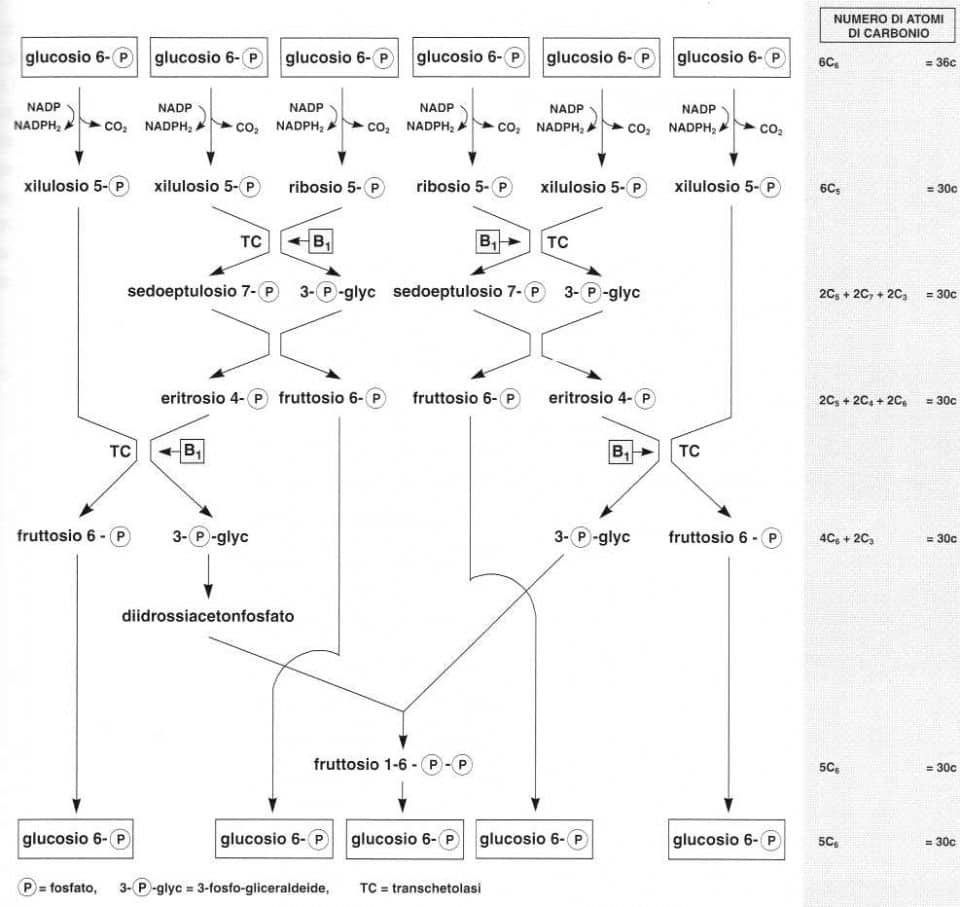
¦ Le transchetolasi
Due reazioni di transchetolazione sono coinvolte nella via dei pentoso-fosfati.
• Sei molecole di glucosio-6-fosfato entrano nel ciclo e sono decarbossilate in sei pentoso-fosfati (zuccheri con cinque atomi di carbonio) e sei CO2.
![]()
Le due reazioni di transchetolazione ridispongono questi sei pentosi (C5) in quattro esosi (C6) e due gliceraldeidi (C3) grazie al trasferimento di unità a due atomi di carbonio (CHO-CH2OH).
Le due gliceraldeidi (C3) produrranno un quinto esoso (C6).
La reazione può essere scritta nel seguente modo:
![]()
come se fosse stata degradata una sola molecola.
• La prima reazione di transchetolazione trasferisce un radicale glicoaldeidico (C2) da un pentoso (C5) su un altro pentoso (C5) secondo la reazione:

• La seconda reazione di transchetolazione trasferisce un radicale glicoaldeidico (C2) di un pentoso (C5) su un eritroso (C4) secondo la reazione:

Per concludere, il bilancio può essere scritto nel seguente modo:
![]()
La via dei pentosi è molto meno efficace della via della glicolisi sul piano energetico.
Tuttavia, piccole quantità di glucosio sono degradate per questa via, in particolare nelle cellule della ghiandola mammaria durante la lattazione nonché nelle cellule della corteccia surrenale, nei leucociti e negli eritrociti.
Permette anche di trasformare alcuni pentoso-fosfati in esoso-fosfati e di reintrodurli nella via di degradazione ossidativa dei glucidi, produttrice di energia. Inoltre, ha un duplice ruolo:
– formazione di NADPH2 che partecipa alla biosintesi degli acidi grassi e degli ormoni steroidei,
– formazione del ribosio 5- (0) che è un precursore degli acidi nucleici del DNA e delTRNA.
Vìa dei pentoso-fosfati
La misurazione dell’attivtà della transchetolasi eritrocitaria viene utilizzata nella diagnosi biochimica della carenza di vitamina B1.
Fonti, Unità, Apporti, Stato
Fonti alimentari
La vitamina B1 è presente in quasi tutti i tessuti animali e vegetali. Molto spesso si trova a bassissime concentrazioni (alcuni decimi o alcuni centesimi di milligrammo). È quindi la totalità degli alimenti consumati che permette di soddisfare i fabbisogni.
Tuttavia, la carne ed il pesce costituiscono per l’adulto una delle principali fonti. La carne di maiale ne è particolarmente ricca.

Secondo recenti studi, l’apporto di vitamina B1, si ripartisce tra le seguenti fonti alimentari:
| Apporto di vitamina | |
| Carne, pesce, uova | da 28% a 40% |
| Pane, cereali, patate | da 21% a 30% |
| Verdura e frutta | da 17% a 24% |
| Latticini | da 14% a 21% |
La solubilità della tiamina e la sua termosensibilità comportano una perdita durante la cottura in acqua.
Queste perdite possono arrivare al 60% del contenuto iniziale. Una parte della tiamina si ritrova nel sugo della carne o nell’acqua di cottura che non sempre vengono consumati.
In assenza d’acqua (fritti, cottura al forno), le perdite sono minori (dal 20% al 30%).
Tenere al caldo gli alimenti e riscaldare degli alimenti già cotti provoca ulteriori perdite. Viceversa, non sembra che i diversi tipi di forno (tradizionale, microonde, …) abbiano un’incidenza sul livello delle perdite.
La surgelazione non sembra avere effetto sul contenuto di tiamina degli alimenti.
Unità
La vitamina B1 viene valutata pesando (mg) il cloridrato di tiamina.
Apporto consigliato
A seconda delle fasce d’età, l’apporto nutrizionale consigliato è da 0,4 a 1,5 mg al giorno.
In caso di apporto glucidico elevato, deve essere aumentato l’apporto di tiamina. Nell’adulto ad esempio, si calcolano 0,5 mg per 1.000 kcal di glucidi.
| mg/giorno | |
| Lattanti | 0,4 |
| Bambini da 1 a 3 anni | 0,7 |
| Bambini da 4 a 9 anni | 0,8 |
| Bambini da 10 a 12 anni | 1,2 |
| Adolescenti, uomini adulti | 1,5 |
| Adolescenti, donne adulte | 1,3 |
| Gravidanza, ailattamento | 1,8 |
| Adulti con consumo energetico elevato | 1,8 |
L’assenza di depositi di riserva di vitamina B1 nell’organismo giustifica la necessità di un apporto quotidiano adeguato.
Stato nutrizionale
• Recenti studi eseguiti in Francia ed in altri paesi industrializzati hanno dimostrato che la tiamina è una delle vitamine i cui apporti alimentari sono giudicati insufficienti: circa un adulto su due riceve apporti di vitamina B1 inferiori a quelli raccomandati. In particolare, dal 30% al 50% delle donne consuma meno di due terzi della quantità raccomandata.
• Questa prevalenza di apporti alimentari insufficienti è confermata dai risultati di studi biochimici (misura dell’attività della transchetolasi eritrocitaria dopo attivazione con pirofosfato di tiamina).
In effetti, circa il 20% degli adulti, tanto uomini quanto donne, presenta un rischio di carenza di tiamina. Questo riguarda anche i bambini e gli adolescenti: dal 6% all’8% secondo lo studio Val-de-Marne 88.
Carenza
Clinica
La carenza di vitamina B1 si manifesta con sintomi generali, neuropsichici e cardiaci.
Si possono osservare quadri clinici diversi in funzione dell’età, del contesto nutrizionale e patologico e dell’evoluzione della malattia.
La sindrome classica di avitaminosi B1, o beri-beri, è eccezionale nei paesi industrializzati mentre le forme non conclamate sono probabilmente sottostimate.
¦ Il beri-beri tipico
• Nell’adulto
Le manifestazioni cliniche cominciano con segni generali: astenia, anoressia, stitichezza.
Si possono osservare anche segni di neuropatia periferica che si manifesta inizialmente con debolezza muscolare degli arti inferiori.
Le manifestazioni psichiche sono frequenti: depressione, irritabilità, disturbi della memoria.
Se la diagnosi non viene effettuata in questo stadio, compare il quadro classico del beri-beri che può presentarsi sotto tre diverse forme a seconda della predominanza delle manifestazioni.
La forma secca con danno neurologico periferico
La polineurite che caratterizza le forme secche si manifesta all’inizio con disturbi dell’andatura dovuti ad una paresi predominante degli estensori.
La paresi evolve in seguito verso una paralisi flaccida, simmetrica, complicata rapidamente da disturbi trofici e della sensibilità. I riflessi tendinei tendono a scomparire.
La forma umida con danno cardiovascolare
Il danno cardiaco è caratterizzato da miocardite associata a tachicardia, dispnea da sforzo, palpitazioni e talvolta dolori precordiali.
Possono essere presenti segni periferici di insufficienza cardiaca destra sotto forma di edemi. Si tratta di un’insufficienza cardiaca ad alta portata.
Le indagini radiologiche dimostrano una cardiomegalia omogenea. L’ elettrocardiogramma rivela in generale alterazioni meno importanti di quanto non si sarebbe supposto sulla base del quadro clinico e radiologico: tachicardia con aumento dell’intervallo Q-T, appiattimento o inversione dell’onda T.
Una delle caratteristiche di questa insufficienza cardiaca è quella di resistere ai cardiotonici e di rispondere solo alla vitaminoterapia specifica.
Il quadro clinico può variare dalla forma cronica alla forma acuta, detta Shoshin, che è fatale se non si istituisce con estrema rapidità il trattamento.
In pratica, le due forme, secca ed umida, di beri-beri sono spesso associate.
Il beri-beri cerebrale con danno neurologico centrale
Questa forma è anche nota con il nome di encefalopatia di Gayet-Wernicke.
Le manifestazioni cliniche associano segni neurologici e psichici.
– I segni psichici consistono in disorientamento spaziotemporale, apatia, confusione mentale e torpore.
– I segni neurologici consistono in disturbi dell’equilibrio di tipo cerebellare, nistagmo, paralisi dell’oculomotore, astenia muscolare intensa ed areflessia tendinea.
In assenza di trattamento, l’encefalopatia di Gayet-Wernicke può evolvere verso la comparsa della sindrome di Korsakoff che consiste in disorientamento, amnesia anterograda e polineurite. La sindrome di Korsakoff è irreversibile.
• Nel neonato
La forma infantile colpisce soprattutto il bambino da due a sei mesi. All’inizio, si osservano segni generali: anoressia, dimagramento, disturbi del sonno associati ad ipertonia muscolare.
Quindi sopravviene improvvisamente insufficienza cardiaca acuta con tachicardia, dispnea e cianosi.
La radiografia toracica evidenzia cardiomegalia e l’elettrocardiogramma presenta voltaggio ridotto.
L’evoluzione è molto rapida e può portare alla morte in dodici-ventiquattro ore se non si istituisce il trattamento.
¦ Le forme non conclamate
Nei paesi industrializzati, le carenze tipiche sono rare. Tuttavia, le forme non conclamate sono probabilmente più frequenti di quanto non si creda.
Il carattere aspecifico dei sintomi rende difficile la diagnosi. La conoscenza che un soggetto appartiene ad un gruppo a rischio deve far sospettare la diagnosi di fronte alla manifestazione inspiegata di alcuni segni: astenia, anoressia, irritabilità, confusione mentale.
Fisiopatologia – Epidemiologia
La carenza di tiamina può risultare da diverse cause:
• difetto di apporto,
• disturbo dell’assorbimento intestinale,
• aumento del fabbisogno,
• aumento dell’eliminazione.
Questi fattori possono essere associati a seconda delle circostanze.
¦ Paesi in via di sviluppo
Il beri-beri tradizionale è diffuso essenzialmente nei paesi del Sud-Est asiatico. È dovuto ad un’alimentazione poco variata a base di prodotti altamente raffinati (farina bianca o riso brillato).
Questi alimenti, che costituiscono la base dell’alimentazione, sono impoveriti di tiamina durante la loro preparazione. Questa situazione porta quindi ad una carenza di apporto di vitamina B1.
Un altro meccanismo può intervenire come ulteriore fattore di rischio nelle popolazioni che consumano pesce crudo. La carne di alcuni pesci contiene una tiami-nasi che distrugge la tiamina di origine alimentare e crea un specifico meccanismo di carenza di tipo antivitaminico.
Il beri-beri rimane una causa importante di mortalità perinatale in questa parte del mondo. Lo si osserva nel bambino allattato al seno da madre carente di vitamina B1.
¦ Paesi industrializzati
Nei paesi industrializzati, le manifestazioni cliniche della carenza di tiamina compaiono in circostanze del tutto particolari.
• L’alcolismo cronico
Questa è di gran lunga la causa più frequente di carenza. Diversi meccanismi possono essere coinvolti nella comparsa della carenza.
Il principale è una diminuzione degli apporti in quanto alcuni alcolisti hanno un’alimentazione totalmente squilibrata in cui l’alcol costituisce talvolta la principale fonte di apporto energetico. In effetti, le manifestazioni cliniche carenziali si osservano più spesso negli alcolisti malnutriti.
Altri meccanismi possono associarsi:
– diminuzione dell’assorbimento dovuta alle alterazioni gastro-intestinali frequenti nell’alcolista,
– alterazioni del metabolismo della tiamina, in quanto l’epatopatia alcolica ha come conseguenza una diminuzione della trasformazione in coenzima attivo (TPP),
– aumento del fabbisogno dovuto al catabolismo cellulare dell’alcol in cui interviene un enzima vitamina B1 – dipendente: l’alcool-deidrogenasi.
Si vede quindi che la somma di diversi meccanismi può condurre all’instaurarsi di una carenza.
Diversi studi hanno dimostrato che dal 20% al 73% degli alcolisti cronici presenta uno stato di carenza marginale.
Tra gli alcolisti ricoverati in ospedale, dal 3% al 12% presenta segni clinici di encefalopatia di Gayet-Wernicke. Tra quelli ricoverati per problemi cardiaci, nel 10% dei casi esiste un beri-beri cardiovascolare.
Dal 21% al 31% degli alcolisti cronici presenta una neuropatia periferica. L’eziologia è mista, tossica e nutrizionale: ruolo dell’alcool stesso, carenza di vitamina B1 (ma anche di altre vitamine del gruppo B), deficit proteico, eccesso di carboidrati.
• Il malassorbimento cronico
Le diarree croniche e le coliti di tipo ulcerativo provocano un difetto di apporto.
• Le persone anziane
Il rischio principale è la carenza di apporto che può essere all’origine di disturbi del comportamento, vale a dire confusione mentale acuta del tipo dell’encefalopatia di Gayet-Wernicke.
Alcuni studi hanno dimostrato stati carenziali nel 7%-17% delle persone anziane. Il rischio sembra tanto più elevato quanto più queste persone vivono sole o in un ambiente psichiatrico o geriatrico.
• La nutrizione parenteraie non integrata
Anche questa costituisce una situazione di possibile carenza a causa di due meccanismi principali.
– Un’assenza di apporto in caso di nutrizione parenteraie che abbia escluso per errore la tiamina e che realizza quindi una vera e propria carenza sperimentale.
– Un aumento del fabbisogno se si usano perfusioni di soluzioni glucosate, in quanto il metabolismo del glucosio consuma la tiamina (vedere: Metabolismo).
In queste situazioni si sono osservate encefalopatia di Gayet-Wernicke e acidosi lattica.
Questa patologia iatrogena dovrebbe scomparire a condizione di integrare sempre con vitamina B1 la nutrizione parenteraie nonché i soggetti a rischio di carenza che ricevono perfusioni di soluzioni glucosate.
• Le malattie genetiche
Esistono alcuni casi eccezionali di malattie genetiche del metabolismo vitamina B1-dipendenti.
Se ne conoscono attualmente quattro tipi, ma il loro meccanismo fisiopatologico non è ancora ben chiaro.
Le leucinosi tiamina-sensibili
Queste anomalie interessano la decarbossilazione ossidativa di tre a-chetoacidi provenienti dalla transaminazione degli aminoacidi ramificati (leucina, isoleucina e valina).
Provocano un accumulo di questi aminoacidi e dei loro corrispondenti a-chetoacidi nel sangue e nelle urine, che hanno un odore caratteristico di sciroppo di acero.
Il deficit completo porta al decesso nei primi giorni di vita.
Il deficit parziale si manifesta con ritardo mentale, atassia e chetoacidosi nel corso dei primi due anni di vita.
Sono stati descritti una decina di casi. L’incidenza è di un caso su 250.000 nascite e la trasmissione è autosomica recessiva.
La forma classica è insensibile alla vitamina B1 ma, in alcuni casi, la tiamina previene gli attacchi di chetoacidosi a dosi da 10 a 100 mg/giorno.
In un caso, è stata dimostrata una diminuzione di affinità dell’enzima per la vitamina B1.
Le acidosi lattiche tiamino-sensihili
Sono stati descritti alcuni casi di anomalia del complesso piruvato-deidrogenasi sensibili alla tiamina.
Le manifestazioni cliniche compaiono ad età variabili (dalla nascita agli otto anni) e consistono in ritardo mentale, atassia e convulsioni.
Le dosi di tiamina necessarie sono molto elevate (da 250 a 1.800 mg/giorno). 11 meccanismo fisiopatologico è sconosciuto.
L’encefalopatia necrotizzante subacuta di Leigh-Feigin-Wolf
Questa sindrome corrisponde a deficit metabolici multipli (piruvato-carbossilasi e deidrogenasi, citocromo-C-ossidasi, biotinidasi, …). La trasmissione sembra essere di tipo autosomico recessivo.
Esistono alcune similitudini cliniche e biochimiche con l’encefalopatia di Gayet-Wernicke.
La somministrazione di dosi elevate di tiamina ha portato, in alcuni casi, ad un miglioramento.
Alcuni autori hanno descritto l’esistenza di un inibitore della fosforilazione della TPP a TTP nel sangue, nel liquido cefalo-rachidiano e nelle urine.
L’anemia megaloblastica tiamina-dipendente
In sei bambini è stata descritta una sindrome che associa anemia megaloblastica, sordità, diabete, manifestazioni neurologiche e cardiache simili al beri-beri. La trasmissione sembra di tipo autosomico recessivo.
L’anemia compare nel primo anno di vita e rimane insensibile alle vitamine B6, B9 e B12
Le manifestazioni cliniche regrediscono dopo somministrazione di tiamina (da 20 a 50 mg/giorno).
In alcuni casi, è stata evidenziata un’anomalia del trasporto transmembrana della tiamina, in particolare a livello delle cellule intestinali e dei globuli rossi.
Per quanto eccezionali, queste affezioni costituiscono un modello unico di studio delle conseguenze metaboliche e cliniche dell’interruzione di una delle vie del metabolismo tiamina-dipendente.
Diagnosi di Carenza
Le manifestazioni cliniche tipiche di carenza sono rare.
Nella maggior parte dei casi la diagnosi è sospettata quando si manifestino sintomi aspecifici in un individuo appartenente ad un gruppo a rischio. Quest’ipotesi merita una conferma con esami biochimici.
La determinazione dello stato biologico può essere effettuata mediante metodi diretti che dosano la tiamina nel sangue o nelle urine e mediante esami funzionali che analizzano le conseguenze biochimiche della carenza.
Dosaggi diretti
• Dosaggi ematici
La tiamina e le sue forme fosforilate sono dosate nel sangue.
I risultati sono i seguenti:
| Tiamina µg/l | Tiamina fosforilata µg/l | Tiamina totale µg/l | |
| Livelli nel sangue | 12 | 35 | 47 |
Dato che i globuli rossi contengono l’80% della tiamina del sangue, i risultati devono essere interpretati in funzione dell’ematocrito.
• Dosaggio urinario
L’escrezione urinaria di tiamina va da 150 a 300µg/24 ore.
Varia in funzione dell’alimentazione e riflette gli apporti recenti più che lo stato di saturazione tissutale.
Esami funzionali
• Dosaggio del piruvato e del lattato nel sangue
Poiché la tiamina è il coenzima della piruvato-decarbossilasi, si può immaginare che una carenza comporti un accumulo di piruvato ed acidosi lattica.
In realtà, questi segni non sono né specifici né costanti.
• Attivazione della transchetolasi eritrocitaria
Questo è il miglior test biochimico per valutare lo stato della vitamina B1 ed un buon indicatore dell’attività enzimatica tissutale.
Si tratta di un dosaggio indiretto della tiamina tramite determinazione dell’attività di un enzima eritrocitario vitamina B1-dipendente. Si misura, su sangue intero emolizzato, la scomparsa del substrato o la comparsa del prodotto formato dalla reazione, prima e dopo l’aggiunta di TPP.
In caso di carenza, l’aggiunta di TPP comporta un notevole aumento dell’attività dell’enzima. L’aumento percentuale rispetto all’attività di partenza viene usato come indicatore.
In situazioni normali, l’aggiunta di TPP provoca un’attivazione inferiore al 15%. L’attività della transchetolasi eritrocitaria è il primo parametro interessato da una carenza di tiamina.
Molto prima della comparsa dei segni clinici, questo è l’esame più specifico e più sensibile.
Interpretazione dei risuitati biochimici secondo diversi autori
| Tiamina totale nel sangue µg/l | Tiamina urinaria (adulto) mcg/24 h | Attivazione deila transchetolasi eritrocitaria % | |
| Normale | 47 | > 100 | < 15 |
| Marginale | 30-47 | 40-100 | 15-25 |
| Carente | <30 | <40 | >25 |
Test terapeutico
Un buon mezzo diagnostico è la regressione rapida della sintomatologia durante il trattamento vitaminico.
Questo è particolarmente importante nelle forme acute, in cui la gravità della prognosi non consente di attendere i risultati dei dosaggi biochimici.
Farmacologia
Proprietà farmacologiche
• Mentre le proprietà biochimiche della vitamina B1 ai quantitativi nutrizionali sono ben definite, meno bene si conoscono i meccanismi della sua attività farmacologica specifica a dosaggi terapeutici. Infatti, per la loro anzianità, le indicazioni corrispondenti non sempre hanno potuto essere confermate con sperimentazioni cliniche controllate.
• Quando la tiamina viene somministrata a dose terapeutica per via endovenosa, può provocare transitoriamente una leggera vasodilatazione ed una caduta della pressione arteriosa.
A dosi molto elevate, si può osservare un blocco della trasmissione dell’impulso nervoso a livello della placca neuro-motoria ed un effetto curarizzante.
Per quanto partecipi direttamente al metabolismo dei carboidrati, la tiamina non modifica la glicemia (anche a dosi elevate).
Interazioni alimentari e farmacologiche
Esiste una tiaminasi termosensibile nella carne di alcuni pesci. Questa può avere un effetto antivitaminico se i pesci sono consumati crudi.
La tiamina è instabile in ambiente alcalino. Occorre quindi evitare di somministrarla in questo tipo di soluzione.
Viene spesso osservata carenza di tiamina nei pazienti affetti da tumore trattati con 5-fluoro-uracile (5FU).
Incidenti e complicanze
La tossicità della tiamina è molto bassa. Dosi molto elevate sono state somministrate nell’animale e nell’uomo per parecchie settimane senza effetti secondari.
In casi assolutamente eccezionali, sono state descritte reazioni di tipo allergico, più spesso in seguito ad iniezioni endovenose di dosi di circa 100 mg. Tuttavia, le complicanze hanno potuto essere collegate, per la maggior parte, alla presenza di impurità nelle soluzioni e non al principio attivo stesso, e la realtà dello “shock tiaminico” è attualmente molto contestata.
Tuttavia nella pratica, rimane preferibile praticare l’integrazione per via orale, ogni volta che sia possibile.
Indicazioni e Controindicazioni
Indicazioni
¦ Trattamento terapeutico
• La polineurite carenziale
Il trattamento comincia per via intramuscolare alla dose di 100-500 mg al giorno, prosegue poi per via orale.
Occorre associare una rieducazione motoria per limitare le sequele dovute ai disturbi trofici ed alle retrazioni tendinee.
Il trattamento deve essere protratto per almeno tre mesi, in quanto i risultati terapeutici sono lunghi da ottenere.
Nel caso di polineurite su base alcolica, il trattamento per via intramuscolare sarà ancora più lungo a causa dei frequenti disturbi dell’assorbimento digestivo.
• L’encefalopatia di Gayet-Wernicke
Si tratta di un’urgenza terapeutica in quanto, in assenza di trattamento, essa evolve verso la sindrome di Korsakoff che è poco sensibile alla vitaminoterapia.
Si eviterà qualsiasi perfusione di soluzioni glucosate prima del trattamento vitaminico a causa del rischio di aggravamento del quadro clinico. Occorre somministrare la tiamina per via parenterale (intramuscolare o endovenosa) alla dose di 500 – 1.000 mg al giorno.
Il trattamento è rapidamente efficace con regressione della sintomatologia in 24 ore. Il proseguimento del trattamento avverrà per via orale.
• Sindrome di Korsakoff
Un trattamento con vitamina B1 deve essere sistematicamente tentato, ma questa sindrome è molto spesso poco sensibile al trattamento in quanto le modifiche cellulari indotfe sono irreversibili.
• La miocardite
La forma acuta (il Shoshin beri-beri) costituisce un’urgenza terapeutica. In effetti, resiste ai cardiotonici e soltanto la vitaminoterapia specifica è efficace in tempi molto brevi.
Questa è una delle indicazioni che richiedono talvolta l’utilizzo della via venosa.
• L’acidosi lattica
Sono stati osservati casi di acidosi lattica, talvolta gravi, durante la nutrizione parenterale senza tiamina e negli alcolisti cronici.
L’acidosi risponde in modo spettacolare alla somministrazione di 500 mg – 1 g di tiamina per via intramuscolare.
• La nevrite ottica retrobulbare
Viene spesso osservata in soggetti etilisti-tabagisti. La sua eziologia può essere tossica e carenziale.
Regredisce molto lentamente (da sei ad otto mesi) con trattamento che associa vitamine del gruppo B comprendente le vitamine B1 e B12
• Le malattie ereditarie del metabolismo
Le dosi di tiamina necessarie per la correzione delle diverse anomalie genetiche sono molto variabili da un caso all’altro. Tuttavia, queste affezioni hanno in comune la necessità di una supplementazione continuativa.
¦ Trattamento preventivo
La prevenzione della carenza di tiamina si basa su un’alimentazione equilibrata. Tuttavia, in alcune situazioni particolari, è giustificato un trattamento preventivo.
• La nutrizione parenterale
Per evitare la comparsa di acidosi lattica o di encefalopatia di Gayet-Wernicke, è necessaria un’integrazione.
La dose raccomandata nell’adulto è di circa 0,02 mg/kg/giorno.
• L’alcolista
L’alcolismo costituisce una situazione a rischio di carenza e la tiamina è indicata a titolo preventivo in caso di disintossicazione, delirium tremens, perfusione di soluzioni glucosate o in corso di anestesia.
Più in generale, la tiamina deve essere prescritta a tutti gli alcolisti che presentino un’affezione intercorrente o una sintomatologia mal definita.
In effetti, l’iniezione intramuscolare di 500 mg di tiamina mette al riparo dallo scompenso improvviso di una carenza cronica.
• Il malassorbimento
Il malassorbimento cronico può provocare una carenza anche quando l’apporto alimentare è normale.
• Le persone anziane
Queste persone possono richiedere un’integrazione prolungata di vitamina B1, associata ad altre vitamine, in particolare in caso di denutrizione o di patologie acute.
• L’integrazione alimentare
L’integrazione delle farine è praticata in parecchi paesi (Inghilterra, USA, Australia, Sud-Est Asiatico).
Questa integrazione è stata valutata nelle Filippine ed in Giappone. Si è dimostrata efficace.
Negli Stati Uniti, l’incidenza di beri-beri è largamente regredita dopo la sua attuazione.
Alcuni autori hanno addirittura previsto di integrare le bevande alcoliche e pensano che questa misura sarebbe economicamente proficua.
¦ Usi abituali
• L’uso della vitamina B1 è proposto:
– nell’alcolista, in particolare in caso di polineurite,
– in altre polineuriti di ipotizzata origine tossicocarenziale.
• La vitamina B1 è anche usata, a dosi elevate, da sola o associata alle vitamine Bg e Bi2, in alcune sindromi dolorose, in particolare in reumatologia o in neurologia.
Controindicazioni
Non esistono controindicazioni assolute. Data l’assenza di effetti secondari, la tiamina può essere prescritta al minimo dubbio diagnostico.
Soltanto l’iniezione endovenosa deve essere valutata prudentemente, in caso di somministrazione di dosi elevate, e riservata alle situazioni d’urgenza. Si preferirà usare la perfusione continua a goccia lenta.
Ricerche attuali
Le ricerche attuali sono orientate verso la migliore comprensione del meccanismo fisiopatologico delle anomalie ereditarie del metabolismo tiamina-dipen-dente.
Potrebbe inoltre esistere una suscettibilità genetica alla comparsa dell’encefalopatia di Gayet-Wernicke, in quanto alcuni pazienti hanno una diminuzione di affinità della transchetolasi per la TPP.
È anche stata osservata una diminuzione dell’attività del complesso piruvato-deidrogenasi nel cervello dei pazienti colpiti dal morbo di Alzheimer.
Conclusioni
La vitamina B1 è il coenzima delle transchetolasi e di alcune decarbossilasi.
Svolge un ruolo nel metabolismo dei glucidi, di alcuni aminoacidi ed a livello del ciclo di Krebs.
Le manifestazioni cliniche carenziali tipiche sono rare e si manifestano in contesti particolari: alcolismo cronico, nutrizione parenterale non integrata.
Viceversa, le forme non conclamate sono probabilmente più frequenti di quanto non si pensi, in particolare negli alcolisti cronici. In questi pazienti, qualsiasi sintomatologia neurologica o cardiaca mal definita dovrebbe far procedere alla somministrazione di tiamina.
Indice delle monografie sulle Vitamine:
- Le Vitamine: generalità
- Vitamina A o Retinolo (beta-carotene)
- Vitamina B1 o Tiamina
- Vitamina B2 o Riboflavina
- Vitamina B5 (Acido Pantotenico)
- Vitamina B6 (Piridossina)
- Vitamina B8 o Vitamina B7 o Vitamina H (Biotina)
- Vitamina B9 (Acido Folico)
- Vitamina B12 (Cobalamina)
- Vitamina C (Acido Ascorbico)
- Vitamina D (Colecalciferolo)
- Vitamina E (Tocoferolo)
- Vitamina PP o Vitamina B3 (Niacina)


