Veratro Bianco e Veratro Verde
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
I – Veratro bianco.
Veratrum album L. (non Michaux) – Fam. Gigliacee/Colchicee/Veratree)
(Sin. – Helleborus sive Veratrum album Black. Dod. – Helleborus albus Fuch.).
(Da non confondere con gli Helleborus p.d., delle Ranuncolacee).
II –Veratro verde(Americano).
(Veratrum virideAlton. – Fam.Liliacee/Veratree)
(Sin. –Helonias viridisBot. Mag. Questa pianta è anche elencata col nomeVeratrum albumMichaux. e non va confusa colVeratrum albumdi Linneo. Non va confusa anche con l’Helleborus viridisL. delle Ranuncolacee/Elleboree, nostrale).
Veratro Bianco e Veratro Verde- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

I – Veratro bianco.
Etimologia – Veratrum, da vere = veramente e atrum = nero, allusione al colore della radice.
Secondo altri la pianta era usata per purgare l’umor nero dei melanconici (dal greco melagcolikos da melanw = divenire nero (Lemery).
album, per i fiori biancastri internamente, verdicci all’esterno.
Helleborus – Nome usato da Virgilio (Georg. III, 451) da elein =
far perire, uccidere e bora = pasto. Pianta che, mangiata, fa morire. Ha origine orientale, dal semitico helibar o helebar = rimedio contro la follia e proviene da Anticira (antica Focide, Grecia) dove cresceva abbondante l’elleboro, che si credeva guarisse dall’insania (donde il consiglio di Orazio «naviget Anticyram» = vada (a curarsi) ad Anticira).
Nomi volgari – Velatro (antiq.), giglio verde, elabro bianco, condisi (tosc.), luxerciu, veleno da pighoeggi, dragu (lig.), varaso, vrairo, vrar, sabadiglia, (non confondere con lo Schoenocaulon officinale Asa Gray), aulero, ecc. (piem), veladro, falò, faller, belàer (lomb.), falagro, giavardo, sabadilla nostrana, sabadilion, regòss (ven.), cimirice (friul.), flabò, lauscià, Sgiarvoi, ecc. (Gamia).
Weisse Nieswurzel (ted.), thè white hellebore (ingl.), hellebore blanc, varaire, vrairo, varaso (fr.), vedegambre blanco, ballestea bianca, hierba ballestea, surbia, hierba des ballesteros (spagn.), fehér zàszpa (ungh.).
Habitat – Europa (Pirenei, Cevenne, Plateau central, Vosgi, Giura e regioni temperate), Caucaso, Siberia, Giappone. In Italia nei prati umidi e paludosi delle Alpi e Appennini, infestante dei pascoli sino a 2600 s. m. (zona montana e subalpina). Esistono specie affini: Veratrum Lobelianum Bernh. (Alpi e zona pedemontana), coi fiori verdi (da alcuni AA. considerata varietà dell’album); Veratrum nigrum L. (Alpi or. e centr., Appennino sino all’Abruzzo, Campania), coi fiori brunastri o rosso bruni.
Pianta erbacea perenne.
Parti usate – II rizoma, raccolto in autunno.
II –Veratro verde.
Etimologia– Veratrum(vedi Veratro bianco).
viridis,per i fiori verdi.
Helonias,dal grecoelos=palude, stagno, pratoeneomai=venire,cioè cheviene nei prati paludosi.
Questo nome indica anche un genere di Giuncacee (Reichenbach).
Nomi volgari–American White Hellebore (ingl.), varaire verte, ellebore veri (fr.). indian poke (America).
Habitat– Canada (boschi umidi e savane del Quebec e Ontario) U.S.A. (Illinois, Michigan, Carolina/n., Virginia).
Parti usate–Il rizoma.
Componenti principali
Le basi alcaloidiche sinora isolate dal Veratrum album e dal Veratrum viride Ait. sono classificate nei tre seguenti gruppi:
1) alcammine libere (veratramina, rubiiervina, isorubiiervina, iervina e germina);
2) glucoalcaloidi, cioè alcammine in forma glucosidica (veratramina o iervina o isorubiiervina + D-glucosio);
3) esteri, che sono alcammine in forma esterificata e che per idrolisi producono L’alcammina — zigadenina o protoverina o germina — ed acidi organici (acidi acetico, metilbutirrico, ossimetilbutirrico, diossi-metilbutirrico, ossimetilacetossibutirrico, angelico, veratrico).
Gli alcaloidi estratti dal Veratrum album L. e dal V. viride Ait. sono stati in un primo tempo erroneamente identificati con quelli estratti dallo Schoenocaulon officinale A. Gray (Sabadilla). Le prime ricerche sistematiche dei componenti di queste tre Liliacee sono state fatte da Wright e Luff nel 1878-1879 per la Sabadilla (1) e nel 1879 per il Veratro bianco (2) e per il V. verde (3). In seguito, dopo la relazione di Salzberger (4), che nel 1890 comunicò di avere isolate la protoveratrina e la protoveratridina, trascorsero circa 50 anni prima dell’inizio di nuove intense ricerche sulla composizione chimica dei Veratrum. L’avvio agli studi, che dovevano condurre all’isolamento ed all’identificazione dei numerosi componenti oggi noti, fu dato nel 1937 dai lavori di Poethke (5) (6) (7), seguiti da quelli di Jacobs e Craig (8-11) nel 1942, che valsero a migliorare i processi di estrazione e di purificazione degli alcaloidi. Successivamente, negli ultimi 25 anni, alla determinazione dei componenti alcaloidici del Veratro hanno contribuito le ricerche di parecchi gruppi di studiosi e principalmente di Saito e coll. (12-14), di Seiferle, Johns e Richardson (15), di Fried e coll. (16) (17), di Klohs e coll. (18-23), di Myers e coll. (24-27), di Stoll e Seebeck (28-31), di Nash e Brooker (32), di Kupchan e coll. (33) (34), di Tsukamoto e coll. (35) (36), di Tomko, Dvorakova, Bauer e Mokry (37) (38) e di Shimizu, Suzuki e coll. (39-45).



1) Alcammine
Dai rizomi di varie specie di Veratrum sono state isolate anche alcammine libere (v. tabella 1), ma è dubbio se esse siano veramente presenti nelle droghe esaminate o se invece si formino, come derivati secondari dalla idrolisi enzimatica o chimica degli alcaloidi, durante i processi di estrazione.
2) Glucoalcaloidi
Veratrosina, C33H49O7N, che per idrolisi acida produce D-glucosio e l’aglucone veratramina, C27H39O2N, è stata isolata da Jacobs e Craig (10) dalle radici e dai rizomi del Veratrum viride Ait.
Pseudoiervina, C33H49O8N, è stata trovata da Wright e Luff (2) per la prima volta nei rizomi del Veratrum album L. (2) e poi da Wright (3) anche da quelli del V. viride Ait, Per idrolisi acida si scinde con formazione di D-glucosio e isoiervina, C27H39O3N (10), ma l’aglucone originale deve essere la iervina, poiché il suo diidroderivato per scissione idrolitica produce diidroiervina e non diidroisoiervina (57a).
Isorubiiervosina, C33H53O7N, isolata dai rizomi del Veratrum eschscholtzii A. Gray (18) (21), per idrolisi produce D-glucosio ed isorubiiervina, C27H43O2N (21), l’alcammina già ottenuta del V. album da Jacobs e Craig (9).
3) Esteri
a) Esteri della zigadenina
Zigacina, C29H45O8N, è un O(3)-monoacetilderivato della zigadenina, ottenuta originariamente da Kupchan, Lavie e Zonis (58) dal Zygadenus venenosus. E’ stata poi isolata da Shimizu anche dal V. album var, grandiflorum Loes. (41) (44) e dal V. oxysepalum Turcz. (45),
Angeloilzigadenina, C32H49O8N, è stata estratta dal Veratrum album stamineum Maxim. (40) (59 ).
Veratroilzigadenina, C36H51O10N, originalmente isolata da Kupchan e Deliwala (60) (61) dal Zygadenus venenosus, è stata in seguito estratta da Stoll e Seebeck (30) anche dal Veratrum album L. e da Klohs e coll. (23) dal V. eschscholtzii Gray. Per idrolisi alcalina a caldo la veratroilzigadenina dà come prodotti di scissione pseudozigadenina e acido veratrico (61), mentre per idrolisi alcalina a freddo dà, oltre all’acido veratrico, l’alcammina originale, zigadenina C27H43O7N (30), già isolata da Heyl ed Herr (62) dal Zygadenus venenosus.
b) Esteri della germina
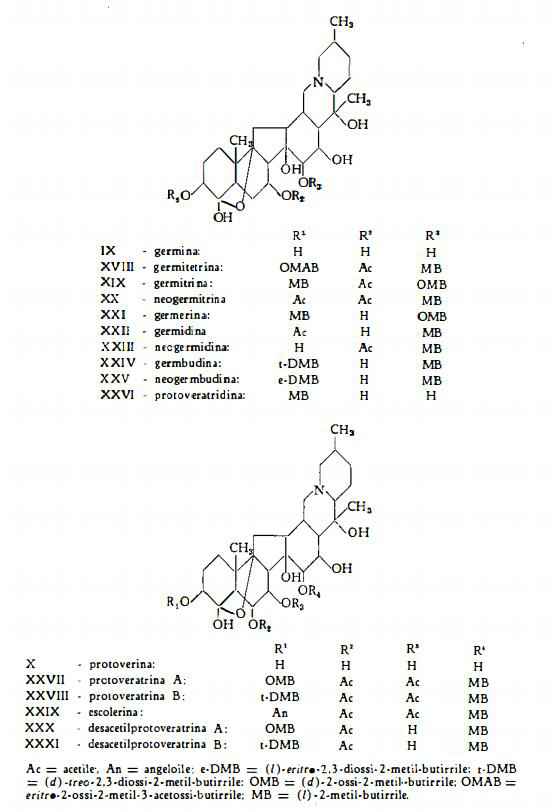
Germitetrina (germitetrina B), C41H63O14N, che, scissa per idrolisi, dà germina e gli acidi acetico, (l)-2-metil-butirrico ed eritro-2-ossi-2-metil-3-acetossi-butirrico (27) (32) (63), è stata estratta dai rizomi del Veratrum album (27) (32) (33) (50) e da protoveratrina commerciale (64).
Germitrina, C39H61O12N, è stata ottenuta insieme alla germidina dal Veratrum viride Ait. da Fried e coll. (16). L'idrolisi alcalina dell’estere dà germina e gli acidi acetico, (l)-2-metil-butirrico e (d)-2-ossi-2-metil-butirrico (16) (65).
Neogermitrina, C36H55O11N, originalmente estratta dal Veratrum viride (17) (26) (34), è stata ottenuta anche dal V. album (33). E’ l’estere della germina con gli acidi acetico (2 mol.) e (l)-2-metil-butirrico (17) (65).
Germerina, C37H59O11N, già separata da Poethke (5-7) da una miscela di basi ricavate dal V. album, è stata recentemente isolata anche dal V. viride Ait. (16) (17) (24) (26) (34). L’idrolisi alcalina della germerina produce germina e gli acidi (l)-2-metil-butirrico e (d)-2-ossi-2-metil-butirrico (16) (65).
Germidina, C34H53O10N, ricavata da Fried, White e Wintersteiner (16) dal Veratrum viride Ait. e da Kupchan e Gruenfeld (34) dalla «criptenamina» si forma probabilmente durante l’estrazione da un estere primario.
L’idrolisi alcalina della germidina dà origine a germina ed agli acidi acetico e (l)-2-metil-butirrico (16).
Neogermidina (isogermidina), C34H53O10N, è stata estratta dal Veratrum viride Ait. da Myers e coll. (24) (26), i quali l’hanno in un primo tempo denominata isogermidina e l’hanno poi identificata alla neogermidina ottenuta da Kupchan e Deliwala (66) dal Zygadenus venenosus. E' l’estere della germina con gli acidi acetico e (l)-2-metil-butirrico (26) (67).
Germbudina, C37H59O12N, è stata ottenuta per la prima volta da Myers e coll. (24) (26) dai rizomi del Veratrum viride. La scissione idrolitica della germbudina dà origine a germina ed agli acidi (l)-2-metil-butirrico e (d)-treo-2,3-diossi-2-metil-butirrico (26)
(34).
Neogermbudina, C37H59O12N, isomera della germbudina, è stata estratta prima dal Veratrum viride (26) (34) e poi anche dal V. album (27). E' l’estere degli acidi (l)-2-metil-butirrico e (l)-eritro-2,3-diossi-2-metil-butirrico con la germina (26) (27) (63).
Protoveratridina, C32H51O9N, è stata per la prima volta isolata da Salzberger (4) dai rizomi del Veratrum album. Poethke (5) ha dimostrato che essa non si trova come tale nella pianta, ma si forma per idrolisi alcalina da un esteralcaloide più complesso. Protoveratridina è stata trovata anche nei rizomi del V. viride (15). Per idrolisi produce l’alcammina germina ed acido (l)-2-metil-butirrico (5) (65).
c) Esteri della protoverina
Protoveratrina A, C41H63O14N, fu isolata dal Veratrum album L. da Stoll e Seebeck (31) e da Nash e Brooker (32). E’ stata estratta successivamente anche da un preparato alcaloidico, «criptenamina», di Veratrum viride Ait. da Kupchan e Gruenfeld (34).
Per idrolisi dalla protoveratrina A sono stati ottenuti l’alcammina protoverina, C27H43O9N, e gli acidi acetico (2 mol.), (l)-2-metil-butirrico (1 mol.) e (d)-2-ossi-2-metil-butirrico (1 mol.) (31) (68).
Protoveratrina B (neoprotoveratrina, veratetrina), C41H63O15N, è stata separata dalla protoveratrina grezza, estratta dal Veratrum viride Ait., da Klohs e coll. (19) ed è stata da questi AA. denominata neoprotoveratrina. Fu pure isolata dal V. viride e designata con il nome di veratetrina da Myers e coll. (24). Infine Stoll e Seebeck (31) e Nash e Brooker (32), che l’hanno ricavata dal Veratrum album e l’hanno denominata protoveratrina B, l’hanno identificata alla neoprotoveratrina di Klohs (19). Myers e coll. (26) d’altro lato l’hanno riconosciuta identica alla veratetrina.
La scissione idrolitica della protoveratrina B dà origine a protoverina ed agli acidi acetico (2 mol.), (l)-2-metil-butirrico (1 mol.) e (d)-treo-2,3-diossi-2-metil-butirrico (31) (68).
Verso la fine del secolo scorso Salzberger (4) estrasse dai rizomi del Veratrum album L. una sostanza alcaloidica fortemente tossica, che denominò protoveratrina in analogia con la veratrina dello Schoenocaulon officinalis. Successivamente Bredemann (69), Poethke (5), Jacobs e Craig (8) e Myers e coll. (25) si occuparono della purificazione della protoveratrina. Nel 1952 Klohs (19) ottenne dalle radici del Veratrum viride Ait. una protoveratrina grezza, da cui separò due alcaloidi, cui diede il nome di protoveratrina e neoprotoveratrina ed ai quali assegnò le formule grezze C30H61O18N e C31H63O15N, rispettivamente.
Nel 1953 Stoll e Seebeck (31) e Nash e Brooker (32) hanno isolato dal Veratrum album L. la protoveratrina e ne hanno separate due sostanze, indicandole con i nomi di protoveratrina A e protoveratrina B. Per la protoveratrina Salzberger (4) stabilì la formula bruta C32H81O11N, che venne variata da Poethke (5) in C40H63O14N. Poethke (5), poiché dopo idrolisi alcalina della protoveratrina, oltre alla protoverina amorfa, C29H45O10N, aveva trovato due acidi volatili in corrente di vapore (acido acetico e acido (—)-a-metil-butirrico) e un acido non volatile (acido (+)-a-metil-a-ossi-butirrico), ritenne la protoveratrina un triestere della protoverina. Jacobs e Craig (8) confermarono nel proprio primo lavoro la formula bruta attribuita da Poethke (5) alla protoveratrina, ma poi la cambiarono in C30H61O18N (70), quando per la protoverina cristallizzata trovarono la formula bruta C27H48O9N, che è quella attualmente accettata. La formula attribuita da Jacobs alla protoveratrina fu confermata da Myers e coll. (25) e da Klohs e coll. (19). Stoll e Seebeck (31) ottennero la scissione idrolitica della protoveratrina A, in 1 mol. di protoverina, 2 mol. di acido acetico, 1 mol. di acido (—)-a-metil-butirrico ed 1 mol. di acido (+)-a-metil-a-ossi-butirrico. Essi definirono perciò la protoveratrina A come tetraestere, con formula bruta C41H63O14N. Stoll e Seebeck (31) inoltre per saponificazione della protoveratrina B seguendo il procedimento di Klohs (19), hanno trovato i prodotti di scissione descritti da questo Autore per la neoprotoveratrina. Alla protoveratrina B è stata assegnata la formula bruta C41H63O15N (31) (32), la stessa determinata per la neoprotoveratrina da Klohs (19). Mentre Klohs per quanto riguarda l’acido a-metil-butirrico ottenuto dalla neoprotoveratrina non dice se si tratta di una forma racemica o di una forma otticamente attiva, Stoll e Seebeck (31) hanno trovato che per idrolisi della protoveratrina B si libera l'acido (—)-a-metilbutirrico otticamente attivo. In base al confronto dei punti di fusione e del potere rotatorio, gli stessi AA. (31) hanno identificato la protoveratrina B ottenuta dal Veratrum album alla neoprotoveratrina, isolata da Klohs (19) dal V. viride. Kupchan e Ayres (68) hanno infine stabilito che la protoveratrina A è il 3-(d)-2‘-ossi-2'-metil-butirrato-6,7-diacetato-15-(l)-2'-metil-butirrato della protoverina e la protoveratrina B è il 3-(d)-treo-2’,3’-diossi-2'-metil-butirrato-6,7-diacetato-15-(l)-2’-metil-butirrato della protoverina.
Desacetilprotoveratrina A, C39H31O13N, è stata ricavata dai rizomi del Veratrum album (27). E’ il 3-(d)-2’-ossi-2’-metil-butirrato-6-acetato-15-(l)-2'-metil-butirrato di protoverina (71).
Desacetilprotoveratrina B, C39H61O14N, è stata isolata dal Veratrum viride e denominata in un primo tempo desacetilneoprotoveratrina (22) (26). E’ stata trovata anche nel Veratrum album (27). E’ il 3-(d)-treo-2’,3'-diossi-2’-metil-butirrato-6-acetato-15-(l)-2’-metil-butirrato di protoverina (71).
Escolerina, C41H61O13N, è l’esterealcaloide estratto dal Veratrum eschscholtzii Gray (18) (21) (23) che per idrolisi alcalina dà l’alcammina protoverina e gli acidi acetico (2 mol.), (l)-2-metil-butirrico e angelico (23) (72a).
Altri alcaloidi di struttura nota
d-Lattone dell’acido zigadenilico, C27H41O7N, è stato identificato da Shimizu (42) (43) nel Veratrum album var. oxysepalum.
Estere angelico del d-lattone dell’acido zigadenilico, C32H47O8N, è stato isolato da Tsukamoto e Yagi (36) dal Veratrum grandiflorum (Maxim.) Loes. fil.
Alcaloidi di composizione ignota
Parecchie basi di composizione sinora non definita sono state estratte dai rizomi dei Veratrum (v. tabella 1).
Struttura chimica delle alcammine e degli alcaloidi del Veratro
Le alcammine, che in forma glucosidica od esterificata, costituiscono gli alcaloidi dei Veratrum hanno struttura steroidica o steroide-simile, per cui il nucleo basale comprende il ciclopentanoperidrofenantrene, come nello schema di tipo soladinico della rubiiervina e della isorubiiervina (schema I) oppure il nucleo (II) o (III), in cui a differenza del precedente, l’anello C è pentagonale e l’anello D esagonale, come nella iervina e nella veratramina (schema II) e nella zigadenina, germina e nella protoverina (schema III).
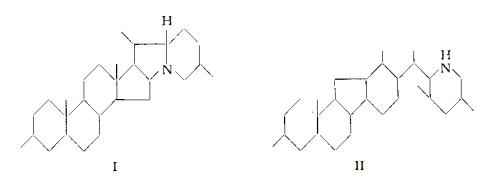
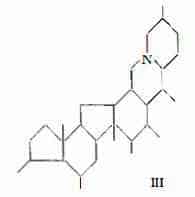
A seconda del numero di atomi di ossigeno le alcammine con nucleo II o III, sono state distinte rispettivamente in due gruppi, il primo detto dello «jerveratrum» con due o tre atomi di ossigeno, comprendente iervina e veratramina, il secondo detto del «ceveratrum» includente zigadenina, germina e protoverina (73).
La struttura delle alcammine del Veratro è stata trattata in parecchie recenti rassegne (72a-76b) anche per quello che concerne il rapporto tra la composizione chimica e l'attività farmacologica dei singoli alcaloidi (76) (76b) (77) (78).
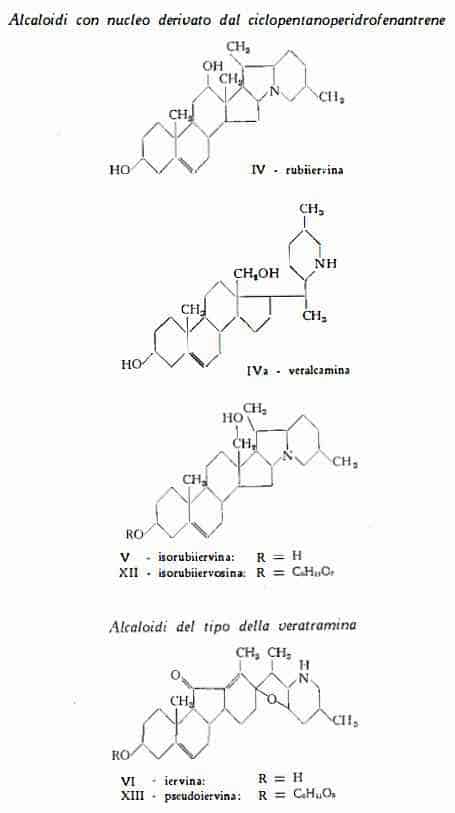
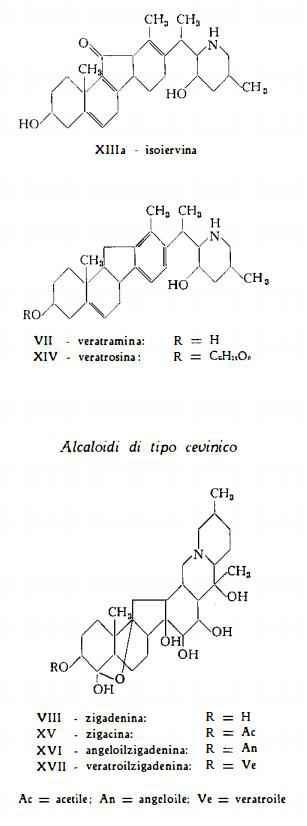
In seguito alle ricerche di Sato e Jacobs (79) e di Locke e Pelletier (80) (81) è stata stabilita la composizione della rubiiervina, definita come 12-ossi-solanidina (IV). La formula della isorubiiervina, proposta da Sato e Jacobs (82), è stata definitivamente stabilita in base all’esito degli studi successivi sui prodotti di trasformazione dell’alcaloide (83) (84). La isorubiiervina è risultata essere la 18-ossi-solanidina (V). Dall’esame delle proprietà chimiche e chimico-fisiche della veralcamina Tomko e Bendik (55) hanno dedotto la composizione di questo alcaloide, per il quale hanno proposto la formula IVa. Wintersteiner e coll. (85-91) hanno dimostrato che la formula di struttura della iervina è la VI. Simile a questa è stata riconosciuta la formula (VII) della veratramina, proposta in un primo tempo da Wintersteiner e coll. (92) e confermata poi mediante una serie di studi dei prodotti di trasformazione (93-95). Wintersteiner e Moore (95a) hanno proposto per la isoiervina, derivante dall’idrolisi acida della pseudoiervina, la formula XIIIa, confermata da Dauben, Epstein, Tanabe e Weinstein (95b) e da Masamune e coll. (95c). Kupchan e coll. (98) hanno messo in evidenza la relazione esistente tra la composizione della zigadenina e quella della germina ed hanno determinato per la prima la formula VIlI. La formula di struttura IX della germina è stata pure elaborata per opera dei lavori di Kupchan e coll. (96-98), eseguiti sulla base delle prime ricerche di Jacobs e coll. (99). Per la protoverina, dopo che Jacobs e Pelletier (100) avevano determinato la presenza del nucleo basilare, Kupchan e coll. (101-103) hanno definito la formula strutturale X, che differisce da quella della germina per la presenza di un OH nella posizione 6.
Le tavole seguenti rappresentano le formule delle alcammine e dei singoli alcaloidi, di cui è stata chiarita la struttura.

0

1
Contenuto di alcaloidi del Veratro
Per il contenuto di alcaloidi del Veratro in letteratura sono riportati titoli molto differenti. Scarse notizie si trovano per quanto riguarda il titolo alcaloidico del Veratrum viride, il quale sembra raggiungere valori vicini a quelli del V. album (104). Tuttavia la maggiore tossicità riscontrata talora per il V. album è stata riferita ad un contenuto più elevato di alcaloidi di questa ultima specie (105). Secondo dati analitici inediti (106) risultano titoli varianti dallo 0,5 all’1 % per i rizomi del V. viride.
Nel Veratrum album Bredemann (69) ha trovato dallo 0,3 all’1 % di alcaloidi totali. Da 6 kg di rizomi della stessa specie sono stati estratti 1,67 g (= mg 27,8%) di protoveratrina amorfa (51).
Considerevoli variazioni sono state notate per il titolo alcaloidico dei rizomi e delle radici di V. album di diversa provenienza. In quattro droghe di differente origine Cionga e coll. (53) hanno trovato 0,74%, 0,85%, 1,18% e 2,378% di alcaloidi rispettivamente.
Gli alcaloidi sono probabilmente presenti in tutte le parti della pianta (5) (46) (107) (108) e variano sia qualitativamente che quantitativamente nei diversi organi (5) (46) (107). Poethke (5) ha saggiato diversi organi del Veratrum album ed ha determinato i seguenti titoli di alcaloidi; nei rizomi (senza radici) 1,63%, nelle radici 1,28%, nelle foglie 0,12-0,31%, nei semi 1,26%. Fluck e Jaspersen-Schib (108) hanno studiato le variazioni del titolo delle parti aeree del Veratrum album ed hanno rilevato un contenuto molto differente per i diversi organi e più elevato per le foglie giovani rispetto a quelle pienamente sviluppate. Inoltre il titolo è più elevato per le foglie raccolte ad altitudini tra i 750 m. ed i 1200 m. in confronto con le foglie delle piante cresciute ad altitudini superiori.
Radici e rizomi essiccati di Veratrum album var. grandiflorum hanno prodotto 0,84-1,05% di alcaloidi (112).
Nel Veratrum album var. lobelianum raccolto in Cecoslovacchia sono stati trovati 1,39-1,53% di alcaloidi totali (37).
Nelle radici del Veratrum lobelianum sono stati rilevati titoli (1,48-1,70%) superiori a quelli dei rizomi (1,20-1,35 %): nelle foglie e nei fusti prima della fioritura sono stati trovati valori pari allo 0,3-0,4% ed allo 0,21% di alcaloidi rispettivamente: mentre durante la fioritura, soltanto 0,1 % nei fusti e tracce nelle foglie. Nelle parti aeree della pianta appassita gli alcaloidi risultano assenti (113).
La variabilità della composizione alcaloidica dei Veratrum dipende da molti fattori. Per quanto riguarda la classificazione sistematica delle singole specie di Veratro, si nota che esse in realtà sono molto simili, essendo le loro differenze per lo più di tipo botanico-morfologico. La distinzione fra il Veratrum album L., il V. viride L. e il V. grandiflorum Loes. fil. è di carattere geografico; il V. album e il V. lobelianum Benth. crescono generalmente insieme sulle Alpi e si può presumere che la distinzione tra queste due specie non sia tenuta in considerazione dai raccoglitori.
Diverse razze di Veratrum album L., che si distinguono per i differenti alcaloidi in essi contenuti, sono state descritte da Poethke (5) e da Tomko (114).
Del V. album, raccolto nella Baviera, Poethke (5) ha esaminato la ripartizione dei singoli alcaloidi nelle varie parti della pianta. Così egli trovò protoveratrina e germerina soprattutto nel rizoma, radici e nella base delle foglie, iervina principalmente nel rizoma, in quantità minore anche nelle radici e solo in tracce nella base delle foglie. La rubiiervina, che si trova di solito in piccole quantità, è contenuta nel rizoma e nelle radici, la pseudoiervina solo nel rizoma.
Nei rizomi e radici del Veratrum album, raccolto in varie zone della Romania in ottobre e novembre, è stata notata una rilevante differenza nel contenuto degli alcaloidi più comunemente presenti nella droga: inoltre non è stata trovata protoveratrina (115).
La droga slovacca costituita da Veratrum lobelianum, raccolto fresco, è stata trovata mancante di protoveratrina (38). La droga di origine bulgara dà resa in germerina, iervina e rubiiervina simile a quella ottenuta dalla droga bavarese, mentre la protoveratrina vi è contenuta in quantità molto inferiore. Anche in altre droghe, di cui manca l'indicazione dell’origine, il contenuto di protoveratrina è molto variabile ed anche per la iervina si hanno variazioni notevoli. Si osserva una rilevante differenza fra le droghe bavaresi e le jugoslave (116).
Componenti non alcaloidici
Nel Veratrum album (rizomi), secondo dati della vecchia letteratura (117), sono stati trovati un glucoside amaro denominato veratramarina, acido veratrico, olio grasso, resina, zucchero e amido; anche pectine, acido gallico e inulina, sulla cui presenza però non tutti gli AA. sono concordi. Sono stati estratti inoltre acido chelidonico, che Schmidt (118) ha identificato con l’acido iervico, trovato precedentemente da Weppen (119); grasso (1,8% dai rizomi, 0,45% dalle radici) con gliceridi degli acidi palmitico, stearico, oleico e linoleico e con elevata quantità percentuale di insaponificabile (22,2% per i rizomi, 45,8% per le radici), in cui è stato trovato n-nonacosano (5) (120).
Tra i componenti non azotati dei rizomi del Veratrum album Poethke e Gerlach (121) (122) hanno trovato tre sostanze; Sostanza A, C30H50O2, Sostanza B, C32H54O2 e Sostanza C, C25H42O2. Alle prime due, di natura triterpenica, essi hanno dato i nomi di veratrum-triterpeni A e B.
Nei rizomi e nelle radici secchi del Veratrum album 1,8% e 3,4% di ceneri rispettivamente, secondo Winkler (123); ceneri 9,6%, secondo Peyer e coll. (124). Nella droga commerciale la D.A.B. (125) ammette un massimo del 12 % di ceneri, la Pharm. Helv. (126) un massimo del 14%. Dai rizomi del Veratrum grandiflorum Loes. fil. Takaoka (127) ha

2
isolato i derivati stilbenici, resveratrolo C14H12O3, e ossiresveratrolo, C14H12O4, ottenuti nella quantità dello 0,1% e 0,03% rispettivamente.
Nel Veratrum viride (rizomi) è stata segnalata la presenza di olio grasso, mucillaggine, glucosio e resina (117), La presenza di colchicina nel Veratrum viride Ait. e nel V. album L., riportata in letteratura (128), è stata successivamente negata da Santavy (129).
Proprietà farmacologiche ed impiego terapeutico
Il Veratro verde era noto forse, soltanto come pianta tossica agli indiani del Nord America i quali sembra, lo usassero anche nelle loro primitive pratiche giudiziarie come «prova del veleno», analogamente a quanto veniva fatto con altre droghe, quale per es. la Fava del Calabar presso alcune popolazioni dell’Africa tropicale.
Dai coloni europei era invece impiegato come insetticida e anche come purgante [Fluckinger e Hamburger (130)], come emetico, come controirritante locale, nelle nevralgie e come antitermico. Da essi venne poi introdotto in Europa dove, dopo la metà del 1800 ebbero inizio i primi studi farmacologici e le sue proprietà vennero indagate comparativamente con quelle del suo congenere europeo, il Veratrum album, l’uso del quale come pianta medicinale, è molto più antico, almeno per quanto ci è dato sapere, poiché essendo il Veratro verde originario dell’America settentrionale, non è possibile dire se era noto ed usato da quelle popolazioni nell’epoca precolombiana.
Sembra che il Veratro fosse noto in Cina sin dai tempi più lontani ed usato per le sue proprietà antielmintiche, emetiche ed espettoranti. Probabilmente la pianta ricordata nel Pen Ts’Ao, che risale al 2800-2700 a.C., corrisponde al Veratrum nigrum, che è appunto la specie che alligna in Cina.
Ippocrate, Teofarsto, Dioscoride, Catone, Plinio, Cornelius Celsus, Scribonio Largo, Galeno, parlano nelle loro opere dell’uso dell’Elleborus leucos, dell’Elleborus nigrum, dell’Elleborus mela, come piante emetiche, sternutatorie, insetticide e velenose e pressocchè con le stesse indicazioni queste piante erano note nel Medioevo.
Il medico farmacognosta ispanoarabo Ibu Baithar descrisse le due specie di Elleboro (bianco e nero), le quali sono ricordate anche in altre opere del tempo, quali l’Alphita del XIII secolo e l'Ortus sanitatis del 1485. Occorre dire però che le varie specie di Veratro e di Elleboro venivano facilmente confuse ed è oggi difficile stabilire se le piante descritte ed usate allora, corrispondano veramente a quelle note attualmente con le denominazioni di Veratrum album e di Veratrum nigrum.
L’azione bradicardizzante del Veratro verde è nota sin dal 1862 e sin da allora veniva impiegato come sedativo cardiaco. Qualche anno più tardi (1867), Bezold e Hirt (131) dimostrarono che iniezioni endovenose di preparati totali di Veratro verde determinano negli animali da esperimento, un’azione riflessa cui consegue un effetto ipotensivo ed un rallentamento della frequenza cardiaca. Tale azione riflessa, attualmente nota col nome di «effetto Bezold» venne più recentemente confermata e chiarita, come vedremo in seguito, anche da altri autori.
I risultati di questi primi studi sui due veratri bianco e verde, condussero intanto alla conclusione che, sia la loro composizione chimica che la loro attività farmacologica e terapeutica, sono qualitativamente molto simili e che se differenze esistono, esse riguardano soprattutto, le variazioni quantitative del contenuto alcaloideo, il diverso rapporto in cui i diversi alcaloidi attivi si trovano nelle due droghe e qualche differenza nel contenuto di alcuni alcaloidi secondari.
Differenze quantitative e qualitative nel contenuto alcaloideo, possono verificarsi del resto anche nella stessa droga, in relazione con la sua diversa provenienza, metodo di essiccazione, stato di conservazione ecc., come è stato dimostrato anche recentemente da Poethke e Kerstan (132) a proposito del Veratrum album.
Tale somiglianza di composizione e di attività giustifica dunque la trattazione delle due droghe, per quanto riguarda la parte farmacologica e terapeutica, nello stesso capitolo nel quale cercheremo di riassumere le conclusioni delle indagini più significative e più recenti e di ordinare questo vastissimo argomento, trattando prima dell’azione dei preparati totali delle due droghe, poi quella dei loro complessi alcaloidici e quindi quella dei loro singoli alcaloidi.
La principale azione farmacologica del Veratro è quella che riguarda l’apparato cardiovascolare, alla quale si debbono anche le sue più importanti applicazioni terapeutiche. A quest’azione è strettamente connessa anche quella che la droga svolge sulla funzione respiratoria e per ciò queste due azioni verranno trattate contemporaneamente.
1) Azione sul sistema cardiovascolare e respiratorio
a) azione dei preparati totali
L’azione bradicardizzante e ipotensiva che consegue alla somministrazione dei preparati di Veratro o dei suoi alcaloidi è stata estesamente indagata ma nonostante le numerose ricerche eseguite, non si può ancora affermare che il suo meccanismo sia stato precisato in tutti i particolari.
Differenze fondamentali d’azione fra i due veratri, non sembra siano state rilevate. La specie europea, il Veratrum album, sembrerebbe essere tossicologicamente più attiva, in relazione col suo più elevato contenuto alcaloideo.
Wood e Wood (133) che studiarono comparativamente le due droghe per incarico del Comitato per la revisione dell’VIII edizione della U.S.P., pervennero alla conclusione che raramente è possibile rilevare differenze farmacologiche fra la droga americana e quella europea, la quale si distinguerebbe tuttavia per provocare più frequentemente disturbi intestinali ed è quella la sola ragione per la quale i due autori americani consigliano di dare la preferenza al Veratrum viride nell’uso terapeutico.
L’iniezione endovenosa di tintura di Veratro, opportunamente diluita, induce negli animali da esperimento, diminuzione della pressione arteriosa, rallentamento del ritmo cardiaco e modificazioni dell’attività respiratoria, le quali ultime possono variare a seconda della dose e di altre particolari condizioni che saranno considerate.
La fig. 1 dimostra l’effetto ipotensivo e l’aumento di ampiezza degli atti respiratori, ottenuti nel coniglio con l’iniezione endovenosa di cc 1 di tintura di Veratro verde al 10%, diluita 1:100 (134).
Nella Fig. 2 si può notare l'effetto ipotensivo e le contemporanee modificazioni dell’attività cardiaca che si manifestano con una diminuzione del tono della contrazione ventricolare, con disturbi del ritmo e con diminuzione della frequenza.
L'azione della droga, almeno nel coniglio, non è affatto costante poiché mentre alcuni soggetti reagiscono a dosi minime con un cospicuo effetto ipotensivo, altri tollerano dosi relativamente elevate senza che la pressione e l’attività respiratoria vengano proporzionalmente modificate.
L’effetto ipotensivo e bradicardizzante prodotto dalla somministrazione dei preparati di Veratro verde, venne studiato, come già fu detto, da Bezold e Hirt fin dal 1867 e da essi attribuito ad un meccanismo riflesso originantesi per stimolazione dei recettori cardiaci, ciò che venne più tardi confermato e approfondito da altri autori (Jarisch e Richter (135), Richter e Amann (136), Krayer e coll. (137), Dawes (138), Krayer e Acheson (139) ed altri). Ma le complesse manifestazioni respiratorie e cardiovascolari determinate dai preparati di Veratro, non sono facilmente interpretabili, anche perchè i principi attivi contenuti nella droga, singolarmente considerati, agiscono in maniera sensibilmente diversa.
L’azione ultima dei preparati totali della droga, deve essere pertanto considerata, non come l’espressione di un’unica azione, ma piuttosto come la risultante di più componenti, la cui analisi farmacologica è resa anche per questo particolarmente complicata e difficile.
Indubbiamente altri fattori, oltre l’effetto Bezold, concorrono a determinare le suddette modificazioni respiratorie e cardiovascolari e diverse sono infatti, sotto questo aspetto, le opinioni dei vari autori.
Dell’effetto Bezold, in rapporto all’azione del Veratro, dobbiamo considerare la componente cardiovascolare la quale è caratterizzata da una diminuzione riflessa della frequenza cardiaca e da una caduta, anch’essa riflessa, della pressione arteriosa. Questa non sarebbe però dovuta alla diminuzione della portata cardiaca, ma alla vasodilatazione periferica determinata da un effetto vasodilatatore puramente riflesso [Dawes (138)].
La localizzazione dei recettori e delle vie afferenti ed efferenti, fu oggetto di numerose indagini ma non è stata ancora completamente chiarita. Sembra tuttavia che in questo complicato meccanismo riflesso intervengano, oltre i recettori cardiocoronarici, cui è dovuto l’effetto Bezold, anche quelli delle zone vasosensibili senocarotidee, senoaortiche, delle arterie polmonari e della zona che si trova all’origine dell'arteria mesenterica superiore: inoltre, le fibre vagali, i nodi gangliari, i centri bulbari, ipotalamici e corticali.
Si ammette che le vie afferenti siano costituite da fibre vagali (Dawes (138), Jarisch e Richter (140) ed altri) , ma l’ipotensione da Veratro è soltanto parzialmente prevenuta dall’atropina e il sistema colinergico, secondo alcuni, non sarebbe primariamente coinvolto nell’ipotensione [Goodman e Gilman (141)].
Secondo Abreu (142), Rose e Lauro (143) ed altri, l’effetto Bezold verrebbe completamente bloccato dalla vagotomia bilaterale, ma su ciò non

3

4
tutti sono d’accordo e noi stessi abbiamo potuto notare che, almeno nel coniglio, l'effetto ipotensivo persiste anche dopo vagotomia bilaterale, dopo atropinizzazione e anche dopo contemporanea vagotomia bilaterale e atropinizzazione, come è dimostrato dall’esperienza riassunta nella Fig. 3.
Sembrerebbe quindi logico ritenere che anche altri meccanismi, centrali e periferici, intervengano nel determinismo dell’azione del Veratro e, particolarmente per quanto riguarda l'interpretazione dell’ipotensione prolungata che permane anche dopo che le funzioni respiratoria e cardiaca hanno ripreso la loro normale attività, alcuni autori ritengono che oltre a una azione riflessa mediata dai chemiocettori [Dawes (138)], possono interferire anche un'azione centrale [Swiss e Maison (144)] e un’azione diretta sui vasi periferici [Wilson e Smith (145)]. La quale ultima non dovrebbe essere quindi interpretata soltanto come un effetto puramente riflesso [Wood e Wood (133)], ma anche come un’attività vasodilatatrice periferica diretta, ciò che potrebbe essere confermato anche dal fatto che

5
essa può essere ottenuta sui vasi dell’orecchio isolato di coniglio, come venne più tardi osservato da Petkov e coll. (146) secondo cui gli alcaloidi totali del Veratro bianco, iniettati endovena alla dose di 0,01-0,02 mg/kg nel cane e nel gatto, abbassano la pressione di circa il 50 %, esercitano un’azione cardiotonica sul cuore isolato di coniglio ed un’azione vasodilatatrice sull’orecchio isolato di questo animale.
Diverse e di non facile interpretazione sono anche le reazioni che si possono notare sul pneumogramma e sulla curva emodinamica per somministrazione di dosi elevate o ripetute di tintura di Veratro a varie diluizioni, come risulta dall’esperienza riassunta nella Fig. 4.
In questo caso l’iniezione di cc 2 di tint. di Veratro al 10% diluita 1:10, non modifica la pressione arteriosa ma determina una forte rarefazione degli atti respiratori i quali appaiono anche fortemente aumentati di ampiezza. Alla successiva iniezione di cc 3, segue un leggero aumento di pressione che gradualmente diminuisce sino a raggiungere un livello inferiore di circa 20 mmHg a quello iniziale. L’attività respiratoria tende a normalizzarsi, ma cessato il periodo iniziale d’ipertensione, riappare la rarefazione e l’aumento di ampiezza degli atti respiratori. Alla successiva iniezione di cc 1 della stessa soluzione, non seguono importanti modificazioni respiratorie o emodinamiche, mentre l’iniezione di altri 3 cc provoca ipertensione e le stesse modificazioni iniziali precedentemente descritte, dell'attività respiratoria.
Un fenomeno interessante si nota dopo la prima iniezione di cc 2 della suddetta soluzione: gli atti respiratori sono interrotti da pause che raggiungono la durata di 30-40" e così pure le onde respiratorie che si notano sulla curva emodinamica. Fra due onde respiratorie consecutive è possibile notare chiaramente la comparsa di altre onde molto frequenti che non possono essere interpretate come onde respiratorie, manifestandosi esse durante la lunga pausa respiratoria descritta. E’ quindi probabile che queste onde si identifichino con le oscillazioni di II ordine osservate da Foà (147) nel cane curarizzato e mantenuto in vita con insufflazione tracheale continua di aria e di ossigeno, secondo il metodo di Meltzer e Auer, e anche da Pupilli (148), in particolari condizioni sperimentali.
Queste oscillazioni, che normalmente non appaiono perchè mascherate dalle onde respiratorie, sarebbero dovute all’attività automatica del centro vasomotore bulbare. Si potrebbe quindi formulare l’ipotesi che il Veratro verde, a certe dosi, produca una depressione del centro respiratorio, lasciando però immodificata e forse stimolando, l’attività automatica del centro vasomotore.
Lo stesso fenomeno è possibile osservarlo anche con dosi di molto inferiori, come nell’esperienza riassunta nella Fig. 5 dove le oscillazioni precedentemente descritte e le onde respiratorie sono ben distinguibili, essendo queste ultime nettamente delimitate dalle escursioni respiratorie che con esse esattamente coincidono.
Un’altra esperienza che dimostra come nello stesso animale si possano ottenere risposte pressorie e respiratorie diverse, è quella riassunta nelle Figg. 6 e 7, nelle quali si nota che le dosi di cc 0,5, 1 e 2 di tintura di Veratro al 10% diluita 1:100, provocano soltanto una riduzione della ampiezza degli atti respiratori e nessuna reazione pressoria (Fig. 6). La

6

7
successiva iniezione (di cc 4 invece, che determina una leggera ipotensione, è seguita da un forte aumento delle escursioni respiratorie.
Nella figura successiva (Fig. 7), si nota che all’iniezione di cc 5 della stessa soluzione, segue la stessa reazione respiratoria ottenuta con le tre piccole dosi iniettate precedentemente, mentre una dose sensibilmente superiore (cc 0,8 della stessa tintura, ma diluita 1:10), provoca una più forte ipotensione e la stessa reazione respiratoria caratterizzata da un forte aumento di ampiezza.
Interessante notare che negli animali atropinizzati o vagotomizzati o vagotomizzati e atropinizzati, manca del tutto o quasi, la reazione respiratoria (ved. anche Fig. 3).
Altro fatto interessante che si può notare nella Fig. 8, è che il Calcio è capace di antagonizzare completamente l’effetto ipotensivo prodotto dalla tintura di Veratro.
Anche sul cuore isolato l'azione del Veratro può manifestarsi in maniera diversa secondo le dosi o la maniera con cui esse vengono fatte agire.
Un cc di tintura di Veratro al 20% diluita 1:10 iniettata nel ventricolo sinistro di un cuore isolato di coniglio, attraverso la cannula laterale del tubo di raccordo cui viene innestata la cannula aortica dell’apparecchio di Spadolini, determina un durevole aumento della contrazione sistolica dopo una transitoria diminuzione iniziale, mentre la frequenza delle contrazioni non viene affatto alterata (Fig. 9).
Modificazioni più profonde si ottengono facendo circolare la tintura di Veratro col liquido nutritizio a varie diluizioni: aumento della frequenza e regolarizzazione del ritmo con tintura di Veratro al 10% diluita 1:250

8

9

0

1
e marcato aumento della contrazione sistolica dopo lavaggio (Fig. 10, I tracciato). Regolarizzazione del ritmo, diminuzione della contrazione sistolica durante il periodo in cui il cuore viene perfuso con la suddetta tintura di Veratro diluita 1:100 e aumento dopo lavaggio (Fig. 10, II tracciato). Elevando la concentrazione a 1:50 si ottiene una forte e progressiva riduzione della contrazione cardiaca, interessante la sistole e la diastole, con gravi disturbi del ritmo che iniziano quando le contrazioni cardiache hanno raggiunto la minima ampiezza (Fig. 10, III tracciato).
La circolazione della tintura di Veratro al 10% diluita 1:50 può provocare arresti diastolici, reversibili dopo lavaggio, con aumento dell’ampiezza e della frequenza delle contrazioni (Fig. 11, I tracciato), o arresto diastolico e ripresa delle contrazioni, dopo lavaggio, con diminuzione della frequenza, e disturbi del ritmo. Nel tracciato è ben visibile anche l’aumento della contrazione sistolica.
In alcuni casi si possono osservare anche arresti diastolici irreversibili dopo lavaggio (Fig. 12).
Abbiamo voluto riferire piuttosto estesamente i risultati di queste ricerche che datano dal 1942, al fine soprattutto di dimostrare la diversità dei risultati che si ottengono, non soltanto variando le dosi, ma anche impiegando le stesse dosi e nello stesso animale.
Risulta inoltre da queste indagini che nel coniglio, a differenza di quanto alcuni autori (142), hanno osservato nel cane, la vagotomia bilaterale e l’atropinizzazione, possono annullare gli effetti del Veratro sul cuore e sulla respirazione, ma non l'effetto ipotensivo (Fig. 3). Si potrebbe logicamente pensare che ciò possa essere dovuto al diverso decorso delle vie afferenti che partono dai barocettori del seno aortico (nervi aortici)
Nel coniglio queste vie infatti, non decorrono col vago, ma costituiscono il nervo depressore di Cyon (Fig. 14). Nel cane invece, come è noto, le fibre dei nervi aortici sono frammiste con quelle del vago e decorrono nella stessa guaina: per cui, praticando la vagotomia nel cane, si interrompe contemporaneamente anche la conduzione del depressore, ciò che evidentemente non avviene allorché la vagotomia viene praticata nel coniglio.

2

3

4
Ma una prova eseguita sul coniglio, somministrando il Veratro dopo la sezione bilaterale del vago e del depressore, ha dimostrato che neppure in questo caso l'effetto ipotensivo viene annullato, pur manifestandosi con un certo ritardo e dopo una lieve e transitoria ipertensione iniziale (Fig. 13).
Vedremo quali conclusioni generali potranno essere tratte in base ai risultati delle indagini più recenti che saranno riassunte nei prossimi capitoli.
b) Azione dei complessi alcaloidici del Veratro
I preparati risultanti da questi complessi alcaloidici, contenenti cioè gli alcaloidi totali o gruppi di essi, sono stati largamente sperimentati sia farmacologicamente che terapeuticamente e, in generale, si può dire che essi si comportano, sotto questo aspetto, in maniera molto simile ai preparati totali della droga di cui abbiamo parlato nel paragrafo precedente.
I risultati di queste ricerche completano èd approfondiscono però alcuni non ancora sufficientemente chiariti aspetti del problema riguardante il complesso meccanismo d’azione del Veratro e apportano un ulteriore contributo alla sua soluzione.
Ricerche comparative sull’azione di un preparato risultante da una miscela standardizzata degli esteri alcaloidi del Veratro verde (il Veriloid) e della veratridina, furono condotte da Dawes e coll. (150) i quali hanno concluso che il meccanismo d’azione del suddetto preparato, non differisce fondamentalmente da quello dell’alcaloide puro, il quale sarebbe dovuto, secondo gli AA., sia ad un riflesso di Bezold periferico, che ad un’azione nervosa centrale.
Abreu e coll. (151) hanno studiato invece un preparato risultante da una miscela standardizzata di protoveratrina A e B (il Veralba), comparativamente con la protoveratrina A e la germitetrina B. Tutti questi

5

6
preparati avrebbero dimostrato un’uguale attività ipotensiva nel cane, sebbene quella della protoveratrina B sia apparsa quantitativamente meno intensa.
Con protoveratrina A e con il Veralba, non è stata osservata una dissociazione dell'attività ipotensiva dalla proprietà emetica. La protoveratrina A riduce, secondo gli AA., la pressione arteriosa agendo sui recettori i cui impulsi giungono ai centri vasomotori attraverso il vago e i nervi del seno carotideo.
Ricerche comparative fra un preparato totale di Veratro, il Veriloid, e alcuni alcaloidi (protoveratrina, germitrina, neogermitrina, germerina, veratridina e veratramina), vennero eseguite da Wang e coll. (152) su gatti e su cani, al fine di determinare la loro sede di azione extravagale. I preparati vennero iniettati endovena e endoarteria o applicati localmente sulla zona reflessogena senocarotidea. In animali totalmente o parzialmente vagotomizzati, si sono osservate reazioni ipotensive sia col preparato totale che con protoveratrina, germitrina, neogermitrina e germerina. Durante la risposta ipotensiva gli AA. osservarono che il riflesso senocarotideo era depresso o eliminato e che l’eccitabilità del centro vasomotore midollare era aumentata. Essi osservarono che la risposta ipotensiva non è dovuta al corpo carotideo e ritengono che ciò sia dovuto ad aumentata eccitazione dei barocettori del seno carotideo.
La veratramina e la veratridina deprimono, secondo gli AA., il centro vasomotore e essi ritengono che ai barocettori del seno carotideo debba essere attribuito un ruolo secondario nel determinismo della reazione ipotensiva. Gli AA. hanno inoltre confermato che il sistema circolatorio risponde relativamente poco a dosi moderate di Veratro e dei suoi alcaloidi, eccettuata la veratramina la quale è dotata di un effetto diretto sul cuore.
L’assenza di una reazione ipotensiva dopo iniezione degli alcaloidi del Veratro in cani cronicamente simpatectomizzati o spinali, indica che tutte le reazioni vasomotorie negli animali vagotomizzati, sono mediate dal simpatico.
Poiché la Hydergina abolisce queste risposte ipotensive. l’azione del Veratro dovrebbe essere spiegata, secondo gli AA., più come una inibizione dello scarico simpatico che come una eccitazione delle radici vasodilatatrici simpatiche dorsali.
Secondo Salva (153) l’azione tonicardica del Veratro e l’azione deceleratrice delle basi secondarie, aggiunge ancora un interesse terapeutico a queste sostanze. Nonostante la loro straordinaria attività fisiologica, la tossicità è relativamente debole e, in ogni caso, le dosi tossiche sono assai lontane da quelle terapeuticamente attive e tali quindi da permettere un agevole uso terapeutico.
Successivamente lo stesso Salva in collaborazione con Valdecasas (156) ha studiato l'azione delle piccole e delle forti dosi di un preparato contenente gli esteri alcaloidi del Veratro bianco (EVA). Con l’impiego di forti dosi di questo preparato gli AA. hanno ottenuto risposte molto diverse da quelle provocate dalle dosi piccole biologicamente attive.
Nell'animale integro, la prima iniezione del preparato non determina ipertensione, ciò che invece si osserva di regola nell’animale spinale. Secondo gli AA., ciò sarebbe dovuto al fatto che nell’animale integro, la prima iniezione di una dose elevata determina inibizione dei centri nervosi superiori, il che permetterebbe in seguito, un’azione sui centri vasomotori inferiori. L’ipotensione veratrica dovrebbe avere la sua origine, secondo gli AA., nei centri vegetativi midollari essendo essa annullata dal tetrametilammonio e non si manifesta nell’animale demidollato.
Il suddetto preparato eserciterebbe, come molte altre sostanze, un miscuglio di azioni eccitanti e depressive, secondo le dosi impiegate e le condizioni nelle quali esso viene fatto agire. Il fenomeno più notevole, secondo gli AA., sarebbe dato dalla comparsa di un ritmo periodico spinale, in tutto simile a quello descritto da Valdecasas vent’anni prima (157).
Questo ritmo è facile ad ottenersi e non è in relazione con le variazioni del ritmo cardiaco, restando quest'ultimo costante.
Modificazioni elettrocardiografiche importanti, contemporanee a variazioni della pressione arteriosa, vengono pertanto constatate durante il ritmo periodico.
Contrariamente a Salva (153), secondo il quale, come già detto, la dose tossica degli alcaloidi del Veratro, sarebbe notevolmente lontana dalla dose terapeutica, Zaimis (158) ritiene invece che l’azione ipotensiva può essere ottenuta soltanto con dosi tossiche.
Muresan e coll. (159) hanno eseguito accurate ricerche con lo scopo di determinare la sede e il meccanismo d’azione degli alcaloidi del Veratro, sperimentando sul cane il complesso alcaloidico estratto da una droga di origine rumena. Essi sono giunti alla conclusione che i punti di partenza dell’azione ipotensiva prodotta da tale complesso, sono le zone reflessogene cardioaortiche, polmonari, coronariche e senocarotidee e che le vie afferenti decorrono con le fibre afferenti del vago (probabilmente i nervi depressori di Cyon e di Hering). I centri del riflesso sono rappresentati dai centri vasomotori bulbari con connessioni ipotalamiche, bulbari e corticali.
Gli stimoli afferenti delle zone reflessogene, determinano una inibizione del tono dei centri vasomotori e, nello stesso tempo, un’ipotensione per abbassamento del tono simpatico vascolare, azione alla quale il pneumogastrico non dovrebbe essere estraneo.

7
L'azione ipertensiva prodotta dagli alcaloidi totali sarebbe dovuta, secondo gli AA., a un meccanismo di eccitazione neurogena centrale diretta, ciò che venne ammesso anche da Martini (160) e da Valdecasas e Salva (161) per la protoveratrina e la germitrina.
L'iniezione degli alcaloidi totali nella carotide al disotto delle zone reflessogene, determina un effetto ipertensivo iniziale dovuto al contatto diretto con i centri nervosi. Questa reazione è seguita dall’ipotensione caratteristica, soltanto dopo che il prodotto, entrato nella circolazione generale, ha raggiunto le zone reflessogene note.
L’interruzione delle vie riflesse ipotensive, ottenuta con la sezione del vago e l’enervazione dei seni carotidei, provoca ugualmente la comparsa dell’effetto ipertensivo dopo la somministrazione di dosi elevate del complesso alcaloidico. Lo stesso effetto si otteneva anche dopo la sezione sopra bulbare, per l'interruzione delle connessioni del bulbo coi centri corticali.
L’azione neurogena ipertensiva diretta, non si manifesterebbe dunque, secondo gli AA., se non quando le vie del riflesso ipotensivo sono interrotte. Il luogo di origine di questa eccitazione centrale deve essere il bulbo, perchè la sezione sottobulbare impedisce tutta la reazione vascolare.
Nabufusa Natori e coll. (162) hanno studiato l’azione di varie droghe ipotensive, fra le quali il Veratro, su gatti normali e con ipertensione renale indotta, e hanno constatato che tutte sono più attive negli animali ipertesi che in quelli normali. L’effetto combinato di dosi uguali di esametonio e di Veratro, producono una diminuzione dell’effetto ipotensivo, mentre nel rapporto di 1 di esametonio e 3 di Veratro, si produce un aumento.
c) Azione degli alcaloidi puri del Veratro
Altre ricerche infine, sono state eseguite sui principali alcaloidi, isolatamente considerati, comparativamente fra loro e con altri preparati totali della droga o complessi alcaloidici. Anche se i risultati di queste ricerche aggiungono poco a quanto già detto a proposito del meccanismo d’azione della droga, valgono anche in questo caso a confermare alcuni dati o a lumeggiare ulteriormente qualche particolare. Fra i risultati dei molti lavori di cui è ricca la letteratura, noi riferiremo quelli che ci sembrano più significativi fra i più recenti e comunque non anteriori all’ultimo decennio.
Protoveratrina
Rothlin e Cerletti (163) hanno sperimentato una protoveratrina cristallizzata, costituita da protoveratrina A e B (2/3 di A e 1/3 di B), trovando che l’ipotensione che si manifesta nel gatto, nel cane, nel coniglio, nella cavia e nei ratti, dopo la somministrazione di questa sostanza, è dovuta per la massima parte alla diminuzione della resistenza vasale periferica e, per una minima parte, al contemporaneo rallentamento del battito cardiaco.
Queste azioni non sarebbero, secondo gli AA., conseguenti a un’azione diretta sul cuore e sui vasi, ma a un meccanismo nervoso che determina un’attivazione dei riflessi circolatori depressivi. Gli AA. hanno trovato inoltre che la protoveratrina induce un effetto cardiotonico digitalisimile nell'insufficienza cardiaca.
Fernandez e Cerletti (164) hanno successivamente osservato che nel gatto in anestesia cloralosica, la dose di 1,5-2,5 di protoveratrina, provoca una caduta massima della pressione del 26%, valore che si riduce al 14% nell'animale atropinizzato. Dopo vagotomia bilaterale la caduta della pressione è molto lenta, con un effetto massimo dopo 20’. In animali con denervazione bilaterale del seno carotideo ma col vago intatto, la caduta della pressione è più pronunciata e viene ridotta con preatropinizzazione.
Negli animali bivagotomizzati o con denervazione bilaterale del seno carotideo, la protoveratrina non ha azione ipotensiva, mentre nella maggior parte dei casi la pressione aumenta. Questi risultati dimostrerebbero, secondo gli AA., che al vago deve essere attribuito un ruolo preminente nell’effetto ipotensivo immediato, determinato dalla protoveratrina e che il seno carotideo ha un’importante azione tampone, in quanto limita la caduta, inizialmente rapida, della pressione.
Un diretto effetto sul sistema nervoso centrale non avrebbe, secondo gli AA., alcuna parte importante nel determinismo dell’azione ipotensiva di piccole dosi di protoveratrina.
Secondo Calliauw (65) l’effetto ipertensivo della protoveratrina A, sarebbe il risultato di diversi meccanismi opposti. Nel cane vagotomizzato e in cui sia stata operata la denervazione dei seni aortico e carotideo, l’ipertensione è prodotta per diretta stimolazione dei centri vasomotori superiori e dei centri secondari midollari. Nel cane normale predomina una forte ipotensione riflessa per stimolazione dei barocettori senocarotidei e dei chemocettori del corpo carotideo. Un’azione diretta della protoveratrina sui vasi sanguigni periferici, è esclusa dall’Autore.
La somministrazione sottocutanea di protoveratrina determina, secondo Hoobler e coll. (166), una moderata diminuzione del lavoro cardiaco e talvolta una diminuzione della resistenza periferica totale. Il flusso sanguigno renale rimane invariato ma la velocità di filtrazione glomerulare diminuisce leggermente, mentre notevole è la diminuzione del flusso urinario dopo somministrazione di dosi elevate.
Il flusso sanguigno nelle estremità (piedi) e nell’avambraccio, diminuisce moderatamente allorché la conduzione simpatica è intatta.
La misura delle costanti emodinamiche, su un periodo di controllo di 30-60’, eseguita da Durand e coll. (167) dopo l’iniezione di mg 0,1 di protoveratrina nella circolazione polmonare, ha rivelato una caduta della pressione auricolare di riempimento e della pressione ventricolare di svuotamento. Venne contemporaneamente notato un aumento della gittata sistolica e una diminuzione della frequenza cardiaca. Queste modificazioni dell’attività cardiaca vennero dagli AA. attribuite ad un meccanismo riflesso.
Reuse-Blom (168) notò che la protoveratrina e la veratramina sopprimono la conduzione in alcune porzioni del tessuto auricolare. Questi effetti vengono completamente o parzialmente invertiti dall’adrenalina o dalla acetilcolina.
Le modalità d’azione dei due alcaloidi sarebbero però alquanto diverse.
Hapke (169) osservò che la protoveratrina A induce negli animali da esperimento (ratti, cavie, gatti e cani), una variazione respiratoria e circolatoria riflessa. Dopo iniezione di esobarbital sodico e di tiopental, si notò un arresto e una più marcata paralisi respiratoria che veniva antagonizzata da endoanestetici o da analettici centrali.
Nel gatto l'azione della protoveratrina è diminuita dal narcotico, ciò che può essere dovuto, secondo l’A., all’azione sedativa periferica dei narcotici in generale.
Un sinergismo esisterebbe fra narcotici e sostanze la cui azione inibitrice sul centro respiratorio viene trasmessa attraverso le vie afferenti vagali.
Differenze nel meccanismo d’azione della protoveratrina e dell’esobarbital, sono stare notate in vari animali.
Veratramina, Veratridina, cevadina ed altri alcaloidi
La veratramina alla dose di 200-600 g/kg, abbassa la pressione, diminuisce la frequenza cardiaca, determina rigidità muscolare e convulsioni cloniche nei ratti anestetizzati con pentobarbital. Essa antagonizza l’aumento della frequenza cardiaca indotta dall’adrenalina e dall’N-isopropil-arterenolo. A piccole dosi (160 g/kg), la veratramina provoca rigidità muscolare e scosse miocloniche, diminuisce la frequenza cardiaca e abbassa la pressione nei cani in anestesia. Con dosi superiori (1 mg/kg), gli effetti divengono gradualmente più evidenti e si manifestano con la comparsa di convulsioni cloniche, con aumento della frequenza respiratoria, con abbassamento della pressione e con forte diminuzione della frequenza cardiaca, effetti questi che non vengono influenzati dall’atropina.
L’accelerazione cardiaca prodotta dall'adrenalina alla dose di 2-3 g/kg, può essere antagonizzata nella misura del 70 %.
Tale azione acceleratrice è più pronunciata nei cani non anestetizzati e depressi con tiopental: meno pronunciata lo è nei cani in anestesia da pentobarbital e molto meno ancora nei cani in anestesia eterea o da barbital sodico [Marsh e coll. (170)].
In un solo esperimento condotto dagli AA. sull'uomo, la protoveratrina somministrata per os alla dose di 250 g, non è stata tollerata.
Krayer e coll. (171) hanno studiato su preparati cuore-polmone di cane in condizioni standard di pressione, di volume totale del sangue, di gittata e di velocità, l'azione dell'adrenalina e della veratramina sul periodo di funzionalità e di refrattarietà assoluta della trasmissione atrio-ventricolare.
L'adrenalina per perfusione continua alla velocità di 0,1-0,6 g/minuto, abbrevia il periodo di funzionalità e di refrattarietà assoluta e il tempo di propagazione atrio-ventricolare. Quantunque questa attività fosse condizionata dalla velocità di perfusione e quindi dall’intensità dell’effetto, gli AA. osservarono che le tre suddette funzioni non presentano variazioni parallele.
La veratramina alla dose di 0,1-1 mg non induce effetti distinti sulle funzioni studiate e alla dose totale di 0,1-0,2 mg, non era in grado di abolire o di prevenire gli affetti dell’adrenalina quantunque l’azione cardioacceleratrice di questa fosse notevolmente ridotta o abolita.
L'alto grado di selettività dell’azione veratraminica sull’attività automatica del nodo seno-auricolare verrebbe, secondo gli AA., ulteriormente confermata.
La veratramina e la veratrosina iniettata a gatti spinali e vagotomizzati, alla dose di 0,1-0,3 mg/kg diminuiscono, secondo Innes e coll. (172) la velocità basale cardiaca e ostacolano l’aumento di frequenza dovuto a stimolazione dei nervi acceleratori.
L’azione della veratrosina è più lenta di quella della veratramina nel ridurre la velocità basale cardiaca. La denervazione simpatica cronica del cuore, praticata due settimane prima, non altera l’effetto della veratramina sulla velocità basale cardiaca e sull’azione acceleratrice dell’adrenalina.
Lo stesso Innes, in collaborazione col Krayer (173), ha studiato ulteriormente l’azione della veratramina sul preparato cuore-polmoni di cane liberato dalle catecolamine mediante iniezioni di reserpina alla dose di 0,5 mg/kg, 2-3 giorni prima dell’esperimento.
Essi osservarono che la velocità iniziale del cuore era significativamente più bassa di quella del preparato cuore-polmoni di cane normale e che la sensibilità all’azione cardioacceleratrice dell’efedrina era ridotta.
Una definitiva azione deceleratrice, mascherata nel preparato cuore-polmoni di cane normale, per emissione di catecolamine, è stata osservata dagli AA. dopo svuotamento, in seguito a iniezione di reserpina alla dose di 3-20 mg.
La veratramina ha un effetto cronotropo negativo sul cuore nel preparato cuore-polmoni liberato dalle catecolamine, non meno significativo di quello che si osserva sullo stesso preparato di cane normale.
L’azione, secondo gli AA., deve essere considerata diversa da quella dovuta ad una inibizione dell’azione cardioacceleratrice della noradrenalina e dell’adrenalina intrinseca.
De Jong e van Proosdij-Hartzema (174) hanno osservato che la veratramina alla dose di 0,1 mg/kg produce nei ratti normali e con ipertensione indotta mediante legatura dell’arteria renale, dopo nefrectomia unilaterale, un effetto ipotensivo che può raggiungere la durata di 6 ore.
Kenjiro Kimishima e Tario Kanno (175) hanno osservato che iniezioni endovenose di veratramina nel coniglio, determinano caduta della pressione dovuta a rallentamento cardiaco e aumento dovuto alla sua azione centrale. La veratramina inibisce l’attività del cuore isolato di rana e di coniglio, aumenta, al di sopra di determinate concentrazioni, la contrazione dell’intestino isolato di coniglio e antagonizza l’effetto della veratrina sul muscolo isolato di rana. Alla concentrazione dello 0,1% la veratramina non ha azione stimolante locale, nè azione paralizzante.
Reuse-Blom (176) ha studiato l'azione della veratramina sulle orecchiette isolate del cuore di coniglio ed ha trovato che questa sostanza, alla concentrazione di 0,25 g per cc ne arresta il battito. L'aggiunta di adrenalina alla concentrazione di 2,5 g per cc o di acetilcolina alla concentrazione di 0,25 g per cc antagonizza l’azione veratraminica, riconducendo l’ampiezza e la frequenza delle pulsazioni sin quasi ai valori iniziali.
Il cloridrato di veratramina possiederebbe, secondo l’A., indipendentemente dalla sua azione cronotropa negativa già descritta da altri AA., un’azione inotropa negativa molto marcata sull'orecchietta destra del cuore di coniglio che viene compensata tanto dall’adrenalina quanto dall’acetilcolina. La veratramina diminuisce moderatamente la velocità di conduzione, la quale viene bruscamente soppressa con la riduzione dell’ampiezza al disotto di un livello critico. La conduzione ristabilita dall’adrenalina e dall’acetilcolina sembra essere essenzialmente legata all’aumento d’ampiezza delle contrazioni e non al ristabilirsi della normale velocità di conduzione.
Benforado e coll. (177) hanno studiato gli effetti della veratramina sul ritmo nodale atrioventricolare e sul flutter auricolare nel preparato cuore-polmoni di cane nel quale era stato prodotto il ritmo atrioventricolare per distruzione del nodo senoatriale.
Il valore medio della diminuzione della frequenza così ottenuta, era di 100 battiti/minuto. L’efedrina fino alla dose di 3 mg, riportò la frequenza ad un valore massimale di 187 battiti/minuto, corrispondente ad un aumento della frequenza media massimale di 140 battiti/minuto.
La curva di attività costruita in base al log della dose per l’efedrina nel ritmo senoatriale e atrioventricolare, era simile.
La ED50, in entrambi i casi era di circa mg 0,2. La veratramina esercita una marcata azione cronotropa negativa durante il ritmo atrioventricolare. A piccole dosi è stata notata un’attività periodica del ritmo del seno (pace maker) che non si osserva durante il ritmo senoatriale nel preparato cuore-polmoni di cane.
L’effetto antiacceleratore della veratramina durante l’accelerazione atrioventricolare prodotta dall'efedrina, non era rimarchevole. La ED40 approssimata era di 40 mg.
Durante il ritmo atrioventricolare (diverso dal ritmo senoatriale) è stata notata dagli AA. una grande differenza fra la dose necessaria per l’azione cronotropa negativa e la dose necessaria per l’effetto antiacceleratore della veratramina. Ciò fa pensare che le due proprietà della sostanza siano ben distinte e non in relazione fra loro.
In un flutter auricolare indotto sperimentalmente, forti dosi di veratramina (da 7 a 30 mg per preparato cuore-polmoni), rallentarono la velocità del flutter e produssero una reversione a ritmo senoatriale. Ciò si verifica con la stessa dose necessaria per l’effetto antiaccleratore durante il ritmo atrioventricolare.
Le forti concentrazioni di veratramina necessarie per indurre l'azione antiacceleratrice al nodo atrioventricolare e l’effetto antiaritmico, contrastano notevolmente con l’alta sensibilità nel nodo senoatriale.
Un’inibizione non selettiva del tessuto respiratorio per le alte concentrazioni, può essere la causa di questa differenza.
Murnaghan (178) trovò che la veratramina, sulle orecchiette isolate e sul cuore perfuso di cavia è meno attiva nell’antagonizzare l’effetto acceleratore prodotto dall’istamina che quello prodotto dall’adrenalina.
Sul cuore isolato e perfuso di gatto o sul gatto spinale, la veratramina è meno attiva, come agente antiacceleratore, contro la teofillina e la caffeina che contro l'isoproterenolo o l’adrenalina.
In base a questi risultati, l'A. ritiene che l’istamina e le basi xantiniche inducano un’accelerazione cardiaca per azione diretta piuttosto che mediante l’emissione delle catecolamine di riserva nel cuore e che la veratramina possegga un’azione cronotropa negativa meno sensibile, indipendentemente dal suo effetto antisimpaticomimetico.
Maison e coll. (179) hanno determinato l’attività pressoria relativa a 15 sostanze derivate dal Veratro, comparativamente col Veriloid. Le varie sostanze venivano somministrate per perfusione endovenosa e considerando uguale a 1 l’attività ipotensiva del Veriloid, gli AA. hanno ottenuto un valore uguale a 11 per la germitrina, 8,7 per la neogermitrina, 5,3 per la germerina, 4,7 per la protoveratrina, 2,4 per la germidina, 0,5 per la veratridina, 0,3 per la veratrina, 0,18 per la veradina e 0,03 per la veratramina. Per la germina, la rubiiervina, la iervina e la isorubiiervina, data la loro scarsa attività, non è stato possibile agli Autori giungere ad una determinazione esatta.
Le curve della risposta-dose, fanno ritenere agli AA. che esista un’identità nel meccanismo d’azione della protoveratrina, della veratridina e di una miscela degli esteri alcaloidi.
Kupchan (180) da un esame comparativo dell’azione ipotensiva relativa agli esteri alcaloidi del Veratro, trae la conclusione che il numero, la natura e la posizione degli acidi esterificati, hanno importanza nel determinare il grado dell’azione ipotensiva. L’A. ha raccolto i dati da lui ottenuti in una tabella dalla quale appare evidente la relazione esistente fra struttura e attività.
2) Azione locale
I preparati totali di Veratro verde o bianco e i loro alcaloidi, applicati sulla cute o sulle mucose, eccitano prima e paralizzano poi i recettori sensoriali, ragione per cui essi furono impiegati come revulsivi cutanei, come sternutatoci e come anestetici locali (anestetici dolorosi).
Sulla cute essi provocano bruciore, rossore e quindi anestesia. Sulle mucose del naso, degli occhi, della bocca e delle prime vie respiratorie, determinano forte irritazione e, rispettivamente, sternuti, lacrimazione, salivazione e tosse.
3) Azione sul rene
Il Veratro e i suoi alcaloidi, allorché vengono somministrati a dosi normali o comunque non elevate, non modificano sostanzialmente la funzionalità del rene. Il flusso sanguigno renale non viene significativamente diminuito e soltanto quando l’ipotensione raggiunge valori molto bassi, la filtrazione glomerulare diminuisce e conseguentemente diminuisce anche la secrezione urinaria, la quale però si normalizza di solito, anche prima che la pressione torni ai valori iniziali (166).
La vasodilatazione riflessa, tanto negli individui normali quanto in quelli affetti dalle varie forme di ipertensione, interessa anche i vasi renali e in particolare, le arteriole glomerulari afferenti (141).
4) Azione sui muscoli scheletrici
Gli esteri alcaloidi del Veratro manifestano sui muscoli striati la caratteristica azione della veratrina descritta per la prima volta da Bezold e Hirt (131) circa cento anni fa.
Sotto l’azione della veratrina un muscolo striato, reagisce alla stimolazione elettrica con una contrazione normale, ma la seguente fase di decontrazione o di rilasciamento, è molto ritardata e avviene in un tempo superiore di circa 50 volte a quello normale (Fig. 16).

8
Gli alcaloidi veratrinici puri, quali la protoveratrina, la veratridina, la cevadina, la iervina, la rubiiervina, la cevina e la germina, rendono sensibile, secondo Gautier (182), il muscolo isolato di anfìbio, agli joni K+ con un’intensità d’azione che è parallela alla loro tossicità. Per la cevina, la cevadina e la veratridina, l’A. ha posto in evidenza un’azione decurarizzante.
Lister e Lewis (183) hanno studiato gli effetti della protoveratrina A negli scambi jonici dei muscoli e dei nervi nella rana e nel ratto rispetto al K+ e al Ca++. Essi hanno notato che la protoveratrina A aumenta l’efflusso del K+ dal cuore ma non dai muscoli scheletrici della rana e del ratto. L’assunzione di K+ da parte dei muscoli scheletrici è aumentata ed è favorita l’emissione di una maggior quantità di Ca++.
Secondo gli AA. questi risultati indicano che la protoveratrina e relativi alcaloidi del Veratro, interferiscono col metabolismo del Ca++ sulla superfìcie cellulare, alterando la permeabilità della membrana e l’equilibrio ionico che è il fattore responsabile delle azioni caratteristiche del Veratro sui nervi e sui muscoli.
Successive ricerche degli stessi AA. (184) sugli effetti della protoveratrina, sul livello plasmatico del K+ nel gatto e nel coniglio, hanno dimostrato che questa sostanza aumenta il livello del K+ nel plasma venoso dei conigli normali e dei gatti anestetizzati.
A dosi terapeutiche la protoveratrina induce un aumento del K+ nel plasma sanguigno della circolazione coronarica, ma non in quello dei muscoli scheletrici.
E’ significativo, secondo gli AA., che dei vari tipi di terminazioni nervose che possono essere stimolate dalla protoveratrina, quelle che sembrano essere più sensibili, in quanto stimolate dalle concentrazioni più basse, sono situate nelle pareti del cuore e nell’area di distribuzione coronaria sinistra e possono dar inizio all’effetto Bezold.
Sembra possibile agli AA. che il relativamente elevato afflusso di K+ che si verifica in questa regione per azione della protoveratrina, possa interessare prevalentemente queste terminazioni e facilitare così l’inizio del riflesso.
Kolb e Korein (185), che hanno studiato un preparato contenente gli alcaloidi totali del Veratro bianco, ritengono di poter spiegare gli effetti tossici che si manifestano in pazienti cui il preparato veniva somministrato a dosi piuttosto elevate, con nausea, vomito e con una sindrome miotonica interessante i muscoli delle estremità e la lingua, pensando ad un aumento del postopotenziale negativo con aumento della depolarizzazione della membrana muscolare, dominante gli impulsi ripetuti dopo un singolo stimolo. Questo effetto che sembra essere secondario all'imperfetto trasporto jonico (K+ e Na+) attraverso la membrana, causato dalla droga, fa pensare agli AA. all’esistenza di una possibile relazione fra questi effetti e il meccanismo della miotonia.
Non tutti gli alcaloidi del Veratro agiscono sui muscoli striati nella maniera anzidetta. La veratramina per es., non solo non è dotata di azione veratrinica ma, antagonizza l’azione della veratrina sul muscolo isolato di rana, come fu notato da Kenjiro Kimishima (175) e più recentemente da Witt e Swain (186), i quali trovarono che di uguale azione antiveratrinica sono dotate anche altre sostanze quali la strofantina, la chinina e la chinidina a particolari concentrazioni.
Flacke (187) ha studiato l’effetto della germina e di alcuni suoi esteri acetici (manoacetato, diacetato, tetracetato, isotetracetato e pentacetato), sul muscolo sartorio di rana, misurando l’aumento di tensione dopo ogni singolo shock e durante la stimolazione tetanica, la velocità di aumento di tensione e la durata delle contrazioni. Il potenziale di transmembrana era registrato con microelettrodi. Nessuna delle sostanze studiate altera l’ampiezza della tensione tetanica a concentrazioni che provocano variazioni massimali nella risposta ad ogni singola stimolazione.
La germina, il monoacetato e il diacetato, aumentano la tensione di contrazione solo moderatamente; nelle migliori condizioni, il monoacetato e il diacetato producono una tensione di contrazione che è uguale alla tensione tetanica.
La germina tetracetato, isotetracetato e pentatetracetato, inducono una postcontrazione simile a quella determinata dalla veratridina. La contrazione durante la postcontrazione, non raggiunge neppure l’intensità della tensione tetanica. Tutte le sostanze studiate determinano la comparsa di un’attività elettrica ripetuta in risposta ad ogni singola stimolazione. In tutti i casi la durata e la frequenza dell’attività ripetitiva era sufficiente per spiegare lo sviluppo di tensione osservato.
Con germina monoacetato e con diacetato, l'attivazione del muscolo durante il periodo di attività ripetitiva era completo, cioè tutte le fibre partecipavano all’effetto della droga per tutta la loro lunghezza.
Con germina tetracetato e pentatetracetato e con veratridina, invece, non tutte le fibre erano simultaneamente attive durante la postcontrazione. Secondo gli AA., è possibile che ciò sia dovuto alla concentrazione critica necessaria della droga e all’affaticamento parziale delle fibre.
5) Azione sui muscoli lisci
La tintura di Veratro verde fatta agire su segmenti di intestino isolato di coniglio, determina un notevole aumento del tono delle fibre longitudinali mentre l’ampiezza delle contrazioni ritmiche rimane invariata.
Le contrazioni delle fibre circolari subiscono invece un modesto e transitorio aumento di ampiezza (Fig. 17).

9
Dopo atropinizzazione o ergotaminizzazione, l’ipertono delle fibre longitudinali prodotto dalla stessa dose di tintura di Veratro verde, è meno intenso, mentre la ripresa delle contrazioni delle fibre circolari è più duratura (Figg. 18 e 19).

0
Dopo atropinizzazione ed ergotaminizzazione, l’aggiunta di tint. di Veratro porovoca dopo qualche minuto, un leggero ipertono delle fibre longitudinali mentre la ripresa delle contrazioni delle fibre circolari è più attiva e più durevole (Fig. 20).

1
Questi risultati dimostrerebbero un’evidente azione sulla fibra muscolare liscia, pur senza escludere una componente vagale, la cui presenza potrebbe essere giustificata dalla più attiva azione tonica che si osserva nei segmenti normali.
Un aumento delle contrazioni dell’intestino isolato di coniglio venne più recentemente osservata anche da Kenjiro Kimishima e coll. (175) per azione della veratramina.
6) Azione sul sistema nervoso
Salva (153) in uno studio comparativo sull’azione farmacologica del Veratro bianco e della Rauwolfia, osservò che l’attenzione dei ricercatori venne diretta specialmente allo studio dell’azione ipotensiva del Veratro e a quello delle azioni ipotensiva e sedativa della Rauwolfia, ma non hanno posto in evidenza le caratteristiche farmacologiche simili dei loro principi attivi i quali, sotto questo aspetto, hanno secondo l’A., molti punti in comune:
«Gli alcaloidi del Veratro hanno sul sistema nervoso centrale un’azione complessa che produce a dosi deboli, una modificazione della reattività dei centri vegetativi e progressivamente una inibizione funzionale che arriva sino alla narcosi totale reversibile.
Questo rallentamento delle funzioni nervose, con ipotermia ed ipotensione, può essere considerata come una neuroplegia comparabile a quella che si ottiene con la cloropromazina e con le associazioni litiche preconizzate da Laborit e Huguenard (154). Questa attività inibitrice si avvicina a quella designata da Decourt (155) con il termine di «narcobiotica», poiché essa si estende ad animali che occupano gradini molto diversi nella scala zoologica».
Felcete e Saporny (188) notarono che un preparato costituito da protoveratrina A e B, era dotato della proprietà di prolungare il sonno prodotto da vari anestetici, di aumentare l'effetto convulsivante del pentametilentetrazolo e di ridurre la tossicità della fenilisopropilamina, trovando anch'essi che il comportamento del suddetto preparato era, sotto alcuni aspetti, simile a quello della reserpina.
Un'azione totalmente diversa fu constatata da Fukuma Keizo (189) e da altri per la veratramina la quale somministrata a dosi di 0,2-0,5 mg/kg a conigli, gatti, cavie e cani, produce eccitamento in tutte le specie. Dosi intracisternali pari a 1/5 della dose per via endovenosa, determinano un analogo stato di eccitazione. L'etere, la mefenesina e l'aminopirina, antagonizzano tale azione nei conigli. Il fenobarbital, la difenilidantoina, il trimetadione e la morfina, sono inibitori molto meno attivi dell'azione eccitatrice e la difenidramina, la procaina e la cloropromazina, sono senza effetto.
L'allontanamento dell’area motrice corticale e della corteccia totale nel gatto, diminuiscono l'azione eccitatoria. La sezione fra il cervello medio e il ponte, abolisce l'eccitazione dovuta a veratramina. Questa produce rapidamente attività e punte sull’elettroencefalogramma nel coniglio, ma non ha effetto sui preparati mesencefalici.
La veratramina per somministrazione intracisternale nel coniglio, aumenta la pressione arteriosa e inibisce la respirazione, effetti questi che non sono influenzati dalla sezione del cervello medio. Alcune azioni della veratramina sul sistema nervoso furono studiate da Schoetensack e Scheibler (190), i quali trovarono che la veratramina somministrata ai conigli alla dose di 0,25 mg/kg, per via endovenosa, provoca tremore: alla dose di 1 mg/kg convulsioni e che la dose di 2 mg/kg può essere letale.
Gli stessi fenomeni di tremore, convulsioni e morte, possono essere determinati nei ratti con la somministrazione endovenosa di dosi, rispettivamente, di 0,46, 1,35 e 7,05 mg/kg e, nei topi, con dosi di 0,06, 1 e 2,68 mg/kg.
I fenomeni convulsivi da veratramina in questi animali, differiscono da quelli che conseguono alla somministrazione di metrazolo (cardiazolo) e non sono antagonizzati dai barbiturici nè dalla 5-5-difenilidantoina, dalla 3-metil-5-fenil-5-etilidantoina o dal 3,5,5-trimetil-2,4-osazolidinedione. L’l-etinilcicloesilcarbamato, l'l-(bromoetinil)-cicloetanolo, la fenilacetilurea, la reserpina, la mianesina, il benzimidazolo, il 2-aminobenzotiazolo e il 2-amino-5-clorobenzoxazolo, inibiscono le convulsioni ma non il tremore il quale resiste anche alle alte dosi di atropina.
Tario Kanno (191) ha studiato comparativamente l'azione determinata dalla protoveratrina, dalla veratridina e dalla cevadina, somministrate per iniezioni intracisternali nei conigli ed osservò che queste sostanze inducono un aumento della respirazione, disordini motori, agitazione, inquietudine e fenomeni convulsivi.
La protoveratrina ha dimostrato di possedere una marcata azione anestetizzante mentre la veratridina e la cevadina, dotate di azione farmacologica qualitativamente e quantitativamente simile, inducono una forte eccitazione motoria. L’azione della protoveratrina sarebbe, sotto questo aspetto, di circa 10 volte inferiore.
Il pretrattamento con cloropromazina inibisce l'eccitazione provocata da questi alcaloidi per iniezione endocisternale.
L'encefalogramma del coniglio viene gradatamente influenzato dall'azione di questi alcaloidi i quali, per iniezione intracisternale, dopo un’iniziale e temporanea riduzione della pressione arteriosa, determinano un prolungato aumento.
La vagotomia non modifica questi effetti prodotti dai tre suddetti alcaloidi i quali, per iniezioni ripetute, danno luogo a fenomeni di tachifilassi.
Tutti e tre gli alcaloidi considerati e in particolare la protoveratrina, iniettati endovena, provocano vomito che non viene influenzato dalla vagotomia ma viene inibito dopo la rimozione di ambedue i gangli nodosi. Il vomito da protoveratrina viene notevolmente ostacolato anche dai depressori centrali, quali l'etere, l'uretano, il metil exabital, la morfina e la cloropromazina.
7) Azione sulla regolazione termica
L'azione antitermica dei veratri è stata studiata da Salva (153) su conigli resi ipertermici mediante iniezione di pirogeni. I risultati ottenuti sono stati giudicati straordinariamente interessanti dall'A., avendo egli rilevato che gli esteri alcaloidi del Veratro bianco, sono dotati di un'azione sui ceatri termoregolatori, superiore a tutti gli antitermici oggi conosciuti.
Più recentemente Valdecasas, in collaborazione con lo stesso Salva e con Laporte (192), ha studiato l'effetto ipotermizzante della protoveratrina e degli esteri alcaloidi totali del Veratro bianco, trovando che quando questi vengono iniettati nei conigli alla dose di 100 g/kg, determinano un'immediata diminuzione della temperatura corporea che dopo 2 ore raggiunge un abbassamento massimo di 0,6°-1,8°, con ritorno alla norma dopo 5 ore.
Nei conigli infettati con Salmonella Typhosa pirogena, la quale produce un aumento della temperatura di 0,6°, il trattamento coi suddetti alcaloidi produce un abbassamento della temperatura di 0,1° al di sotto dei valori osservati nei controlli.
Quando ai ratti vengono somministrate dosi di 200-500 g/kg dei suddetti esteri alcaloidi, un'ora prima di essere posti in un ambiente chiuso alla temperatura di 21°, il tempo di sopravvivenza veniva prolungato rispetto ai controlli, del 13-56%.
Analoga azione ipotermizzante dovuta agli esteri alcaloidi del Veratro bianco, era stata notata precedentemente anche da Illera e coll. (193).
8) Terapia
a) Preparati totali e complessi alcaloidici
L'impiego dei preparati totali di Veratro (estratti, tinture) nella terapia dell'ipertensione arteriosa è noto da tempo ma è specialmente in questi ultimi 10 o 15 anni che gli studi sull'azione di questa droga, sia dal punto di vista farmacologico che terapeutico, si sono moltiplicati al fine di ricercare i mezzi più idonei da offrire al medico per combattere la malattia ipertensiva. Così, ai preparati totali della droga, incostanti nella loro composizione e nella loro attività terapeutica, si sono venuti sostituendo i suoi complessi alcaloidici, sotto forma di vari preparati a composizione costante e titolati biologicamente, gli alcaloidi puri e specialmente la protoveratrina.
Occorre dire però che, data la tossicità di questi preparati, il ristretto margine esistente fra dose terapeutica e dose tossica, le azioni secondarie cui possono dar luogo e le differenze individuali di tollerabilità, il loro impiego in terapia non è attualmente così diffuso come quello di altre droghe meglio tollerate e con un più elevato coefficente terapeutico, il cui impiego risulta più facile e privo di quelle azioni secondarie che limitano l'uso dei preparati di Veratro.
Fra i numerosi autori dai quali questi preparati sono stati largamente sperimentati nelle varie forme di ipertensione, molti sono favorevoli al loro impiego, mentre altri sono più cauti o decisamente contrari. Tutti sono però concordi nel ritenere che questi preparati debbano essere impiegati con le dovute cautele, che non debbono essere usati nelle forme leggere di ipertensione ma riservati ai casi più gravi o ribelli ad altri trattamenti, casi nei quali si sono ottenuti i risultati migliori ed a volte risolutivi.
Noi riferiremo i risultati ottenuti dai diversi autori, al fine di delineare un quadro sufficientemente esatto dell'utilità terapeutica di questi preparati e dal quale risultino più chiari i limiti delle loro indicazioni, gli inconvenienti che ne possono derivare, le dosi e le vie di somministrazione più opportune.
Freis e Stanton (194) hanno sperimentato l'azione di un complesso alcaloidico di Veratro verde su 40 pazienti affetti da ipertensione arteriosa ed hanno notato che l'azione ipotensiva comincia a manifestarsi dopo 1-2 h, raggiungendo il massimo dopo 4-6 h e cessa dopo 14 h. Al fine di ottenere i risultati terapeutici migliori, evitando gli effetti tossici dovuti all'accumulo, specialmente allorché vengano impiegate dosi elevate, gli Autori consigliano di somministrare il preparato con intervalli di 12 h.
I migliori risultati sono stati ottenuti nei casi di ipertensione complicata da debolezza cardiaca e in quei malati soggetti a crisi ipertensive o a fenomeni gravi dovuti a ipertensione di vecchia data e resistenti ai comuni trattamenti. In alcuni casi la somministrazione prolungata ha prodotto una diminuzione del volume cardiaco ed ha normalizzato l’ECG.
Pur non avendo osservato l'insorgere di fenomeni tossici, gli AA. raccomandano tuttavia che i pazienti vengano attentamente seguiti durante il trattamento, in considerazione degli effetti secondari che sono stati notati e della particolare sensibilità osservata in alcuni casi di ipertensione moderata. Secondo Wilkins (195), l'impiego del Veratro verde non è scevro di pericoli. Somministrato per via orale può produrre disturbi gastrici con nausea, vomito ed anche collasso, qualora non si abbia estrema cura nel dosaggio. In alcuni pazienti la gravità di questi disturbi può essere ridotta mediante pretrattamento con dramamina (50 mg prima dei pasti) o con l’impiego combinato di atropina ed efedrina. Meglio tollerati si sono dimostrati gli estratti purificati e gli alcaloidi puri. La dose terapeutica deve essere stabilita, secondo l’A., caso per caso.
Un preparato stabile ed a composizione costante, contenente gli esteti alcaloidi del Veratro verde (il Veriloid), è stato impiegato con successo da Kauntze e Trounce (196) i quali consigliano di iniziare il trattamento con la dose di 10 mg pro die suddivisa in 4 singole dosi. Questo preparato può essere somministrato endovena e per via orale, ma in quest’ultimo caso l’assorbimento è irregolare e quindi il dosaggio risulta più difficile: il paziente dovrà essere allora strettamente sorvegliato e ciò anche perchè la sua sensibilità può variare nel corso della terapia.
Azioni secondarie spiacevoli, quali indisposizione, vomito, disturbi circolatori, collasso, sono piuttosto rari e vengono antagonizzati con barbiturici ma non con antistaminici. Il preparato abbassa la pressione in circa il 66% dei pazienti che possono tollerare il trattamento. Nel 20-30% dei casi non è tollerato. L’insufficienza renale non costituisce una controindicazione.
Seliger (197) che ha impiegato questo preparato per via endovenosa, secondo il dosaggio indicato dagli AA. precedentemente citati, in 60 casi di ipertensione di varia natura, ha potuto constatare che esso è efficace nelle ipertensioni essenziali, arteriosclerotiche e climateriche. Gli stati ipertensivi recenti reagiscono bene, di solito, mentre le ipertensioni arteriosclerotiche di vecchia data sono poco influenzate da questo trattamento.
E’ nota da lungo tempo l’efficacia dei preparati di Veratro nell’ipertensione dovuta a tossicosi gravidica e all’eclampsia, che si manifesta sia durante la gestazione che nelle puerpere [Mangiagalli (198), Zuike (199), Haultain (200), Miranda (201)], ciò che venne confermato anche più recentemente da diversi autori fra i quali Garber e coll. (202) che trattarono con Veratro verde 196 casi di eclampsia ottenendo un solo risultato negativo, Cutforth (203), Seliger (204) il quale trattò 9 casi di eclampsia con un preparato contenente gli esteri alcaloidi del Veratro (il Veriloid) e con soluzioni di solfato di magnesio al 50% e di glucosio al 20%, protraendo il trattamento sin dopo il parto.
La soluzione di magnesio e glucosio venne somministrata al fine di compensare la ritenzione iniziale di urina dovuta all’ipotensione. Alban e coll. (205) che impiegarono, con pieno successo in 10 pazienti affette da tossicosi gravidica, un altro preparato di Veratro (il Veratrone) alla dose di 2 cc diluito in 10 cc di soluzione di glucosio al 5%, ogni ora, notarono effetti secondari consistenti in sintomi, non gravi, di vertigine e di vomito, che soltanto in un caso resero opportuna la sospensione del trattamento.
Anche da Baird e Assali (206) vennero riferiti i buoni risultati ottenuti con l’impiego di due preparati, in uno dei quali il Veratro era associato con rutina e con luminal (Verenteral e Veraflex) e che vennero somministrati per os e endovena a 47 pazienti preeclamptiche ed a 6 eclamptiche.
Casi di eclampsia e di tossicosi gravidica furono trattati con diversi preparati di Veratro e con buoni risultati da numerosi altri autori, quali Kàser (207), Krupp e coll. (208), Meilman (209), Morris (210) ed altri.
Secondo Stearns e Ellis (211) gli alcaloidi del Veratro verde possono essere somministrati per via endovenosa con relativa sicurezza anche nei pazienti affetti da gravi disfunzioni renali, cardiache o cerebrali, purché essi vengano somministrati per infusione endovenosa lenta. Questa può essere iniziata con una dose di 0,60-0,68 microgrammi/kg/minuto, continuando poi a seconda dei pazienti, sino a raggiungere la dose massima di 10-12 g/kg.
In due casi è stata raggiunta la dose di 19 g/kg.
La pressione deve essere controllata ogni minuto durante l’iniezione e anche dopo.
Gli effetti secondari che a volte si manifestano, sono dati da sintomi di vomito e di bradicardia, i quali però non giungono ad un grado di gravità tale da rendere necessaria la sospensione del trattamento.
Elek e coll. (212) hanno studiato le alterazioni elettrocardiografiche che seguono la somministrazione endovenosa di una miscela di alcaloidi del Veratro verde in soggetti ipertesi. Il tracciato ECGrafico, che veniva eseguito prima, durante e dopo la somministrazione, ha dimostrato la frequente comparsa dell’inversione dell’onda T nelle derivazioni precordiali e specialmente da V2 a V4.
Tale inversione risulta molto pronunciata e simile, nell’aspetto, a quella che si osserva nelle cosiddette T ischemiche. La persistenza di una tale immagine si prolungava sino ad un’ora e mezza. Non coesistevano sintomi anginosi e neppure alterazioni della potassiemia che potessero giustificare le suddette modificazioni dell’onda T, le quali non venivano influenzate da inalazioni di ossigeno, mentre venivano annullate dai farmaci simpaticomimetici. In qualche caso gli AA. notarono un’aritmia ectopica e un blocco atrioventricolare di I grado o totale.
In un caso la stimolazione senocarotidea ha determinato modificazioni dell’onda T simili a quelle prodotte dall’iniezione endovenosa degli alcaloidi del Veratro verde. Secondo gli AA. l’alterazione ECGrafica suddetta dovrebbe essere attribuita a modificazioni (ritardi) di origine vagale, nella ripolarizzazione degli strati epicardici.
Secondo Smirk e Chapman (213) soltanto 1/3 o 1/4 dei soggetti trattati con una miscela di alcaloidi del Veratro verde, somministrata oralmente, reagiscono con un abbassamento della pressione arteriosa, compreso fra i 40 e gli 80 mmHg, senza gravi fenomeni tossici. Quando il paziente risponda alla terapia, il livello della pressione arteriosa poteva essere controllato durante il giorno con una somministrazione opportunamente intervallata, benché l’insorgere di fenomeni tossici di media gravità, fossero occasionalmente inevitabili. Un inconveniente era dato dal fatto, secondo gli AA., che non era possibile prevedere quali pazienti avrebbero reagito favorevolmente al trattamento senza avere prima eseguito prove individuali: occorrono inoltre molti giorni per stabilire l’effettiva dose di mantenimento. Le miscele degli alcaloidi del Veratro, non sembrano adatte, secondo gli AA., per il trattamento di complicazioni cardiache acute da ipertensione e di fatti cerebrali, poiché troppo numerosi sarebbero i casi refrattari al trattamento.
I fenomeni da intolleranza (vomito, sensazioni retrosternali della gravità di attacchi anginosi) sono inoltre molto frequenti e quando si presentano, pregiudicano la ripresa degli ammalati acuti.
Saphire (214) al contrario, trovò che gli esteri alcaloidi del Veratro, sotto forma di un preparato standardizzato (il Veriloid), sono utili nella forma di ipertensione maligna e in quelle non maligne ma con sintomi ipertensivi di notevole gravità. Lo sconsiglia invece, trovandone irrazionale l’impiego, nei casi di ipertensione benigna e con leggeri disturbi ipertensivi.
A pazienti ospedalizzati, con ipertensione maligna, essenziale o di origine renale, egli somministrava oralmente, tavolette contenenti 1-2 mg di esteri alcaloidi, alla dose iniziale di 3 mg, 4 volte al giorno dopo i pasti, dose che veniva aumentata sino a ottenere una risposta ipotensiva o emetica. Spesso questi effetti si manifestavano simultaneamente e allora il dosaggio veniva corretto sino a ottenere soltanto la risposta ipotensiva, la quale avveniva da mezz'ora a un’ora dopo la somministrazione e scompariva dopo 4 o 5 ore.
Anche Ford e coll. (215) trovarono che gli alcaloidi del Veratro sono superiori ad altri medicamenti nel trattamento delle crisi ipertensive. E’ sempre possibile, secondo gli AA., ridurre una marcata ipertensione in
10-20’, mediante infusione endovenosa di esteri alcaloidi (Veriloid), pur essendo necessario un costante controllo della velocità di iniezione.
Anche per via intramuscolare, per iniezioni ripetute e stabilendo la dose optimum del preparato, è possibile ottenere gli stessi effetti che normalmente si ottengono con la somministrazione endovenosa. Tuttavia, avendo notato che la durata della riduzione pressoria ottenuta per questa, via, è relativamente breve (3 ore e un quarto, in media), gli AA. hanno sperimentato il complesso alcaloidico contenuto nel suddetto preparato, sciolto in olio invece che in acqua.
Con ciò è stato possibile ottenere un prolungamento della durata di azione di circa il doppio (6 ore circa in media). La pressione dei pazienti, che prima del trattamento raggiungeva un valore medio di 212/127 mmHg, venne ridotta in media a 133/84. In alcuni casi la dose optimum ha prodotto effetti secondari di nausea e vomito, ma di breve durata, non preoccupanti e che venivano attenuati o prevenuti con la somministrazione di un antiemetico. La soluzione oleosa (preparato deposito) degli esteri alcaloidi contenuti nel Veriloid, consente la somministrazione intramuscolare a dosi più distanziate. Tuttavia, sia le soluzioni acquose che quelle oleose, somministrate per via intramuscolare, sono meno efficaci delle soluzioni acquose somministrate endovena. La preparazione oleosa è consigliata dagli AA. nei casi in cui non sia possibile seguire il trattamento con una costante sorveglianza com’è necessario qualora la somministrazione venga fatta per via endovenosa. Anche in questo caso però la dose deve essere stabilita caso per caso.
Tumiotto e coll. (216) che trattarono con un preparato a base di protoveratrina (il Veralba) un gruppo di 30 pazienti, 19 dei quali ricoverati e 11 seguiti ambulatoriamente, confermano in linea di massima, i risultati ottenuti da altri AA. e concludono consigliando «di saggiare in ogni caso d’ipertensione arteriosa, la sensibilità individuale alla protoveratrina, potendo questo farmaco, nei casi positivi, rappresentare un efficace controllo del regime pressorio attraverso la messa in funzione di meccanismi riflessi che rientrano nei sistemi fisiologici di regolazione della omeostasi circolatoria».
Mills e Moyer (217) i quali hanno studiato comparativamente l’azione di due preparati commerciali a base di esteri alcaloidi del Veratro verde nel trattamento dell’ipertensione, giungono alla conclusione che essi esercitano un definito effetto ipotensivo in alcuni pazienti, ma che in una larga percentuale questo effetto è minimo e non si può sperare di ricondurre la pressione al livello normale. Un’alta incidenza di azioni secondarie (nausea, vomito, bruciore epigastrico, sensazione di stanchezza, debolezza e aumento della salivazione) limitano inoltre l’impiego di questi preparati.
Gli AA. hanno tuttavia trovato che per il trattamento delle crisi ipertensive ed encefalopatiche, la somministrazione di uno dei due preparati (il Veriloid) per infusione endovenosa continua, dà risultati molto favorevoli.
Essi somministravano il preparato alla dose di 0,5 g/kg/minuto, fino ad ottenere una soddisfacente risposta ipotensiva: il trattamento era poi continuato con l’infusione endovenosa di una soluzione contenente mg 0,36%o del preparato, alla velocità di 10-100 goc./minuto, per 18, 96 ore.
Ottenuti gli effetti voluti, il trattamento veniva continuato con la somministrazione del preparato per via intramuscolare o orale.
Lo studio comparativo di questi preparati con gli agenti bloccanti adrenergici e ganglioplegici, avrebbe dimostrato che con l’esametonio si ottengono i migliori risultati per somministrazione orale nelle cure prolungate e che il Veriloid per somministrazione endovenosa, è molto attivo nel ridurre rapidamente una crisi ipertensiva.
Lo studio di una frazione degli esteri alcaloidi ottenuti dal Veratro bianco, eseguito da Salva e Tarrida (218) ha dimostrato l’efficacia di questo preparato nel trattamento dell’ipertensione e, inoltre, la possibilità di adattare la dose secondo la reazione individuale al medicamento, la buona tollerabilità e l’assenza totale di accidenti ipotensivi. L’impiego dei preparati totali di Veratro e dei suoi complessi alcaloidici, oltre nella terapia dell’ipertensione arteriosa, è stato preconizzato anche nel trattamento di altre malattie. Forster (219) ne consigliò l’uso nella miastenia e Broat (220) riferisce di aver ottenuto buoni risultati in alcuni casi gravi somministrando tintura di Veratro verde oralmente alla dose di 15 goc. 2-5 volte al giorno (in media 30 goc. al giorno). L’azione subentra dopo 30’ e perdura per parecchie ore. Dosi di efedrina di g 0,05, 2-3 volte al giorno, ne esaltano l’azione e il cloruro di potassio alla dose di 4 mg al giorno, ne determina un prolungamento. In tutti i casi l’A. ottenne risultati compatibili con quelli che si ottengono con la prostigmina ed, a volte, migliori.
Fuller (221), in considerazione del fatto che nello scleroderma le alterazioni vascolari rappresentano un importante fattore nel progredire della malattia e ch
b) Protoveratrina
Meilman e Krayer (222) constatarono che la protoveratrina produce negli ipertesi un abbassamento della pressione arteriosa protraentesi da 1 a 3 ore, accompagnato da un rallentamento della frequenza cardiaca. L’atropina può prevenire o annullare questa azione bradicardizzante senza influenzare l’effetto ipotensivo. La veratridina sarebbe dotata, secondo gli AA., di un’azione analoga alla protoveratrina, seppure quantitativamente inferiore. La sua elevata tossicità la rende però poco adatta all'uso terapeutico.
Successivamente gli stessi AA. (223) hanno studiato su 10 soggetti normali e su 83 affetti da ipertensione di varia eziologia, il rapporto esistente fra dose ed effetto della protoveratrina somministrata per via endovenosa (per iniezione singola o per infusione continua), per iniezione intramuscolare e per via orale. Essi hanno osservato che all'iniezione endovenosa segue una caduta della pressione la cui intensità varia da soggetto a soggetto ma che è molto costante nello stesso individuo. Benché alle dosi più elevate corrisponda, in generale, un effetto ipotensivo più marcato e più duraturo, gli AA. non hanno potuto notare una stretta relazione di proporzionalità fra dose e effetto. Una buona risposta ipotensiva è stata ottenuta con dosi comprese fra 1,6-1,9 g/kg di p.c. (endovena). Alla somministrazione di dosi più elevate possono seguire sintomi di nausea, vomito, ipotensione marcata e disturbi del ritmo. Il massimo effetto ipotensivo è raggiunto di solito dopo 10’ dall’iniezione e la sua durata varia da una a tre ore ed a volte anche di più. Il coefficente terapeutico è molto basso. L’atropina può prevenire la bradicardia e le aritmie ma non la nausea e il fastidio retrosternale; la digitalizzazione preventiva facilita la comparsa dei fenomeni tossici.
Con la perfusione endovenosa continua, è possibile mantenere un determinato livello pressorio per tutto il tempo voluto e i fenomeni tossici sono, in questo caso, molto rari.
Per via intramuscolare la dose deve essere superiore da 2,5 a 3,5 volte a quella endovenosa. La comparsa dell'effetto si ottiene di solito dopo 20’ e raggiunge il massimo dopo 30’-60’: la sua durata è di 4-6 h e talvolta di 12 h.
In 15 pazienti ai quali la protoveratrina venne somministrata oralmente alla dose di mg 1-2,5, suddivisa in 3-5 somministrazioni ad intervalli di 4-6 ore, si ottennero risultati modesti ed incostanti.
Hoobler e Corley (224) che hanno impiegato la protoveratrina in soggetti ipertesi e per via endovenosa, oltre un intenso abbassamento della pressione, accompagnato da vasodilatazione periferica, hanno notato anche un rallentamento del polso ma non effetti secondari negativi. La dispnea derivante da insufficienza ventricolare sinistra acuta, tipica degli ipertesi, venne, almeno temporaneamente, alleviata. Benché la quantità delle urine emesse subisse una certa diminuzione durante il trattamento, gli AA. non notarono disturbi nell’ambito della circolazione renale. Essi ritengono però che, data la labilità della sua azione, la protoveratrina non si presti per trattamenti terapeutici prolungati.
Spuler (225) ha riferito i risultati ottenuti con protoveratrina nel trattamento di 20 pazienti sofferenti di gravi forme ipertensive, in gran parte resistenti a altre terapie. Una rapida caduta dei valori pressori venne osservata in tutti i casi e indipendentemente dalla forma ipertensiva da cui erano affetti e dalla sua eziologia. La dose di 0,125 mg di protoveratrina A e B, per via orale, veniva somministrata ogni 1-2 h, come dose di mantenimento. Un dosaggio più elevato (0,50-0,75 mg) veniva somministrato al mattino e alla sera.
I risultati più favorevoli furono ottenuti nei giovani e, con l’impiego delle dosi suddette, non furono mai osservati fenomeni da intolleranza.
I preparati contenenti protoveratrina A e B vengono di solito somministrati a dosi più elevate di quelli contenenti soltanto protoveratrina A. Aubertin (226) consiglia la dose di 1-2 compresse da 1 mg a colazione, ½ compressa dopo pranzo e ½ compressa dopo cena. Nei pazienti che presentano crisi parossistiche notturne, la dose più elevata va somministrata dopo il pasto serale.
Un altro prodotto a base di veratrina A e B venne sperimentato da Guzzi e Brina (227) i quali lo avrebbero trovato indicato in tutte le forme ipertensive, purché non complicate da situazioni coronaropatiche recenti. La sua azione terapeutica lenta ma graduale e progressiva, risulta positiva in un’elevata percentuale di casi: più sensibili, anche secondo questi AA., sono le forme senza grave compromissione sclerotica arteriolare.
Con la posologia media impiegata e cioè 0,25 mg di maleato di protoveratrina A e B, tre volte al giorno, aumentando a seconda dell’intensità, a 3 mg al giorno e somministrata a dosi singole ogni 8 ore dopo i pasti, gli AA. non hanno osservato i segni collaterali di ipersimpaticotonia, mentre i modesti e rari disturbi comparsi sono risultati molto facilmente dominabili.
I risultati più brillanti, specialmente nei soggetti con forme ipertensive refrattarie ai comuni trattamenti terapeutici, furono ottenuti dagli AA. associando alla protoveratrina A e B, l’idrazinoftalazina.
La protoveratrina A, secondo Winer (228) é un potente agente ipotensivo ma con un ristretto margine di dosaggio terapeutico, superato il quale, possono comparire effetti secondari la cui intensità é diversa nei vari pazienti.
La dose minima efficace corrisponderebbe, secondo l'A., a 0,4 mg e variazioni di 0,1-0,2 mg al di sopra di questa dose minima ipotensiva, provoca emesi.
Una miscela di protoveratrina A e B, in parti uguali, ha un effetto pari a circa la metà di quello relativo alla protoveratrina A pura. La protoveratrina B é inattiva per via orale, a dosi di molte volte superiori a quella ipotensiva di protoveratrina A.
Risultati di studi preliminari, hanno dimostrato inoltre, che la protoveratrina B, in dosi suddivise non superiori ai 10 mg al giorno, è dotata di azione ipotensiva duratura ma accompagnata da emesi e da effetti miotonici. L’A. raccomanda pertanto l’impiego della protoveratrina A pura, piuttosto di quello della miscela della A e della B.
Successivamente lo stesso Winet (229) eseguì alcune indagini cliniche comparative su di un gruppo di pazienti affetti da ipertensione essenziale o renale, ai quali le protoveratrine A e B vennero somministrate lentamente per via endovenosa, praticando per ciascun alcaloide almeno 4 dosaggi diversi. La dose massima somministrata a ciascun paziente veniva determinata in base al manifestarsi della caduta della pressione arteriosa ed alla comparsa dei sintomi di nausea e di vomito. I malati, su cui venivano eseguiti frequenti controlli ECGrafici, erano attentamente sorvegliati durante tutto il periodo dell'esperienza.
I risultati hanno dimostrato che ambedue gli alcaloidi sono dotati di energiche attività ipotensiva e bradicardizzante, che possono essere accompagnate da sintomi di nausea e di vomito, la cui intensità è risultata proporzionale alla dose somministrata e la rapidità con cui essi compaiono come la loco durata, sono risultate uguali per i due alcaloidi.
La protoveratrina B può essere un efficace agente ipotensivo anche se somministrata per os, ma in questo caso sono necessarie dosi molto elevate perchè il suo assorbimento gastrointestinale è incompleto e perchè essa viene in parte inattivata a livello del fegato. La somministrazione orale permette, secondo l’A. di ottenere un effetto ipotensivo molto più prolungato, con il vantaggio che i sintomi di nausea e di vomito sono meno frequenti.
Allorché i due alcaloidi vengano somministrati per via endovenosa, compaiono inizialmente sintomi di dispnea, parestesie e sensazione di calore che si estendono progressivamente dal torace al perineo e alle estremità, regredendo di solito, nello spazio di mezz’ora.
La diminuzione della pressione sistolica, diastolica e della frequenza del polso, inizia dopo pochi minuti, raggiunge il suo massimo dopo 12-25’ e ritorna ai valori iniziali dopo circa 3 ore. Soltanto in 5 malati l’A. ha osservato l’insorgere di una bradicardia piuttosto notevole, con 48 pulsazioni al minuto.
Sui tracciati ECGrafici si notò soltanto una transitoria inverisone dell’onda T in V4, V5, e V6.
Tutti questi effetti secondari sono stati immediatamente antagonizzati dalla somministrazione di solfato di atropina a dosi variabili da 0,4 a 1 mg.
Se l’attività delle due protoveratrine è risultata qualitativamente uguale, quantitativamente la protoveratrina B si è dimostrata meno attiva ma essa provoca con minor frequenza i sintomi secondari di nausea e di vomito.
In complesso la protoveratrina B dimostrò proprietà emetizzanti inferiori alla A, a dosi ugualmente attive sulla pressione arteriosa e venne meglio tollerata.
L’impiego della protoveratrina B dovrebbe essere pertanto preferito, secondo l'A., per la somministrazione endovenosa, nella terapia delle crisi ipertensive e in particolare, allorché all'ipertensione si associ uno stato eclamptico o un’insufficienza ventricolare sinistra, oppure ove si tratti di un’ipertensione maligna con encefalopatia ipertensiva.
La protoveratrina B dovrebbe essere preferita ai preparati di Rauwolfia in tutti i casi in cui è richiesto un effetto ipotensivo rapido ed intenso, mentre l’associazione dei due farmaci è ritenuta razionale dall’A., in quanto la protoveratrina si presta meglio per la terapia di attacco, mentre i preparati di Rauwolfia sarebbero più adatti per la terapia di mantenimento.
A risultati analoghi sono pervenuti Cray e Hamer (230) i quali hanno sperimentato la protoveratrina A e B su gruppi di pazienti ricoverati e ambulatoriali. Anch’essi hanno notato che le due protoveratrine somministrate per via endovenosa (alla dose di 0,15-0,21 mg) sono ugualmente efficaci, mentre per via orale la protoveratirna A ha un’azione molto più attiva e costante. Dopo somministrazione endovenosa i pazienti avvertono sensazione di calore alla testa e agli arti, talvolta singhiozzo ma non sintomi di nausea e vomito, i quali compatirebbero invece ove l’alcaloide venga somministrato per via orale.
Allorché la protoveratrina A viene somministrata per os, la caduta della pressione si manifesta dopo un’ora e perdura per 2-3 ore.
Ai pazienti ricoverati la protoveratrina A veniva somministrata per bocca, 3-5 volte al giorno, aumentando la dose sino ad ottenere l’effetto voluto o fino alla comparsa degli effetti collaterali. Seguendo questo metodo l’A. ha potuto ottenere risultati positivi la cui durata giungeva fino a due mesi. I risultati ottenuti nei pazienti trattati ambulatoriamente furono soddisfacenti soltanto in un limitato numero di casi.
Pur esistendo limiti di tolleranza individuali, la protoveratrina A risulta terapeuticamente molto utile, sia pure nel limitato numero di pazienti che possono tollerare dosi attive per un lungo periodo ed é da preferirsi ad altri farmaci ipotensivi, in particolare ai ganglioplegici, sui quali presenta il vantaggio di non determinate bruschi effetti ipotensivi e di non produrre paralisi della vescica e del tubo gastroenterico.
Wildbrand (231) trattò con un preparato contenente protoveratrina A e B, 23 soggetti con gravi forme di ipertensione ai quali il preparato veniva somministrato per infusione endovenosa alla velocità iniziale di 10 g/minuto di una soluzione contenente 0,1 mg in 10 cc, velocità che veniva diminuita quando la pressione cominciava a scendere. In totale venivano somministrate dosi di 0,1-0,2 mg del preparato. In queste condizioni, la durata della fase ipotensiva non superava di solito, i 60-70 minuti. Contemporaneamente all’ipotensione l’A. notò costantemente una notevole bradicardia che poteva essere però evitata con opportune somministrazioni di atropina. Altri sintomi notati dall'A. durante l’iniezione, furono sensazione di stanchezza, di sonnolenza e in molti casi anche nausea e vomito.
Il preparato venne impiegato anche per via intramuscolare alla dose di 0,2 mg, dopo aver saggiata la sensibilità del malato mediante la prova endovenosa. Per via orale, alla dose di 0,5 mg pro die, si ottengono effetti analoghi a quelli che è possibile ottenete con 0,1-0,2 mg per infusione endovenosa.
La protoveratrina si é dimostrata attiva in tutti i casi di ipertensione trattati, indipendentemente dalla genesi e dalla gravità di essi.
E’ stato inoltre possibile dimostrare, oltre al netto miglioramento dello stato generale che si verificava contemporaneamente alla caduta della pressione, anche una notevole regressione dei segni ECGrafìci del sovraccarico sinistro, con un innalzamento dell'onda T.
Currens e coll. (232) hanno sperimentato la protoveratrina nel trattamento delle cardiopatie ipertensive su 100 soggetti, 81 dei quali con ipertensione essenziale, 14 con ipertensione da pielonefrite: gli altri erano ipertesi con poliarterite e coartazione aortica o sindrome di Cushing.
L’A. riferisce i risultati ottenuti soltanto su 27 pazienti fra quelli curati, perchè solo su questi il trattamento fu potuto protrarre per un periodo sufficientemente lungo (da sei mesi a tre anni), mentre gli altri, per vari motivi, non escluso quello dovuto all’intollerabilità del farmaco, furono trattati per periodi più brevi.
La protoveratrina somministrata per via endovenosa, ha dimostrato di essere molto spesso efficace nelle cefalee che insorgevano durante le crisi ipertensive, nel trattamento degli ipertesi con insufficienza congestizia cardiaca, con insufficienza renale e con disturbi visivi. Non si sono osservati fenomeni negativi in ipertesi anginosi, mentre in soggetti ipertesi che avevano precedentemente sofferto di fatti cerebrali, la protoveratrina ha prodotto in qualche caso, temporaneo peggioramento dei fenomeni emiparetici.
Gli AA. osservano che la determinazione della dose è difficile in quanto essa deve essere diversa per ogni singolo paziente. In generale venne impiegata dagli AA. una dose iniziale di 0,10-0,12 mg per via endovenosa, seguita da una dose maggiore alla distanza di almeno 3 ore, se la prima era risultata insufficiente. Gli estremi del dosaggio per via endovenosa, sarebbero compresi fra 0,10-0,23 mg. L’effetto massimo si ottiene entro 15' e la sua persistenza è di 1-2 ore. Per via intramuscolare le dosi efficaci variano da 0,20 a 50 mg, con un effetto massimo entro 2 ore e una persistenza dell’effetto di 4-8 ore.
La somministrazione per via endovenosa determina una pronta riduzione della pressione arteriosa e una concomitante riduzione della frequenza cardiaca, purché il dosaggio sia sufficiente.
Margotin e coll. (233), infine, hanno notato in sei ipertesi, la comparsa di diverse forme di aritmia cardiaca: bradicardia sinusale, arresto sinusale, segnapasso migrante, blocco atrioventricolare di 1° grado, dissociazione atrioventricolare parziale o completa, aritmie che scomparivano con la ripresa di un ritmo sinusale normale, dopo un certo tempo dalla sospensione del trattamento protoveratrinico, oppure a breve distanza dalla somministrazione di atropina.
9) Titolazione dei preparati di Veratro
I risultati delle prove cliniche sin qui riferite, dimostrano che se non esiste un completo accordo sul valore terapeutico da attribuire al Veratro nella terapia della malattia ipertensiva, nelle sue varie forme, tutti sono però concordi nel riconoscergli, ad eccezione del Salva (153), più che un’elevata tossicità, un molto ridotto coefficiente terapeutico. In considerazione di ciò, tutti gli autori riconoscono anche la necessità che i preparati di Veratro usati in terapia, debbano essere costanti, non solo nella loro composizione, ma anche nella loro attività farmacologica e terapeutica, la quale specialmente nel caso dei preparati totali della droga e di quelli derivati
dall’associazione dei suoi alcaloidi, può subire non trascurabili variazioni.
Sorse così la necessità di studiare un metodo di titolazione che, indipendentemente dalla costanza della composizione chimica, che non sempre è possibile ottenere, ne assicuri la costanza degli effetti terapeutici.
La Farmacopea Svizzera consiglia un metodo chimico per la determinazione degli alcaloidi totali contenuti nel Veratro o nei suoi preparati, ma è ovvio che, per le ragioni anzidette, questo metodo non può dare un sicuro affidamento sulla loro costanza di attività, essendo state notate, non solo notevoli variazioni nel rapporto di associazione dei diversi principi attivi, ma anche una loro quantitativamente diversa attività terapeutica e tossica.
Fra i diversi metodi biologici proposti per la valutazione terapeutica dei preparati totali di Veratro, si annoverano quelli basati sulla determinazione della DL, quelli basati sulla determinazione della dose emetica nel piccione e nel cane e quelli che si basano sulla misura dell'effetto ipotensivo nei cani.
Fra i metodi basati sulla determinazione della DL, va ricordato quello proposto da Craw (234) e descritto da Perdue e coll. (235).
Craw, valendosi di un piccolo crostaceo facilmente allevabile in acquario, la Daphnia magna o pulce d'acqua, è riuscito a ottenere un metodo di titolazione sufficientemente esatto. Egli chiamò Unità Daphnia (o Craw), la quantità del preparato capace di uccidere in 2 ore e 22’, 1000 Daphnie col cuore in sistole. Se è vero che questo metodo offre la possibilità di ottenere risultati sufficientemente precisi e costanti, è anche vero che esso non è nè semplice nè di facile esecuzione. L’elevato numero di Daphnie che occorre usare, la loro estrema piccolezza e l’osservazione microscopica cui è necessario sottoporre un gran numero di soggetti, rendono questo metodo poco pratico e tale da non poter soddisfare le esigenze di un laboratorio in cui titolazioni di questo genere debbano essere eseguite con una certa frequenza, tanto su campioni di droga, quanto sui suoi diversi preparati. In considerazione di tutto ciò, noi abbiamo studiato la possibilità di rendere questo metodo più semplice, più rapido e meno indaginoso, impiegando un reattivo biologico altrettanto sensibile ma più maneggevole della Daphnia magna usata da Craw. Trovammo così che un piccolo pesce ovoviviparo, anch’esso facilmente allevabile in acquario, il Lebistes reticulatus, si presta molto bene per la titolazione dei preparati di Veratro, alla cui azione si è dimostrato altrettanto sensibile della Daphnia magna (236).
Per la determinazione della DL non occorrono più di 20-30 esemplari i quali generalmente, non tutti muoiono e possono essere usati, a distanza di tempo, per altre titolazioni.
Abbiamo così determinato la UL (Unità Lebistes) la quale corrisponde alla concentrazione minima del preparato di Veratro, capace di provocare la morte di 3 Lebistes su 3, nello spazio di 5 h.
Sperimentando comparativamente con un preparato titolato in Unità Daphnia o Craw, abbiamo trovato che 5,7 U.L. corrispondono a 10 Unità Daphnia e che questa pertanto, deve essere considerata la dose terapeutica unitaria per os.
Occorre tuttavia riconoscere che questi metodi basati sulla tossicità, non sempre esprimono esattamente la misura dell'attività terapeutica e ciò in particolare, allorché essi vengano impiegati per la titolazione dei preparati totali della droga, nei quali ai principi terapeuticamente attivi, si trovano associati anche principi meno attivi terapeuticamente ma altrettanto tossici. Risultati più esatti si potrebbero invece ottenere con l’impiego di questi metodi per la titolazione di preparati contenenti le varie associazioni degli esteri alcaloidi o, in generale, dei principi attivi puri.
Christensen e McLean (237) hanno proposto un metodo di titolazione simile a quello in uso per i preparati digitalici, basato sulla determinazione della dose emetica nel piccione, trovando che fra effetto emetico ed effetto ipotensivo, esiste una stretta relazione quantitativa, ciò che venne successivamente confermato anche dallo stesso Christensen in collaborazione con Jenkins (238), da Richards (239) e da altri.
Swiss (240) ha modificato il metodo determinando la ED50 (dose emetica 50) sul cane, dimostrando che la dose emetica e la dose ipotensiva è, in questo caso, circa la stessa per tutti gli alcaloidi attivi e che perciò questo saggio può dare una soddisfacente misura dell'attività ipotensiva e quindi terapeutica.
Maison e Stutzman (241) hanno invece proposto un metodo più diretto che si basa sulla determinazione della dose minima ipotensiva nei cani anestetizzati.
La sostanza viene somministrata per infusione endovenosa nello spazio di 10' e la sua attività viene confrontata con un preparato campione capace di determinare la stessa risposta ipotensiva. L’approssimazione dei risultati che si ottengono è di ± 25 % dell'attività di un preparato campione avente un'attività superiore di circa 50 volte quella dei rizomi secchi.
Chen e Russel (242) hanno impiegato lo stesso metodo ma completato da una più accurata analisi dei risultati ottenuti. Essi, dopo aver trovato la dose minima attiva del preparato in studio, confrontandolo con un preparato campione, hanno eseguito un’analisi della varianza dei risultati desunti da una serie di esperimenti ed hanno stabilito la variazione della risposta ipotensiva dei singoli animali e fra i diversi animali. Essi hanno potuto così constatare che l'intervallo fra la dose minima attiva e la dose massima è molto piccolo essendo la dose attiva massimale superiore soltanto del 3 % alla dose attiva minima.
O’Dell (243) infine, descrisse un procedimento di dosaggio del Veratro verde sul cane, basato sulla perdita progressiva della risposta pressoria del riflesso senocarotideo e sull’abbassamento graduale della pressione arteriosa per ripetute piccole dosi del preparato in esperimento. Questo saggio basato sul potere ipotensivo della droga, ha un netto punto di riferimento, dato dalla perdita della risposta pressoria determinata dal riflesso senocarotideo ed è riproducibile, essendo la variazione fra i risultati di due saggi, inferiore al 15% Per questo saggio inoltre, non è necessario il confronto con un preparato campione.
L’A. propone una unità di potenza basata su questo saggio, U.S.R. (Unità risposta senocarotidea) che rappresenti la quantità di sostanza ipotensiva che, somministrata endovena, per kg di p.c., abolisce la risposta pressoria determinata dal riflesso senocarotideo nel cane.
10) Assorbimento ed eliminazione
Gli alcaloidi del Veratro vengono assorbiti dal tratto gastrointestinale ma in maniera variabile e incompleta. Essi vengono assorbiti anche per via sottocutanea ed intramuscolare, ma valutazioni quantitative sull'entità di tale assorbimento, non sembra siano state eseguite.
Illera e coll. (193) hanno notato che nei gatti, l’assorbimento può avvenire anche per via perlinguale, ciò che invece non avverrebbe nei cani.
Con dosi di 5-20 volte superiori a quella terapeutica, somministrate per via orale o intramuscolare, si ottiene un’azione equivalente.
La distribuzione degli alcaloidi del Veratro nell’organismo e la maniera con cui essi vengono distrutti o metabolizzati, sono poco note.
Incomplete sono anche le notizie che si posseggono sulle loro caratteristiche di eliminazione. Soltanto una piccola parte della dose somministrata, viene eliminata con le urine e la nefrectomia nei cani, non prolunga la durata dell’azione ipotensiva [Goodman e Gilman (244)].
11) Tossicologia
La tossicità del Veratro e dei suoi alcaloidi è stata determinata sperimentalmente sugli animali da diversi autori e noi abbiamo già riferito qualche dato in proposito nei capitoli riguardanti l’azione farmacologica (174-186). Aggiungeremo ancora altri dati in questo capitolo, prima di passare all'azione tossica sull’uomo.
Perdue e coll. (235) hanno studiato la tossicità acuta e cronica di un preparato a base di polvere di Veratro la cui attività era pari ad una Unità Craw per ogni 15,6 mg di polvere. La DL50 orale acuta di questo preparato è stata trovata pari a 8 g/kg per il ratto e a g 2,5 ± 0,3/kg per il coniglio; la DL50 intraperitoneale nel ratto pari a 118 ± 11 mg/kg.
Lo studio della tossicità cronica, condotto su ratti in stato di denutrizione, ha dimostrato che non si manifestano effetti tossici sino ad una concentrazione del 2,9 % nella dieta.
La maggior parte degli effetti tossici sembra essere in relazione con la inanizione. Nei visceri non sono state riscontrate lesioni anatomopatologiche caratteristiche.
Kraye (245) ha studiato comparativamente la tossicità degli alcaloidi puri del Veratro, trovando che gli esteri alcaloidi protoveratrina, veratridina e cevadina (la quale ultima non e contenuta nel Veratro verde e nel Veratro bianco), sono quelli dotati di maggior tossicità. I dati ottenuti dall’A. sono riassunti nella tabella 1.
Sokolov (246) per gli alcaloidi totali del Veratro bianco, ha trovato una DL50, per via sottocutanea nella rana, pari a mg 0,8/kg e di 0,065 mg/kg nel coniglio per via endovenosa. La dose di 1 mg per via gastrica nel coniglio, non ha provocato effetti tossici.
Bergman e coll. (247) hanno notato l’elevata tossicità di una dieta di Veratrum album somministrata a larve di mosca comune, tossicità che diminuisce con l'età larvale e scompare con la maturità. Essa appare dovuta alla frazione benzensolubile, la quale contiene gli esteri alcaloidi, la cui tossicità, come già notato da altri AA. (180), è proporzionale al numero dei gruppi acidi esterificati.
Estrazioni di rizomi di Veratro con acido acetico e alcool sono state usate a scopo insetticida contro i pediculus [Pankiewicz e coll. 248)].

2
Della tossicità dei preparati di Veratro nell’uomo abbiamo già trattato nel paragrafo riguardante la terapia. Aggiungiamo qui che tali effetti tossici possono essere considerati, data l’esiguità dell’intervallo esistente fra dose terapeutica e dose tossica, come uno sconfinamento, per così dire, dell’azione farmacologica, allorché i suddetti preparati vengono impiegati a dosi elevate o anche a dosi normali in individui particolarmente sensibili. Tali effetti che sono già stati di volta in volta descritti, si manifestano con un senso di bruciore epigastrico e retrosternale, sudorazione, salivazione, nausea, vomito, senso di calore alla testa e al collo; più raramente, disturbi visivi e confusione mentale. A volte si possono osservare aritmie cardiache e, con dosi elevate, marcata bradicardia, ipotensione grave, collasso vascolare ed anche sintomi a carico dell’apparato respiratorio, quali spasmo bronchiale e depressione respiratoria. Talvolta la compressione retrosternale e il senso di oppressione, possono simulare fenomeni anginosi e, se associati a collasso, possono essere scambiati con sintomi dovuti a infarto coronarico.
Gli avvelenamenti accidentali da Veratro sono molto rari. Un caso verificatosi in un operaio per aver masticato un rizoma di veratro bianco, scambiato per un rizoma di Genziana, è stato descritto da Albano e Fragasso (249). Il paziente presentava al momento del suo ricovero in ospedale, avvenuto due ore dopo l’ingestione, violenti dolori addominali, vomito incoercibile, senso di mancamento, obnubilamento visivo, sensorio integro, cianosi intensa e diffusa, cute algida, pupille isocoriche leggermente miotiche e scarsamente reagenti alla luce, orofaringe arrossata, lingua patinosa e intensa scialorrea, l’aia cardiaca nei limiti normali, itto puntale in sede fisiologica, toni cupi e lontanissimi, ritmici e rari, 42 al minuto. Pressione arteriosa omerale sinistra 75/60 mmHg, polso ritmico, filiforme e molle, addome pianeggiante, trattabile, dolente alla palpazione profonda su tutti i quadranti specie all’epigastrio. Il fegato era palpabile, debordante di un dito dall’area costale, milza nei limiti normali, riflessi superficiali e profondi presenti e vivaci.
Lo stato del malato e il progressivo peggioramento del quadro sintomatologico, imposero un sollecito intervento terapeutico il quale, non essendo nota al momento del ricovero la causa precisa dell’avvelenamento, fu puramente sintomatico e volto soprattutto a combattere la sintomatologia cardiovascolare. Vennero così somministrati analettici simpaticomimetici (Sympatol, efedrina) per via intramuscolare, Supercort endovena e ipodermoclisi glucosate. Dopo 5 ore dall’ingresso in ospedale, le condizioni circolatorie erano pressocchè normalizzate e i disturbi gastrici scomparsi. Il giorno dopo il paziente era in buone condizioni ed ogni disturbo totalmente scomparso. Venne tuttavia continuata la somministrazione di Sympatol e efedrina e dopo 3 giorni il malato potè essere dimesso clinicamente guarito.
L’esame ECGrafico eseguito subito dopo il ricovero, dimostrò l’esistenza di una bradicardia sinusale con frequenza di 42 pulsazioni al minuto, un’onda T negativa in D3 e difasica (+-) in VE. L’intervallo QT era di 0,46”. Un secondo ECG eseguito alla distanza di 5 ore dal primo, dimostrò una normalizzazione della frequenza (78 pulsazioni al minuto), una netta diminuzione della negatività dell’onda T in D3 ed una diminuzione del difasismo aVF con aspetto +–, opposto quindi a quanto notato nel primo ECG. Nell’asse elettrico del QRS vennero riscontrate variazioni di poco conto. L’intervallo QT era di 0,37”.
Un altro ECG venne eseguito prima della dimissione dall’ospedale ed un altro alla distanza di qualche settimana. Questi due ECG, che risultavano perfettamente uguali fra loro, differivano dai precedenti per una onda T leggermente positiva in D3 e decisamente positiva in aVF. La frequenza era di 98 al minuto e l’intervallo QT di 0,33”.
12) Terapia dell'avvelenamento
All’infuori del caso fortunato, in cui l’intervento può avvenire immediatamente dopo l’ingestione, la terapia è soltanto antagonistica, poiché il vomito, immancabile sintomo dell’avvelenamento veratrico, determina l’espulsione degli eventuali residui rimasti nello stomaco. Comunque, nei rari casi in cui l’intervento può essere immediato, si provvederà al vuotamento dello stomaco mediante lavanda gastrica e alla somministrazione di sostanze tanniche.
Ad assorbimento avvenuto, la terapia dovrà essere volta a combattere i fenomeni gastrici (nausea, vomito) e i sintomi a carico dell’apparato cardiovascolare (ipotensione, bradicardia, aritmia ecc. ). La nausea e il vomito cedono difficilmente agli antiemetici e raramente si ottengono risultati favorevoli con somministrazione di atropina. Wilkins (195) consiglia l’atropina associata all'efedrina ed anche la dramamina. Kauntze e Trounce (196) consigliano invece i barbiturici ma non gli antistaminici.
Secondo Tario Kanno (191) il vomito da protoveratrina sarebbe antagonizzato notevolmente dai depressori centrali quali l'uretano, la morfina, la cloropromazina ecc. L’atropina è invece consigliata da tutti gli AA. [Meilman e Krayer (222) (223), Winer (229), Margotin e coll. (233)], nei disturbi cardiaci (bradicardia, disturbi del ritmo) e i simpaticomimetici per combattere il collasso cardiovascolare.
13) Controindicazioni
I preparati di Veratro sono controindicati negli stati ipotensivi, nella coartazione aortica, nei feocromocitomi, nell’intossicazione digitalica e nell’ipertensione intracranica non secondaria a ipertensione (141).
Secondo Stearn e Ellis (211), come già detto, i preparati di Veratro possono essere somministrati per via endovenosa, con relativa sicurezza, anche nei pazienti affetti da gravi disfunzioni renali, cardiache e cerebrali, purché vengano somministrati per infusione endovenosa lenta.
14) Riassunto e conclusioni
Da quanto abbiamo sin qui riferito risulta dunque quanto segue:
a) A proposito dell’azione ipotensiva del Veratro e dei suoi alcaloidi, che è poi la più importante e quella da cui derivano le principali applicazioni terapeutiche, si può dire che essa risulta da un complicato meccanismo riflesso.
Sebbene non tutti i particolari di questo meccanismo siano stati soddisfacentemente e definitivamente precisati, sembra che le sedi sulle quali i principi attivi del Veratro esplicano, almeno prevalentemente, la loro azione, siano rappresentate dalle zone reflessogene cardiocoronariche, senoaortiche, senocarotidee, polmonari e mesenteriche le cui vie afferenti, secondo Muresan e coll. (159), sarebbero rappresentate dal vago, dal nervo del seno o di Hering e dal depressore; centri di questi riflessi, sono i centri vasomotori bulbari, con connessioni ipotalamiche e corticali.
Secondo Wang e coll. (152) invece, al seno carotideo dovrebbe essere attribuito un ruolo secondario nel determinismo delle reazioni ipotensive. Tutte le reazioni vasomotorie negli animali vagotomizzati, sarebbero mediate dal simpatico, secondo questi AA. i quali, avendo osservato che i simpaticolitici aboliscono le risposte ipotensive, ritengono che l’azione del Veratro dovrebbe essere spiegata, più come un’inibizione dello scarico simpatico che come una eccitazione delle radici vasodilatatrici simpatiche dorsali.
Salva e Valdecasas (156) ritengono a loro volta, che l’ipotensione veratrica, non manifestandosi nell’animale demidollato ed essendo essa annullata dal tetrametilammonio, dovrebbe avere la sua sede sui centri vegetativi midollari.
La vasodilatazione periferica che consegue all’azione del Veratro, non dovrebbe essere interpretata, secondo alcuni autori, come un effetto puramente riflesso [Wood e Wood (133)], ma anche come un’azione diretta sui vasi periferici [Wilson e Smith (145), Petkov e coll. (146)].
Per quanto riguarda le diverse reazioni che, come abbiamo veduto, si possono manifestare negli animali da esperimento sotto l’azione del Veratro e dei suoi alcaloidi, è presumibile che la spiegazione debba essere ricercata anche nel fatto che fibre vagali afferenti esistono sulla superfìcie del ventricolo del cuore dei mammiferi, la cui eccitazione può provocare diversi effetti; rallentamento o accelerazione del cuore, aumento della pressione arteriosa per costrizione nell’area splancnica o diminuzione per dilatazione arteriolare, effetti questi che si possono verosimilmente verificare a seconda delle dosi, delle condizioni sperimentali o di altre particolari condizioni fisiologiche o occasionali, relative all’animale su cui si sperimenta.
b) L’azione sul rene, del Veratro e dei suoi alcaloidi, compare soltanto dopo somministrazione di dosi elevate e si manifesta con una diminuita filtrazione glomerulare e quindi con una diminuzione della secrezione
c) Sui muscoli scheletrici gli esteri alcaloidi del Veratro, esplicano la caratteristica azione veratrinica, azione che viene attribuita ad un alterato metabolismo cellulare del Ca++ e all’imperfetto trasporto jonico (K+ e Na+) (Lister e Lewis (183) (184), Kolb e Korein (185) e altri).
Alcuni alcaloidi veratrinici, quali la cevina, la cevadina e la veratridina (che non sono però contenuti nei due veratri dei quali ci siamo interessati), sono dotati di un’azione decurarizzante [Gautier (182)] e così pure la veratramina secondo Kenjiro Kimishima e coll. (175).
d) Sulle fibre muscolari lisce (intestino), i preparati di Veratro verde aumentano il tono delle fibre longitudinali e le contrazioni automatiche delle fibre circolari, per un’azione prevalentemente muscolare, che però non esclude una componente vagale [Benigni (134), Kenjiro Kimishima (175)].
e) Sul sistema nervoso centrale gli alcaloidi del Veratro determinano a dosi deboli, un’azione modificatrice dei centri vegetativi e progressivamente un’inibizione che arriva sino alla narcosi totale reversibile [azione narcobiotica secondo Salva (153)].
L'azione prolungatrice del sonno da anestetici, della protoveratrina, osservata da Fekete e Saporny (188) è verosimilmente connessa con questa azione depressiva centrale.
Per iniezioni intracisternali la protoveratrina produce, in misura minore di altri alcaloidi veratrinici non contenuti nei due veratri da noi considerati (la veratridina e la cevadina), aumento dell’attività respiratoria, disordini motori, agitazione, inquietudine e fenomeni convulsivi. La protoveratrina ha anche dimostrato di possedere una marcata azione anestetizzante [Tario Kanno (191)].
La veratramina per iniezioni endovenose e intracisternali produce eccitamento ed effetto convulsivante, aumento della pressione arteriosa e inibizione dell’attività respiratoria [Fukuma Keizo (189), Schoetensack e Scheiber (190)].
f) Il Veratro e i suoi esteri alcaloidi sono dotati anche di una marcata azione ipotermizzante [Salva (153), Valdecasas, Salva e Laporte (192), Illera e coll. (193)].
g) I preparati più razionali per l’uso terapeutico, sono considerati quelli a composizione e attività costante (titolati biologicamente), i quali a seconda dei casi, possono essere somministrati oralmente, per via intramuscolare o endovenosa per infusione lenta.
Le dosi debbono essere determinate caso per caso, in quanto non tutti i malati reagiscono ugualmente alle stesse dosi, di fronte alle quali essi presentano una sensibilità molto diversa.
Nella ricerca della dose attiva, occorre soprattutto tener conto del fatto che la dose efficace è molto vicina alla dose tossica.
In considerazione delle azioni secondarie cui la somministrazione dei preparati veratrici possono produrre, i malati debbono essere attentamente seguiti e sottoposti a frequenti controlli.
I preparati di Veratro e la protoveratrina in particolare, si sono dimostrati efficaci in tutti i casi d’ipertensione e indipendentemente dalla loro genesi e dalla loro gravità. Gli autori sono tuttavia concordi nel consigliarne l’impiego soltanto nei casi più gravi (ipertensione maligna, crisi ipertensive, tossicosi gravidica, eclampsia, casi resistenti ad altri trattamenti ecc.).
Le complicazioni cardiache, renali o cerebrali, non costituiscono di solito, controindicazioni, purché il trattamento venga praticato con le dovute precauzioni.
Risultati brillanti si possono ottenere con l’associazione di preparati di Veratro (protoveratrina in particolare) con idrazinoftalazina o Rauwolfia.
Estratti e preparati vari
a) Estratto fluido veratro bianco (g 1 = XLII gtt).
Dosi: II-III gtt pro dose.
b) Tintura veratro bianco al 10% di droga.
Dosi: XX-XXX gtt pro dose.
c) Estratto fluido veratro verde. Titolo biologico 11,4 Unità Lebistes in 1 g (Benigni) (g 1 = LXI gtt).
Dosi: V-XX pro dose.
d) Tintura veratro verde. Titolo biologico 1,14 Unità Lebistes in 1 g (Benigni).
Dosi: L gtt pro dose più volte pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido veratro bianco……. …………………………. g 10
Alcool di 60° …… g 90
(XX-XXX gtt pro dose).
Tintura
Estratto fluido veratro verde……………………………………… g 10
Alcool di 90° . ……………………………………………………… g 90
(XX-XXX gtt più volte pro die).
BIBLIOGRAFIA
(1) WRIGHT C. R. A. e LUFF A. P., J. Chem. Soc.. 33. 338, 1878 â– (2) WRIGHT C. R. A. e LUFF A. P., ibid., 35. 405, 1879 – (3) WRIGHT C. R. A., ibid., 35. 421, 1879 – (4) SALZBERGER G., Arch. Pharm.. 228. 462, 1890 – (5) POETHKE W„ Ibid., 275. 357 e 571, 1937; 276, 170, 1938 – (6) POETHKE W„ Pharm, Monatsh.. 18. 77, 1937 • (7) POETHKE W., Sci. Pharm.. 9. 110, 1938 • (8) JACOBS W. A. e CRAIG L. C., J. Biol. Chem., 143. All, 1942 – (9) JACOBS W. A. e CRAIG L. C., ibid.. 148, 41, 1943 – (10) JACOBS W. A. e CRAIG L. C., ibid.. 155, 565, 1944 – (11) JACOBS W. A. e CRAIG L. C, ibid., 160. 555, 1945 –
(12) SAITO K., SUGINOME H. e TAKAOKA M., Buil. Chem. Soc. Japan. 9. 15, 1934 – (13) SAITO K. e SUGINOME H., ibid„ JJ. 168, 1936 • (14) SAITO K., ibid.. J5. 22, 1940 – (15) SEIFERLE E. J., JOHNS f. B. e RICHARDSON C. H., £con. Entomol., 35. 35, 1942 • (16) FRIED J., WHITE H. L. e WINTER- STEINER O., J. Am. Chem. Soc.. 7Ì. 3260, 1949; 72. 4621, 1950 – (17) FRIED J., NUMEROF P. e COY N. H. ibid., 74. 3041, 1952 • (18) KLOHS M. W., KELLER F., KOSTER S. e MALESH W., Ibid.. 74, 1871, 1952 • (19) KLOHS M. W„ ARONS R., DRAPER M. D., KELLER F., KOSTER S., MALESH W. e PETRACEK F. J., ibid.. 74. 5107, 1952 – (20) KLOHS M. W., DRAPER M. D., KELLER F., KOSTER S., MALESH W. e PETRACEK F. J„ ibid., 75. 4925, 1953 – (21) KLOHS M. W„ DRAPER M. D-, KELLER F., MALESH W. e PETRACEK F. J., ibid., 75. 2133, 1953 – (22) KLOHS M. W., DRAPER M. D., KELLER F., MALESH W. e PETRACEK F, J., ibid., 75. 3595, 1953 – (23) KLOHS M. W., DRAPER M. D., KELLER F., KOSTER S„ MALESH W. e PETRACEK F. J., ibid.. 76. 1152. 1954 – (24) MYERS G. S., GLEN W. L., MOROZOVITCH P., BARBER R. e GRANT G. A., ibid.. 74. 3198, 1952 – (25) MYERS G. S„ GLEN W. L, BARBER R., MOROZOVITCH P. e GRANT G. A., Nature, 170, 932, 1952 – (26) MYERS G. S., MOROZOVITCH P., GLEN W. L„ BARBER R-, PAPI- NEAU-COUTURE G. e GRANT G. A., /. Am. Chem. Soc.. 77, 3348, 1955 – (27) MYERS G. S., GLEN W. L., MOROZOVITCH P., BARBER R., PAPINEAU-COUTURE G. e GRANT G. A., Ibid., 78. 1621, 1956 – (28) STOLL A. e SEEBECK E., Science, 115, 678, 1952 – (29) STOLL A. c SEEBECK E., /. Am. Chem. Soc., 74. 4728, 1952 – (30) STOLL A. e SEEBECK E., Helv. Chim. Acta, 36, 1570, 1953 • (31) STOLL A. e SEEBECK E., tbid., 36. 718, 1953 – (32) NASH H. A. e BROOKER R. M., J. Am. Chem. Soc., 75, 1942, 1953 – (33) KUPCHAN S. M. e DELIWALA C. V., ibid., 75. 4671, 1953 – (34) KUPCHAN S. M. e GRUENFELD N., J.A.Ph.A., sci. ed.. 48. 727, 1959 – (35) TSUKAMOTO T. e KISHIMOTO Y.. J. Pharm. Soc. Japan. 74. 729, 1954 – (36) TSUKAMOTO T. e YAGI A., ibid., 79. 1102, 1959 – (37) TOMKO J., DVORAKOVA B., BAUER S. e MOKRY J., Chem. Zvesti. 10. 642, 1956 – (38) TOMKO J., DVORAKOVA B„ BAUER S. e MOKRY J.. ibid.. 11. 542, 1957-(39) SHIMIZU B., Ann. Rept. Takamine Lab.. 7. 30, 1955 • (40) SUZUKI M., SHIMIZU B., MURASE Y„ HAYASHI R, c SANPEI N., J. Pharm, Soc. Japan, 77, 1050, 1957 – (41) SHIMIZU B., J. Pharm. Soc. Japan, 78, 443, 1958 • (42) SHIMIZU B.. ibid-, 78. 444, 1958 – (43) SHIMIZU B., ibid., 79, 993, 1959 – (44) SHIMIZU B. c HAYASHI R., ibid., 79. 615, 1959 • (45) SHIMIZU B. e SUZUKI M., ibid.. 79, 609, 1959 – (46) HEGI H. R. c FLUCK H., Pharm. Acta Hetv.. 31. 428, 1956 – (47) SIMON, Pogg. Ann.. 41. 569, 1837 – (48) MAJ J. c HANO J., Dissert. Pharm-, 8. 9, 1956 – (49) SUZUKI M., MURASE Y., HAYASHI R, e SANPEI N., J. Pharm. Soc. Japan. 79. 619, 1959 • (50) GLEN W. L., MYERS G. S.. BARBER R., MOROZOVITCH P. e GRANT G. A., Nature, 170, 932, 1952 – (51) PIJEWSKA L- Acta Polon. Pharm., 15, 219, 1958 – (52) CIONGA E. e CUCU V., ibid., 14, 73, 1957 – (53) CIONGA E. e CUCU V., Ann. pharm. frane.. J6. 511, 1958 • (54) POETHKE W. c KERSTAN W., Arch. Pharm.. 293. 743, 1960 – (55) TOMKO J., BENDIK I., BAUER S. e MOKRY J., Pharm. Zhaile. 99. 373, 1960; Chem. Abs., 55. 2013, 1961; TOMKO J, e BENDIK I„ Coll. Czech. Chem. Communs.. 27. 1404, 1962 – (56) BAUER S., Relaz. alla Tschecho»!. Pharmaz. Gesell., 7-10/9/1959 ^ (57) EDWARDS, Chem. a. Ind., 488, 1953 – (57a) JACOBS e HUEBNER, J, Biol. Chern.. 170, 635, 1947 • (58) KUPCHAN S. M., LAVIE D. c ZONIS R. D., J. Am. Chem. Soc., 77, 689t 1955 –
(59) SUZUKI M., MURASE Y., HAYASHI R. e SANPEI N,, J. Pharm. Soc. Japan, 79, 619, 1959 •
(60) KUPCHAN S. M. e DELIWALA C. V., J. Am. Chem. Soc., 74, 2382, 1952 – (61) KUPCHAN S, M. e DELIWALA C. V., ibid., 75. 1025, 1953 – (62) HEYL F. W. cd HERR M, E., ibid.. 71, 1751, 1949 – (63) KUPCHAN S. M. e AYRES C. L, J.A Ph.A., sci. ed., 48, 440, 1959 – (64) LEVINE J. e FISCHBACH H., ibid., 46, 191, 1957 – (65) KUPCHAN S. M., J. Am. Chem. Soc., 81, 1913, 1959 – (66) KUPCHAN
S. M. c DELIWALA C. V., ibid., 74. 3202, 1952 – (67) KUPCHAN S. M, e DELIWALA C. V., ibid., 76.
5545. 1954 – (68) KUPCHAN S, M. e AYRES C I., ibid., 82, 2252, 1960 – (69) BREDEMANN E„ Disch.
Ap. Ztg.. 21, 41 c 53, 1906 • (70) JACOBS W. A. c CRAIG L. C, J. Biol, Chem., 149, 271, 1943 –
(71) KUPCHAN S. M„ AYRES C. I. c HENSLER R. H„ J. Am. Chem. Soc., 82, 2616, 1960 • (72 a) KUPCHAN S. M. e AYRES C, I., J.A.Ph.A., 5ci. ed., 48, 735, 1959 – (72 b) KUPCHAN S. M., ZIMMER- MANN J. H. c AFONSO A„ Lloydia. 24, 1, 1961 – (73) FIESER L. F, e FIESER M„ Stcroids. Rcinhold Publishing Corp., New York, 1959, p. 867 – (74) MORGAN K. J, e BARLTROP J. A., Quart. Rev., 12, 34, 1958 * (75) JEGER O. c PRELOG V., Stcroid alkaloids; Veratrum, 1960, p. 363; in MANSKE R. H.
F. , The Alkaloids, voU VII, Acadcmic Press Ine., New York – (76a) KUPCHAN S. M., J. Pharm. Sci.. 50, 273, 1961 – (76 b) ALAUDDIN M. c MARTIN-SMITH M., J. Pharm. Pharmacoi., 14, 469, 1962 • (77) VEJDELEK Z. J., TRCKA V. c MACEK K., Abbondi, deut. Akad. IViss. Berlin, Kl. Chem., Geol. «. Biol., 1956. n. 7, 208, 1957; Chem. Abs., 52, 16594 f, 1958 – (78) KUPCHAN S. M. c HENSLER R. H., /. Med. Pharm, Chem., 3, 129, 1961; Chem. Abs., 55, 15528h, 1961 – (79) SATO Y. c JACOBS W. A., J. Biol, Chem., 179. 623, 1949 – (80) LOCKE D. M. c PELLETIER S, W., Chem. a. Ind., 1049, 1956 – (81) PELLETIER S. W. c LOCKE D., J. Am. Chem. Soc., 79, 4531, 1957 – (82) SATO Y. e JACOBS W. A., J. Biot, Chem.. 191, 63, 1951 – (83) PELLETIER S. W. c JACOBS W. A., /. Am. Chem. Soc., 75, 4442, 1953 – (84) WEISENBORN F. L. c BURN D., ibid., 75, 259, 1953 * (85) FRIED J., WINTER- STEINER O., MOORE M., ISELI B. M., KLINGSBERG A., ibid„ 73, 2970, 1951 – (86) WINTER- STEINER O., Abstraets XII. International Congress 1951, p. 292 – (87) WINTERSTEINER O. e MOORE M., J. Am. Chem. Soc.. 75, 4938, 1953 – (88) WINTESTEINER O. e MOORE M., ibid., 78, 6193, 1956 – (89) WINTERSTEINER O., MOORE M. e ISELIN B. M., ibid., 76 , 5609, 1954 – (90) ISELIN B. M. e WINTERSTEINER O., ibid., 77, 5318, 1955 – (91) ISELIN B. M.. MOORE M. e WINTERSTEINER O., ibid., 78, 403, 1956 – (92) TAMM C. e WINTERSTEINER O., ibid., 74. 3842, 1952 – (93) WINTER- STEINER O. e HOSANSKY N„ ibid.. 74, 4474, 1952 – (94) WINTERSTEINER O., MOORE M. e HOSANSKY N., ibid., 75, 2781, 1953 • (95) HOSANSKY N. L. c WINTESTEINER O.. ibid.. 78. 3126, 1956 – (95a) WINfERSTElNER O. e MOORE M., Tetrahedron Letters, 795, 1962 – (95b) DAUBEN W.
G. , EPSTEIN W. W., TANABE M. e WEINSTEIN B., 7. Org. Chem,. 28, 293, 1963- (95 c) MASAMUNE
T. , TAKASUGI M., SUZUKI H„ KAWAHARA S„ GOHDA M. e IRIE T., Bull. Chem. Soc. Japan., 35, 1749, 1962; Chem. Abs., 58, 11437c, 1963 – (96) KUPCHAN S. M„ FIESER M., NARAYANAN C R„ FIESER L. F., J. Am. Chem. Soc., 77, 5896, 1955 – (97) KUPCHAN S. M. e NARAYANAN C. R.. Chem. a. Ind., p. 251, 1955 – (98) KUPCHAN S. M. e NARAYANAN C. R., Ibid., p. 1092, 1956 – (99) CRAIG. L. C. e JACOBS W. A., J. Biol. Chem., 148, 57, 1943 – (100) JACOBS W. A. e PELLETIER S. W., J. Org. Chem., 18, 765, 1953 – (101) KUPCHAN S. M., NEEMAN M., AYRES C. L. HENSLER R. H. e RAJAGOPALAN S., Chem. a. Ind., 1626, 1958 – (102) KUPCHAN S. M., MASAMUNE T. e AYRES C.J., J. Am. Chem. Soc., 81. 4753, 1959-(103) KUPCHAN S.M., AYRES C I., NEEMAN M.. HENSLER R. H.. MASAMUNE T. e RAJAGOPALAN S„ ibid., 82, 2242,1960 – (104) VIERHOFER e CLEVENGER, J.A Ph.A., JI, 166, 1922 – (105) United States Dispensatory ed. 1960, p. 1487 – (106) BOCCHIA A., (Laboratori di Ricerche Fitochìmiche della Inverni &. Della Beffa – Milano) ~ Comunicaz. personale •> (107) HEGI H. R. e FLUCK H., Pharm. Acta Helv., 32, 57, 1957 – (108) JASPERSEN-SCHIB R. e FLÙCK H., ibid., 35, 1, 1960 – (109) JASPERSEN-SCHIB R. e FLUCK H., Ibid., 35, 238, 1960 • (110) JASPERSEN-SCHIB R. e FLUCK H., ìbid., 36, 461, 1961 – (111) JASPERSEN-SCHIB R. e FLUCK H., ibid., 36, 667, 1961 – (112) KISHIMOTO Y. e TSUKAMOTO T., Brevetto, Japan 2797 (1957); Chem. Abs., 52, 4708 e, 1958 – (113) NANOBASCHWILI, yeterinariya. 28, 40, 1951; Chem. Zbl., 2385, 1952 – (114) TOMKO J., Chem. zvesti, 10, 692, 1956 – (115) CIONGA E., CUCU V., MORGANU S., NICHI- FORESCU E. e FACLER S.. Lucratile prezeniate coni. noli. )arm. Bucharest. 369, 1958; Chem. Abs., 53. 6530d, 1959 – (116) POETHKE W. e KUSTAN W„ Pianta Med., 6. 430, 1958 – (117) Confr. con WEHMER C., Die Pftanzenstoffe, Il ed., p. 143-144 – (118) SCHMIDT E., Arch. Pharm., 224, 513, 1886 – (119) WEPPEN, ibid., 202, 101 e 193, 1873 – (120) POETHKE W. e AUSTER F., ibid., 281, 241, 1943 – (121) GERLACH H., Pianta Med., 6. 448, 1958 – (122) POETHKE W. e GERLACH H., Arch. Pharm., 293, 103, 1960 – (123) WINKLER L. W., Pharm. Zhallc, 73, 616, 1932 – (124) PEYER W., LIEBISCH W. e IMHOF H., Sùdd. Apoth. Ztg., 68, 545, 1928 – (125) Deutsches Arzneibuch, ed. VI, 1940, p. 587 – (126) Pharmacopoea Helvetica ed. V, 1934, p. 808 – (127) TAKAOKA M., Chem. Zbl., Il, 1301, 1940 • (128) KLEIN G. e POLLAUF G., Oesterr. Botan. Z., 78, 251, 1929; Chem. Zbl., II, 1104, 1930 – (129) SANTA VY F., Oesterr. Botan. Z. 103, 300. 1956 – (130) FLUCKINGER e HAMBURGER, Pharmacographia, 1874, p. 632 – (131) BEZOLD A. e HIRT L., Uruers, PhysioL Lab. tVUrzburg, /, 75, 1876 • (132) POETHKE W. e KERSTAN W„ Pianta Med.. 6, 430, 1958 – (133) WOOD H. C. e WOOD H. C. JUN., Am. J. Med. Sci., maggio 1899 • (134) BENIGNI R., Quaderni di Fitoterapia, n. 4, ed. Inverni Se Della Beffa, MUano 1942 • (135) JARISCH A. e RICHTER Arch. exp. Path. u. PharmakoL 193. 347, 1939 – (136) RICHTER H. e AMANN A., Klin. Woch., 18. 185, 1939 – (137) KRAYER O., MOE G. K. e MENDER R„ 7. Pharmacoi exp. Ther.. 82. 167, 1944 – (138) DAWES G. S., J Pharmacoi. exp. Ther.. 89, 325, 1947 – (139) KRAYER O. e ACHESON G. H., PhysioL Rev., 26. 383, 1946 – (140) JARISCH A. e RICHTER H., ved. n. (135) – (141) GOODMAN L. G. e GILMAN A., The Pharmacological basis of Therapeutics, II ed. McMillan Comp. New York, 1955, p. 747 – (142) ABREU B. E., First Hahnemann Symposium on Hypcitensive disease Sunders W. B. ed. Philadelpbia, 1959, p. 327 – (143) ROSE J. C. e LAZARO W, B., J. Pharmacoi exp. Ther., 119, 324, 1957 – (144) SWISS E. D. e MAISON G. L.. Ibld., 105, 87, 1952 – (145) WILSON J. R. e SMITH R. C, ibid.. 79, 208, 1943 – (146) PETKOV V., POPOV ST. e TSONEV Jv., Farmakoi i ToksikoL. 22, 324, 1959 – (147) FOA‘ C., Atti della Soc. It. per U Progr. delle Scienze, Perugia 1927, p. 421 – (148) PUPILLI G., cit, da PUGLIESE in Fisiologia, III ed., Hoepli, Milano, 1935, p. 247 • (149) SPADOLINI J., Fisiologia umana. Un. Tip. Ed. Torinese, 1943, voi. I, pp. 846 e 850 – (150) DAWES R. S., MOTT J. C. e WIDDICOMBE J. B., Brit, J. Pharmacoi, 6. 675, 1951 – (151) ABREU R. E., RICHARDS A. B., ALEXANDER Wm. W. e WEAVER L. C., J. Pharmacoi exp. Ther., 112, 73, 1954 – (152) WANG S. C.. NGAI S. H. e GROSSMAN R. B., ibid., 113, 100, 1955 – (153) SALVA J. A., ActuaUlés Pharmacoi., 8* ser., p. 153, 1955 – (154) LABORIT H. e HUGUENARD P., J. de Thérapeutìque de Paris, p. 115, 1955; cit. da SALVA J. A. (153) – (155) DECOURT PH., Thérapie. 8, 846, 1953 • (156) VALDECASAS F. G. e SALVA J. A., Thérapie, 11, 876, 1956 – (157) VALDECASAS F. G., Rev. Espan. de Biologia. 5. 143, 1936; cit. da VALDECASAS e SALVA (156) – (158) ZAIMIS E. J., Actualité Pharmacoi., n. 9, 179, 1956 – (159) MURESAN V., SIMIONOVICI M., BOTEZ A., VINTER D. e STANESCU L., Ann. pharm. frane-, 16, 46, 1958 – (160) MARTINI L. e colL, Arch. intern. pharmacod. et de thér., 101, 49, 1955 – (161) VALDECASAS F, G. e SALVA J. A., Thérapie, 11. 376, 1956 -(162) NABUFUSA NATORI, YASUO KAKCHASI e NOBUYUKI NAGAZAKI, Kusume Med. J., 4, 35, 1957; Chem. Abs., 52, 577a, 1958 – (163) ROTHLIN E. e CERLEITI A., Schweiz. Med. i^och., 84, 137, 1954 – (164) FERNANDEZ E. e CERLEITI A., Arch. intern. pharmacod. et de thér., 100. 425, 1955 – (165) CALLIAUW A. L., ibid., 107, 75, 1956 – (166) HOOBLER S W„ KABZA T. G. e CORLEY R. W., J. din. Invest.. 34, 559, 1955; Chem. Abs., 53, 11658 c, 1959 – (167) DURAND J., VORIDIS E. e SCEBAT L., Réx', Frane- études din. et Bioi., 2, 1005, 1957; Chem, Abs., 52. 7506 e 1958 – (168) REUSE-BLOM S„ J. Physiol (Paris), 52, 211, 1960 • (169) HAPKE H., Arch. intern. phar^ macod. et de thér., 134, 454, 1961 – (170) MARSCH D. F., HERRING D. A. e HOWARD A., J Pharmacoi exp. Ther-, 103. 172, 1951 – (171) KRAYER O., MANDOKI J. J. e MENDEZ C., ibid., p. 412 (172) INNES J, R., KOSTERLITZ H. W. e KRAYER O., ibid-, 117, 317, 1956 – (173) INNES J. R. e KRAYER O., ibid., 124, 245, 1958 – (174) DE JONG D. D. e VAN PROOSDIJ-HARTZEMA E. G.. Acta Physiol et Pharmacoi. NeerL, 4, 153, 1955 e 4, 160, 1955; Chem. Abs., 53, 20533 c, 20533 e, 1959 – (175) KENJIRO KIMISHIMA e TARIO KANNO, Yonago Igaku Zasshi, 8, 429, 1957; Chem. Abs.. 53, 573 f, 1959 – (176) REUSE-BLOM S., C. R Soc. Biol. 153, 711, 1959 – (177) BENFORADO J. M., DORNER J. e FUENTES Y., Arch. exp. Path. u. Pharmakoi, 240, 382, 1961 – (178) MURNAGHAN M. F., Arch. intern. pharmacod. et de thér., 134, 297, 1961 – (179) MAISON C. L., GATZ E. e STUTZMAN J. W„ J. Pharmacoi., 103, 74, 1951 • (180) KUPCHAN S. M.. J. Pharm. Sci., 50, 273, 1961 – (181) ADAMI E., Farmacologia e Farmacoterapia, Ist. Ed. Cisalpina, Miiano-Varese, 1960, p. 886 – (182) GAUTIER R., Brit. J. Pharmacoi, 5, 33, 1950 – (183) LISTER R. E. e LEWIS J. J., J. Pharm. Pharmacoi, II (suppl), p. 176T, 1959 – (184) LISTER R. E. e LEWIS J, J., ibid., p. 185T – (185) KOLB E. J. e KOREIN J„ Neurology, 11, 159, 1961 – (186) WITT P. N. e SWAIN C. R., J. Pharmacoi exp. Ther., 120, 63, 1957 – (187) FLACKE W., ibid., 137, 62, 1962 – (188) FEKETE G. e SAPORNY L., Arch. exp. Path. u. Pharmakoi, 236, 117, 1959 – (189) FUKUMA KEIZO, Japan J Pharmacoi, 5, 102, 1956 –
(190) SCHOETENSACK W. e SCHEIBLER G., Arch. exp. Path. u. Pharmakoi 232, 335, 1957 –
(191) TARIO KANNO, Yonago Igaku Zasshi. 7, 407, 1956 – (192) VALDECASAS F. G., SALVA J. A. e LAPORTE, Rev Espan. Fisioi, 16. suppl. 1-3, 155, 1961 – (193) ILLERA M., OLALLA E. e SANCHEZ F. S„ Anaie.t Insi invest. vet. (Madrid), 8, 283, 1957-58; Chem Abs.. 55. 2924. 1961 – (194) FREIS e STANTON, Am. Near J„ nov. 1948 . (195) WILKINS R. W., New. £ngi J. Med., 242, 535, 1950 – (196) KAUNTZE R. e TROUNCE J., Lancet. n. 6692, 1002, 1951; n. 6654, 549; Disch. Med. Woch.. n. 20, 687, 1951 – (197) SELIGER H., Hippokrates, n. 16, 443, 1951 – (198) MANGIAGALLI, cit da MARFORI P. in Trattato di Farmacologia e Terapia, Napoli, 1917, p. 596 – (199) ZUIKE, Disch. Med. Woch.. p. 1351, 1911 – (200) HAULTAIN. Mitnch. Med. Woch., p. 108, 1914 – (201) MIRANDA, cit. da CHISTONI A. in «Farmacologia». Faenza, 1938, p 384 – (202) GARBER e coll., Pro Medico, n. 9, 343, 1951 – (203) CUTFORTH R. H.. Kongr. Zbl. inn. Med., 144, 64. 1953 – (204) SELIGER H-, Therap. Umschau, n. 8, 144, 1953 – (205) ALBAN E. J., Jr. e coll-, Kiin. Woch., n. 37/38, 919, 1953 – (206) BAIRD W. W. e ASSALI N. S.. Chem. Zbl., p. 833, 1954 – (207) KAESER O- Schweiz. Med. Woch., 84. 171,1954 – (208) KRUPP P. J., FARRIS C., PIERCO C. e JACOBS A„ Am. J Oòst. Gynecoi., 7Ì. 247, 1956 .
(209) MEILMAN E.. J. Clin. Invest., 32, 80, 1953 – (210) MORRIS N.. Proc. Roy. Soc. Med., 46. 402, 1953 – (211) STEARNS N. S. e ELUS L. New Erigi J. Med., 246. 397, 1952 – (212) ELEK S. R„ MCNAIR J. D. e GRIFFITH G. C., Circulation, 7, 903, 1953 – (213) SMIRK F. H. e CHAPMAN O. W„ Am. Heart. J.. 43. 586, 1952 – (214) SAPHIRE E. J.. Ann. Int. Med., 41. 1211, 1954 – (215) FORD R. V., LIVESAY W. R„ SPURR C. c MOYER J. H., Am. Heart. ]., 48, 123, 1954 – (216) TUMIOITO G^ OLIVA A., GATTINI G. C. e ROSA Min. Med., 48. 4459, 1957 – (2l7) MILLS L. C. e MOYER H, Arch. Int. Med.. 90, 587, 1952 – (218) SALVA J. A. e TARRIDA F. L, Presse Méd.. 64. 1251,
1953 – (219) FORSTER, Mercks Jahresb^ p. 275, 1933 – (220) BROAT, dL da TIDOW in Dtsch. Med. fVoch., n. 39, 1090, 1940 – (221) FULLER C B. S., Lancet. 270. 507, 1956 – (222) MEILMAN E. e KRAYER 0„ Circulation, n. 1, 205, 1950 – (223) MEILMAN E. e KRAYER O., ibid.. n. 4, 212, 1952 • (224) HOOBLER S. W. e CORLEY R. W., Univ, Mich. Med. Bull, 16. 362, 1950 – (225) SPULER O. e WISS ST., Schweit. Med. fVoch.. 84, 925, 1954 – (226) AUBERTIN E., Journ. de Med. de Bordeaux, novembre 1954 – (227) GUZZI L. e BRINA A,. Min. Med., 46. 1051, 1955 – (228) WINER B. M„ New Engl. J. Med., 255, 1173, 1956 – (229) WINER B. M., Circulation. 22. 1074, 1960 – (230) GRAY I. R. e HAMER N. A. J, Brit. Med. J,. 5045, 609, 1957 – (231) WILDBRAND R., Schweiz. Med. Woch., 84, 142,
1954 – (232) CURRENS J. H.. MYERS G. S. e WHITE P. D., Am. Heart. !.. 46. 576, 1953 – (233) MARGOTIN E. G.. LEVINE H. D. e MERRILL J. P„ ibid.. 52. 257, 1956 – (234) CRAW R. O. e TREALOAR A. E., J.A.Ph.A.. 40, 345, 1951 – (235) PERDUE A. S., BELL F., STARNES W. R., HITCHCOCK F. e TEAGNE R. S., J.A.Ph.A., 39, 91, 1950 • (236) BENIGNI R., Boll Chlm. Farm., 90. 384, 1951 – (237) CHRISTENSEN B. V. e MC LEAN, l A.Ph.A.. 28. 74, 1939 – (238) JENKINS H, J, e CHRISTENSEN B. V., ibid., 41. 239, 1952 – (239) RICHARDS A. B. e coll., Meet. Fedcrat Am. Soc. cxptL Biol, Atlantic City, aprile 12, 16, 1954; in J.A.Ph.A.. prat. ed., 15, 332, 1954 – (240) SWISS E. D., J. Pharmacol exp. Ther., 104. 76, 1952 – (241) MAISON G. L. e STUTZMAN J. W., Arch. intertu pharmacod. et de ihér.. 85, 357, 1951 – (242) CHEN G. e RUSSEL D., J.A.Ph.A., 42, 373, 1953 – (243) O’DELL T. B.. ibid., 41. 316, 1952 – (244) GOODMAN L. S. e GlLMAN A., The Pharmacological Basis of Therapeutics, McMillan Comp. Ed., New York, 1955, p. 750 – (245) KRAYER O., Arch. exp. Path. u. Pharmakoi, 209. 405, 1950 – (246) SOKOLOV S. D., Uchenye Zapiski, Pyatigtx^skii Farmatsevt. Insù 3. 78, 1959; Chem. Abs., 56. 5371h, 1962 – (247) BERGMAN E. D, LEVINSON Z. R e MECHOULAM R., J. Insect. Physioi, 2, 162, 1958; Chem. Abs., 52, 18920, 1958 – (248) PANKIEWIC2 H„ GOGOLEWSKA-MIKUCKA B., Acta Polon. Pharm., 17, 463, I960: Chem. Abs., 55, 12752 b, 1961 – (249) ALBANO T- e FRACASSO V., Min. Med., 47, 529, 1956.


