Liquirizia
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Glycyrrhiza glabra L. var. typica Reg. et Her. Fam. Leguminose/Papilionacee)
(Sin. – Liquiritia officinalis Moench. – Glycyrrhiza laevis Pallas.)
Liquirizia- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Glycyrrhiza, dal greco glukos = dolce e riqa = radice; cioè radice dolce.
glabra – per i legumi glabri.
laevis – senza peli (per lo stesso motivo di glabra).
Nome volgare – Regolizia, liquirizia, argalizia (piem.), regolissia (lomb.). legn dols (em.) , maurizia (abbr.), rigorizza (cal.), ruculizia, glisirizza, niculizia (sic.), regallizia, liccarizzu (sard.). Reglisse (fran.), Sussholz (ted.), Licorice (ingl.), Sùs (arab.), Areg as Sus (arab. le parti radicali), Kan ts’ao, Mi ts'ao ecc. (cinese), Regaliza (spagn.), Regoliz, Rigoliz, Alcaçuz (port.), Lakrycya (pol.), Igazi édesgyokér (ungh.).
Habitat – Spontanea nell'Europa orientale (regione arabo-caspiana) (Aleppo, Baghdad, Antiochia, Damasco), sino allo Afghanistan, subspontanea nei luoghi argillosi, qua e là, del litorale marittimo italiano e forse anche nella regione padana [argini del Primaro (Ravenna) (Cocconi)]. Coltivata nell'Italia centrale e meridionale e nelle isole (Sicilia), in Spagna (Prov. di Cordoba, Madrid, Alicante, Valencia, Tarragona, Navarra, Zaragoza) nel Marocco, nel sud della Francia, in Inghilterra (Mitcham, Surrey, Yorkshire), in Germania, in Asia (Persia, Cina), in Australia (Nuova Galles del Sud), Nuova Zelanda.
Pianta erbacea perenne.
Si distinguono parecchie varietà (considerate anche come specie autonome):
G. glandulifera Wald et Kit. – Russia (bacino del Volga), Ungheria, Galizia, Anatolia (questa varietà o specie ha il rizoma molto grosso, fibroso, giallastro, un po’ meno zuccherino). E' amarognola.
G. violacea Boiss. – Iraq (vallate dei Tigri e dell'Eufrate), Mesopotamia.
G. pallida Boiss. – Assiria (Mesopotamia).
e le specie:
G. asperrima L. (sin. – G. pallidiflora Maxim. – G. aspera seu hispida Pallas – G. uralensis Fisch.), Russia, Transcaucasia, Cina, Manciuria, Mongolia meridionale, Siberia, Persia, Afghanistan.
P. J. Roi (Plantes médicinales chinoises, 1955) considera la G. uralensis Fisch., non sinonimo di G. asperrima L., ma una entità a sè, del Kansu, Mongolia meridionale, Siberia.
G. foetida Desf. specie del Marocco (Rharb.). Le parti radicali sono da considerarsi una sofisticazione.
G. echinata L. – Questa specie è confusa in commercio con la G. glandulifera Wald et Kit., è spacciata come liquerizia russa o ungherese. Cresce in Italia nelle Puglie, in prov. di Bari e Lecce, in Basilicata (Pomarico). Ha le radici grigie esternamente e bianche, anziché gialle, nell'interno. E' insipida e non ha alcune delle proprietà della specie tipo o varietà. Si deve ritenere una mistificazione.
Parti usate – I rizomi (stoloni) e le radici (grezzi o decorticati) seccati (Liquiritiae radix F.U.). Il succo.
Componenti principali
Triterpenodi – 1) Acido glicirrizico è stato isolato per la prima volta dalle radici della Glycyrrhiza glabra L. da Robiquet (1) e fu da questi denominato glicirrizina. Il nome di acido glicirrizico gli fu dato in seguito da Roussin (2) ed il termine glicirrizina fu conservato poi propriamente per il sale, quale si trova nella droga, cioè il sale di potassio, di calcio (3) (3 a) e di magnesio (3a) dello stesso acido, o per il sale di ammonio, che è il comune preparato commerciale.
La natura glucosidica dell’acido glicirrizico fu riconosciuta da von Gorup-Besanez (4), mentre la scissione idrolitica di esso in acido glicirretico ed in 2 molecole di acido glucuronico fu attuata più tardi da Tschirch e Cedeberg (3). Diverse formule sono state suggerite per gli acidi glicirrizico e glicirretico, finchè le esatte formule centesimali, C42H62O16 e C30H46O4 rispettivamente, sono state definite da Voss e coll. (5) (6). Agli studi di Ruzicka e coll. (7-12) si deve la risoluzione del problema riguardante la formula di struttura (I) dell'acido glicirretico.
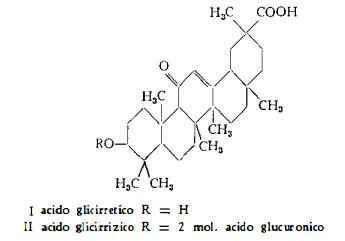
L'acido glicirretico è quindi classificato tra le sapogenine triterpeniche, appartenenti al gruppo dell'acido oleanolico-b-amirina. Esso è stato trovato nelle forme isomere a e b, delle quali la seconda è la più diffusa in natura. La configurazione spaziale dell'acido glicirretico è stata chiarita in parte da Ruzicka e Marxer (9) mediante conversione in b-amirina ed in parte da Beaton e Spring (13) per quanto riguarda la stereochimica del gruppo carbossilico.
Nell’acido glicirrizico l’aglucone è legato a due molecole di acido glucuronico, ciò che è stato dimostrato da Tschirch e coll. (3). Lythgoe e Trippet (14) hanno stabilito che il radicale unito all'aglucone è un acido b-1:2-diglucopiruronico. Il legame tra le due molecole di acido glucuronico, come era già stato suggerito da Voss e Pfirschke (15), è pertanto di tipo b. Successivamente Marsh e Levvy (16) hanno ottenuto la completa idrolisi dell’acido glicirrizico con b -glucuronidasi, provando così che questo glucuronido-glucuronide ha una configurazione b-b, cioè che anche il legame tra il radicale diglucuronico e l’aglucone ha configurazione b.
2) Acido glabrico, C30H46O5, è un nuovo acido triterpenico, che è stato isolato dalle radici della Glycyrrhiza glabra da Beaton e Spring (16a). L’acido glabrico contiene, oltre ad un gruppo carbossilico, due ossidrili ed un gruppo chetonico ab-insaturo ed è probabilmente un acido ossi-18-a-glicirretico (16a).
Contenuto di glicirrizina delle radici
Il ciclo di formazione della glicirrizina, sostanza considerata quale materiale di riserva della pianta, è notevolmente influenzato da vari fattori ecologici e specialmente dalla temperatura ambiente (17). Rilevanti differenze si osservano nel contenuto di glicirrizina nei vari stadi di crescita della pianta; si verifica un massimo poco prima della fioritura, in maggio o giugno (17) (18) (19): si ha quindi una diminuzione e di nuovo un aumento del titolo in settembre (17) (18). Il grafico seguente, dedotto da uno studio fatto dal Serrano (17) sulla Glycyrrhiza glabra L. Spagno-
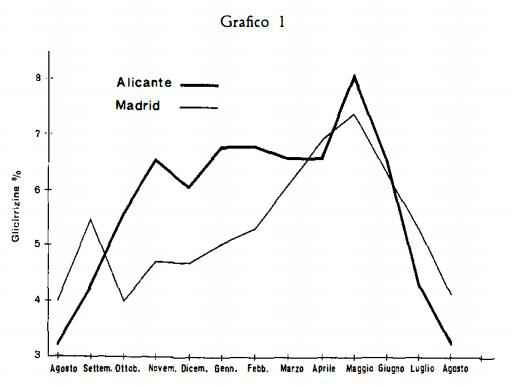
la, mette in relazione le variazioni di temperatura, nel periodo di minore attività della pianta, cioè dall'autunno alla primavera, con le variazioni del contenuto di glicirrizina nelle radici. In località (zona di Alicante), dove la temperatura invernale presenta minori variazioni, il titolo di glicirrizina delle radici di Liquirizia subisce minori dislivelli rispetto ai titoli trovati per la droga raccolta in zona (Madrid), in cui le temperature invernali sono piuttosto basse.
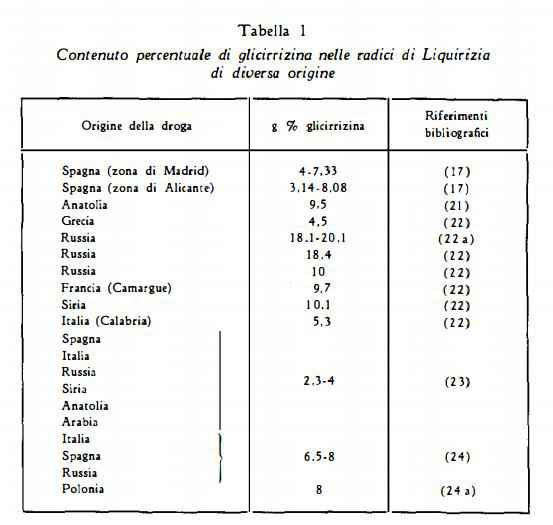
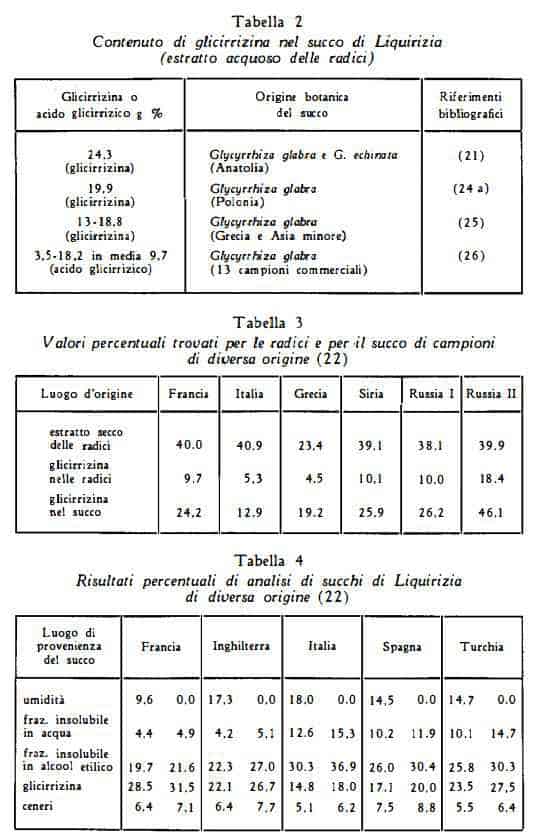
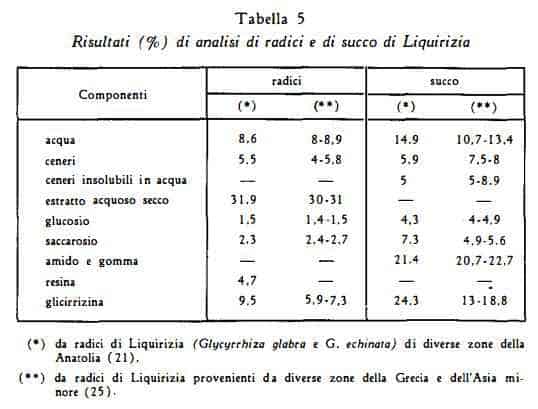
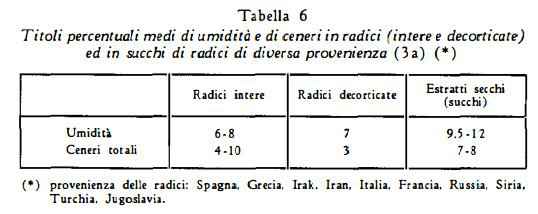
In letteratura si trovano dati analitici notevolmente diversi per il contenuto di glicirrizina nelle radici; queste discordanze sono probabilmente da attribuirsi anche alla diversità dei metodi di titolazione, oltre che alle differenze di contenuto dei campioni esaminati dai vari AA. Ruzicka (20) ha ottenuto una resa del 4% di acido glicirrizico come sale di potassio; Gelbakhiani e coll. (19) nelle radici di droga russa (diverse zone della Georgia) hanno trovato dal 13 al 15,73% di acido glicirrizico. Nelle tabelle che seguono sono raccolti i risultati di analisi di campioni di differente provenienza.
Flavonoidi
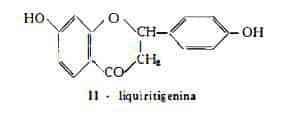
Il glucoside flavanonico liquiritina, C21H22O9, è stato isolato dalle radici della Glycyrrhiza glabra L. da Shinoda e Ueeda (27), i quali ne hanno ottenuto la scissione idrolitica con formazione dell'aglucone e di 1 molecola di glucosio. L’aglucone liquiritigenina, C15H12O4, identificato dagli stessi AA. (27) con il 4’,7-diossiflavanone (II) è stato trovato recentemente anche in forma libera nel succo di Liquirizia (28). Questa sostanza era già stata ottenuta per sintesi (29), mentre la sintesi del glucoside fu compiuta successivamente (30).
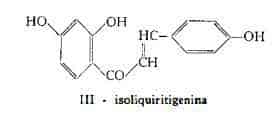
Oltre alla liquiritina, Puri e Seshadri (31) dalle radici della Liquirizia hanno estratto anche il corrispondente calcene e precisamente dalla radice fresca hanno ricavato in prevalenza il calcene, denominato dagli stessi AA. isoliquiritina, mentre dalla radice secca hanno ottenuto liquiritina ed isoliquiritina pressapoco nelle stesse quantità. L'isoliquiritina, C21H22O9, è stata identificata con il monoglucoside, in posizione 4’, dell’isoliquiritigenina, C15H12O4, che è il 2,4,4’-triossicalcone (III) (31). Nel succo della Liquirizia Holler e Berger (28) hanno trovato isoliquiritigenina anche in forma libera.
Pointet-Guillot (3a) e Paris e Guillot (32) hanno riferito di aver isolato dalla frazione flavonica della Glycyrrhiza glabra un glucoside flavanonico di formula grezza C27H32O13-2H2O, non identificabile con la liquiritina di Shinoda e Ueeda (27), poiché per scissione idrolitica, oltre alla genina liquiritigenina ed a glucosio, produce una molecola di ramnosio. A questo glucoside è stato dato il nome di digluco-liquiritoside o di liquiritoside-flavanone (3a).
Pointet-Guillot (3a) ha inoltre estratto un calcone glucosidico C27H32O13-2H2O, e l’ha denominato liquiritoside-calcone o isoliquiritoside. Esso per idrolisi si scinde in isoliquiritigenina, glucosio (1 mol.) e ramnosio (1 mol.).
Lo stesso A. (3a) ha estratto dalla droga secca l’1-1,5% di flavonoidi grezzi.
La liquiritina in forma di cristalli grezzi è stata ricavata dalla Liquirizia russa con una resa di 45 g da 10 kg di radici e da droga cinese con un rendimento di 60 g da 10 kg di radici (33). In quantità sensibilmente inferiore (27 g da 10 kg di liquirizia di provenienza cinese) la liquiritina era già stata ottenuta da Houseman e Swift (34), che, prima di Shinoda e Ueeda (27), l’avevano estratta dalle radici, ma non l’avevano identificata.
Altri componenti
Vitamine del gruppo B sono state trovate nelle radici di Liquirizia e precisamente: un fattore acido pantotenico-simile ( 33 g/g) (35), un fattore biotina-simile e lo stesso in forma di solfossido (36) (37), identificabile con la sostanza che è stata descritta da Melville (38).
Un fattore antilisozima è stato ricavato da Voorspuij e Coll. (39) dal succo di Liquirizia in concentrazione tale che una parte della frazione estratta aveva l’attività di 400 parti di succo. Secondo un processo di estrazione, pubblicato dallo stesso A. (40), il rapporto quantitativo del fattore antilisozima rispetto all’acido glicirrizico nella frazione purificata era di 1:0,1, mentre nel succo di Liquirizia, usato quale materiale d'estrazione, era di 1:15.
17-chetosteroidi in piccole quantità sono stati trovati nelle radici, nel succo e nella glicirrizina grezza (41).
Dalla Liquirizia è stata in seguito estratta una frazione resinosa con attività cortisone-simile. Sono stati ottenuti cioè g 12 di frazione resinosa attiva da g 500 di estratto di Liquirizia, preparato secondo il metodo della Brit. Pharm. 1948 (42). Il residuo, dopo la separazione dalla sostanza attiva, conteneva praticamente tutto l'acido glicirrizico del materiale iniziale (42).
Una frazione (0,035 % delle radici), dotata di elevate proprietà estrogene, è stata ricavata da Costello e Lynn (43) ed è stata ulteriormente estratta ed esaminata da Pointet-Guillot (3a), che l'ha sottoposta a frazionamento cromatografico, ottenendo sostanze, i cui Rf sono molto vicini a quelli dell’estrone e dell’estradiolo.
Sono stati inoltre trovati un fitosterolo identificato con il 22,23-diidrostigmasterolo (44) (45), acido benzoico (43), albumina, mucina (3a), glucosio, saccarosio, resina (ved. le tabelle 4, 5 e 6). Secondo risultati analitici di vecchia data anche asparagina 2-4 % (46), mannite (47), acido malico (1) (48), olio etereo 0,03-0,035 % (49) e sostanze amare non identificate (23) (50).
Proprietà farmacologiche ed impiego terapeutico
Nota nella medicina dell’antico Egitto e dell’antica India, la Liquirizia era ben conosciuta anche nella medicina greco-romana. Ippocrate, Teofrasto, Dioscoride, Celso, Galeno, Plinio, Tralliano, la impiegarono già nella medicazione delle ferite, contro la tosse e come correttivo del sapore. Dioscoride ci insegna che «Il succo di Liquirizia giova nei casi di raucedine. Esso è buon medicamento nei bruciori di stomaco, nei dolori di petto e del fegato; bevuto con vino dolce giova nei crampi vescicali e nei dolori renali. Sotto forma di pomata si usa nella medicazione delle ferite». Erano già note quindi quelle proprietà emollienti, bechiche ed espettoranti per le quali la Liquirizia ha sempre trovato vasto impiego terapeutico, come pure note dovevano essere le proprietà antiflogistiche, antisettiche, antispastiche e antiulcera che i risultati delle più recenti ricerche cliniche e sperimentali hanno confermate.
A prescindere dalle note azioni emolliente, espettorante e leggermente diuretica e lassativa, la Liquirizia cominciò a destare nuovo interesse dopo che Revers (51) comunicò le sue osservazioni sull’azione di questa droga nella terapia dell’ulcera gastrica. Questo A. avendo notato come alcuni malati affetti da ulcera gastrica, trassero giovamento dall’uso empirico di un preparato a base di Liquirizia, volle controllarne l’azione su malati in cui l’esistenza dell’ulcera era stata radiologicamente accertata. A questi malati venne somministrato tre volte al giorno prima dei pasti, un cucchiaino da caffè di una pasta preparata con 4 parti di polvere di estratto di Liquirizia e di una parte di acqua. Revers osservò che nella maggior parte dei casi trattati, i sintomi dolorosi scomparvero in pochi giorni e il successivo controllo radiografico permise di constatare la scomparsa completa o una notevole riduzione delle lesioni ulcerative. In 4 casi in cui il trattamento venne sospeso, la sintomatologia dolorosa ricomparve però dopo breve tempo.
L’effetto antiulcera della Liquirizia non sembra però manifestarsi in tutti i casi con costanza e con la stessa intensità.
Più recentemente Gutman e Kanoni (52) dopo aver constatato l’azione favorevole della Liquirizia nell’ulcera sperimentale della cavia, hanno potuto notare un’azione nettamente favorevole nell’uomo, soltanto nei casi di gastrite. Nell’ulcera invece hanno potuto constatare soltanto una azione antalgica e nessun effetto nelle dispepsie di soggetti operati di gastrectomia o di gastroenterostomia.
Schulze e coll. (53) che hanno trattato 200 gastroenteropazienti con estratti di Liquirizia affermano, al contrario, di aver osservato nel 90% dei casi di ulcera gastrica, un netto miglioramento controllabile anche radiologicamente. L’effetto terapeutico si manifesterebbe però soltanto nelle forme recenti e, contrariamente agli AA. precedenti, non hanno ottenuto alcun risultato favorevole nelle gastriti. Secondo gli AA. la Liquirizia agirebbe anche prevenendo l’evoluzione neoplastica dell'ulcera.
Secondo questi AA. l’azione dell’estratto di Liquirizia, sarebbe dovuto al suo alto contenuto di sostanze ad azione DOCAsimile.
Le osservazioni del Revers indussero molti ricercatori a rivolgere la loro attenzione a queste particolari proprietà della Liquirizia, il cui meccanismo d’azione venne poi indagato nei suoi diversi aspetti.
Da Busquet (54) era già stata notata l’azione sedativa della Liquirizia sulla peristalsi intestinale, osservazione questa che venne poi confermata dai risultati di ricerche successive di Nelemans-Stamperius e Nelemans (55) i quali trovarono che un estratto di Liquirizia, preparata secondo la Farmacopea olandese, induce, su segmenti isolati di intestino e di stomaco, una diminuzione del tono e della motilità. Questi AA. notarono anche che l’estratto di Liquirizia determina una marcata azione inibitrice dell’effetto istaminico e acetilcolinico sul muscolo retto di rana e sul duodeno di ratto.
L’azione sulla pressione arteriosa nel gatto sarebbe invece, secondo gli AA., trascurabile ed anche sul cuore di rana osservarono che soltanto dosi elevate possono provocare una diminuzione della contrazione ventricolare e turbe della conduzione.
L’argomento venne ripreso da Vincent (56-59) il quale sperimentando l’azione di decotti di Liquirizia su cani cloralosati e su organi isolati, confermò l’esistenza di un'attività antispastica, antistaminica e antiacetilcolinica nella Liquirizia e precisò inoltre che tale attività si manifesta in maniera pressocchè specifica sull'intestino isolato, mentre verrebbe a mancare o si manifesterebbe molto più debolmente e fugacemente su altri organi e sistemi.
Vincent ritiene pertanto probabile che l’azione della Liquirizia sull’ulcera sperimentale e su quella spontanea dell’uomo, possa essere riferita a queste proprietà e forse anche ad un’azione trofica oltre ad un eventuale effetto tampone sull’acidità gastrica, ciò che venne ammesso anche da Czok e Kreienberg (60) e da Desmarez (61). In realtà non sembra provato che alle sostanze ad azione spasmolitica, antiacetilcolinica, antistaminica o atte a diminuire il pH del succo gastrico, possa essere attribuita un’azione terapeutica sull’ulcera gastrica sperimentale o spontanea, simile a quella di cui è dotata la Liquirizia. La papaverina, la Belladonna, gli antistaminici, gli alcalinizzanti infatti, se rappresentano dei coadiuvanti nella terapia dell’ulcera gastrica, atti ad attenuarne la sintomatologia dolorosa, non sono certo sufficenti a determinare una più o meno rapida o più o meno transitoria cicatrizzazione della lesione ulcerosa. E’ quindi probabile che l’azione terapeutica dimostrata dalla Liquirizia in questi casi, sia dovuta anche ad altri fattori non ancora bene accertati.
Più recentemente Delso (62) confermò l’azione antistaminica degli estratti di Liquirizia sull’ileo di cavia, mentre sulla pressione arteriosa constatò, con l’impiego di dosi elevate, un effetto ipotensivo istaminosimile e, sull’utero di cavia, un effetto contratturante.
I risultati terapeutici ottenuti da Revers, indussero Molhuysen e i suoi coll. (63) ad approfondire lo studio delle proprietà della Liquirizia alla quale essi poterono riconoscere un’azione simile a quella del desossicorticosterone e certe azione proprie dell’ACTH, ad eccezione di quella, nota, sull’artrite reumatoide.
Gli AA. hanno potuto controllare, durante un periodo di 18 mesi, l’attività del succo di Liquirizia su 9 malati. Gli effetti più salienti da essi osservati, riguardano l'assorbimento dell'acqua, dei cloruri, del sodio da parte dei tubuli renali, la diminuzione dell'emoglobina e delle proteine del siero, l'aumento della pressione ematica, della frequenza del polso e dell'eliminazione del potassio. L'azione notata sarebbe dunque simile a quella che consegue all'iniezione di alte dosi di desossicorticosterone, ma di questa più duratura. La pressione arteriosa tende a permanere elevata anche dopo l'interruzione del trattamento, a meno che non si somministri una dieta aclorurata. Gli AA. giungono a raccomandare ai medici l'uso moderato della Liquirizia, specialmente nei casi di malati in età avanzata, ai quali una troppo intensa eliminazione di potassio potrebbe riuscire dannosa e provocare fenomeni di asma cardiaca. Durante le esperienze sull'azione dell'estratto di Liquirizia sull'ulcera peptica, gli AA. notarono infatti la comparsa di ipertensione e di edemi, accompagnati o non da asma cardiaca. Anche secondo altri autori questi fenomeni dovrebbero essere messi in relazione appunto, con la presenza nella Liquirizia di una sostanza ad azione desossicorticosteronesimile che, mediante una ritenzione del sodio e a una maggior eliminazione del potassio, favorirebbe un aumento del liquido extracellulare e del volume del plasma, con conseguente aumento della pressione venosa e della pressione arteriosa sistolica.
L'argomento venne successivamente ripreso da Groen, Pelser, Willebrands e Kamminga (64) e i risultati delle loro esperienze confermarono quelli ottenuti dagli AA. precedentemente citati, conducendo a confermare la presenza nell'estratto di Liquirizia, di una sostanza ad azione desossicorticosteronesimile la cui azione si manifesterebbe molto più lentamente di quella del DOC, ma che permarrebbe più a lungo dopo la sospensione del trattamento. Degno di nota apparve agli AA. il fatto che questa sostanza si dimostra attiva anche quando gli estratti di Liquirizia vengano somministrati per os. Gli AA. riferiscono un caso di malattia di Addison in cui ottennero, dopo un trattamento preliminare con desossicorticosterone, il mantenimento dell'equilibrio minerale con la sola somministrazione orale di 15 g di estratto di Liquirizia al giorno.
Sospendendo la somministrazione ricomparvero le alterazioni biochimiche ed emodinamiche, ma riprendendo il trattamento con 30 g al giorno di estratto, fu di nuovo possibile ottenere la ritenzione del sodio, l'eliminazione del potassio, la modificazione della concentrazione ematica e la remissione clinica della sintomatologia caratteristica.
Borst, Holt, De Vries e Molhuysen (65) trovarono a loro volta che l'attività DOCAsimile della Liquirizia, osservata in soggetti con ghiandole surrenali intatte, non si manifestava invece in pazienti affetti da morbo di Addison e gli AA, ne dedussero che, molto probabilmente, quei pazienti affetti da morbo di Addison che rispondono al trattamento con estratti di Liquirizia, hanno una parte del tessuto corticosurrenalico ancora funzionante.
Accertata dunque questa attività corticosurrenalica degli estratti di Liquirizia, le ricerche che seguirono furono logicamente dirette a precisare a quale, fra i principi attivi contenuti nella droga, tale interessante attività potesse essere attribuita.
Card e coll. (66) riuscirono a dimostrare che l'acido glicirretico presente nella Liquirizia sotto forma del suo glucuronide acido glicirrizico, determina nei soggetti normali, analogamente agli estratti grezzi di Liquirizia, ritenzione dell’acqua, del sodio e dei cloruri. Essi osservarono anche che l’acido glicirretico somministrato ad un paziente affetto da morbo di Addison, agì sul peso corporeo e sul metabolismo degli elettroliti, nello stesso modo con cui agiscono il desossicorticosterone e il cortisone ma che, contrariamente a quanto avviene con questi corticosteroidi, la Liquirizia e l’acido glicirretico non prolungano il periodo di sopravvivenza degli animali surrenalectomizzati.
Uno studio comparativo dell’azione degli estratti di Liquirizia, della glicirrizina e dell’acido glicirretico con il DOCA, sul ricambio elettrolitico, fu successivamente eseguito da Hassan, Palumbo e Elmadjian (67) i quali fra l’altro, osservarono che i valori del rapporto K:Na dopo somministrazione di estratti di Liquirizia o di glicirrizina ammoniacale o di glicirrizinato monoammonico a dosi elevate, sono simili a quelli che si ottengono con il DOCA, mentre l’acido glicirretico determinerebbe una minor eliminazione del potassio.
Gì sembra intanto interessante notare il fatto che queste ricerche, iniziate con lo scopo di indagare il meccanismo dell’azione terapeutica con cui gli estratti di Liquirizia agiscono sull’ulcera gastrica, abbiano condotto alla scoperta di una loro attività DOCAsimile e che tale attività è legata alla presenza della glicirrizina, dell’acido glicirrizico e quindi dell’acido glicirretico, sostanze queste che, peraltro, non sembrerebbero interferire, secondo alcuni AA., nel determinismo dell’azione antiulcera, tanto che il Sogdrager (68), in considerazione del fatto che gli estratti di Liquirizia impiegati nel trattamento dell’ulcera gastrica, determinano azioni secondarie indesiderabili, consiglia l’uso di estratti di Liquirizia privi di glicirrizina ed indica il metodo per ottenerli.
Berger e Boiler (69-70), basandosi sulla constatazione che l'attività terapeutica della Liquirizia sull’ulcera gastrica sembra verificarsi anche per gli estratti dai quali è stato allontanato l’acido glicirrizico, si sono proposti di indagare se fra l’azione spasmolitica di alcuni estratti di Liquirizia del commercio e il loro contenuto in acido glicirrizico, esistesse una certa relazione di proporzionalità. L’azione spasmolitica venne studiata dagli AA. su segmenti isolati di intestino di coniglio, resi ipertonici con cloruro di bario e prendendo come termine di confronto la papaverina. Essi poterono così stabilire che l’azione spasmolitica non è proporzionale al contenuto di acido glicirrizico e concludono che oltre questa sostanza debba influire sulla suddetta azione anche qualche altro fattore e che essa non può essere valutata con la sola determinazione dell'a. glicirrizico. Anch'essi ritengono che le azioni secondarie dovute all'uso dell'estratto di Liquirizia a dosi elevate, possono essere evitate sostituendo l’estratto totale con estratti privi di glicirrizina dalla quale, secondo gli AA., l’ulcera gastrica non verrebbe influenzata.
A conclusioni analoghe giungono Bòiler e Schirmer (71) e Muresan e coll. (72) i quali avendo studiato l’azione antiulcera di estratti di Liquirizia totali ed esenti da glicirrizina, trovarono che questi ultimi sono dotati di un’azione parasimpaticomimetica e che sono capaci di prevenire l’insorgere dell’ulcera sperimentale nei ratti.
Occorre dire però, che di un’azione simile sarebbe dotato, secondo Klosa (73) e contrariamente all’opinione degli AA. precedentemente citati (68-71) anche l’acido glicirrizico che venne impiegato dall’A. sotto forma del suo sale potassico, il quale pur non influenzando direttamente lo stato ulcerativo già esistente, sarebbe capace di prevenire la formazione di nuove ulcere.
Nelle prove cliniche, il sale suddetto avrebbe dimostrato un’azione calmante della sintomatologia gastralgica provocata dall’ulcera ed un effetto terapeutico, controllabile radiologicamente, nel 40-60% dei casi.
Successive ricerche di Berger e Bòiler (28) condussero a considerare l’importanza delle sostanze flavonoidi contenute nel succo di Liquirizia.
Gli AA. avendo notato l’esistenza di un certo parallelismo fra la colorazione gialla delle soluzioni di succo di Liquirizia e la loro azione antiulcera, hanno formulato l’ipotesi che i flavoni possano interferire nel meccanismo di quest’azione. Gli AA. sperimentarono la liquiritigenina (ved. parte chimica) ottenuta per sintesi e il suo calcone, comparativamente con la papaverina, sull’intestino isolato di coniglio. L’attività spasmolitica del calcone è risultata pari alla metà di quella della papaverina e doppia di quella della liquiritigenina.
Il calcone inoltre, praticamente atossico, manifesterebbe una netta azione analgesica nei disturbi gastrici provocati sperimentalmente nel topo.
Questi risultati furono in seguito confermati da Formanek, Roller ed altri (74), i quali sperimentarono comparativamente con la papaverina, l’attività spasmolitica di alcuni flavonoidi, fra i quali l’isoliquiritigenina. L'attività di quest’ultima è risultata pari alla metà di quella della papaverina nell’antagonizzare l’effetto contratturante del cloruro di bario su segmenti di intestino e uguale alla papaverina nell’antagonizzare l’effetto della carbaminoilcolina.
Voorspuij e coll. (39-40) trovarono inoltre che l’estratto di radici di Liquirizia possiede un’attività antilisozimica che non sarebbe legata ad alcuna particolare sostanza contenuta nell'estratto stesso.
Gli AA. pur non essendo riusciti ad isolare una sostanza pura, hanno preparato estratti dotati di un’attività antilisozimica superiore di 400 volte a quella relativa agli estratti naturali.
Secondo Schumacher (75), alle sostanze ad azione antilisozimica potrebbe essere legato un ruolo importante nella terapia dell’ulcera. E’ stato infatti osservato che le feci di pazienti affetti da colite ulcerosa, sono dotate di un’elevata attività antilisozimica e si suppone che il lisozima, attaccando lo strato mucoso protettivo, possa rappresentare uno dei momenti patogenetici dell’ulcera del tratto gastrointestinale.
Emerge da tutto ciò che all’azione antiulcera degli estratti di Liquirizia prendono parte come fattori coadiuvanti, le attività antiacetilcolinica, antistaminica ed antispastica sul tubo gastroenterico, l’azione tampone sulla acidità del succo gastrico (58) (60) (61) e probabilmente anche l’azione DOCAsimile dell’acido glicirretico presente negli estratti di Liquirizia sotto forma di glicirrizina e di acido glicirrizico. Il fatto però che della stessa attività siano dotati anche gli estratti esenti da glicirrizina, indica che in essi sono contenute altre sostanze, quali quelle flavonoidi, antilisozimiche e forse anche altre non determinate, la cui attività sembra manifestarsi in maniera più specifica nella terapia dell'ulcera gastrica.
L’acido b-glicirretico è certamente il derivato più importante della Liquirizia e quello più studiato in questi ultimi anni. Sulla sua azione farmacologica e terapeutica esiste oggi una letteratura molto vasta ma ciò nonostante, alcuni aspetti della sua attività che hanno suscitato e continuano a suscitare molte discussioni, attendono ancora di essere definitivamente chiariti.
Vengono attribuite all’acido glicirretico le proprietà caratteristiche dei mineralocorticoidi e alcune di quelle dei glucocorticoidi. Gli autori sono concordi nel ritenere che questo triterpene rappresenti, sotto questo aspetto, il principio attivo della Liquirizia nella quale vi è contenuto, come già detto, sotto forma del suo glucuronide acido glicirrizico e del suo derivato ammonico, la glicirrizina.
Sul metabolismo idrico salino l’acido glicirretico, come gli estratti di Liquirizia, la glicirrizina e l’acido glicirrizico, determina negli animali e nell’uomo normale, alterazioni qualitativamente simili a quelle caratteristiche determinate dal DOCA e dagli altri corticoidi mineralattivi: aumento della ritenzione dell’acqua, del sodio, dei cloruri e della eliminazione del potassio [Molhuysen e coll. (63), Groen e coll. (64), Borst e coll. (65), Card e coll. (66), Hassan e coll. (67), Calai (76), Menkyna (77), Finney e coll. (78), Kraus (79), Delso e Fraile (80), Bernard (81), Louis e Conn (82)].
Questa attività sulla quale sono ormai concordi la grande maggioranza degli autori, è stata negata da alcuni altri [Muresan e coll. (72), Wenzel e Emick (83)]. Essa, comunque, non si manifesterebbe negli animali surrenalectomizzati e nei malati di morbo di Addison in cui non esista almeno una parte del tessuto corticosurrenalico funzionante [Borst e coll. (65), Card e coll. (66), Hudson e coll. (84)].
Li-Sheng Chang e coll. (85) trovarono che i pazienti affetti da tbc che non reagivano più alla streptomicina, all’idrazide dell’acido isonicotinico e al Pas, rispondevano al trattamento combinato con Liquirizia, con miglioramento constatabile all'esame radiografico, con riduzione della temperatura e con miglioramento delle condizioni generali, il che fa ritenere agli AA. che la Liquirizia manifesti in questi casi un'azione simile a quella del desossicorticosterone.
L’azione antiflogistica caratteristica dei corticoidi glucoattivi, venne notata come già fu detto, dal Molhuysen e coll. (63) il quale attribuì all’acido glicirretico alcune azioni dell’ACTH, Tale azione venne confermata in seguito anche da altri AA. ed ebbe vaste applicazioni terapeutiche specialmente, come vedremo in seguito, in campo dermatologico.
Gijon e Murcia (86) hanno recentemente investigato l’azione antiflogistica dell’acido glicirretico comparativamente col cortisone. I risultati da essi ottenuti dimostrano che l’acido glicirretico agisce favorevolmente sulla formazione del granuloma prodotto per impianto sottocutaneo di batuffoli di cotone nei ratti, inibendone lo sviluppo con un’attività che, quantitativamente, gli AA. considerano di 13 volte inferiore a quella del cortisone (13 mg di acido glicirretico equivarrebbero a 1 mg di cortisone).
In ratti trattati per un periodo di 21 giorni con acido glicirretico o con cortisone, gli AA. notarono che l’infiammazione prodotta da iniezioni di formolo nell’aponeurosi plantare, era inibita più energicamente dall’acido glicirretico che dal cortisone, mentre nei ratti trattati per soli tre giorni, l’azione del cortisone risultò più elevata. Questo diverso comportamento osservato nei trattamenti protratti per un lungo periodo o limitati a pochi giorni, viene spiegato dagli AA. con la più elevata tossicità del cortisone che agirebbe più intensamente nei ratti. Per questo motivo gli AA. ritengono che l’acido glicirretico debba essere preferito al cortisone allorché il suo impiego debba essere molto prolungato.
Delso e Fraile (80) che hanno studiato comparativamente con il cortisone, l’attività degli estratti di Liquirizia, della glicirrizina e dell’acido glicirretico su ratti normali e surrenalectomizzati, concludono che l’acido glicirretico aumenta discretamente la glicemia nei ratti surrenalectomizzati e normali, determina involuzione parziale del timo ed eleva moderatamente il tempo di sopravvivenza dei ratti surrenalectomizzati sottoposti a «stress» da fame. Per quanto riguarda l’attività dei preparati di Liquirizia sul metabolismo idrico salino, gli AA. avrebbero dimostrato che essi e in particolare l’acido glicirretico, manifestano un’azione DOCAsimile sia sui ratti normali che su quelli surrenalectomizzati.
Anche secondo Kraus (87) l’acido glicirretico si avvicinerebbe ai glucocorticoidi nell’azione antiflogistica la quale sarebbe indipendente dalla presenza delle surrenali. L’inibizione della formazione dei granulomi negli animali surrenalectomizzati, può essere attribuita, secondo l’A., all’analogia chimica esistente fra acido glicirretico e corticoidi, mentre l’assenza di una correlazione tra dose ed effetto potrebbe essere attribuita al debole assorbimento o alla rapida eliminazione della sostanza, o ad entrambi questi fattori.
Lo stesso Kraus (88), in considerazione del fatto che la glicirrizina esercita un effetto inibente sul sistema corticosurrenale-ipofisario, ha voluto accertarsi se tale attività fosse dovuta al suo aglicone, l’acido glicirretico. Sperimentando su ratte sottoposte a stress parziale e prendendo come unità di misura dell’attività del sistema corticosurrenale-ipofisario la concentrazione dell’acido ascorbico nelle surrenali, l’A. ha potuto infatti dimostrare che la somministrazione prolungata di acido glicirretico esercita un’azione inibente sull’attività ipofisaria.
Quest’azione glicocorticoidesimile sarebbe invece esclusa da Finney e coll. (78), da Louis e Conn (82) ed anche da Chirico e coll. (89) per quanto riguarda le modificazioni ematologiche centrali e periferiche.
Successivamente Finney e Tarnoky (90) studiarono l’attività antiflogistica e gli effetti biochimici di un derivato dell’acido glicirretico, il sale dell’acido succinilglicirretico. Questa sostanza sperimentata sugli animali da laboratorio, ha dimostrato di essere dotata di azione antiflogistica, di più bassa tossicità e di essere più solubile in acqua, ciò che la rende più facilmente applicabile dell’acido glicirretico.
Somministrata per via sottocutanea, esercita un’azione necrotica locale. Influisce sul metabolismo idrominerale dei ratti ma non su quello dei gatti. Non agisce sulla secrezione dei 17-chetosteroidi nè su quella dei 17-idrossicorticosteroidi nel coniglio. E’ dotata di una leggera azione emolitica in vitro e, a forte concentrazione, sembra essere dotata di un effetto anticoagulante. Questi risultati fanno ritenere agli AA. che il sale sodico dell’acido succinilglicirretico possa essere impiegato in terapia, nel trattamento delle varie forme infiammatorie.
L’azione antiestrogena dell’acido glicirretico è stata studiata dallo stesso Kraus (87) sull’inibizione dell’accrescimento proliferativo dell’utero prodotto dagli steroidi della serie dell’estrano. La sua azione sarebbe simile, sotto questo aspetto, a quella dei D-3-chetosteroidi e pertanto agirebbe come un attivo inibitore dell’accrescimento dell’utero indotto dai suddetti estrogeni, in dosi che non interferiscono con l’accrescimento somatico, nè con l’azione degli estrogeni sugli ormoni trofici ipofisari. Tale effetto inibente non sembra esplicarsi attraverso l’inibizione delle gonadi, della eccitazione o del potenziamento dell’azione corticosurrenalica, in quanto non è modificato dalla surrenalectomia.
L’effetto inibente dell’acido glicirretico sulla suddetta attività estrogenica potrebbe dunque verificarsi attraverso lo stesso meccanismo d’azione attribuibile agli steroidi naturali, piuttosto che alla sua capacità di interferire con il metabolismo dell’idrocortisone e del desossicorticosterone.
Il testosterone, il progesterone ed i corticosurrenalici, agiscono come antagonisti della risposta dell’utero agli estrogeni, mediante un (alterazione dei sistemi enzimatici e, pertanto, risultano influenzate le variazioni della permeabilità della cellula uterina prodotte dagli estrogeni e, per conseguenza, il grado della risposta proliferativa.
Le due curve parallele, dose-risposta, ottenute dall’A. con benzoato di estradiolo, con o senza acido glicirretico, indicano che anche aumentando di 4 volte la dose degli estrogeni esogeni, non è possibile diminuire il grado di inibizione prodotto da 6 mg di acido b-glicirretico. L’azione antiestrogena ottenuta con la dose minima attiva di acido glicirretico (mg 1,2) non è stata accresciuta aumentando il dosaggio di 5 volte (mg 6).
Apparentemente la diminuzione del peso dell’utero non è in relazione con il rapporto estradiolo-acido glicirretico.
Atherden (91) ha trovato che l’acido glicirretico inibisce il metabolismo del progesterone (e dell’11-desossicorticosterone) negli omogenati di fegato di ratto, con un effetto diretto sul sistema enzimatico steroidico. Essenziale per il determinismo di tale inibizione sarebbe secondo l’A., la presenza dell’11-oxogruppo a-b-insaturo, nella molecola dell’acido glicirretico.
A conclusioni analoghe giunse Saburo Vano (92) il quale trovò anche che l’effetto inibente della glicirrizina sul metabolismo del progesterone e di altri corticoidi (idrocortisone, desossicorticosterone) su omogenati di fegato, è dovuto all’acido glicirretico.
Per completare questo paragrafo, aggiungiamo che notevoli quantità di una sostanza estrogena sarebbero state isolate dalla Liquirizia da Costello e Lynn (43), ma da un esame critico e sperimentale eseguito da Hòller e coll. (93) sui ratti e impiegando campioni di Liquirizia austriaca e i loro estratti, risulta che non è stato possibile agli AA., porre in evidenza alcuna azione estrogena, anche impiegando dosi superiori di 50 volte a quella considerata massima nell’uomo. Ciò potrebbe essere spiegato dal fatto che Costello e Lynn, oltre la suddetta sostanza estrogena, riconobbero negli estratti di Liquirizia anche la presenza di un principio antiormonico la cui attività inibirebbe, per certe dosi, quella della sostanza estrogena.
Sull’azione sostitutiva e sulla possibilità di potenziare e di prolungare l’azione cortisonica mediante la Liquirizia e i suoi principi attivi, non tutti gli AA. sono concordi.
Hart e Léonard (94) che hanno sperimentato l’attività dell’acido glicirretico in associazione con il cortisone in alcuni pazienti affetti da febbre reumatoide, concludono che l’azione potenziatrice dell’acido glicirretico sull’attività del cortisone è troppo lieve ed incostante in questi casi, per poterle attribuire qualche valore pratico.
Borst e coll. (65) osservarono che l’azione DOCsimile degli estratti di Liquirizia che si nota in pazienti con surrenali intatte, non si è manifestata in 3 pazienti affetti da morbo di Addison. In questi malati l’azione della Liquirizia è stata ripristinata con la somministrazione quotidiana di mg 2,5 di cortisone. Con Liquirizia e ACTH l’azione non si è manifestata su due pazienti. Gli AA. in base a queste osservazioni ritengono che negli addisoniani la Liquirizia possa agire soltanto allorché esista una parte del tessuto corticosurrenalico funzionante.
Hudson e coll. (84) al contrario, osservarono che la glicirrizina, pur essendo risultata insufficiente a mantenere in vita 3 pazienti che avevano subito la surrenalectomia bilaterale per metastasi di carcinoma, associata ad una terapia cortisonica praticata con dosi considerate subminime, riuscì a prolungare la vita per un periodo di 3-8 settimane.
In due casi i pazienti poterono essere mantenuti adeguatamente per
8-16 giorni rispettivamente, con la sola glicirrizina, dimostrando cosi, secondo gli AA., la superiorità di questa sostanza sul DOCA nella terapia di pazienti iposurrenalici.
Girerd e coll. (95) al contrario, trovarono che tanto gli estratti di Liquirizia quanto la glicirrizina, si sono dimostrati incapaci di prolungare la sopravvivenza dei ratti surrenalectomizzati, per un tempo superiore ai controlli, mentre il DOCA si sarebbe dimostrato molto attivo.
Un potenziamento e un prolungamento dell’azione idrocortisonica fu invece osservato da Akira Kumagai e coll. (96) in pazienti con febbre reumatica acuta e in altri con lupus eritematoso disseminato.
Non è facile trarre conclusioni definitive dall’analisi di osservazioni così contradditorie; in linea di massima si potrebbe dire che l'azione dell’acido glicirretico sul metabolismo idrominerale si manifesta soltanto negli animali e nell’uomo non surrenalectomizzati e con surrenali funzionanti o parzialmente funzionanti.
L’attività cortisonosimile, secondo alcuni AA., sarebbe invece posseduta dall’acido glicirretico in misura superiore al DOCA, la cui azione sarebbe più specificamente o quasi esclusivamente idromineralattiva. In altri termini, l’acido glicirretico sarebbe simile al DOCA per quanto riguarda l’attività sul metabolismo idrominerale, nel deprimere la produzione dell’ACTH, nel diminuire la resistenza del topo allo stress da freddo e la capacità dei ratti tenuti a digiuno a mobilizzare il glucosio [Kraus (97) (98)]; ne differirebbe perchè la sua azione sul metabolismo idrominerale sarebbe indiretta in quanto mediata dalla corticale surrenalica e perchè la sua attività si estenderebbe in maniera superiore a quella del DOCA, anche nel campo dei glicocorticoidi.
Resta comunque da precisare l’estensione di questa attività e in quali casi essa può manifestarsi e in maniera terapeuticamente utile.
Secondo Aho (41) nella Liquirizia e nei suoi estratti sarebbero contenuti i 17-chetosteroidi i quali si troverebbero liberi nella droga ed estraibili con etere senza preidrolisi. Essi verrebbero eliminati con le urine dove si ritroverebbero combinati con acido glucuronico e acido solforico. L’A. aggiunge che la ricerca cromatografica di questi chetosteroidi non avrebbero ancora dato risultati sicuri perchè il loro contenuto nella droga è piuttosto basso.
Il Mitchel (42) inoltre, ha successivamente separato da un estratto di Liquirizia, una frazione resinosa dotata di attività cortisonesimile quantitativamente uguale o maggiore, a parità di peso, a quella del cortisone. Molto verosimilmente è la presenza di queste sostanze che giustificano il diverso comportamento degli estratti totali di Liquirizia e dei suoi principi attivi, notato da qualche autore, negli animali surrenalectomizzati o nei soggetti in cui le surrenali non erano funzionanti.
Alla Liquirizia e ai suoi derivati sono state riconosciute, oltre le surricordate, anche altre proprietà fra le quali considereremo le seguenti:
a) L’azione cardiovascolare della glicirrizina è stata studiata da Gujral e coll. (99), su cani, gatti e rane. Essi hanno osservato che sulla pressione arteriosa la glicirrizina non è attiva sino alla dose di 100 mg/kg nel cane e di 20 mg/kg nel gatto. Al di sopra di questa dose è stato osservato un ulteriore, benché transitorio, effetto ipotensivo. Tale effetto non sarébbe dovuto, secondo gli AA., a un’azione sui riflessi cardiovascolari efferenti.
Nei ratti e nei cani la glicirrizina, somministrata oralmente, ha manifestato un effetto antidiuretico che non si verifica invece sull’uomo.
b) L'azione batteriostatica degli acidi 18a e b-glicirretico, del sale potassico dell’acido b-glicirretico, di un derivato di sintesi, il b-glicirreticoside e della glicirrizina, è stata studiata da Benigni e Franco (100). Da tali ricerche risulta che la maggior e più estesa attività batteriostatica è posseduta dall’acido b-glicirretico che si manifesta sullo Staph. di Oxford, sullo Staph. hemolyticus, sullo Strept. faecalis, sul Corynebacterium difteriae, sul B. anthracis, sul Pseud. aeruginosa e sui micobatteri paratubercolari (Myc. Pellegrino, Phlei, Milch, Minetti, 607, Rabinowitsch, Battaglini). La semplice salificazione (sale potassico) determina già una notevole riduzione dell’attività verso tutti i ceppi di germi considerati, ad eccezione dei paratubercolari sui quali il sale potassico agisce molto attivamente, specialmente allorché tali germi vengano coltivati in brodocolture nelle quali, per la sua solubilità in acqua, il sale può agire in maniera più completa, mentre nelle colture in agar la sua attività appare ridotta, forse per l’azione colloido-protettrice dell’agar stesso.
L’attività del b-glicirreticoside è anche meno estesa. Essa si limita allo Staph. aureus, allo Staph. di Oxford e al B. anthracis, mentre è ridottissima sui paratubercolari.
L’attività della glicirrizina è invece debolissima e si manifesta in maniera trascurabile soltanto verso l’E. coli, mentre l’acido glicirrizico appare del tutto inattivo.
Nessuna attività è stata riscontrata nell’acido 18a-glicirretico.
c) Il valore antitossico della glicirrizina è stato posto in evidenza da Velluz (101), secondo cui essa sarebbe caratterizzata dal gusto zuccherino dei suoi sali e dalla sua proprietà di neutralizzare la tossina tetanica. L’aggiunta di una soluzione di glicirrizinato di ammonio, rende innocua, secondo l’A., la tossina tetanica dopo 4 giorni di contatto alla temperatura di 38-39°. 5 mg di acido glicirrizico sarebbero sufficienti per inattivare 800 dosi mortali cavia di tossina tetanica e quest’azione viene attribuita dall’A. all’acido glicirretico.
Tale attività della glicirrizina venne più tardi confermata da Hideo Miyoshi (102), il quale constatò che negli animali da esperimento essa riesce ad ostacolare l’azione della tossina difterica, della tossina tetanica e dimostra inoltre, di essere dotata anche di attività antiallergica. L’A. suppone che questi effetti siano dovuti all’aglicone della glicirrizina, l’acido glicirretico. Secondo Norito Kuboki e Kazuko Hoshizaki (103), la glicirrizina è dotata anche di un effetto detossicante di fronte alla stricnina, effetto del quale sarebbero però esenti i prodotti della sua idrolisi, acido glicirretico e acido glucuronico.
d) L'attività antitosse dell’acido 18-b-glicirretico è stata studiata su cavie anestetizzate e sul gatto in leggera anestesia, da Anderson e Smith (104) i quali hanno potuto dimostrare che esso esercita un'azione antitosse centrale. Alcuni suoi derivati sono dotati, secondo gli AA., della stessa attività della codeina allorché vengano iniettati sottocute alle cavie. Il sale di colina dell'acido succinilglicirretico manifesta la stessa attività anche se somministrato per os.
e)
f) Come correttivi gli estratti di Liquirizia e la glicirrizina sono impiegati nella tecnica galenica per correggere il sapore di preparazioni contenenti cloruro di calcio, cloralio, paraldeide, aminoacidi, creosoto, joduri alcalini, acido paraminosalicilico, estratti di organi animali o vegetali (Aglio, Aloe, Altea, Cascara, Drosera, Frangola, Grindelia, Politala, Senna, Viburno); di preparati contro la tosse e antiulcera (casi nei quali agisce anche come base o coadiuvante) e, inoltre, di sostanze piccanti, amaro-saline e saline [Capra (106)].
In considerazione dell’attività DOCAsimile di cui sono dotati gli estratti di Liquirizia e la glicirrizina e delle reazioni secondarie cui possono dar luogo (ritenzione di acqua e di sodio, eliminazione di potassio, comparsa di edemi ecc.) alcuni AA. sconsigliano, come già detto, l'impiego delle suddette sostanze come correttivi, specialmente nei casi di trattamenti protratti [De Jong (107)].
Terapia – La Liquirizia, sotto forma dei suoi estratti, è tuttora usata per le sue proprietà emollienti, espettoranti e leggermente diuretiche. Essa viene raramente impiegata da sola, mentre più frequentemente entra, come coadiuvante, nella composizione di pozioni diuretiche, lassative e antitosse.
Oltre questi impieghi, per così dire, tradizionali, l'uso degli estratti di Liquirizia viene oggi esteso alla terapia dell’ulcera gastrica e, in base alle più recenti acquisizioni sull’attività corticosurrenalica dell'acido glicirretico, alla terapia dell’iposurrenalismo e di alcune dermatopatie.
Dell’attività degli estratti di Liquirizia nella terapia dell'ulcera gastrica si è già detto precedentemente. Questi estratti, più o meno purificati, fanno parte della composizione di molti preparati antiulcera e ne costituiscono la base.
Schulze e coll. (108) hanno sperimentato clinicamente un prodotto a base di Liquirizia su 200 gastroenteropazienti. Nel 90 % dei casi di ulcera gastrica, essi constatarono un netto miglioramento, che potè essere confermato anche al controllo radiologico. Secondo gli AA., la Liquirizia agirebbe anche prevenendo la trasformazione neoplastica dell’ulcera. Risultati terapeutici favorevoli si otterrebbero però soltanto nelle forme recenti. Nai casi di gastrite gli AA. non ottennero alcun risultato.
Un preparato molto noto, in cui un estratto di Liquirizia si trova associato con sottonitrato di bismuto, carbonato di magnesio, bicarbonato di sodio, Frangola e Calamo aromatico, è stato largamente sperimentato con risultati molto buoni. Il Siemes (109) riferisce di aver trattato ambulatoriamente 35 pazienti affetti da gastriti croniche recidivanti, con o senza ulcera. Di essi, 24 guarirono, 3 migliorarono oggettivamente e soggettivamente e 8 non reagirono. Ferenbach (110) riferisce di aver ottenuto buoni risultati nelle ulcere gastriche e duodenali. Su 11 pazienti affetti da ulcera gastrica, 6 guarirono clinicamente e radiologicamente; 3 furono dimessi con una piccola nicchia residua e furono in seguito, trattati ambulatoriamente: 2 non reagirono.
Su 24 casi di ulcera duodenale, 19 guarirono e 4 migliorarono. La gastrite ulcerosa guarì completamente e la gastrite cronica migliorò clinicamente e radiologicamente.
Anche il Neukamm (111) si esprime favorevolmente sull'azione del suddetto preparato nella terapia delle gastriti iperacide e dell’ulcera.
Secondo Dietz (112) le ulcere gastriche e duodenali di origine neurogena reagirebbero particolarmente bene al suddetto trattamento.
Lo stesso preparato venne più recentemente sperimentato dal Giungi (113) il quale trattò 34 casi ottenendo un miglioramento soggettivo del quadro morboso in 32 di essi. La scomparsa del dolore che avveniva di solito dopo 8-20 giorni dall’inizio del trattamento, è stata ottenuta in 7 casi di ulcera gastrica, in 7 di ulcera duodenale, in 2 di gastrite diffusa e negli 8 affetti da gastroduodenite diffusa.
Sull'attività degli estratti di Liquirizia nella terapia dell'ulcera gastrica, duodenale e delle gastriti, si esprimono favorevolmente anche molti altri AA. fra i quali Hennemann e Kuhnert (114) Hennemann e coll. (115), Buttner (116), Broicher (117), Schwarzlose (118), Ròssing e Lehr (119) ecc.
Anche Doll e coll. (120) che sperimentarono l’attività terapeutica di un derivato dell’acido glicirrizico, l’acido 3-O-(b-carbossipropionil)-11-oso-18-olean-12-en-30-oico, noto con la denominazione di Biogastrone, nel trattamento dell’ulcera gastrica e duodenale, ottennero risultati che dimostrarono che questa sostanza favorisce la guarigione dell’ulcera gastrica esplicando un’azione antiflogistica locale sulla mucosa.
Gli estratti di Liquirizia, la glicirrizina e l’acido glicirretico vennero sperimentati piuttosto largamente nell’iposurrenalismo e in particolare nella terapia della malattia di Addison, con risultati diversi ma generalmente buoni.
Dai risultati ottenuti dai già citati Groen e coll. (64), Borst e coll. (65), Card e coll. (66), Hudson e coll. (84), risulta che tanto gli estratti di Liquirizia quanto la glicirrizina e l’acido glicirretico, manifestano un’attività nel morbo di Addison che sembrerebbe essere proporzionale alla quantità di tessuto corticosurrenalico funzionante.
Strong e Wilson (121), in base ai risultati ottenuti trattando un caso di morbo di Addison con acido glicirretico, presumono che questa sostanza pur potendo dimostrarsi attiva, non si presta, se somministrata da sola, per il trattamento prolungato di pazienti nei quali esista una insufficienza surrenalica.
Il Calvert (122) al contrario, riferisce il caso di un paziente affetto da morbo di Addison che fu trattato per un lungo periodo di tempo con solo estratto di Liquirizia. Durante il primo mese l’estratto venne somministrato alla dose di 60 g al giorno, dose che nei successivi 4 mesi venne ridotta a 30 g e a 4,5 g ancora per un anno, continuando quindi il trattamento con 3 g pro die. Sin dal primo mese i valori della pressione, dell’uremia e degli elettroliti nel siero, furono ricondotti alla normalità e tali sono rimasti anche dopo le successive riduzioni della dose. Oltre questa particolare sensibilità del paziente alla Liquirizia, l’A. ha notato una vera e propria azione di accumulo, tanto che fu necessario interrompere per due volte il trattamento per il manifestarsi di un incipiente edema polmonare. Il trattamento venne poi ripreso 7 e 10 giorni dopo, quando la pressione tornò ai valori normali. L’A. conclude affermando che la terapia del morbo di Addison con l’estratto di Liquirizia presenta indiscutibili vantaggi, per la sicurezza dell’impiego, per la sua efficacia e per l’assenza di azioni secondarie di rilievo, allorché il trattamento venga condotto con un dosaggio ben appropriato.
Analogamente, Groen e coll. (123) trovarono che l’estratto di Liquirizia alla dose di 20 g al giorno si è dimostrato attivo come l’acido glicirrizico e l’acido glicirretico, sul metabolismo degli elettroliti nel morbo di Addison e che tale metabolismo potrebbe essere mantenuto in condizioni soddisfacenti anche per 2 anni.
Gli stessi AA. (124) che avevano anche precedentemente notato l’analogo comportamento degli estratti di Liquirizia e dell’acido glicirretico nel morbo di Addison, poterono anche constatare che i malati reagiscono molto diversamente tanto che, mentre in alcuni la dose di 2 g al giorno si è dimostrata sufficiente per mantenere intorno ai valori normali il bilancio idrico-salino, per altri sono state necessarie dosi molto superiori, tanto che in alcuni casi si è dovuta raggiungere la dose di 40 g al giorno. Molto verosimilmente in questi casi influisce, oltre la sensibilità del paziente, in relazione soprattutto, allo stato delle surrenali, anche la differenza di composizione dei diversi estratti di Liquirizia.
L’acido glicirretico, sottoforma di pomate (al 2 % di solito e in eccipienti vari) è stato estesamente sperimentato in campo dermatologico nel trattamento di diverse forme di dermopatie in sostituzione dei cortisonici, ma con risultati che specialmente nei primi due anni di sperimentazione (1955, 1957) furono molto discordi e tali da suscitare non poche discussioni e vivaci polemiche fra i dermatologi.
La letteratura sull’argomento apparsa in questo periodo, venne da noi riassunta e discussa nel nostro già citato lavoro (100) al quale rimandiamo, mentre ci limiteremo qui a compilare un succinto esame della bibliografia più recente.
Colin Jones e Somers (125), dopo aver dimostrato sperimentalmente l’attività antiflogistica dell’acido glicirretico valendosi di diversi tests, hanno sperimentato clinicamente su 254 casi, una pomata contenente isomeri attivi dell’acido glicirretico, comparativamente col cortisone. Tale pomata, applicata topicamente, è stata trovata molto attiva nell'eczema flexurale, nelle dermatiti traumatiche e di contatto, in alcune neurodermatiti e nei pruriti associati con psoriasi. Buoni risultati sono stati ottenuti anche nll’eczema infantile, nell’eczema nummulare e nel prurito vulvare e anale. L’acido glicirretico agirebbe inoltre, come sinergico in associazione con la neomicina e darebbe ottimi risultati nell’impetigine e nell’eczema impetiginoso.
Nella psoriasi l’azione antiflogistica dell’acido glicirretico sarebbe più attiva e più rapida, ove lo si associ con acido salicilico.
Gli AA. concludono che l’acido glicirretico e certi suoi isomeri attivi, sono dotati di una notevole attività antiflogistica. Essi manifestano una marcata attività in molte dermatopatie e anche in alcuni casi resistenti ad altri trattamenti.
Sperimentati comparativamente con il cortisone in varie dermatopatie acute e croniche, hanno dato risultati migliori. Ad analoghe conclusioni sono giunti successivamente Finney e Somers (126). Lo stesso Somers, in collaborazione con Phillips (127), ha sperimentato un preparato di acido glicirretico in animali da laboratorio affetti da diverse forme infiammatorie della pelle e delle mucose (otite esterna, eczemi, congiuntivite, cheratite, balanite, forme flogistiche prodotte da trementina). In 144 casi trattati, l’acido glicirretico si è dimostrato veramente attivo come agente antiflogistico e come potenziatore dell’attività antibiotica della neomicina ed anche dell’azione di un cheratoplastico.
Quentin Evans (128) avendo sperimentato clinicamente su 124 pazienti che presentavano varie manifestazioni dermopatiche, conclude che gli isomeri biologicamente attivi dell'acido glicirretico sono dotati di una notevole attività antiflogistica e che nella terapia delle affezioni cutanee acute, subacute, croniche e ribelli ad altri trattamenti, sono superiori all’idrocortisone. Essi non sensibilizzano i pazienti e non hanno controindicazioni.
Nello stesso senso si esprimono numerosi altri AA. fra i quali Lipmann Cohen (129), Bertaccini e coll. (130), Cavalieri (131), Terrier (132), Maxwell (133), Colin Jones (134) (135), Gottfried e Baxendale (136) i quali ultimi ritengono l’acido glicirretico un ottimo agente antiflogistico, specialmente allorché venga incorporato in lozioni, pomate, suppositori, polveri o in materiale di medicazione da applicarsi negli alveoli dentali, in associazione con agenti antisettici e antistaminici. In questi casi l’azione antiflogistica dell’acido glicirretico si manifesterebbe contemporaneamente a quella degli agenti antisettici e antistaminici, determinando un più rapido ritorno dei tessuti allo stato normale.
Capalbi e Cristiani (137) hanno sperimentato l’acido glicirretico, comparativamente col cortisone nella cheratite anafilattica ottenuta sperimentalmente nel coniglio. Le due sostanze applicate localmente in pomata all’1 % avrebbero manifestato un’attività antiflogistica e antianafilattica qualitativamente simile ma quantitativamente diversa, in quanto la pomata con cortisone si sarebbe dimostrata più attiva.
Tossicologia – La tossicità della Liquirizia e dei suoi principi attivi é molto bassa e non risulta che siano stati descritti casi di intossicazione acuta. Casi di intossicazione cronica sono stati osservati, come già detto, nel corso di trattamenti terapeutici prolungati con estratti di Liquirizia o di acido glicirretico. In questi casi é sufficiente interrompere la somministrazione per un certo periodo, perchè i sintomi regrediscano rapidamente.
Harders e Rausch-Stroomann (138) hanno descritto il caso di un paziente che avendo appreso dalla stampa la notizia dell’azione terapeutica del succo di Liquirizia nell’ulcera gastrica, si curò spontaneamente e senza assistenza medica di una sua presunta malattia ulcerosa, protraendo il trattamento sino ad assumere un totale di 4 kg di un preparato di Liquirizia. Ne conseguì un peggioramento dei suoi preesistenti disturbi coronarici, per il notevole aumento della pressione arteriosa, per l’instaurarsi di uno stato idremico, per la perdita di potassio e per l’aumento della colesterolemia. Sospendendo la somministrazione, la pressione discese ai valori iniziali e tutta la sintomatologia andò progressivamente attenuandosi.
Drosdowski e coll. (139) hanno descritto un caso di pseudo aldosteronismo simulante la malattia di Conn, dovuto all’ingestione abituale di una bevanda a base di succo di Liquirizia, contenente il 14 % di glicirrizina. Fra i sintomi più salienti rilevati dagli AA. sono da annoverare l’ipopotassiemia, l’alcalosi, l’ipertensione arteriosa, l’astenia accompagnata da episodi paretici interessanti specialmente gli arti inferiori, la polidipsia e la poliuria, la perdita progressiva della libido e l’impotenza. La sospensione della suddetta bevanda conduceva alla rapida scomparsa della sintomatologia che ricompariva riprendendo l’uso della bevanda stessa.
Gli AA., in considerazione del fatto che l’impiego di questa bibita è molto diffuso, mentre rarissimi sono i casi di intossicazione, si chiedono se essi non possano essere spiegati ammettendo l’esistenza di una predisposizione costituzionale. Bernard (81) ha riferito il caso di un edema piuttosto diffuso e recidivante insorto in una malata per l’uso di Liquirizia a scopo lassativo e Charpy e coll. (140) hanno descritto casi di reazioni da intolleranza per applicazioni topiche di una pomata a base del sale sodico dell’acido glicirretico. Tali reazioni, che gli AA. hanno creduto di poter attribuire al carattere di instabilità chimico-fisica del prodotto, nella forma in cui è stato impiegato, non furono osservate allorché l’acido glicirretico veniva sostituito al suo sale sodico.
Più recentemente Guenel e coll. (141), hanno osservato il manifestarsi di una sintomatologia molto simile a quella descritta da Drosdowski e coll. (139), in un paziente alcoolizzato il quale per alcuni mesi, fece un uso eccessivo di bevande a base di estratto di Liquirizia. Esso presentava infatti, paralisi dei membri inferiori, ipertensione arteriosa, diabete insipido, ipopotassiemia, alcalosi ed elevata eliminazione urinaria del potassio. Gli AA. osservarono che il bilancio potassico poteva essere ricondotto ai valori normali, anche durante il periodo in cui il malato si trovava sotto l’azione della droga, con somministrazione di potassio a dosi elevate. Essi osservarono inoltre, che gli spirolattoni sono capaci di inibire l’effetto della glicirrizina sui tubuli renali.
L’assorbimento e l'eliminazione dell’acido glicirretico e della glicirrizina sono stati studiati da Cariat e coll. (142) con molecole marcate con tritium. Le due sostanze somministrate per os, sono poco assorbite dal tubo gastroenterico, come è indicato dal livello di radioattività del sangue, della bile e delle urine.
La quantità ingerita viene eliminata direttamente con le feci e, nel caso dell’acido glicirretico, come composto inalterato. Piccole quantità di esso sono state isolate dalle orine di soggetti cui era stato somministrato.
Per riassumere quanto è stato sin qui esposto, potremo dire che la Liquirizia, oltre che per le sue azioni emolliente, espettorante e leggermente diuretica e lassativa, trova oggi impiego anche nella terapia della malattia ulcerosa e nell’iposurrenalismo. Per quanto riguarda l’impiego di questa droga nella terapia dell’ulcera gastrica e duodenale, sembra che la sua azione risulti dal convergere di diverse attività, quali l’antiacetilcolinica, l’antistaminica e l’antispastica, dovute specialmente alla glicirrizina e alle sostanze flavonoidi; coadiuvano molto probabilmente a questa attività anche l’azione antilisozimica, o quella DOCAsimile dell’acido glicirretico e forse anche quella di altri fattori ancora non ben noti.
L’attività della Liquirizia nella terapia dell’iposurrenalismo e del morbo di Addison in particolare, è dovuta all’acido glicirretico e alla presenza nella composizione di essa dei 17-chetosteroidi accertata da Aho (41) e di una frazione resinosa ad azione cortisone-simile isolata da Mittchel (42).
Di non facile interpretazione è l’azione corticosurrenalica, prevalentemente DOCAsimile, dell’acido glicirretico, a proposito della quale ci si potrebbe chiedere se si tratti di un’azione diretta o indiretta.
L’acido glicirretico presenta indubbiamente molte analogie strutturali con i corticosteroidi ma non sufficienti, secondo noi, a giustificare un’azione corticosurrenalica diretta e quindi sostitutiva. Gli AA. sembrano infatti, per lo più concordi nel ritenere che il manifestarsi dell’azione dell’acido glicirretico, sia subordinata alla presenza delle capsule surrenali funzionanti o parzialmente funzionanti. In questo caso sono possibili due ipotesi: o che l'acido glicirretico esplichi un’azione di stimolo ACTHsimile e prevalentemente diretta sulla zona glomerulare corticosurrenalica, oppure che l’acido glicirretico possa subire una degradazione del tipo di quelle descritte da Voser e coll, e da Crabbé per altri triterpeni (vedi Agrimonia eupatoria), per la quale potrebbe essere trasformato in ormone attivo. Dai risultati di ricerche eseguite da Capretti e coll. (143) risulterebbe inoltre che la Liquirizia e la glicirrizina agiscano attraverso un meccanismo DOCAsimile diretto o secondariamente indotto da una stimolazione ipofìsaria.
In maniera diversa potrebbero agire gli estratti totali di Liquirizia, i quali, allorché vengano impiegati in dosi sufficientemente elevate, potrebbero esplicare anche un’azione cortisonica, oltre che DOCAsimile, e quindi almeno sino ad un certo punto, sostitutiva, per la presenza di sostanze chetosteroidiche e ad azione cortisonesimile.
Per quanto riguarda infine, l'attività terapeutica dell’acido glicirretico per applicazione topica in alcune dermatopatie, é da ritenere che, molto verosimilmente, la sua attività antiflogistica come quella antistaminica, non sia di tipo cortisonico, ma che rappresenti una sua caratteristica specifica, caratteristica comune del resto a molte altre sostanze di origine vegetale. Tale attività, antiflogistica e antistaminica, unite a quella batteriostatica, possono giustificare le indicazioni dell’acido glicirretico nelle forme dermopatiche nelle quali é stato sperimentato ed anche la sua azione potenziatrice dell'attività di alcuni antibiotici.
Estratti e preparati vari
a) Estratto fluido (g 1 = XXXIV gtt).
Dosi: g 2-5 e più, più volte pro die.
b) Estratto molle acquoso F.U. (1 p. = 6 p. circa di droga).
Dosi: g 0,2-1 e più, più volte pro die.
c) Estratto molle acquoso (1 p. = 5 p. circa di droga).
Dosi: g 0,2-1 e più, più volte pro die.
d) Estratto secco acquoso (1 p. = 7 p. circa di droga).
Dosi: g 0,2-1 e più, più volte pro die.
Preparazioni usuali e formule galeniche
Tintura
Estratto fluido liquirizia……………………………………………….. g 20
Alcool di 20°…………………………………………………………………. g. 80
(a cucchiaini).
Sciroppo
Estratto fluido liquirizia……………………………………………. g 10
Sciroppo semplice F. U…………………………………………… g 90
(a cucchiai).
Elisir
Estratto fluido liquirizia…………………………………………………. g 125
Elisir aromatico…………………………………………………………….. g 875
(a bicchierini).
Sciroppo espettorante
Estratto fluido liquirizia……………………………………………. g 50
Estratto fluido drosera
Estratto fluido poligala
Estratto fluido castagno ana g 10
Tintura ipecacuana……………………………………………………. g 5
Tintura scilla……………………………………………………………… g 5
Sciroppo di altea fino a………………………………………………… g 500
(a cucchiai o cucchiaini).
BIBLIOGRAFIA
(1) ROBIQUET, Ann. chim., 72, 143, 1809 – (2) ROUSSIN Z., J. pharm. chim., 22, 6, J875; Arch. Pharm., 208, 156, 1876 – (3) TSCHIRCH A. e CEDEBERG H., Arch. Pharm., 245, 97, 1907 – (3a) POINTET- GUILLOT M., Thèse Pharm. Paris. 1958; Brev. Brit. 901.085, 11 luglio 1962; Brev. Brìi. 901.086, 11 luglio 1962 – (4) VON GORUP-BESANEZ E., Lieb. Ann., II8, 236, 1861 – (5) VOSS W., Angew. Chem., 49, 556, 1936 – (6) VOSS W., KLEIN P. e SAUER H., Ber., 70, 122, 1937 – (7) RUZICKA L. e COHEN S. L., Heiv. Chim. Acta, 20, 804, 1937 – (8) RUZICKA L., LEUENBERGER H. e SCHELLENBERG H., ibid., 20, 1271, 1937 – (9) RUZICKA L. e MARXER R., ibid., 22, 195, 1939 – (10) RUZICKA L. e JEGER O., ibid., 25, 775, 1942 – (11) RUZICKA L., JEGER O. e WINTER, ibid., 26, 265, 1943 – (12) RUZICKA L., JEGER O. e JNGOLD W., ibid., 26, 2278, 1943 – (13) BEATON J. M. e SPRING F. S., J. Chem. Soc., 3126, 1955 – (14) LYTHGOE B. e TRIPPET S., J. Chem. Soc., 1983, 1950 – (15) VOSS W. e PFIRSCHKE J, Ber., 70, 132, 1937 – (16) MARSH C. A. e LEVVY G. A., Biochem. J., 63, 9, 1956 – (16a) BEATON J. M. e SPRING F. S., J. Chem. Soc., 2417, 1956 – (17) SERRANO M., Tesis Doctoral, Facultad de Farmacia, Madrid 1946 – (18) BOHDAN DROZDZ, Acta Polon. Pharm., 15, 99, 1958; Chem. Abs., 52, 20436f, 1958 – (19) GELBAKHIANI P., TRAPAIDZE M., GELEISHVILI P. e STILADZE R., Trudy Tbiìl^sk. Med. Inst., 10, n. 2, 39, 1957; Chem. Abs., 53, 18195h, 1959 – (20) RUZICKA L. e LEUENBERGER H., Helv. Chim. Acta, 19, 1402, 1936 – (21) BAYTOP O. T., Material Vegetables, I, 369, 1954; Chem. Abs., 52, 10493f, 1958 – (22) SAG G., Rev. Int. Bot. Appi. Agr. Trop., 361-362, 570, 1952 – (22a) MURAV'EV I. A., Uch. Zap., Pyatigorskii Farmatsevt Inst., 3. 56, 1959; Chem. Abs., 56, 13010, 1962 – (23) HOUSEMAN, Am. J. Pharm., 84, 531, 1912 – (24) ERIKSSON, Arch. Pharm., 249, 144, 1911 – (24a) BORKOWSKI B. e DROZDZ B., Dissert. Pharm., 12, 35, I960 – (25) EMMANUEL, Fetschrift Tschirch, 1926, 288 – (26) BERGER H. e HOELLER H., Sci. pharm., 21, 145, 1955 – (27) SHINODA J, e UEEDA S., Ber., 67, 434, 1934 – (28) HOLLER H. e BERGER H., Sci. pharm., 25, 172, 1957; Chem. Abs., 52, 3267b, 1958 – (29) TAMBOR J., Ber., 49, 1704, 1916 – (30) TATSUTA H., J. Chem. Soc. Japan, 67, 119, 1946; Chem. Abs., 45, 614, 1951 – (31) PURI B. e SESHADRI T. R., J. Sci. ind. Res., 13, 475, 1954; Chem. Abs., 49, 11569, 1955 – (32) PARIS R. e GUILLOT M., Ann. pharm. frang., 11, 592, 1955 – (33) GRASSHOF H., Arch. Pharm., 293/65, 550, 1960 – (34) HOUSEMAN P. A. e SWIFT C. K., Am. J. Pharm., I0I, 679, 1929; GRASSHOF H., Arch. Pharm., 291/65, 551, 1960 – (35) MINORU GOTO, Yakugaku Zasshi, 77, 471, 1957; Chem. Abs., 5I, 12433b, 1957 – (36) TAKESHI WATANABE e MINORU GOTO, J. Pharm. Soc. Japan, 74, 157, 1954; Chem. Abs., 48, 6076a, 1954 – (37) MINORU GOTO, 1. Pharm. Soc. Japan, 75, 1452, 1955; Chem. Abs., 50, 5241 a, 1956 – (38) MELVILLE D. B., I. Blol. Chem., 208, 495, 1954; Chem. Abs., 48. 943Ia, 1954 – (39) VOORSPUIJ Z. A. J., GOOTJES J. e NAUTA W. T., Arzneim.- Forsch., I0, 604, 1960 – (40) VOORSPUU Z. A. J., Koninklijke Pharmaceulischc Fabrieken voorheen Brocades – Slheeman & Pharmacia, Dutch 89.490, nov. 15, 1958; Chem. Abs., S4, 83Se, 1960 –
(41) AHO ESA, Suomen Apteekkaryhdistyksen Aikakauslehti, 393, 1953; Dtsch. Ap. Ztg., 94, 467, 1954 –
(42) MITCHELL W., Brit., 724.230, 16 febbr. 1955; Chem. Abs., 49, 11257c, 1955 – (43) COSTELLO C. H. e LYNN E. V., J.A.Ph.A., 39, 177, 1950 – (44) ROMEO A. e CARELLI V.,Ann. chimica, 45, 1146, 1955 – (45) ROMEO A., VILLOITI R. e CARELLI V., Ann. chimica, 46, 1092, 1956 – (46) PLISSON, I. pharm.,
14. 181, 1828; SESTINI, Gazz. Chim. /tal., 131, 1878; WEHMER C., Die Pflanzensloffe, Il ediz., p. 549 – (47) TSCHIRCH e RELANDER, Schweiz. Wochenschr. Chem. Pharm., 243, 1898; WEHMER C., loc. clt. in (46) – (48) WINCKLER, Buchn. Repert., 67, 401, 1839; WEHMER C., loc. cit. in (46) – (49) HAENSEL, Pharm. Zentralh., 40, 533, 1899; WEHMER C., ìoc. cit., in (46) – (50) RASENACK, Arb. Kaiserl. Gesundheitsamt., 28, 420, 1908; WEHMER C., ìoc. cit. in (46) – (51) REVERS F., Ned. TUdschr. Geneesk., 90, 135, 1946 – (52) GUTMAN e KANONI, Soc. Nat. Frang. de Gastroenterol., 9 marzo 1953 – (53) SCHULZE e coli., Dtsch. med. Woch., 79, 716, 1954 – (54) BUSQUET H., Soc. de Terapeut., 9 marzo 1932 – (55) NELEMANS-STAMPERIUS J. e NELEMANS F., Acta Physiol. Pharm. Neerl., I, 198, 1950 e
I. 212, 1950 – (56) VINCENT D., Thérapie, 6, 448, 1951; Rev. de Phytothér., I5, 115, 1951 – (57) VINCENT D., Thérapie, 7, 337, 1952 – (58) VINCENT D., ibid., 9, 68, 1954 – (59) VINCENT D., Rev. de Phytothér.,
15, 114, 1951 – (60) CZOK G. e KREIENBERG W., Dtsch. med. Woch., 79, 831, 1954 – (61) DESMAREZ
J. ]., C. R. Soc. Biol., 150, 1022, 1956 – (62) DELSO J. L. J., Medicamento (Madrid), I2, 202, 1960 – (63) MOLHUYSEN J. A., GERBRANDY J. B., DE VRIES L. A., DE JONG J. C., LEUSTRA J. B., TURNER K. P., BORST J. G. C., Lancet, 259, 381, 1950 – (64) GROEN J., PELSER H., WILLEBRANDS A. F. e KAMMINGA C. E., New Eng. J. Med., 244, 471, 1951 – (65) BORST J. G. C., HOLT S. P., DE VRIES L. A. e MOLHUYSEN J. A., Lancet, n. 6762, 657, 1953 – (66) CARD W. L., MITTCHEL W., STROG J. A., TAYLOR N. R., TOMPSETT S. L. e WILSON J. M., lbid., n. 6762, 663, 1953 – (67) HASSAN W. E., PALUMBO J. F., ELMADJIAN F., J.A.Ph.A., ed. sci., 43, 551, 1954 – (68) SOGDRAGER, Pharm. J., 777, 1952; riass. in Dtsch. Ap. Ztg., 3, 50, 1953 – (69) BERGER H. e HOELLLER H., Sci. pharm., 23, 145, 1955 – (70) BERGER H. e HOELLER H., ibid., 23, 157, 1955 – (71) HOELLER H. e SCHIRMER H., Wien. med. Woch., I02, 423, 1952 – (72) MURESAN V., SIMIO- NOVICI M., BOTEZ A. e SANDA TAUTU, Farmacia, (Bucarest), 5, 333, 1957 – (73) KLOSA J., Pharm. Ztg., unito aiVAp. Ztg., I02, 946, 1957 – (74) FORMANEK K., HOELLER H., JANISCH H. e KOWAC V., Pharm. Acta Helv., 33, 437, 1958 – (75) SCHUMACHER H., Aerztl. Forsch., 9, 534, 1955; ved. editoriale J.A.M.A.. I48, 653, 1952 – (76) GALAL E. E., Brlth Med. Pharmacol. a. Chemother., I0, 3S, 1955 – (77) MENKYNA R. A., Bratislav. Lekàrské Listy, 33, 281, 1954 – (78) FINNEY R. S. H., SOMERS G. F. e WILKINSON J. H.. J. Pharm. Pharmacol., 10, 687, 1958 – (79) KRAUS S. D., J. ExpH. Med., I06, 415, 1957-(80) DELSO JIMENO J. L. e FRAILE OVEJERO A., Farmacognosia, 20, 27, 1960-(81) BERNARD A., Presse Méd., 66, 1537, 1958 – (82) LOUIS L. H. e CONN J. W., I. Pharm. Pharmacol., 8, 556, 1956 – (83) WENZEL D. G. e EMICK G. H. jun., J.A.Ph.A., ed. sci., 45, 284, 1956 – (84) HUDSON P. B., MITTELMAN A. e PODBEREZEC M., New Engl. J. Med., 25I, 641, 1954 – (85) LI-SHENG CHANG, TAN LI, YING-TSU LIU, CHEN-SHENG CHANG e HSIANG-YUN LOU, Jén Min Pao Chlen., 3, 253, 1959; Chem. Abs., 53, 16395 f, 1959 – (86) GIJON R. J. e MURCIA C. R., Ann. de la Real Acad. de Farmacia de Madrid, 26, 5, 1960 – (87) KRAUS S. D., J. Pharm. Pharmacol., I2, 300, 1960 – (88) KRAUS S. D., fJature, 193, 1082, 1962 – (89) CHIRICO G., FALCHI F. e MONTAGNA C., Arch. sei. med., 106, 848. 1958 – (90) FINNEY R. S. H. e TARNOKY A. L., J. Fharm. Fharmacol., 12, 49, 1960 – (91) ATHERDEN L, M., Biochem. J.> 69. 75, 1958 – (92) SABURO VANO, Nippon Naibunpi Gakkai Zassfd, 34, 745, 1958; Chem. Abs., 53, 6370c, 1959 – (93) HOELLER H.. HUCKEL H. c SCHNEIDER W., Sci. pharm., 28, 33. I960 – (94) HART F. D. e LÉONARD J. C., Lancet, n. 6816, 804, 1954 – (95) GIRERÒ R. J-, RASSAERT L. L., DI PASQUALE G. e KROC R. L., Am. J. Fhysioi, 198, 718, 1960 • (96) AKIRA KUMAGAI. SABURO YANO, MASAAKI OTOMO e KAZUYUKY TAKEUKI, Endocrinol. Japon., 4, 17, 1957; Chem. Abs.. 52. 576a, 1958 – (97) KRAUS S. D., J. expti. Med., 208, 325, 1958 – (98) KRAUS S. D., ibid.. J06, 415. 1957 – (99) GUJRAL M. L„ SAREEN K., PHUKAN D. P. e AMMA M. K. P„ Indian J. Med. Sci., 25, 469, 1961; Chem. Abs., 56, 5359, 1962 – (100) BENIGNI R. e FRANCO E., Clin. terap., 14bis suppl. aprile-giugno. 95, 1958 – (101) VELLUZ L„ C.R. Soc. BioL, 222, 354, 1932 – (102) HIDEO MIYOSHI, Nissfùn Igaku, 39, 358, 1952; Chem. Abs., 48, 8418H, 1954 – (103) NORITO KUBOKI e KAZUKO HOSHIZAKI, 5ogo Igaku. 22, 792, 1955 e Yakugaku Kenkyu, 28, 398, 1956; Chem. Abs., 54, 13440C, 1960 e Chem. Abs., 52, 132l9f, 1957 – (104) ANDERSON l c SMITH W. G-, J. Fharm. Fharmacol., 13. 396, 1961 – (105) JAMES B.. Lancet, n. 6950, 996, 1956 • (106) CAPRA C., lì Farmaco. 13, 499, 1958 – (107) DE JONG J. C., Fharm. Weekbl.. n. 29-30, luglio 1952 – (108) SCHULZE E. e coll., Dfsch. med. Woch., n. 17, 716, 1954 – (109) SIEMES E., Therap. Cegenw., n. 6, 235, 1954 – (11()) FERENBACH n. 1, 18, 1954 – (111) NEUKAMM H„ Med.Klin., n. 2, 79, 1954 – (112) DIETZ R.,
Landarzt., n. 28, 669, 1953 – (113) GIUNGI F., Arch. U. Mal. App. Dig., 26, 685, 1959 – (114) HENNE- MANN H. H. e KUHNERT G., Fharmazie, 8, 463, 1953 – (115) HENNEMANN H. H. e coll., Zschr. Inn. Med., n. 19-20, 912, 1953 – (116) BUEITNER B., Fharmazie, 8, 725, 1953 – (117) BROICHER H., Med. Klin., n. 7, 258, 1954 – (118) SCHWARZLOSE G., Dtsch. Med. 2.. n. 5/6, 129, 1953 – (119) ROESSING P. e LEHR P., Therap. Gegenw., n. 5, 180, 1954 – (120) DOLL R., HILL I. D.. HOITON C e UNDER- WOOD D. J.. Lancet, n. 7260, 793, 1962 – (121) STRONG J. A. e WILSON J. M, C, Lancet, n. 6855, 150, 1955 – (122) CALVERT R. J., Lancet, n. 6816. 805, 1954 – (123) GROEN J.. PELSER H. E-, WILLE- BRANDS A. F., FRENKEL M. e VAN DER HEIDE R. M., Congr. Intern. biochlm., Résumés communs., 2** Congr., Paris 1952; Chem. Abs., 48, 8399g, 1954 – (124) PELSER H. E.. WILLEBRANDS A. F., FRENKEL M., VAN DER HEIDE R. M. e GROEN J., Ned. Tijdschr. Geneesk., 97, 358, 1953 – (125) COLIN JONES E. e SOMERS G. F., Med. Fress., 238, 206, 1957 – (126) FINNEY R. S. H. e SOMERS G. F., J. Fharm. Fharmacol. 10. 613, 1958 – (127) PHILLIPS A. P. e SOMERS G. F„ Veterln. Ree.. 70, 199. 1958 – (128) QUENTIN EVANS F., Brit. 3. CUn. Fract., 22, 4, 1958 – (129) LIPMAN COHEN E., The Fractitioner., 282. 618, 1958 – (130) BERTACCINI G. e coll., Min. Dermatol., 32. suppl. al n. 1, gennaio-marzo 1958 – (131) CAVALIERI R., Cronache delVl.D.l, n. 7/8, 142, 1958 – (132) TERRIER H„ Fresse Méd., 67, 1994, 1959 • (133) MAXWELL S., Brltish. Dentai, 7 aprile 1959 – (134) COLIN JONES E., Brìi. Med. J.= 1413, 1959 – (135) COLIN JONES E.. Fostgrad. Med. J., 36, 680, 1960 – (136) GOTTFRIED S. e BAXENDALE L., Brev. Brit., 798.655, 1958; Chem. Abs., 53, 1647c, 1959 – (137) CAPALBI
S. e CRISTIANI S.. Ann. Ottalm. din. Ocui, 85. 545, 1959 (138) HARDERS H. e RAUSCH-STROO- MANN J. G., Munck, med. Woch., 95. 580, 1953 – (139) DROSDOWSKI M.. ROBEL P. e SEBAOUN J., Fresse Méd., 69, 294, 1961 – (140) CHARPY J.. CASTELAIN P. Y. e COULIER L., Comunicaz. alla Soc. Frane, de Dermatol. et de Syphilograph., Marsiglia, 16, 2, 1957; Fresse Méd., 65, 1000, 1957 – (141) GUENEL J-, NICOLAS G., BUREAU O. e HOREAU J., Fresse Méd., 70. 2294, 1962 – (142) CARLAT L, E-, MARGRAF L. W., WEATHERS H. H. e WEICHSELBAUM T. E., Frac. Soc. Expti Bioi Med.. 102, 245, 1959 – (143) CAPRElTI G., PIERAGNOLl E, e TELÒ W., RiV. Anat. Fai. Oncoi, 10. 227, 1955.


